Method Article
Un modelo de ratón quimérico hígado humano de hipercolesterolemia familiar con hepatocitos derivados de células madre pluripotentes inducidas
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un protocolo para generar un modelo de ratón quimérico hígado humano de hipercolesterolemia familiar usando hepatocitos derivados de células madre pluripotentes inducidas humanas. Este es un modelo valioso para probar nuevos tratamientos para la hipercolesterolemia.
Resumen
Hipercolesterolemia familiar (FH) en su mayoría es causado por mutaciones de lipoproteína de baja densidad (LDLR) del receptor y los resultados en un mayor riesgo de enfermedad cardiovascular inicio temprano debido a la marcada elevación del colesterol de LDL (LDL-C) en sangre. Las estatinas son la primera línea de fármacos hipolipemiantes para el tratamiento de FH y otros tipos de hipercolesterolemia, pero están surgiendo nuevos enfoques, en particular anticuerpos PCSK9, que ahora se están probando en ensayos clínicos. Para explorar nuevos enfoques terapéuticos para FH, nuevos fármacos o nuevas formulaciones, necesitamos apropiados modelos en vivo . Sin embargo, las diferencias en los perfiles metabólicos de lípidos en comparación con los seres humanos son un problema clave de los modelos animales disponibles de FH. Para solucionar este problema, hemos generado un modelo de ratón quimérico hígado humano usando la célula de vástago de pluripotent FH inducida (iPSC)-derivado de hepatocitos (iHeps). Se utilizaron ratones/Ldlr- / -/Rag2- / -/Il2rg- / - (LRG) para evitar el rechazo inmune de las células humanas trasplantadas y a evaluar el efecto del LDLR-iHeps deficientes en un LDLR nulo fondo. IHeps FH trasplantado podría repoblar 5-10% del hígado de ratón LRG, basado en la coloración de la albúmina humana. Además, el iHeps implantada había respondido a fármacos hipolipemiantes y recapituló las observaciones clínicas de la eficacia creciente de anticuerpos PCSK9 en comparación con las estatinas. Nuestro modelo quimérico hígado humano así podría ser útil para la prueba preclínica de terapias nuevas para FH. También se puede generar utilizando el mismo protocolo, ratones quiméricos hígados humanos similares para otras variantes genéticas de FH o correspondientes a otras enfermedades hepáticas hereditarias, mutaciones.
Introducción
Receptor de la lipoproteína de baja densidad (LDLR) captura el colesterol LDL (LDL-C) en sangre para modular la síntesis de colesterol en el hígado. Mutaciones en el gen LDLR son la causa más frecuente de hipercolesterolemia familiar (FH)1. Las estatinas han sido tradicionalmente la primera línea de medicamentos para tratar el FH y otros tipos de hipercolesterolemia (heredado o adquirido). Las estatinas inhiben la 3-hidroxi-3-metilglutaril-coenzima reductasa para reducir la síntesis del colesterol en el hígado2. Además, las estatinas aumentan los niveles de LDLR en la superficie del hepatocito para promover la separación de C-LDL del plasma. Sin embargo, una advertencia importante del tratamiento con estatinas es que al mismo tiempo inducen la expresión de cualquiera convertasa subtilisin/hexin 9 (PCSK9), una enzima que se une a LDLR para promover su degradación3. Este efecto es responsable de la insuficiente o incluso nula respuesta a las estatinas observadas en muchos pacientes. Estudiar este mecanismo, inesperadamente, lleva al descubrimiento de una forma alternativa para tratar la hipercolesterolemia. PCSK9 anticuerpos recientemente aprobados por la FDA en la actualidad se están utilizando en ensayos clínicos y mostrar mayor eficacia y mejor tolerancia que las estatinas4. El éxito de PCSK9 anticuerpos también implica que puede haber otras posibilidades terapéuticas para modular la vía de degradación de LDLR (además de PCSK9) en pacientes con hipercolesterolemia. Asimismo, existe interés en el desarrollo de nuevos inhibidores de PCSK9 distintos anticuerpos, por ejemplo, siRNA oligos5.
Para probar terapias nuevas para FH y en general cualquier otro tipo de hipercolesterolemia, apropiado en vivo modelos son necesarios. Un problema importante de la actual en vivo modelos, sobre todo ratones de6 y7, de conejos son sus diferencias fisiológicas con los seres humanos. Fundamentalmente, estos problemas incluyen un perfil metabólico de lípidos diferentes. La generación de animales quiméricos hígado humano8 podría ayudar a superar esta advertencia. El ratón quimérico hígado humano es un tipo de ratón "humanizado" con su hígado con hepatocitos humanos, por ejemplo, hepatocitos primarios humanos (pHH)9. Un problema con pHH es que no puede ser ampliada ex vivo, rápidamente pierden su función al aislamiento, y son una fuente limitada. Una alternativa a HPH es el uso de células madre pluripotentes inducidas (iPSC)-derivado de hepatocitos (iHeps)10. En particular, iPSCs son específicos para cada paciente y puede crecer indefinidamente, por lo que iHeps puede ser producido según la demanda, que es una ventaja significativa sobre HPH fresco. Por otra parte, iPSCs puede también ser fácilmente genéticamente modificados con nucleasas diseñador para corregir o introducir mutaciones en un segundo plano isogénicas para permitir comparaciones más fiel11.
Ratón quimérico hígado humano con pHH engrafted demuestran semejanzas a los seres humanos en perfiles metabólicos hígados, drogas respuestas y susceptibilidad a virus de hepatitis infección12. Esto los hace un buen modelo para el estudio de la hiperlipidemia en vivo. Los modelos de ratón más utilizados se basan en la/Fah- / -/Rag2- / -/Il2rg- / - (RFA) ratón13 y la uPA Ratón transgénico8, en que hasta el 95% del ratón hígado puede reemplazarse por pHH. Curiosamente, un informe reciente describió un humano FH hígado quimérico ratón (basado en el ratón de la RFA) con pHH de un paciente que llevaba una de mutación homocigótica de LDLR 14. En este modelo, los hepatocitos humanos repoblados no tenían funcional LDLR, pero hicieron los hepatocitos ratón residual, reduciendo así la utilidad de realizar en vivo pruebas de drogas confiando en el camino del LDLR.
Aquí, Divulgamos un protocolo detallado basado en nuestro trabajo recientemente publicado15 de engrafting FH iHeps en el hígado de ratón/Ldlr- / -/Rag2- / -/Il2rg- / - (LRG). Este ratón quimérico hígado humano es útil para modelos FH y la realización de pruebas de drogas en vivo.
Protocolo
Todos los métodos aquí descritos que implican el uso de animales han sido aprobados por el Comité sobre el uso de animales viven en docencia e investigación (CULATR) de la Universidad de Hong Kong.
1. preparación y las pruebas fenotípicas de ratón
-
Generación de ratones knockout (KO) de inmunodeficientes Ldlr .
- Utilice ratones cepas Ldlr- / -, Rag2- / -y Il2rg- / - (véase Tabla de materiales).
- Cruz Rag2- / - ratones con Il2rglos ratones generar Rag2- / -- / - / Il2rgratones de- / - , luego cruce Ldlr- / - ratones Rag2- / - / Il2rgratones- / - generación de ratones/Ldlr- / -/Rag2- / -/Il2rg- / - (LRG)15. A la edad de 3 a 4 semanas, recoger la DNA de genomic del oído para determinar el genotipo por PCR y secuenciación.
- En la edad de 8 a 12 semanas, utilizar ratones machos LRG como receptores para iHeps para generar ratones quiméricos hígados humanos.
- Alimentar los ratones con una dieta de alto contenido de grasa y colesterol (HFHC) 7 días antes del trasplante para ayudarles a desarrollar hipercolesterolemia iHep.
- Para inducir lesión hepática que facilita la proliferación de iHeps implantada en el hígado, coloque el ratón en un recipiente estéril e irradiar a través de un irradiador gamma γ-rayos en una dosis de 3 Gy 24 h antes del engraftment. A continuación, volver a los ratones a sus jaulas de alojamiento. El estado saludable de estos ratones irradiados puede controlarse mediante la medición de su peso. Ratones con pérdida de peso de 20% o más serán sacrificados.
2. iHep diferenciación y disociación
KO heterozigótico LDLR (+-) u homocigoto iPSCs humano de KO (- / -) o FH paciente-iPSCs con mutaciones heterozigóticas en LDLR (FH iPSCs) se utilizan para producir iHeps. La generación de LDLR +- o- / - iPSCs y FH iPSCs se describe en nuestro anterior informe15.
- Diferenciación dirigida de iPSCs en iHeps
Nota: El método de diferenciación de iPSCs humana en iHeps se modifica de un anterior informe16.- Tres días antes de la diferenciación (día -3), semillas iPSCs en matriz extracelular revestido de placas de 6 pocillos (véase Tabla de materiales) a una densidad de 300.000 células/pozo en 1,5 mL (también de ahora en adelante) de medio de mantenimiento de iPSC humanas (véase tabla de materiales de ) complementado con inhibidor de roca de 5 μm (Y27632). Cultura de las células a 37 ° C en una incubadora humidificada 5% CO2 . Normalmente, iHeps de una placa de 6 pozos son suficientes para engraft 5 ratones.
- 24 horas más tarde (día -2) y 48 h más tarde (día -1), cambiar el medio a medio de mantenimiento de iPSC humanas frescas sin inhibidor de la roca.
Nota: iPSCs antes de diferenciación debe expresar altos niveles de OCT4 y NANOG, que puede ser examinado por RT-PCR cuantitativa, inmunofluorescencia o citometría de flujo. - En el día 0 de la diferenciación, lavan las células con RPMI 1640 una vez y luego añadir RPMI 1640 suplementado con 100 ng/mL A activina y WNT3a de 25 ng/mL.
- En el día 1 y 2 de diferenciación, cambiar el Medio RPMI 1640 suplementado con 100 ng/mL A. activina
Nota: Si hay demasiada muerte celular en esta etapa (días 0-3), hasta el 0,5% de suero bovino fetal (FBS) puede añadirse al medio para mejorar la viabilidad de las células. Sin embargo, le sugerimos de ensayo la cantidad mínima de FBS a añadir para cada línea de iPSC específicas, los FBS exceso también puede afectar a la diferenciación. - En el día 3, lavan las células con DMEM una vez y luego a 2 medio de etapand (reemplazo del 20% de suero, 1 x no esenciales aminoácidos, 2 M L-glutamina, 0.1 M beta-mercaptoetanol y 1% dimetil sulfóxido en medio DMEM). Cambiar el medio día hasta el día 10.
Nota: En el día 7, las células deben han llegado a confluencia y pantalla bordes claros. Puede haber algunas áreas indiferenciadas que aparecen en esta etapa; ignoran si es pequeño el porcentaje de estas áreas. Si el porcentaje es alto, reducir la confluencia de iPSCs en el día 0 y reducir la cantidad de equipos utilizados en la primera etapa de la diferenciación. - En el día 10, lavan las células con medio basal de hepatocito una vez y luego al medio de cultivo de hepatocitos con 20 ng/mL hepática factor de crecimiento humano y 20 ng/mL Oncostatina M para promover la maduración iHep. Cambiar el medio cada día.
Nota: en esta etapa, > 90% de las células debe ser positivo para HNF4A, según citometría de flujo o tinción de inmunofluorescencia. - Día 15 – 17, las células están listas para el engraftment. Opcionalmente, el sobrenadante de cultivo celular puede ser recogido y almacenado a-80 ° C para la cuantificación de la albúmina secretada (Alba) por iHeps.
Nota: en esta etapa, > 80% iHeps debe ser positivo para HNF4A, Alba y α1-antitripsina (AAT) según la tinción de inmunofluorescencia. Unos 60 – 70% del día 17 iHeps debe ser positivo para ASGPR, como se muestra por citometría de flujo. En nuestras manos, iHeps en este período tiene una óptima capacidad de repoblar el hígado del ratón; iHeps puede secretar niveles más altos de Alba in vitro pero también se convierten en senescentes si se retrasa el engraftment.
- Disociación y la carga de iHeps en una jeringa de insulina
- Preparar los materiales y reactivos necesarios:
- 24 h antes de engraftment, descongele la cantidad necesaria (V = 40 μl * número de ratones) de matriz extracelular en un hielo de la caja en un cuarto frío y poner la jeringa de insulina y una caja de 200 puntas μL en un refrigerador de 4 ° C.
- Una hora antes de engraftment, caliente la enzima de disociación celular suplementado con 50 μg/mL de DNasa I a temperatura ambiente y coloque el Medio RPMI 1640 suplementado con reemplazo de suero de 20% en el hielo.
- Tomar imágenes de contraste de fase (100 X y 200 X) de iHeps para registrar su estado, incluyendo la morfología celular, el crecimiento y la densidad celular.
- Lave iHeps con 2 mL/pozo de temperatura Ca2 + y Mg2 +-libre PBS dos veces y luego agregar 1 mL de enzima de disociación celular suplementado con 50 μg/mL de DNasa I en cada pocillo. Vuelva a colocar las células en la incubadora durante 8 – 10 minutos.
Nota: Para mejorar la disociación celular con enzima de disociación celular, se lavan las células con Ca2 + y Mg2 +-libre de PBS. Para maximizar la viabilidad celular, sugerimos disociar no más de 6 pozos por lote a la vez. Además, le sugerimos limitar el tratamiento de enzima de disociación celular a menos de 10 minutos. - Vigilar la morfología de la célula bajo el microscopio. Cuando la mayoría de las células se convierten en redondeada, añadir un volumen igual de fría 1640 RPMI suplementado con reemplazo de 20% de suero a cada pozo, pipetear las células suavemente para despegar de la placa y transferir la suspensión de células a un nuevo tubo de 15 mL.
Nota: Este paso es crítico para la viabilidad de las células cosechadas. Si las células son difíciles de separar de la placa, no importa si algunas de las células se dejan. Si las células separarla como grandes plazas de monocapa, luego pipetee suavemente después de la centrifugación para obtener una suspensión unicelular. - Repita el paso 2.2.4 para cada bien hasta que se recogen las células casi todo atadas. Centrifugar a 200 x g durante 3 min a 4 ° C.
- Quite el sobrenadante y resuspender las células con 2 mL de PBS frío en un tubo de 15 mL. Pipetear las células suavemente para obtener una suspensión unicelular y luego añadir PBS frío hasta un volumen final de 1 mL * número de pozos disociados. Por último, pasar las células un 40 μm filtro de célula a eliminar agregados.
Nota: Normalmente 1-2 x 106 células/pocillo se puede cosechar después de filtrar. - Alícuota de 20 μl de la suspensión de células y añadir 20 μl de solución de azul de tripano 0.4%, luego contar las células usando un contador de células automatizado y registrar la concentración de la suspensión celular como "C". Calcular el volumen requerido (V1 = [106 * (n + 1)] / C, donde n es el número de ratones para ser engrafted) de la suspensión celular (1 millón/ratón) para inyección intrasplenic.
- Alícuota del volumen requerido de la suspensión celular en tubos de 15 mL y centrifugar a 200 x g durante 3 min a 4 ° C.
- Eliminar el sobrenadante, resuspender las células en el volumen adecuado de PBS frío para hacer el volumen de suspensión celular (n + 1) * 55/2 μl (n = número de ratones) y luego añadir un volumen igual de la matriz extracelular para el volumen final de la suspensión celular (n + 1) * 55 μl.
- Coloque la jeringa de insulina frío en hielo, desenchufe el pistón, transferencia 55 μl de suspensión celular en la jeringa y luego poner el pistón hacia atrás. Descargar burbujas con cuidado y vuelva a colocar la jeringa en hielo.
- Repita 2.3.10 hasta que todas las jeringas que hayan sido cargadas con las células. Las jeringas están listas para la inyección.
Nota: Para maximizar la viabilidad celular, se recomienda mantener las células en hielo después de la disociación. Para el 2.2.4–2.2.11 de pasos arriba, asegúrese de que todos los reactivos se conservan a 2 – 8 ° C antes de usar.
- Preparar los materiales y reactivos necesarios:
3. intrasplenic inyección de iHeps
- Anestesiar los ratones con ketamina (100 mg/kg) y xilacina (10 mg/kg) inyectados por vía intraperitoneal. Poner ungüento veterinario en ojos de ratones para evitar la sequedad durante el procedimiento de la anestesia y controlar sus reflejos músculo para observar el efecto de la anestesia y para evaluar el dolor.
- Una vez que los ratones perdieron el reflejo muscular a la estimulación, colocarlos en posición de decúbito lateral derecho. Aplicar una capa gruesa de crema depilatoria para la zona de incisión en el flanco izquierdo de 5 – 8 min. Entonces, retire la crema depilatoria y el cabello frotando la zona con una gasa humedecida en agua.
- Friegue el flanco izquierdo con povidona-yodo o, alternativamente, con etanol al 70% 3 veces seguido por una inmersión final con povidona-yodo para la desinfección.
- En un nivel 2 de bioseguridad gabinete, localizar la posición del bazo, que puede ser visualizado de manera transparente en el flanco izquierdo y luego haga una incisión en la piel y pared abdominal de 0,5 – 1 cm. exteriorizar el bazo extrayendo el tejido adiposo suavemente cerca con puntiagudos pinzas. Estabilizar el bazo con un hisopo suavemente.
- Inserte la aguja de la jeringa de insulina 3-4 mm en el parénquima del bazo e inyectar aproximadamente 50 μl de suspensión celular suavemente. Retraer la aguja y colocar una torunda de algodón sobre el sitio de inyección durante un minuto para evitar el sangrado y derrame de material.
- Regresa el bazo al peritoneo y cerrar la herida con suturas de nylon 5-0. A continuación, mantenga ratones en una cámara caliente/incubadora de 3 – 16 h para volver a su temperatura normal del cuerpo y a revivirlas. Ratones que han sido sometidos a cirugía no son devueltos a la compañía de otros animales hasta que se recuperó completamente.
- Añadir meloxicam (26 μg/mL) para el agua potable e inyecte buprenorfina (50 μg/kg) por vía intramuscular como droga antiinflamatoria y analgésica, respectivamente. Monitor quirúrgico heridas diariamente para prevenir cualquier inflamación.
Nota: Asegúrese de que todos los instrumentos y suministros utilizados en los pasos 4-7 son estériles.
4. prueba de nivel de C-LDL del Plasma
- A los días 0, 7, 14, 21 y 28 post engraftment, refrenan los ratones LRG firmemente para minimizar el movimiento de lado a lado de la cabeza mediante método refrene a dos manos, luego pinchar la vena facial con la lanceta. Sangre comenzará a fluir después del retiro de la lanceta. Recoger alrededor de 50 μl de sangre en tubos de 1,5 mL que contiene 1 μl de EDTA.
Nota: Si el apretón es demasiado apretado, puede reducirse el volumen de sangre recogida y ratones pueden morir debido a la dificultad para respirar. - Mezclar suavemente la sangre por invertir los tubos varias veces y luego centrifugar a 950 x g durante 15 minutos recoge los sobrenadantes y almacenarlas a-80 º C inmediatamente.
- Una vez que todas las muestras se recogen, descongelar el plasma a temperatura ambiente y probar el nivel de C-LDL utilizando un kit de detección de C-LDL según el manual del fabricante.
5. in Vivo pruebas de drogas en ratones quiméricos Engrafted con LDLR +/-y FH iHeps
- Para inducir hipercolesterolemia, alimentar los ratones una dieta HFHC 7 días antes del engraftment.
- En el injerto después de 7 días, tratar a cada grupo de ratones con vehículo (PBS, inyectada por vía subcutánea), 10 mg/kg/semana PCSK9 anticuerpos (una formulación de tipo clínico de anticuerpos monoclonales de PCSK9, inyectada por vía subcutánea también), 10 mg/kg/día de simvastatina (40 mg/L mg / mL en el agua potable), o combinado anticuerpos PCSK9 y simvastatina.
- Recoger el plasma de ratón en el engraftment después días 0 (el día del engraftment), 14, 21 y 28. Almacenar las muestras a-80 º C inmediatamente.
- Una vez que todas las muestras están disponibles, prueba el nivel de LDL del plasma utilizando un kit de detección de C-LDL, según el manual del fabricante.
6. prueba de función endoteliales
La función endotelial es afectada temprana en FH y se puede probar en nuestro modelo de ratón como un indicador de la severidad de la enfermedad o evaluar la mejoría con tratamientos diferentes. Un stereomicrocope, pinzas de disección, tijeras, un miógrafo de alambre, hardware de adquisición (véase Tabla de materiales), y un equipo se necesitan para esto.
- Sacrificar a los ratones por inyección intraperitoneal de 100 mg/kg de fenobarbital. Extraer órganos internos la aorta descendente paralela a la espina dorsal es visible y se diseca por tijeras junto con tejido adyacente y corazón. Diseccionar los aortae con unas tijeras finas y colocar en solución de Krebs oxigenada fría (mM: NaCl 119, 4,7 KCl 2,5 CaCl2, 1 MgCl2, 25 NaHCO3, 1,2 KH2PO4y 11 D-glucosa).
- Transferir los aortae en solución Krebs a una placa Petri recubiertas de silicona. El tejido conectivo para fijar la posición de la aorta sin estirar a lo del PIN. Bajo un estereomicroscopio, uso Pinzas finas las tijeras del resorte y disecar la aorta libre desde el tejido adventicial y graso circundante sin dañar la pared del vaso, luego córtalo en 1,5 a 2 mm segmentos de longitud.
- Cortar un aproximadamente 2 cm largo y 40 μm espesor alambre inoxidable y ponga suavemente a través del lumen de la aorta. Transferir el segmento a la cámara de laringe de alambre llenada con solución de Krebs oxigenada manteniendo el cable.
- Para medir la longitud de los segmentos aortae al estudiar la contractilidad, ponga cada segmento perpendicular entre las mandíbulas y el registro de la lectura (D1) en el micrómetro. Quite el segmento y las mandíbulas se mueven juntos y grabar la lectura (D0). La longitud del segmento sería L = D1-D0.
- Siga la guía del usuario para sujetar el cable y asegúrelo con el destornillador mientras colocar el segmento entre las mandíbulas, pero dejarlo sin estirar.
- Para la normalización antes del experimento, establecer el miógrafo a cero en la posición sin estiramiento. Luego, lentamente mover los maxilares separados y observar el cambio hasta llegar a 3 mN de la tensión de la aorta. Después de 15 minutos, vaciar la solución del compartimiento del miógrafo, reemplazar con solución de Krebs fresca, esperar 15 min y ajustar la tensión a 3 mN de nuevo.
- Cambiar la solución Krebs a 60 mM solución de Krebs que contiene KCl para inducir una contracción de al menos 15 minutos enjuague con solución de Krebs fresca 3 veces.
- Agregar cada vez mayor concentración de fenilefrina (Phe; por ejemplo, de 10 nM a 100 μM). Lavar con solución de Krebs estándar y añadir una sola concentración de Phe en ~ 70% de la máxima contracción de la contracción anterior. Cuando la contracción es estable, añadir concentraciones crecientes de acetilcolina (ACh; por ejemplo, de 1 o 3 nM a 10 o 30 μm) para inducir vasodilatación. ACh se añade aproximadamente 2 minutos de intervalo.
Nota: En algunos segmentos aórticos con pequeña contracción inducida por la Phe, por ejemplo inferior al 30% de KCl inducida por contracción, U46619 (otro vasoconstrictor) a una concentración de 1 nM a 30 nM se puede utilizar para inducir una contracción estable que es mayor del 70% de Contracción inducida por el kCl. - Limpiar la laringe según el manual del fabricante.
- Usando software de análisis de datos (véase Tabla de materiales), record la fuerza (F) después de cada adición de fármacos. Señalar el marcador de tensión basal (Fbasal) para la medida relativa, mueva la flecha hasta el punto más alto después de Phe como FPhey luego hacia el punto más bajo después de cada adición de ACh como FACh. Calcular la vasodilatación dependiente del endotelio inducida por ACh (EDV) por % relajación = (ACh-Cbasal) / (FPhe-Fbasal) en el eje y. Preparar una curva de respuesta de concentración en software estadístico usando log10 valor de concentración en M en el eje x.
- Analizar la diferencia estadística, el área bajo la curva de cada segmento de un ratón y analizar la diferencia del área bajo la curva entre grupos mediante ANOVA unidireccional. Los puntos individuales también pueden ser analizados si es necesario.
7. prueba de iHep repoblación en el hígado de ratón
- Al final, sacrificar a los ratones mediante la inyección intraperitoneal de 100 mg/kg de fenobarbital.
- Recoja el plasma mediante punción cardiaca. Diseccionar los lóbulos del hígado usando las tijeras oftálmicas, luego poner hígados en un peri-plato de 10 cm y lavar dos veces con solución salina. Eliminar la solución salina de la superficie del hígado con papel absorbente, luego corte los lóbulos en alrededor de pedazos de 0.6 cm de longitud. Fijar los lóbulos del hígado en formalina al 10%.
- Incorporar los hígados fijados en parafina y usando un sistema y un micrótomo de deslizamiento, de proceso respectivamente, según las instrucciones del fabricante del tejido.
- Calentar los portaobjetos a 60 ° C durante 1 h derretir la cera. Luego, sumerja el portaobjetos en xileno durante 5 minutos dos veces y rehidratar el tejido con etanol 100%, 90% y 70% sucesivamente.
- Sumerja los portaobjetos en la cámara de diapositivas que contiene aproximadamente 50 mL de solución de recuperación del antígeno y luego poner la cámara en la olla a presión, 120 ° C para el lavado de 1,5 min las diapositivas suavemente con la pipa de agua durante 5 minutos.
- Mancha de las secciones con anticuerpos primarios (alrededor de 100 μl/sección) dirigidos a Alba humano (media) y antígeno de núcleos humanos (hNA). Luego, se tiñen con anticuerpos secundarios conjugados con una etiqueta fluorescente o con peroxidasa de rábano (que reacciona con el kit de detección de DAB).
- Para calcular el porcentaje de media + áreas y hNA + células, escanear las diapositivas manchadas con anti-media y anti-hNA y reaccionó con DAB utilizando una diapositiva automatizada sistema de la exploración para obtener imágenes de la sección.
Nota: Toda sección escanear imágenes son útiles para calcular eficiencia repoblación de una manera imparcial basada en áreas de media + o hNA + células en los hígados de tinción de inmunohistoquímica. Como un método alternativo para controlar eficacia de repoblación iHep, nivel del plasma albúmina humana puede probarse con el equipo humano de Alba ELISA específico. - Tomar imágenes instantáneas para cubrir la diapositiva entera utilizando la diapositiva digital asociada ver software bajo vista X 5. Cuantificar el porcentaje de media + áreas, para cada imagen instantánea, utilizan el software de imágenes de microscopio para calificar el área positivo (P) y el área total (T) de la imagen e imagen J para calificar el área en blanco (B). Se expresa el porcentaje de zonas de media + P/(T-B) * 100%. Para cada grupo, deben seleccionar al menos 3 ratones. Y para cada ratón, deben seleccionarse por lo menos 4 secciones de diferentes posiciones del hígado.
- Para cuantificar el porcentaje de hNA + células, para cada imagen instantánea, seleccione al azar 1/16 del área con una software de procesamiento de imagen y luego contar manualmente el número de núcleos total (T) y hNA + núcleos (N). El porcentaje de hNA + se expresa en N/T * 100%. Para cada grupo, deben seleccionar al menos 3 ratones. Para cada ratón, deben seleccionarse por lo menos 4 secciones de diferentes posiciones del hígado.
Resultados
Dirigido iPSCs diferenciación humana en iHeps
Al llegar a la confluencia de 70%, iPSCs humanas se distinguen en iHeps con un protocolo de 3 pasos16 (panel superior de lafigura 1 ). Después de 3 días de diferenciación de endodermo, iPSC colonias ser aflojadas extendiéndose a confluencia completo (panel inferior de lafigura 1 ). Luego, con 2 medio etapa dend , hepatoblasts aparecen y proliferan. Estas células están llenas pero mostrar bordes claros en esta etapa (día 7, panel inferior de la figura 1 ). Después de 17 días de diferenciación, polarizados iHeps con morfología típica hexagonal aparece (panel inferior de lafigura 1 ). Estos iHeps expresan marcadores pHH, incluyendo AAT y Alba (figura 2A). Por otra parte, la proporción de ASGPR + iHeps debe ser relativamente alta, medida por el flujo cytometry (figura 2B)15.
Generación de un FH en Vivo enfermedad modelo usando FH iHeps
Para ayudar a LRG ratones desarrollar hipercolesterolemia, alimentan con una dieta HFHC 7 días antes de engraftment (día -7). En el día del engraftment (día 0), ratones LRG pantalla plasma alrededor 3-fold nivel de LDL-C (aproximadamente 600 mg/dL, figura 3B). Día que 15 – 17 iHeps son engrafted en ratones LRG intrasplenic inyectable; Estos iHeps residen en la parenquimia del hígado pronto y proliferan allí (Figura 3A). En el punto final, hígados de estos ratones quiméricos son recogidos y fija, se tiñe con media y hNA, que deben mostrar una prueba clara de repoblación hígado mediada situado en hígado de ratón LRG basado en coloración para media y hNA (Figura 4A-E). En nuestras manos, LDLR +/-y FH iHeps podría reducir C-LDL del plasma nivel significativamente 21 días después el engraftment (figura 4F). En este punto, ratones quiméricos hígados humanos de FH pueden utilizarse para probar terapias para FH.
Validación del modelo de ratón quimérico hígado humano de FH con fármacos disponibles
Para validar nuestro modelo, se utilizaron 2 conocidos fármacos hipolipemiantes de C-LDL, simvastatina y PCSK9 anticuerpos (figura 5A). Nuestros datos demuestran que 21 días después del tratamiento, PCSK9 anticuerpos tienen una capacidad más fuerte para bajar el LDL y EDV que simvastatina en ratones quiméricos FH (figura 5B-D). En particular, la reducción del porcentaje observado de PCSK9 anticuerpos en ratones quiméricos FH de plasma LDL-C es similar al reportado en los ensayos clínicos4. Estos resultados demuestran la utilidad potencial de los ratones quiméricos LRG engrafted con FH iHeps para la prueba preclínica de nuevos fármacos para FH.

Figura 1: dirigido iPSCs diferenciación de humano en el panel de iHeps.Top, línea de tiempo para la diferenciación de iPSC en iHeps; los medios de comunicación y las citocinas clave se muestran para cada etapa de. (Panel inferior) Imágenes de contraste de fase representativos de diferentes momentos de la diferenciación iHep. KSR: reemplazo de suero octavos de final; HCM: medio de cultivo de hepatocitos; HGF: factor de crecimiento; OSM: Oncostatina M. haga clic aquí para ver una versión más grande de esta figura.

Figura 2: caracterización de iHeps producido con protocolo de diferenciación modificado. Inmunofluorescencia (A) de iHeps en diversas etapas de la diferenciación. Los núcleos se tiñen en azul en las composiciones combinadas. Bar (B) gráfico muestra el porcentaje de ASGPR + iHeps derivados obtenidos en el día 17, según lo medido por citometría de flujo. Las muestras se midieron en los 3 experimentos independientes; se muestran los valores promedio y las barras de error indican la desviación estándar (SD). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Generación de un modelo de enfermedad FH En Vivo con iHeps. (A) tiempo de línea para la generación de ratones quiméricos hígados humanos por inyección intrasplenic de FH iHeps en ratones LRG. Bar (B) el gráfico muestra que alimentar ratones LRG con dieta HFHC conduce a mucho mayor nivel de LDL-C (n = 10). Valores de P se indicaron en la figura y se obtuvieron utilizando una prueba de t no pareada; se muestran los valores promedio y las barras de error indican el error estándar de la media (SEM). Panel B se modifica a partir figura 3I de nuestro anterior informe15. Haga clic aquí para ver una versión más grande de esta figura.
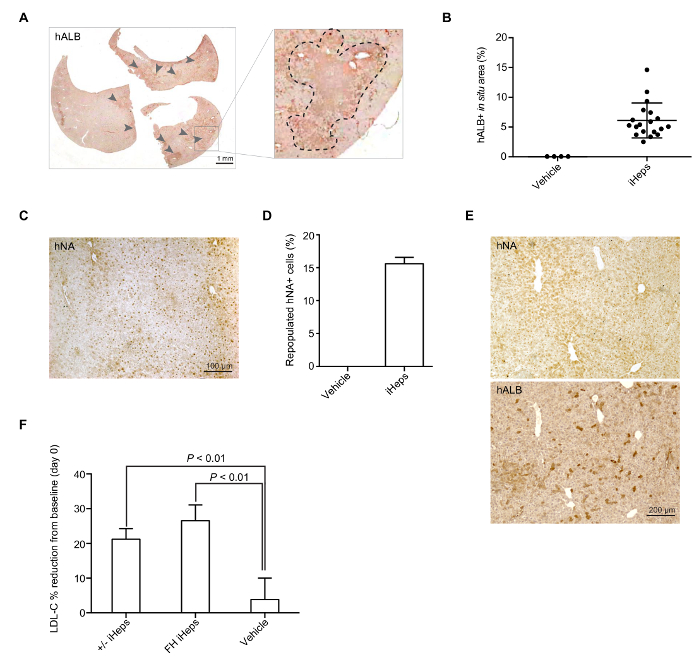
Figura 4: iHep transmitida por repoblación de hígado de ratones LRG. (A) todo análisis de sección imagen representativa de la media de tinción en un hígado de ratón repoblado con LDLR +-iHeps. Las flechas indican grupos de humanos iHeps engrafted en el hígado del ratón; secciones de zoom se muestran en el panel derecho. (B) dispersión diagrama gráfico muestra el porcentaje de repoblado media + correspondientes a áreas que contienen situado en el hígado de un ratón (de diferentes donantes iPSCs), cálculo se basó en imágenes de todo análisis de sección (n = 19). Se muestran los valores promedio y barras de error indican imágenes representativas SD. (C) de la coloración immunohistochemical para hNA en un hígado de ratón con iHeps FH implantada. (D) gráfico de barras muestra el porcentaje de repoblación hNA + iHeps (de diferentes donantes iPSCs) en LRG hígados de ratón (n = 3). Se muestran los valores promedio y barras de error indican media SD. (E) y hNA tinción en dos secciones consecutivas de un hígado de ratón con iHeps de tipo salvaje. (F) gráfico de barras muestra el porcentaje de reducción de LDL-C desde el inicio de plasma en el engraftment después del día 21; n = 5 para LDLR +-iHeps y n = 6 para iHeps FH y el vehículo. Valores de P se indicaron en la figura y se obtuvieron utilizando una prueba de t no pareada; significa que los valores se muestran barras de error indican SEM. paneles B, D y E se modifican de la figura 3-3I de nuestro anterior informe15. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5 : PCSK9 anticuerpos muestran más LDL reducción de capacidad que simvastatina en ratones LRG quimérica hígado humano. (A) vista esquemática de la droga en vivo pruebas de enfoque utilizando ratones quiméricos hígados humanos de FH. (B y C) porcentaje de cambio de plasma LDL-C de la línea de base a los días 14, 21 y 28 en ratones quiméricos FH alimentados con la dieta HFHC y tratados con los medicamentos indicados; n indica el número de ratones. Valores de P fueron obtenidos mediante una prueba de Kruskal-Wallis; se muestran los valores promedio y las barras de error indican SEM. (D) EDV en respuesta al aumento de las concentraciones de ACh. Valores de P se indican en la figura para la concentración indicada. Valores de P fueron obtenidos usando ANOVA dos vías ajustado con la comparación múltiple de Dunnett; barras de error indican que SEM. figura 5 se modifica la Figura 4A-4C y 5A de la figura de nuestro anterior informe15. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Estudios previos usando iHeps en roedores han confirmado que son una manera eficaz para el estudio de enfermedades hepáticas hereditarias17. Aún más ampliar el uso de esta tecnología y porque los modelos animales de FH actuales son subóptimos, engrafted FH iHeps en ratones LRG y demostró que la implantada LDLR +- o heterozigótica LDLR-iHeps FH mutado puede reducir el nivel de C-LDL del plasma de ratones y responder a la reducción de lípidos drogas en vivo.
Hay 3 pasos críticos en nuestro protocolo para la generación de humanos ratones quiméricos FH hígado utilizando iHeps:
1) producción de iHeps de alta calidad a través de diferenciación dirigida. Dada la variabilidad clonal entre iPSC líneas18, es importante utilizar iPSCs isogénicas para comparaciones adecuadas y para probar la eficiencia de la diferenciación de situado de la línea de la madre antes de realizar la ingeniería y el engraftment.
2) situado correcto cargar en la jeringa. A diferencia de otros protocolos, utilizamos matriz extracelular 50% (concentración final, v/v) para suspender de nuevo iHeps y luego subirlas en jeringa de insulina. Creemos que la matriz extracelular protege a las células y proporciona un microambiente que facilita migración de situado en el hígado del bazo. Las burbujas son un factor letal para la cirugía y deben evitarse totalmente en la jeringa.
3) corregir el número de células implantadas. Sobrecarga de células también puede conducir a la tasa de mortalidad alta. Recomendamos engrafting iHeps 1 millón por ratón de 25 – 30 g.
Nuestro protocolo también tiene algunas limitaciones: la lesión del higado inducida por la irradiación es moderada y dosis única, y el estado de maduración de nuestra iHeps no es comparable a pHH. Relaciona ambas consideraciones, el grado de quimerismo de nuestro modelo es similar a los informes recientes que describe NOD/Lt-SCID/IL-2Rγ−/− ratones o ratas Gunn engrafted con derivados de iPSC iHeps17,19 , pero significativamente menor que la RFA ratones o ratones transgénicos uPA engrafted con pHH. Para superar esta advertencia, por un lado, uno podría optimizar aún más el protocolo de diferenciación hepática para mejorar la maduración de los iHeps. Por otro lado, ratones LRG podrían ser cruzados con los ratones de la RFA para generar ratones Ldlr- / -/Fah- / -/Rag2- / -/Il2rg- / .
En Resumen, aquí hemos descrito un protocolo detallado para generar animales quiméricos hígados humanos con FH iHeps y para probar la funcionalidad de la iHeps implantada. Lo importante, estos ratones quiméricos pueden utilizarse para en vivo las pruebas de drogas. Nuestro modelo es probable que puede ser optimizado por mejorar la funcionalidad de iHeps o anulación de genes adicionales (por ej., Fah) en el recipiente de LRG ratones y será útil para investigar mecanismos patológicos de la enfermedad y realizar la preclínica estudios.
Divulgaciones
H.-F.T. es el coordinador nacional e investigador del estudio de los resultados de la odisea patrocinado por Sanofi y Regeneron Pharmaceuticals.
Agradecimientos
Este trabajo fue apoyado por la Shenzhen Ciencia y tecnología Consejo básico programa de investigación (JCYJ20150331142757383), programa de investigación prioridad estratégica de la Academia China de Ciencias (XDA16030502), Hong Kong Research Grant Consejo tema investigación Esquema (T12-705/11), programa de cooperación del Consejo de becas de investigación de la región administrativa especial de Hong Kong y la Fundación Nacional de Ciencias naturales de China (N-HKU730/12 y 81261160506), equipo proyecto de investigación de Ciencias naturales de Guangdong Fundación (2014A030312001), Guangzhou ciencia y tecnología programa (201607010086) y la provincia de Guangdong programa ciencia y tecnología (2016B030229007 y 2017B050506007).
Materiales
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 40 µm Cell strainer | BD | B4-VW-352340 | |
| 6-Well plate | Thermofisher | 140675 | Extracellular matrix coated |
| Accutase | Millipore | SCR005 | |
| Acetylcholine | Sigma Aldrich | A6625 | Dissolve in water |
| Antigen retrieval solution | IHC World | IW-1100-1L | |
| Calcium chloride | Sigma Aldrich | C8106 | CaCl2 |
| Cell dissociation enzyme | Thermofisher | 12604-013 | TrypLE |
| D-glucose | Sigma Aldrich | D8270 | |
| Dimethyl sulfoxide | Sigma Aldrich | D5879 | DMSO |
| DMEM | Thermofisher | 10829 | Knockout DMEM |
| DNase I | Roche | 11284932001 | |
| EDTA | USB | 15694 | 0.5 M, PH=8.0 |
| Extracellular matrix (for cell suspension) | Corning | 354234 | Matrigel |
| Extracellular matrix (for iHep differentiation) | Corning | 354230 | Matrigel |
| Hepatocyte basal medium | Lonza | CC-3199 | |
| Hepatocyte culture medium | Lonza | CC-3198 | |
| High-fat and high-cholesterol diet | Research Diet | D12079B | |
| Human Activin A | Peprotech | 120-14E | |
| Human hepatocyte growth factor | Peprotech | 100-39 | |
| Human iPSC maintenance medium | STEMCELL Technologies | 5850 | mTeSR1 |
| Human oncostatin M | Peprotech | 300-10 | |
| Ketamine 10% | Alfasan | N/A | |
| L-glutamine | Thermofisher | 35050 | |
| LDL-C detection kit | WAKO | 993-00404 and 993-00504 | |
| Magnesium chloride | VWR | P25108 | MgCl2 |
| Meloxicam | Boehringer Ingelheim | NADA 141-213 | |
| Monopotassium phosphate | USB | S20227 | KH2PO4 |
| Non-essential amino acids | Thermofisher | 11140 | |
| PBS | GE | SH30256.02 | Calcium and magnesium-free |
| PCSK9 antibodies | Sanofi and Regeneron Pharmaceuticals | SAR236553/REGN727 | Alirocumab |
| Phenobarbital | Alfamedic company | 013003 | |
| Phenylephrine | RBI | P-133 | Dissolve in water |
| Potassium chloride | Sigma Aldrich | P9333 | KCl |
| Povidone-iodine | Mundipharma | Betadine | |
| Recombinant mouse Wnt3a | R&D Systems | 1324-WN-500/CF | |
| ROCK inhibitor Y27632 | Sigma Aldrich | Y0503-5MG | |
| RPMI 1640 | Thermofisher | 21875 | |
| Serum replacement | Thermofisher | 10828 | |
| Silicone coated petri dish | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Simvastatin | Merck Sharp & Dohme | ZOCOR | |
| Sodium bicarbonate | Sigma Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma Aldrich | S7653 | NaCl |
| Trypan blue solution 0.4% | Thermofisher | 15250061 | |
| U-46619 | Cayman | 16450 | Dissolve in DMSO |
| Xylazine 2% | Alfasan | N/A | |
| β-mercaptoethanol | Thermofisher | 31350 | |
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| AAT | DAKO | A0012 | 1:400 |
| ALB | Bethyl Laboratories | A80-129 | 1:200 |
| ASGPR | Santa Cruz | Sc-28977 | 1:100 |
| HNF4A | Santa Cruz | Sc-6557 | 1:35 |
| NANOG | Stemgent | 09-0020 | 1:200 |
| OCT4 | Stemgent | 09-0023 | 1:200 |
| Name | Company | Catalog Number | Comments |
| Mice | |||
| Il2rg-/- | Jacson lab | 003174 | |
| Ldlr-/- | Jacson lab | 002077 | |
| Rag2-/- | Jacson lab | 008449 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Automated cell counter | Invitrogen | Countess | |
| Gamma irradiator | MDS Nordion | Gammacell 3000 Elan II | |
| Insulin syringe | BD | 324911 | |
| Powerlab | ADInstruments | Model 8/30 | |
| Slides scanning system | Leica biosystems | Aperio scanScope system | |
| Sliding Microtome | Leica biosystems | RM2125RT | |
| Stereomicrocope | Nikon | SMZ800 | |
| Tissue processing system | Leica biosystems | ASP200S | |
| Wire myograph | DMT | 610M | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| Digital slide viewing software | Leica | Aperio ImageScope Version 12.3.2 | |
| Image J | NIH | Version 1.51e | |
| Image processing software | Adobe | Photoshop CC Version 2015 | |
| Microscope imaging software | Carl Zeiss | AxioVision LE Version 4.7 |
Referencias
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Endo, A. The discovery and development of HMG-CoA reductase inhibitors. J Lipid Res. 33 (11), 1569-1582 (1992).
- Dubuc, G., et al. Statins upregulate PCSK9, the gene encoding the proprotein convertase neural apoptosis-regulated convertase-1 implicated in familial hypercholesterolemia. Arterioscler Thrombo Vasc Biol. 24 (8), 1454-1459 (2004).
- Robinson, J. G., et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 372 (16), 1489-1499 (2015).
- Fitzgerald, K., et al. Effect of an RNA interference drug on the synthesis of proprotein convertase subtilisin/kexin type 9 (PCSK9) and the concentration of serum LDL cholesterol in healthy volunteers: a randomised, single-blind, placebo-controlled, phase 1 trial. Lancet. 383 (9911), 60-68 (2014).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. J Clin Invest. 92 (2), 883-893 (1993).
- Watanabe, Y. Serial inbreeding of rabbits with hereditary hyperlipidemia (WHHL-rabbit). Atherosclerosis. 36 (2), 261-268 (1980).
- Carpentier, A., et al. Engrafted human stem cell-derived hepatocytes establish an infectious HCV murine model. J Clin Invest. 124 (11), 4953-4964 (2014).
- Tateno, C., et al. Near completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol. 165 (3), 901-912 (2004).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Soldner, F., et al. Generation of isogenic pluripotent stem cells differing exclusively at two early onset Parkinson point mutations. Cell. 146 (2), 318-331 (2011).
- Bissig, K. D., et al. Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment. J Clin Invest. 120 (3), 924-930 (2010).
- Azuma, H., et al. Robust expansion of human hepatocytes in Fah(-/-)/Rag2(-/-)/Il2rg(-/-) mice. Nat Biotechnol. 25 (8), 903-910 (2007).
- Bissig-Choisat, B., et al. Development and rescue of human familial hypercholesterolaemia in a xenograft mouse model. Nat Commun. 6, 7339 (2015).
- Yang, J., et al. Generation of human liver chimeric mice with hepatocytes from familial hypercholesterolemia induced pluripotent stem cells. Stem Cell Rep. 8 (3), 605-618 (2017).
- Kajiwara, M., et al. Donor-dependent variations in hepatic differentiation from human-induced pluripotent stem cells. Proc Natl Acad Sci USA. 109 (31), 12538-12543 (2012).
- Chen, Y., et al. Amelioration of hyperbilirubinemia in gunn rats after transplantation of human induced pluripotent stem cell-derived hepatocytes. Stem Cell Rep. 5 (1), 22-30 (2015).
- Ortmann, D., Vallier, L. Variability of human pluripotent stem cell lines. Curr Opin Genet Dev. 46, 179-185 (2017).
- Liu, H., Kim, Y., Sharkis, S., Marchionni, L., Jang, Y. Y. In vivo liver regeneration potential of human induced pluripotent stem cells from diverse origins. Sci Transl Med. 3 (82), 82ra39 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados