Method Article
シングル出芽酵母細胞での寿命と細胞表現型を測定するためのマイクロ流体デバイスを使用しました
要約
この記事では、マイクロ流体チップの生産と寿命と、単一の酵母細胞の細胞表現型を測定するためのマイクロ流体実験のセットアップのために最適化されたプロトコルを提示します。
要約
Budding yeast Saccharomyces cerevisiae is an important model organism in aging research. Genetic studies have revealed many genes with conserved effects on the lifespan across species. However, the molecular causes of aging and death remain elusive. To gain a systematic understanding of the molecular mechanisms underlying yeast aging, we need high-throughput methods to measure lifespan and to quantify various cellular and molecular phenotypes in single cells. Previously, we developed microfluidic devices to track budding yeast mother cells throughout their lifespan while flushing away newborn daughter cells. This article presents a method for preparing microfluidic chips and for setting up microfluidic experiments. Multiple channels can be used to simultaneously track cells under different conditions or from different yeast strains. A typical setup can track hundreds of cells per channel and allow for high-resolution microscope imaging throughout the lifespan of the cells. Our method also allows detailed characterization of the lifespan, molecular markers, cell morphology, and the cell cycle dynamics of single cells. In addition, our microfluidic device is able to trap a significant amount of fresh mother cells that can be identified by downstream image analysis, making it possible to measure the lifespan with higher accuracy.
概要
出芽酵母は、研究の高齢化で強力なモデル生物です。しかしながら、酵母における従来の寿命アッセイは労働集約的でなく、低スループット1、2だけでなく顕微解剖、に依存しています。彼らの年齢としてまた、従来の顕微解剖のアプローチは、単一の母細胞の様々な細胞および分子機能の詳細図を提供していません。マイクロ流体デバイスの開発は、酵母寿命を測定するだけでなく、母細胞3、4、5、6、7、8の寿命全体の分子マーカー及び様々な細胞の表現型に従うように自動化された手順を可能にしました。酵母細胞は、マイクロ流体デバイス内にロードされた後、それらは、自動時間ラップを用いて顕微鏡下で追跡することができます電子イメージング。寿命、サイズ、蛍光レポーター、細胞形態、細胞周期動態、 等を含む、撮像処理ツールの助けを借りて、様々な細胞及び分子表現型は3を抽出することができ、6、8、その多くは、使用して得ることが困難または不可能です従来の顕微解剖方法。マイクロ流体デバイスは、数年前に3、4、6、7彼らの開発に成功以来、酵母の老化の研究で注目を集めています。いくつかのグループが、その後、以前のデザイン5のバリエーションに公開している、と多くの酵母ラボは、彼らの研究のためのマイクロ流体デバイスを採用しています。
指数関数的な成長を受けて、細胞培養では、観察のために利用可能な老人母細胞の数はminiscuですル。したがって、寿命測定のためのマイクロ流体デバイスの一般的な設計原理は、母細胞を保持し、娘細胞を除去することです。そのようなデザインは、酵母が非対称細胞分裂を受けるという事実を利用します。デバイス意志トラップ大きな母細胞内の構造と小さな娘細胞を洗い流すことを可能にします。この資料に記載のマイクロ流体チップは、トラップ母細胞へのソフトポリジメチルシロキサン(PDMS)パッド(垂直鉛筆列)( 図1)を使用します。同様の設計のデバイスは、以前に3、4、6、7報告されています。このプロトコルは、マイクロ流体デバイスとタイムラプスイメージング実験のために最適化された単純セルローディング方式を製造するために簡単な手順を使用します。マイクロ流体デバイスの重要なパラメータの一つは、トラップ母細胞に使用さPDMSパッドの幅です。当社のDeviceは、その寿命全体で追跡することができ、新鮮な母細胞のかなりの部分を含め、各パッドの下に、より母細胞を維持することができ、より広いパッドを使用しています。細胞は、多くの世代場合や全体寿命を通して観察が必要であるために追跡する必要がある場合に寿命の測定に加えて、このプロトコルは、単一細胞タイムラプスイメージング実験のために有用です。
プロトコル
1.シリコンウェーハの金型製作
注:フォトマスクは、AutoCADのソフトウェアで設計し、商業の会社によって製造されています。このデザインは異なるパターン(の三つの層が含ま補足ファイル1 )。第一、第二、及び第三の層の高さは、それぞれ、約4ミクロン、10ミクロン、および50ミクロンです。シリコンウェハモールドは、ソフトリソグラフィー9、10を用いてフォトマスクから作成されました。
- 水蒸気を蒸発させ、10分間200℃でシリコンウエハを焼きます。シリコンウェハ上にコートネガフォトレジストSU-8をスピン。
注:30秒間2000rpmで第二の層を生成するために30秒間3000rpmで第一の層、SU-8 2010を生成するために30秒間5000rpmでスピンコートSU-8 3005及びSU-8 3025を生成します第三層。 - ソフトベークトンの前に塗布されたウェハ彼は、パターン転写。合わせ、マスクアライナを使用して「直接接触」モードでウエハを露光します。
注:ソフトベーク第一層のために95℃で2分、第二層のために95℃で3分間、第3層のために95°Cで15分間ウェハ。第二層、第3層のために200ミリジュール/ cm 2のための第一の層、130ミリジュール/ cm 2で100ミリジュール/ cm 2の露光量を使用します。 - 露光後、ウェハをポストベークし、SU-8現像液を使用してそれを開発。 N 2ガン及びハードベーク30分間200℃でウエハを用いてウェハを乾燥させます。
注:シリコンウェーハモールドは、パターン側を上に向けて、スコッチテープを用いて直径15cmのプラスチック製ペトリ皿に固定されています。通常、我々は、複数のマイクロ流体チップを同時に製造することを可能にする同じ金型、上のいくつかの同一のチップ構造を置きます。各金型は、マイクロ流体チップを製造するために何回も再使用することができます。
2.マイクロ流体チップ製造
- バランスの上にきれいな計量ボートを置き、風袋引き。重ボートにPDMSベースの50グラムを注ぎます。
- (PDMSベースから1:10の重量/重量比)計量ボートにPDMS硬化剤を5g加えます。
注:このボリュームは、金型と直径15cmのペトリ皿に基づいています。異なるサイズのペトリ皿を使用する場合、試薬の量を調整します。 - 使い捨てピペットを用いてPDMSベースと硬化剤を攪拌します。計量ボートの端からスタートし、徐々に内側に移動します。小さな気泡が混合物全体に形成されるまで、数分間十分に攪拌。完全な混合は、PDMSの重合のために不可欠です。
- ペトリ皿にゆっくりと混合物を注ぎます。混合物を完全にシリコンウェハ型をカバーしなければなりません。
- PDMSの混合物からすべての気泡を除去するために10分間真空中でペトリ皿を置き。気泡が混合物の表面に残っている場合は、それらを吹き飛ばすためにピペットを使用しています。
- シリコンをインキュベート約2時間75℃のオーブンでPDMSを有するウエハー型。
- 穏やかウエハ型の構造への損傷を回避すること、シリコンウェハモールドオフ重合PDMSの層を剥がします。あるいは、単一のエッジ工業用カミソリの刃を使用して、パターンの周囲に最小5 mmのマージンを有するシリコンウェハ型から直接PDMSを切断;穏やかウエハモールドオフPDMS層を剥離。
- パターン面を上にしてベンチにPDMS層を配置してください。注意深く建設損傷を避けるために、各単一チップのエッジから十分なマージンを保持し、単一エッジ工業用カミソリの刃で個々のチップを切り出しました。
- パターン面を上に向けて、チャネルの両側に入口と出口の円を通ってまっすぐに穴をパンチするパンチペン(0.75 mmのID)を使用します。
注:これらの穴は、媒体の流れのための経路を作成します。したがって、円を通過し、PDMS層を介してすべての方法をパンチすることが重要です。に確認してください穴からPDMS列を削除します。 - 穴に再びパンチペンニードルを挿入することにより、すべてのパンチ穴を確認してください。針が何の詰まりがないことを示し、他の側から出てくることができていることを確認します。その後、優しくダスト粒子をきれいにテープをはがし、パターン面にテープを適用します。このステップを少なくとも3回繰り返します。滅菌を維持するために、PDMS上のスコッチテープのきれいな作品を残します。
- PDMSの反対側に、この手順を繰り返し、同様にテープの最後の部分を残します。
- 0.13〜0.17ミリメートルの厚さ24ミリメートル×30ミリメートルのカバーガラスを準備します。表面を殺菌する除塵装置でガラス上に70%エタノールを噴霧し、乾燥しました。さらに、ガラスは、オートクレーブ水で洗浄し、除塵機で乾燥させることができます。
- プラスチック板にカバーガラスとPDMSを転送します。 PDMSからスコッチテープを外し、上向きパターン側に配置します。転送時のパターン面との接触を避けてください。
- プラズマ機でプラスチック板を置き。 PDMSと次のような動作パラメータを使用して親水性表面レンダリングするカバーガラスに酸素プラズマ処理を適用する:曝露を、75秒;ガスの安定化、20 CC /分;圧力、200;そして、電力、100 W.
- 注意深く両方の親水性表面(プラズマ処理中上向き面)接続、カバーガラス上にPDMSを置きます。 PDMSとカバーガラスの間に気泡がないことを確認します。
- 少なくとも2時間75℃のオーブン中にPDMSチップをインキュベートします。
注:欠損マイクロフルイディクスは、実験中に顕微鏡上に液漏れの原因となります。したがって、わずかにピンセットで縁からPDMSを持ち上げてPDMSとカバーガラスとの間の結合を確認することが重要です。穏やかに成功した結合を示し、カバーガラスからそれを分離してはならないPDMSを持ち上げます。
3.テストの準備
- チューブの準備。
- 別々に1日PDMSチップの製造前に70%エタノール溶液中で入力と出力管を水没。
- チューブを洗浄するためにオートクレーブ水で5 mLの注射器を埋めます。注射器にチューブを接続し、水でチューブを洗い流すことにより、各チューブを洗浄します。
- エタノール残留物をきれいに洗浄工程を少なくとも3回繰り返します。
- 構造は一貫して無傷であることを確認するために10倍の対物レンズを備えた光学顕微鏡下でPDMSチャネルを調べます。スコッチテープを使用して、顕微鏡プラットフォームにPDMSチップを安定化させます。
注:最初にデバイスを作製する場合は特に、バックアップのチップが存在することを確認するために、ステップ2で、一度に複数のチップを作ります。 - オートクレーブ処理水で5 mLシリンジを埋めます。シリンジポンプにシリンジを固定し、対応する入力及び出力管を挿入します。約10分間、チップを洗浄するために750μL/ hに洗浄速度を設定します。分岐流路に空気の泡この期間中に洗い流されるべきです。残留気泡がある場合、手動で気泡を除去するために速度を調整。
- 酵母サンプル調製。
- 3,000×gで5分間のための2つの1.5 mlのマイクロ遠心チューブへmLで調製した酵母試料(OD 600 0.6〜0.8)の転送1及び遠心分離機。
- 各チューブからの上清の大部分を除去し、0.5 mLのサンプルを形成するために、残りを組み合わせます。
- シリンジポンプを一時停止し、PDMSチップからの入力管を取り除きます。
- 手動で各入力チューブに(長さ1~2センチメートル)、小さな気泡を吸引するシリンジポンプを逆転。酵母サンプルを吸引するために移動します。気泡は、サンプルの境界を示し、描かれているどのくらいのサンプルを示します。
注:注射器内に試料を吸引しないでください。 - バックPDMSチップに入力されたチューブを挿入し、750μL/ hの速度で細胞をロードするためにポンプを再始動。
- 10分間にシリンジポンプを残しますnおよび顕微鏡下での細胞のローディングの進行を調べます。成功したロード柱を一時停止の60%以上下になるトラップ細胞。
- 栄養液に切り替えて、細胞培養のための400μL/ hまでの速度を調整します。
- 顕微鏡のための観察位置を選択します。
注:寿命測定のために、画像は、40X対物レンズを備えた光学顕微鏡で一回15分毎に採取しました。蛍光レポーター分析のために、画像は60倍のオイル対物レンズを備えた蛍光顕微鏡で一度15分毎に採取しました。
結果
実験後、細胞および多くの細胞及び分子表現型の寿命が記録タイムラプス画像から抽出することができます。各細胞から抽出することができる異なる機能の数があるので、解析の最初のステップは、位置とセルの境界と追跡されている様々なイベントのタイミングを含む細胞およびイベントを、注釈を付けるようになっています出芽イベントとして。これらのアノテーションは、それが簡単に細胞の同じセットに戻ることにし、将来的に異なる特徴を分析します。そのようなImageJの11および関連のプラグインとして、画像解析ソフトを用いて、表現型のリストは、その後、細胞の記録された注釈を用いて画像データから抽出することができます。
マイクロ流体デバイスを用いて測定した表現型のいくつかの例を以下に示します。酵母の寿命表現型各捕捉された母細胞によって産生さ芽の数をカウントし、カプラン - マイヤー推定と推定することによって得ることができます。当初、マイクロ流体デバイス内に捕捉された細胞は、未知の年齢です。これらの未知の年齢由来寿命測定の偏りを最小限にするために、従来の方法は、寿命4、7を較正するために捕捉された細胞上芽瘢痕の平均数を用います。しかし、出芽痕の測定は、細胞の追加の染色を必要とし、バイアスの唯一の間接的な推定値を提供します。このプロトコルを使用して、デバイスが頻繁に既に捕獲された細胞からオフ出芽新鮮な娘細胞をトラップします。次いで、これらの細胞は母細胞に変わります。このような細胞は、私たちの下流の画像解析ソフト( 動画1)を用いて同定することができます。これらの新鮮な母細胞は、より正確な寿命測定を提供します。 図2に示すように、新鮮母細胞の寿命曲線はコンパました年齢不詳の細胞のものと赤。この実験では、新鮮な母細胞の平均寿命は、(中央値寿命の差を約2世代)やや長かったです。
芽の数、そのような二つの連続出芽イベント間の時間間隔のような他の興味深い表現型に加えて、 図3に示すように、撮像データ3、7、8から抽出することができます。細胞は、いくつかの低速の初期buddings次速く発芽の時期に入りました。出芽は、これらの熟成細胞の不健康な状態を示し、その寿命の終わりに向かって劇的に遅く。細胞周期ダイナミクス若いと古い細胞の細胞状態に関する非常に有益な情報が含まれており、テロメラーゼ変異体12を特徴づけるために、例えば、使用されてきました。重要なことは、このデバイスは、することができ老化過程のドライバとすることができる分子マーカーの追跡を可能にする、寿命( 図4)を通して蛍光シグナルを測定するために使用されます。

図1: マイクロ流体デバイスの設計の概略図。デバイスは、並列に動作することができる6つの独立した機能モジュールから構成されています。各モジュールは、二つのサイドチャネルに接続された1つのメインチャンネルで構成されています。各サイドチャネルは113の鉛筆の列があります。追加のブリッジは、二つのサイドチャネルを有する主要チャネルを接続する途中に添加されます。小さな娘細胞が流れによって洗い流されながら母細胞は、鉛筆の列の下に捕捉されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
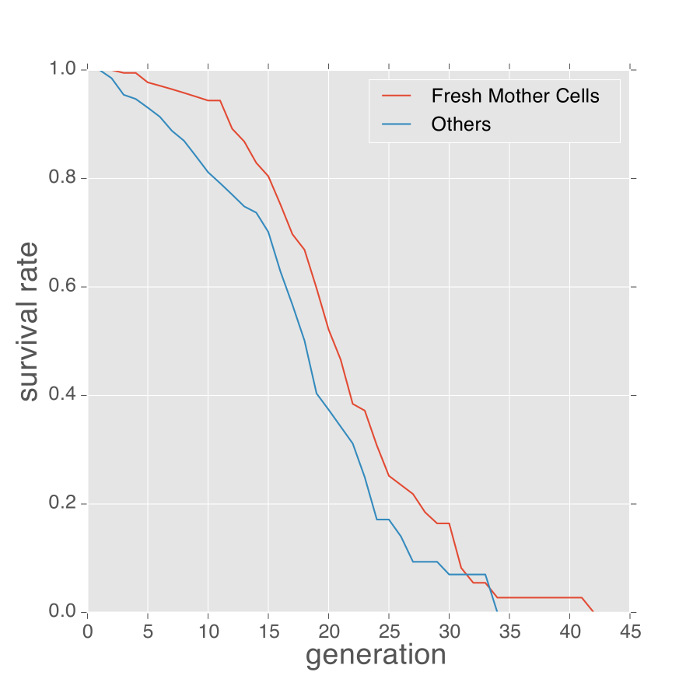
図2: 新鮮な母細胞は、未知の歴史を持つ細胞よりも長く住んでいます。 SDメディア、30度で未知の歴史(実験開始から捕獲された細胞)の細胞に対して新鮮な母細胞の複製寿命。平均して、新鮮な母細胞は、約2世代に長く住んでいます。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3: 高齢細胞として出芽間隔の長さが変化します。 buddingsの間の時間枠として測定新進の間隔が色分けされ、細胞は、その複製寿命によって命じられたし、新鮮な母細胞は9月でした未知の歴史の細胞からarated。 この図の拡大版をご覧になるにはこちらをクリックしてください。
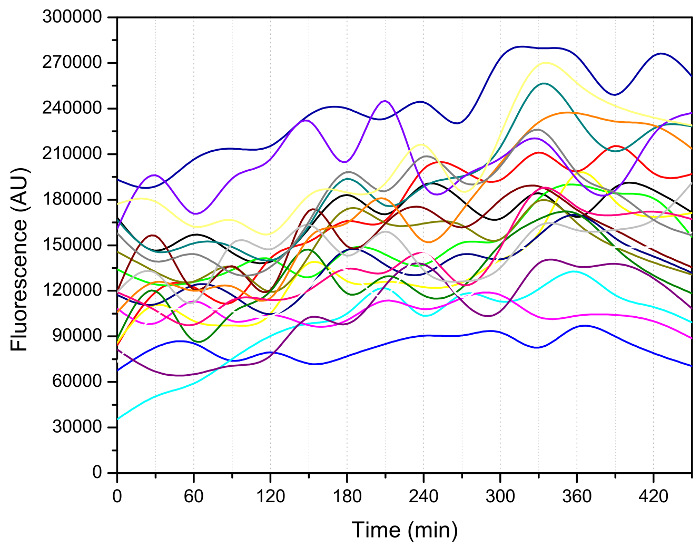
図4: マイクロ流体デバイスを用いた熱ショック因子1(HSF1)の活性を測定します。 HSF1活性レポーター13上流のHSEと不自由CYC1プロモーターに融合した緑色蛍光タンパク質(GFP)で構成されています。蛍光画像は30分ごとに採取しました。 GFP強度は次に、カスタマイズMATLABコード14を用いて定量しました。各単セルのデータポイントが接続され、着色された線で示されています。この実験では、株を一晩30℃で2%グルコース(重量/容量)でSD培地中で増殖させました。それは、その後の回復のために同じ培地で希釈しました。その後、0.05%グルコース(重量/容量)でSD培地は、蛍光測定中にマイクロ流体チップで細胞を成長させるために使用されました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
映画1: 新鮮な母細胞の例は、全体の寿命のための装置内に捕捉されています。映画は、トラップされた細胞から生まれた新鮮な母細胞を示しています。映画の冒頭に赤い矢印が新鮮母細胞とその最初の出芽の位置をマークします。この母細胞は、その全体の寿命のためのマイクロ流体デバイスの中に閉じ込められました。 このビデオを見るにはこちらをクリックしてください。 (ダウンロードするには、右クリックします。)
ディスカッション
PDMSデバイスは、作りたてする必要があります。そうでない場合、デバイスにチューブを挿入することによって引き起こされる気泡は除去するのが困難であろう。ステップ3.4は、細胞を濃縮することによって、細胞の積載効率を向上させることが重要です。実験のスループットを増大させるために、同じPDMSチップ接続独立して動作するポンプに4〜6のモジュールは、典型的には同時に4〜6の異なる実験(異なる株又は培地組成)を実行するために使用されます。
(顕微解剖を使用)は、従来の酵母複製老化アッセイと比較して、ここに提示マイクロ流体の方法は、より少ない労力と時間がかかります。また、マイクロ流体デバイスは、細胞のサイズ、細胞周期動態、細胞形態、および様々な分子マーカーを含む、種々の細胞または分子パラメータの詳細な定量を可能にします。このマイクロ流体方法は、保持することにより、高解像度の顕微鏡との長期的な細胞追跡を実現します娘細胞としてPDMSマイクロパッドの下で母細胞が自動的にフラッシュされます。
このデバイスはHuberts らとして、同様の基本構造を有する、トラップ母細胞4にソフトPDMSマイクロパッドを使用します。彼の作品7で説明しました。装置設計・実験プロトコルの違いがいくつかあります。この装置で広いPDMSパッドは、( 図2及び図3に示すように 、 動画1)いくつかの新生娘細胞が捕捉され、分析されることを可能にします。このような細胞を同定するために、我々は出芽せずに洗い流す娘細胞を無視して、すでに捕獲された母細胞から出芽した娘細胞を注釈付き。平均して、我々は、PDMSパッドあたり約2新鮮母細胞を得ました。 2、約三分の一が、全体の寿命のために装置内に保持された間:未知の歴史の細胞にこれら新鮮母細胞の比は約1でした。これらの細胞は、より正確な寿命測定ANを許可します母と娘細胞との間の相関関係を分析することを可能にするdは。この装置では、より深いメインチャンネルが観察がなされている2つの浅い側のチャネルに接続されています。この設計は、大きな気泡によってブロックされているサイドチャネルの可能性を減らすのに役立ちます。マイクロ流体チップ製造のために、このプロトコルは、成功率を増加させるだけでプラズマ暴露やオーブンベークを使用して、PDMSおよびカバーガラスを接着するための簡単な方法を使用します。
このプロトコルを用いて、マイクロ流体デバイスは、野生型の半数体酵母株( すなわち、BY4741またはBY4742)のために、実験の開始時にロバストトラップPDMSパッドごとに少なくとも1個の細胞(平均3-5細胞)することが可能です。細胞の約30%は、彼らの全体の寿命全体で保持することができます。 PDMSデバイスの性能は、鉛筆列とガラスと酵母細胞のサイズとの間のギャップの大きさに依存することは注目に値します。野生型の半数体酵母株については、ギャップに適した大きさが3.5~4.5ミクロンです。この範囲外では、積載効率とセル保持率が急激に低下。したがって、はるかに大きい又は小さいセルサイズ7を有する酵母株のための新しいデバイスは、ステップ1で作られた第一の層の高さを変更することによって作製されなければなりません。
要約すると、この資料に記載されているデバイスとプロトコルだけでなく、酵母の老化の研究に適しているだけでなく、母細胞の追跡と、多くの世代のためか、寿命全体の分子マーカーのモニタリングを必要とする他の実験にも適用可能です。
開示事項
The authors declare that they have no competing financial interests.
謝辞
This research was supported by NIH Grant AG043080 and the National Natural Science Foundation of China (NSFC), No. 11434001. We thank Lucas Waldburger for proofreading the manuscript.
資料
| Name | Company | Catalog Number | Comments |
| 3'' <111> silicon wafer | Addison Engineering | ||
| SU-8 2000 and 3000 Series | MicroChem | ||
| Sylgard® 184 Silicone Elastomer Kit | ellsworth | 2065622 | Include Sylgard® silicone elastomer base and curing agent |
| Petri dishes | VWR | 391-1502 | |
| Harris Uni-core™ punch (I.D. 0.75 mm) | Sigma-Aldrich | 29002513 | |
| 24 mm x 40 mm SLIP-RITE® cover glass | Thermo Fisher Scientific | 102440 | |
| 3M Scotch Tape | ULINE | S-10223 | |
| VWR® Razor Blades | VWR | 55411-050 | |
| Pure Ethanol, Koptec | VWR | 64-17-5 | |
| Whoosh-Duster™ | VWR | 16650-027 | |
| 5 mL BD Syringe (Luer-Lock™ Tip) | Becton, Dickinson and Company | 309646 | |
| PTFE Standard Wall Tubing (100 ft, AWG Size: 22, Nominal ID: 0.028) | Component Supply Company | SWTT-22 | |
| Needle Assortment | Component Supply Company | NEKIT-1 | |
| Desiccator | HACH | 2238300 | |
| Lab Oven | Fisher Scientific | 13246516GAQ | |
| Nikon TE2000 microscope with 40X and 60X objective | Nikon | ||
| Zeiss Axio Observer Z1 with 40X and 60X objective | Zeiss | ||
| Syringe Pump | Longerpump | TS-1B |
参考文献
- Mortimer, R. K., Johnston, J. R. Life span of individual yeast cells. Nature. 183 (4677), 1751-1752 (1959).
- Polymenis, M., Kennedy, B. K. Cell biology: High-tech yeast ageing. Nature. 486 (7401), 37-38 (2012).
- Xie, Z., et al. Molecular phenotyping of aging in single yeast cells using a novel microfluidic device. Aging Cell. 11 (4), 599-606 (2012).
- Zhang, Y., et al. Single cell analysis of yeast replicative aging using a new generation of microfluidic device. PLoS One. 7 (11), e48275 (2012).
- Chen, K. L., Crane, M. M., Kaeberlein, M. Microfluidic technologies for yeast replicative lifespan studies. Mech Ageing Dev. , (2016).
- Lee, S. S., Avalos Vizcarra, ., Huberts, I., H, D., Lee, L. P., Heinemann, M. Whole lifespan microscopic observation of budding yeast aging through a microfluidic dissection platform. Proc Natl Acad Sci U S A. 109 (13), 4916-4920 (2012).
- Huberts, D. H., Janssens, G. E., Lee, S. S., Vizcarra, I. A., Heinemann, M. Continuous high-resolution microscopic observation of replicative aging in budding yeast. J Vis Exp. (78), e50143 (2013).
- Jo, M. C., Liu, W., Gu, L., Dang, W., Qin, L. High-throughput analysis of yeast replicative aging using a microfluidic system. Proc Natl Acad Sci U S A. 112 (30), 9364-9369 (2015).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. Journal of Micromechanics and Microengineering. 16 (2), 276-284 (2006).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37 (5), 550-575 (1998).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Xie, Z., et al. Early telomerase inactivation accelerates aging independently of telomere length. Cell. 160 (5), 928-939 (2015).
- Boy-Marcotte, E., et al. The heat shock response in yeast: differential regulations and contributions of the Msn2p/Msn4p and Hsf1p regulons. Mol Microbiol. 33 (2), 274-283 (1999).
- Yang, X., Lau, K. Y., Sevim, V., Tang, C. Design principles of the yeast G1/S switch. PLoS Biol. 11 (10), e1001673 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved