Method Article
באמצעות מכשירים microfluidic למדוד פנוטיפים תוחלת החיים סלולר בתאי שמרים ניצני יחיד
In This Article
Summary
מאמר זה מציג פרוטוקול מותאם לייצור שבבי microfluidic ואת ההתקנה של ניסויים microfluidic כדי למדוד את אורך החיים פנוטיפים הסלולר של תאי שמרים בודד.
Abstract
Budding yeast Saccharomyces cerevisiae is an important model organism in aging research. Genetic studies have revealed many genes with conserved effects on the lifespan across species. However, the molecular causes of aging and death remain elusive. To gain a systematic understanding of the molecular mechanisms underlying yeast aging, we need high-throughput methods to measure lifespan and to quantify various cellular and molecular phenotypes in single cells. Previously, we developed microfluidic devices to track budding yeast mother cells throughout their lifespan while flushing away newborn daughter cells. This article presents a method for preparing microfluidic chips and for setting up microfluidic experiments. Multiple channels can be used to simultaneously track cells under different conditions or from different yeast strains. A typical setup can track hundreds of cells per channel and allow for high-resolution microscope imaging throughout the lifespan of the cells. Our method also allows detailed characterization of the lifespan, molecular markers, cell morphology, and the cell cycle dynamics of single cells. In addition, our microfluidic device is able to trap a significant amount of fresh mother cells that can be identified by downstream image analysis, making it possible to measure the lifespan with higher accuracy.
Introduction
ניצני שמרים הוא אורגניזם מודל עצמת הזדקנות מחקר. עם זאת, assay תוחלת חיים מקובל בשמרים מסתמך על microdissection, וזה לא רק עבודה אינטנסיבית אך גם נמוכה תפוקה 1, 2. בנוסף, הגישה המסורתית microdissection אינה מספקת תצוגה מפורטת של תכונות תאיות ומולקולריות שונות בתאים אם חד ההוריים ככל שהם מזדקנים. הפיתוח של מכשירי microfluidic אפשר הליך אוטומטי למדידת אורך חיי שמרים, כמו גם לעקוב סמנים מולקולריים פנוטיפים הסלולר שונים לאורך חיי תאי אמא 3, 4, 5, 6, 7, 8. אחרי תאי שמרים נטענים לתוך מכשיר microfluidic, הם יכולים להיות במעקב תחת מיקרוסקופ אלקטרוני-הקפות זמן אוטומטיותהדמית דואר. בעזרת הדמית כלים לעיבוד, פנוטיפים תאיים ומולקולריים שונים ניתן לחלץ 3, 6, 8, כולל תוחלת חיים, גודל, כתב ניאון, מורפולוגיה תא, דינמיקת מחזור התא, וכו ', שרבים מהם קשים או בלתי אפשריים להשיג באמצעות שיטת microdissection המסורתית. מכשירים microfluidic שזכו להבלטה מחקר הזדקנות בשמרים מאז הפיתוח המוצלח שלהם 3 לפני כמה שנים, 4, 6, 7. מספר קבוצות מכן פרסמו על וריאציות של העיצובים הקודמים 5, ומעבדות שמרים רבות מועסקות התקני microfluidic המחקר שלהם.
בתרבות תא עוברת גידול מעריכי, מספר תאי אמו ישישה זמינים עבור תצפית הוא miniscule. לכן, עיקרון העיצוב הכללי של מכשיר microfluidic למדידות תוחלת חיים הוא לשמר תאי אמא ולהסיר תאים הבת. עיצובים אחד כזה עושה שימוש בעובדה שמרים עובר חלוקת התא אסימטרי. המבנים במלכודת המכשיר תאי אמא גדולים ולאפשר לתאי בת קטנים ייסחפו. שבב microfluidic המתואר במאמר זה משתמש polydimethylsiloxane רך (PDMS) כרית (עמודות pensile אנכיות) לתאי אמא מלכודת (איור 1). התקנים של עיצוב דומה דווחו 3 בעבר, 4, 6, 7. פרוטוקול זה משתמש הליך פשוט לפברק מכשירי microfluidic ו שיטת תא-טעינה פשוטה כי הוא אופטימיזציה עבור ניסויי הדמית הזמן לשגות. אחד הפרמטרים העיקריים במכשיר microfluidic הוא הרוחב של רפידות PDMS המשמשות תאי אמא מלכודת. ד שלנוevice משתמשת רפידות רחבות שיכול לשמור תאי אמא יותר תחת כל כרית, כולל חלק משמעותי של תאי אמא טרייה, שניתן לעקוב אחריהם לאורך כל תוחלת החיים שלהם. בנוסף מדידות אורך חיים, פרוטוקול זה הוא שימושי עבור ניסויי הדמית תא בודד זמן לשגות כאשר התאים צריכים להיות במעקב במשך דורות רבים או כאשר תצפית לאורך טווח החיים היא הכרחית.
Protocol
1. ייצור תבנית סיליקון ופלה
הערה: photomask נועד עם תוכנת AutoCAD ומיוצר על ידי חברה מסחרית. עיצוב זה מכיל שלוש שכבות של דפוסים שונים ( קובץ משלים 1 ). בגבהים של הראשון, השני, השלישי ושכבות עומדים 4 מיקרומטר, 10 מיקרומטר, ו 50 מיקרומטר, בהתאמה. העובש הפרוס סיליקון נוצר מן photomask באמצעות ליתוגרפיה רך 9, 10.
- לאפות פרוסות סיליקון ב 200 מעלות צלזיוס למשך 10 דקות להתאדות אדי מים. ספין מעיל photoresist שלילית SU-8 על גבי פרוסות סיליקון סיליקון.
הערה: מעיל ספין SU-8 3005 ב 5000 סל"ד במשך 30 s כדי ליצור את השכבה הראשונה, SU-8 2010 ב 3000 סל"ד במשך 30 s כדי ליצור את השכבה השנייה, ו SU-8 3025 ב 2000 סל"ד במשך 30 s כדי ליצור את שכבה שלישית. - Soft-אופה את הפרוסות המצופות לפני tהוא דפוס העברה. יישר ולחשוף את הפרוסות במצב "קשר ישיר" באמצעות aligner מסכה.
הערה: Soft-לאפות את רקיק עבור 2 דקות ב 95 מעלות צלזיוס למשך השכבה הראשונה, 3 דקות ב 95 מעלות צלזיוס למשך השכבה השנייה, ולאחר 15 דקות ב 95 מעלות צלזיוס למשך השכבה השלישית. השתמש במינון החשיפה ב 100 mJ / ס"מ 2 עבור השכבה הראשונה, 130 mJ / ס"מ 2 עבור השכבה השנייה, ו 200 mJ / ס"מ 2 עבור השכבה השלישית. - לאחר החשיפה, פוסט-אופים את פרוסות ולפתח אותו באמצעות מפתח SU-8. לייבש את פרוסות באמצעות אקדח N 2 וקשה לאפות את פרוסות סיליקון ב 200 מעלות צלזיוס למשך 30 דקות.
הערה: תבנית סיליקון מקובעת צלחת 15 סנטימטרי קוטר פטרי מפלסטיק באמצעות נייר דבק, עם צד הדפוס פונה כלפי מעלה. בדרך כלל, אנחנו שמים כמה מבני שבב זהה על אותו שטאנץ, המאפשר שבבי microfluidic מרובה כדי להיות מפוברקים בו זמנית. ניתן להשתמש בהן שוב ושוב כל עובש פעמים רבות לפברק שבבי microfluidic.
2. Microfluidicייצור שבב
- מניח סירה במשקל נקיה על איזון טרה את האיזון. יוצקים 50 גרם של בסיס PDMS לתוך הסירה לשקול.
- להוסיף 5 גרם של סוכן ריפוי PDMS לסירה שוקל (w / w יחס של 1:10 לבסיס PDMS).
הערה: נפח זה מבוסס על צלחת 15 ס"מ קוטר פטרי עם עובש. התאם את הכמות מגיב אם באמצעות צלחת פטרי בגודל שונה. - מערבבים את בסיס PDMS ואת הסוכן ריפוי עם טפטפת הפנויה. התחל מקצה הסירה במשקל ולאט לאט להזיז פנימה. מערבבים היטב במשך כמה דקות עד בועות קטנות יוצרים ברחבי תערובת; ערבוב יסודי חיוני פילמור PDMS.
- יוצקים את התערובת לאט לתוך צלחת פטרי; את התערובת יש לכסות את התבנית פרוסות סיליקון לחלוטין.
- מניחים את צלחת פטרי בחלל ריק עבור 10 דקות כדי להסיר את כל בועות אוויר מן התערובת PDMS. אם הבועות נשארים על פני השטח של התערובת, להשתמש פיפטה לפוצץ אותן.
- דגירת סיליקוןעובש פרוס עם PDMS בתנור על 75 מעלות צלזיוס למשך כ 2 h.
- לקלף בעדינות את השכבה של PDMS פולימר את העובש הפרוס סיליקון, להימנע מכל פגיעת בניית התבנית הפרוסה. לחלופין, לחתוך את PDMS ישירות מהתבנית פרוסות סיליקון עם מרווח של 5 מ"מ מינימום סביב התבנית בעזרת סכין גילוח תעשייתי חד קצה; לקלף את שכבת PDMS בעדינות את התבנית הפרוסה.
- מניח את שכבת PDMS על הספסל עם צד הדפוס פונה כלפי מעלה. לחתוך בזהירות את השבב היחיד עם סכין גילוח תעשייתי חד קצה, שמירת מרווח הולם מהקצה של כל שבב יחיד, כדי למנוע ניזק הבנייה.
- עם צד הדפוס פונה כלפי מעלה, השתמש בעט אגרוף (מזהה 0.75 מ"מ) מחורר ישר למטה דרך מעגלי הכניסה ויציאה בכל צד של הערוצים.
הערה: אלה חורים ליצור את מסלול הזרימה של המדיום. לכן, חשוב לעבור את עיגולי אגרוף כל הדרך דרך שכבת PDMS. הקפדלהסיר את עמודות PDMS מן החור. - בדוק בכל חור מנוקב על ידי החדרת מחט עט אגרוף שוב לתוך החור. ודא את המחט יכולה לצאת מהצד השני, המציין כי אין חסימה. החל קלטת אל פני שטח הדפוס, אז בעדינות לקלף את הקלטת כדי לנקות חלקיקי אבק. חזור על פעולה זו לפחות שלוש פעמים. השאר פיסה נקיה של נייר דבק על PDMS לשמור עיקור.
- חזור על הליך זה בצד השני של PDMS ולהשאיר את החלק האחרון של הסרט על גם כן.
- הכן כוס כיסוי 24 מ"מ x 30 מ"מ עם עובי של 0.13-0.17 מ"מ. תרסיס אתנול 70% על הזכוכית ויבשה עם מסיר אבק לעקר פני השטח; בנוסף, ניתן לכבס את הכוס במי autoclaved מיובשת עם מסיר אבק.
- העבר את מכסה זכוכית PDMS לצלחת פלסטיק. הסר את נייר הדבק מן PDMS ומניח את צד הדפוס פונה כלפי מעלה. להימנע מכל מגע עם משטח הדפוס במהלך ההעברה.
- מניח את צלחת הפלסטיק במכונת הפלזמה. החל טיפול פלזמת חמצן PDMS ואת מכסה הזכוכית כדי לעבד את המשטחים הידרופילי עם פרמטרי הפעולה הבאים: חשיפה, 75 s; ייצוב גז, 20 סמ"ק / min; לחץ, 200; וכוח, 100 W.
- בזהירות למקם את PDMS על מכסה הזכוכית, חיבור שני משטחים הידרופיליים (המשטחים אשר התמודדו במהלך טיפול פלזמה). ודא שאין בועות אוויר בין PDMS ואת מכסה הזכוכית.
- דגירת שבב PDMS בתנור על 75 מעלות צלזיוס למשך h 2 לפחות.
הערה: מיקרופלואידיקה חסר עלול לגרום לדליפת נוזל על מיקרוסקופ במהלך הניסוי. לכן, חשוב לבדוק את הקשר בין PDMS ואת מכסה זכוכית על ידי הרמת PDMS מעט מן הקצוות עם פינצטה. בהרימו בעדינות את PDMS לא צריך להפריד אותו מכסה הזכוכית, המצביע על קשר מוצלח.
3. הכנות לקראת הניסוי
- כן Tube.
- לצלול צינורות קלט ופלט בתמיסת 70% אתנול בנפרד 1 יום לפני הכנת שבב PDMS.
- ממלאים מזרק 5 מ"ל עם מים autoclaved לשטוף את הצינורות. לשטוף כל צינור ידי חיבור הצינור על המזרק שטיפה בצינור מים.
- חזור על שלב הכביסה לפחות 3 פעמים כדי לנקות שאריות אתנול.
- בדוק את ערוצי PDMS תחת מיקרוסקופ אופטי עם מטרת 10X לוודא את המבנה עקבי וללא פגע. ייצב את שבב PDMS על פלטפורמת מיקרוסקופ באמצעות נייר דבק.
הערה: הפוך שבבים מרובים בבת אחת בשלב 2 על מנת להבטיח כי ישנם שבב גיבוי, במיוחד אם מה שהופך את המכשיר בפעם הראשונה. - ממלאים מזרק 5 מ"ל עם מים autoclaved. Secure את מזרק משאבת מזרק והכנס את צינורות קלט ופלט המקבילים. קבע את מהירות הכביסה כדי 750 μL / h כדי לשטוף את השבב במשך כ 10 דקות. בועות האוויר בערוצי הסניףיש נשטף במהלך תקופה זו; אם יש בועות נותרות, להתאים את המהירות ידנית כדי לחסל את הבועות.
- הכנת מדגם שמרים.
- העברת 1 מ"ל של מדגם שמרים מוכן (OD 600 0.6-0.8) לשני צינורות 1.5-מ"ל microcentrifuge צנטריפוגות במשך 5 דקות ב 3000 x ז.
- הסר את רוב supernatant מצינור כל ולשלב את השארית ליצירת מדגם 0.5 מיליליטר.
- השהה את משאבת המזרק ולהסיר את צינורות הזנה משבב PDMS.
- ידנית להפוך את משאבת מזרק כדי למצוץ בועת אוויר קטן (1 עד 2 ס"מ אורך) לתוך צינור אחד קלט. הזז על למצוץ במדגם השמרים; בועת האוויר תציג את גבול המדגם מצביע כמה כבר נמשכה מדגם.
הערה: הימנע מוצץ המדגם לתוך המזרק. - הכנס את צינור ההזנה בחזרה לתוך שבב PDMS ולהפעיל מחדש את המשאבה כדי לטעון את התאים במהירות של 750 μL / h.
- השאר את המזרק לשאוב במשך 10 דק 'n ולבחון את התקדמות טעינת תא תחת מיקרוסקופ; עם טעינה מוצלחת תהיה תאי מלכודת תחת יותר מ 60% של להשעות עמוד.
- Switch to פתרון תזונה ולהתאים את המהירות ל 400 μL / h עבור culturing תא.
- עמדות תצפית בחר עבור מיקרוסקופ.
הערה: עבור מדידות אורך חיים, תמונות צולמו אחת 15 דקות על ידי מיקרוסקופ אופטי עם מטרת 40x. לניתוח כתב הניאון, תמונות צולמו אחת 15 דקות על ידי מיקרוסקופ פלואורסצנטי עם מטרת שמן 60X.
תוצאות
לאחר הניסויים, תוחלת החיים של תאים ורבי פנוטיפים תאיים ומולקולריים ניתן לחלץ מן הזמן לשגות תמונות המוקלטות. מאחר שיש מספר תכונות שונות כי ניתן לחלץ כל תא, הצעד הראשון של הניתוח הוא לביאור התאים ואירועים, כולל עמדות וגבולות של התאים ואת התזמון של אירועים שונים נמצאים במעקב, כגון כמו האירועים ניצני. הערות אלו יקלו לחזור לאותה קבוצה של תאים ולנתח תכונות שונות בעתיד. באמצעות תוכנת ניתוח תמונה, כגון ImageJ 11 ואת התוספים הנלווים, רשימה של פנוטיפים ניתן לחלץ אז מהנתונים התמונה באמצעות הסברי רשמה של התאים.
להלן כמה דוגמאות של פנוטיפים נמדד עם מכשיר microfluidic. פנוטיפ תוחלת החיים של שמריםניתן להשיג על ידי ספירת מספר ניצנים המיוצרים על ידי כל תא אמא לכודים והערכת באמצעות מעריך קפלן-מאייר. תאי בתחילה לכודת מכשירי microfluidic הם בגילים ידועים. כדי למזער את ההטיה של מדידות אורך חיים שמקורם הגילים הידועים האלה, שיטות קודמות השתמשו המספר הממוצע של צלקות ניצן על תאי הלכודים לכייל את תוחלת החיים 4, 7. עם זאת, מדידות צלקת ניצן דורשות מכתים הנוסף של תאים ולספק הערכה בלבד עקיפה של ההטיה. שימוש בפרוטוקול זה, המכשיר לוכד תאי בת טריים לעתים קרובות כי מנוצן מן התאים לכודים כבר. תאים אלה יכולים להפוך לתאי אמא. תאים אלה יכולים להיות מזוהים באמצעות תוכנת ניתוח תמונה במורד הזרם שלנו (סרט 1). תאי אמא טרייה אלה מספקים מדידת תוחלת חיים מדויקת יותר. כפי שניתן לראות בתרשים 2, עקומות תוחלת החיים של תאי אמא טרייה היו compaאדום עם אלה של התאים של גיל לא ידוע. בניסוי זה, תוחלת החיים הממוצעת של תאים אמא טרייה מעט ארוכה יותר (כ 2 דורות של ההבדל בתוחלת החיים החציוני).
בנוסף מספר הניצנים, פנוטיפים מעניינים אחרים, כגון מרווח הזמן בין שני אירועי ניצנים רצופים, כפי שמוצג באיור 3, ניתן לחלץ מן נתוני ההדמיה 3, 7, 8. תאים נכנסו לתקופה של ניצנים מהר ביצוע מספר buddings הראשונית איטית. ניצני האטה דרמטית לקראת סוף תוחלת החיים שלהם, המעיד על מצב בריא של התאים המזדקנים האלה. הדינמיקה מחזור התא מכיל מידע שימושי מאוד לגבי מצב הסלולר של תאים צעירים ומבוגרים ומאז משמש, למשל, כדי לאפיין מוטנטים טלומרז 12. חשוב לציין, המכשיר הזה יכול להיות המשמש למדידת אותות קרינה במהלך החיים (איור 4), המאפשרת המעקב של סמנים מולקולריים שעשויה להיות הנהג של תהליך ההזדקנות.

איור 1: סכמטי של העיצוב של המכשיר microfluidic. המכשיר מורכב 6 מודולים פונקציונליים עצמאיים שיכול לפעול במקביל. כל מודול מורכב של ערוץ מרכזי אחד מחובר לשני ערוצי לוואי. לכל ערוץ צד 113 עמודי pensile. גשר נוסף מתווסף באמצע כדי לחבר את הערוץ העיקרי עם שני ערוצי הצד. תאי אמא לכודים מתחת עמודות pensile, ואילו תאי בת הקטנים נשטפים על ידי הזרימה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
התחת = "jove_content" FO: keep-together.within-page = "1"> 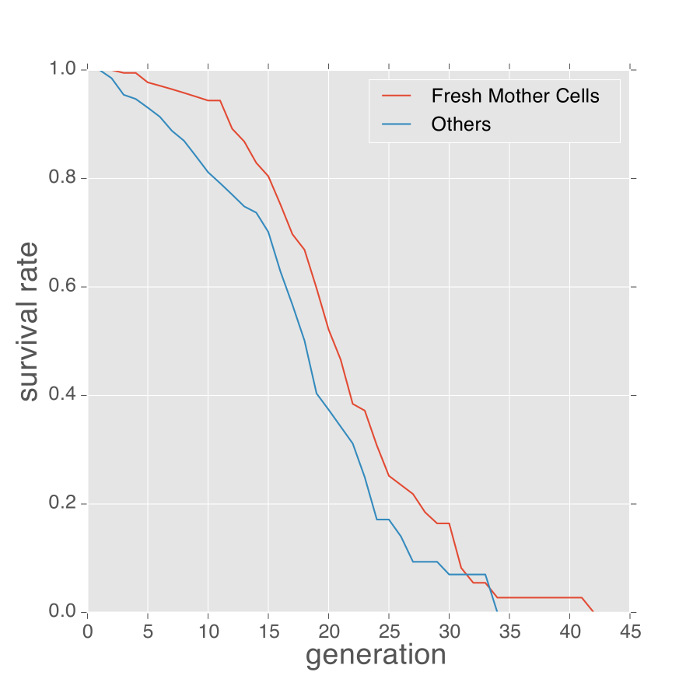
איור 2: תאי אמא טריים לחיות זמן רב יותר מאשר תאים עם היסטוריה ידועה. תוחלת החיים בשכפול הדנ"א של התאים אמא טרייה לעומת תאים של ההיסטוריה ידועה (תאים לכודים מתחילת הניסוי) בתקשורת SD, 30 מעלות. בממוצע, תאי אמא טרייה לחיות חיים ארוכים יותר על 2 דורות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3: אורכו של נבגים במרווחי שינויים כמו תא בגיל. מרווחי ניצנים כפי שנמדדו מסגרות זמן בין buddings היו בצבעים, תאים היו מסודרים על פי תוחלת החיים שהכפולה שלהם, ותאי אמא טרייה היו ספטמברarated מתאי ההיסטוריה ידועה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
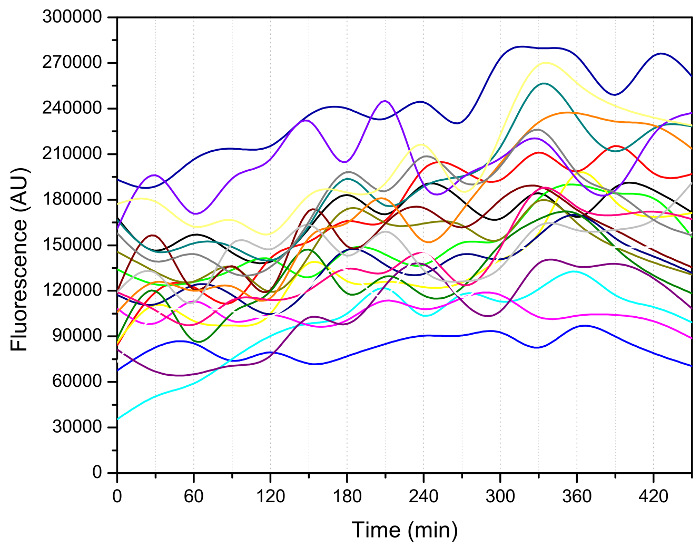
איור 4: מדידת פעילותם של 1 פקטור הלם חום (HSF1) באמצעות מכשיר microfluidic. הכתב-פעילות Hsf1 נבנה על ידי חלבון פלואורסצנטי ירוק (GFP) התמזג אמרגן CYC1 נכה עם 13 upstream HSE. תמונות פלואורסצנטי נלקחו כל 30 דקות '. עוצמת GFP היה אז לכמת באמצעות קוד MATLAB אישית 14. נקודות נתונים עבור כל תא בודד מחוברים מצוינים עם קו בצבע. בניסוי זה, שהמתח גדל בינוני SD עם 2 גלוקוז% (wt / כרך) בשעה 30 מעלות צלזיוס למשך הלילה; אז זה היה מדולל עם אותו בינוני להתאוששות. לאחר מכן,בינוני SD עם גלוקוז 0.05% (wt / כרך) שימש לגדל תאים השבב microfluidic במהלך המדידה פלואורסצנטי. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
סרט 1: דוגמא של תאי אמא טרייה להיות לכודה בתוך המכשיר למשך החיים כולו. הסרט מראה תא אמא טרייה נולד מתא לכודים. החץ האדום בתחילת הסרט מסמן את המיקום של תא אמא טרייה ניצני הראשון שלה. תא האם זה היה לכוד בתוך מכשיר microfluidic עבור תוחלת החיים השלמים שלה. אנא לחץ כאן כדי לצפות בסרטון זה. (לחץ לחיצה ימנית כדי להוריד.)
Discussion
מכשיר PDMS צריך להיעשות טרי. אחרת, את בועות האוויר הנגרם על ידי החדרת צינורות לתוך המכשיר תהיינה קשות להסיר. שלב 3.4 חשוב כדי לשפר את יעילות טעינת תא על ידי ריכוז התאים. כדי להגדיל את התפוקה של הניסוי, 4 עד 6 מודולים באותו השבב PDMS מחוברים משאבות הפועלות באופן עצמאי משמשות בדרך כלל כדי לבצע 4 עד 6 ניסויים שונים (זנים שונים או יצירות תקשורת) בו זמנית.
בהשוואת assay ההזדקנות הקונבנציונלית שמר בשכפול הדנ"א (המשתמשת microdissection), שיטת microfluidic המוצגת כאן היא פחות מייגעת זמן רב. יתר על כן, מכשיר microfluidic מאפשר הכימותים המפורטים של פרמטרים הסלולר או מולקולריים שונים, כולל גודל תא, דינמיקת מחזור התא, מורפולוגיה תא, וכן סמנים מולקולריים שונים. שיטת microfluidic זו משיגה תא לטווח ארוך מעקב עם מיקרוסקופ ברזולוציה גבוהה על ידי שמירהתאי אמא תחת מייקרו-רפידות PDMS כמו תאי בת סמוקים באופן אוטומטי.
מכשיר זה משתמש מיקרו-רפידות PDMS רך לתאים אמא מלכודת 4, עם המבנה הבסיסי, דומה כמו אל Huberts et. מתוארי העבודה 7 שלו. ישנם מספר הבדלים בעיצוב המכשיר ופרוטוקולים ניסיוני. כרית PDMS הרחבה במכשיר זה מאפשרת כמה תאי לבת שנולדו להיות לכוד נתחו (איורים 2 ו 3, סרט 1). כדי לזהות תאים כאלה, אנחנו מבואר לתאי בת מנוצן מתאי אמא לכודים כבר, תוך התעלמות תאי הבת כי סמוק משם בלי ניצנים. בממוצע, קיבלנו 2 על תאי אמא טרייה לכל כרית PDMS. היחס של תאי אמא טרייה אלה לתאים של ההיסטוריה הידועה היה על 1: 2, בקרב אשר כשליש נשמר במכשיר למשך החיים כולו. תאים אלה מאפשרים מדידה מדויקת יותר תוחלת חייםד מאפשר לנתח מתאמים בין תאי אמא ובת. במכשיר זה, ערוץ עיקרי עמוק מחובר לשני ערוצי צד רדודים שבו התצפיות מבוצעות; עיצוב זה עוזר להפחית את הסיכוי של ערוצי הצד נחסם על ידי בועות אוויר גדולות. עבור ייצור שבבי microfluidic, פרוטוקול זה גם משתמש בשיטה פשוטה אג"ח PDMS וזכוכית כיסוי, רק באמצעות חשיפת פלזמת אפייה בתנור, אשר מגדילה את שיעור ההצלחה.
עם פרוטוקול זה, המכשיר microfluidic הוא מסוגל מלכודת וחסונה לפחות תא אחד (3-5 תאים בממוצע) לכל כרית PDMS בתחילת הניסוי עבור זני שמרים הפלואידים wild-type (כלומר, BY4741 או BY4742). אודות 30% של התאים יכולים להישמר לאורך תוחלת החיים כולו שלהם. ראוי לציין כי הביצועים של המכשיר PDMS תלוי בגודל הפער שבין העמודים pensile ואת הכוס ואת הגודל של תאי שמרים. עבור זני שמרים הפלואידים מסוג פרא, אתגודל מתאים הפער הוא 3.5-4.5 מיקרומטר. מחוץ לטווח זה, יעילות העמסת ירידה בשיעור החזקת תא בחדות. לפיכך, מכשירים חדשים עבור זני שמרים עם הרבה גדלי תא גדולים או קטנים 7 חייבים להיות מפוברקים על ידי שינוי הגובה של השכבה הראשונה שנעשתה צעד 1.
לסיכום, המכשיר הפרוטוקול המתואר במאמר זה אינו מתאימים רק עבור מחקרים הזדקנות בשמרים אבל הם חלים גם על ניסויים אחרים הדורשים מעקב של תאי אמא ואת הניטור של סמנים מולקולריים במשך דורות רבים או במהלך החיים.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This research was supported by NIH Grant AG043080 and the National Natural Science Foundation of China (NSFC), No. 11434001. We thank Lucas Waldburger for proofreading the manuscript.
Materials
| Name | Company | Catalog Number | Comments |
| 3'' <111> silicon wafer | Addison Engineering | ||
| SU-8 2000 and 3000 Series | MicroChem | ||
| Sylgard® 184 Silicone Elastomer Kit | ellsworth | 2065622 | Include Sylgard® silicone elastomer base and curing agent |
| Petri dishes | VWR | 391-1502 | |
| Harris Uni-core™ punch (I.D. 0.75 mm) | Sigma-Aldrich | 29002513 | |
| 24 mm x 40 mm SLIP-RITE® cover glass | Thermo Fisher Scientific | 102440 | |
| 3M Scotch Tape | ULINE | S-10223 | |
| VWR® Razor Blades | VWR | 55411-050 | |
| Pure Ethanol, Koptec | VWR | 64-17-5 | |
| Whoosh-Duster™ | VWR | 16650-027 | |
| 5 mL BD Syringe (Luer-Lock™ Tip) | Becton, Dickinson and Company | 309646 | |
| PTFE Standard Wall Tubing (100 ft, AWG Size: 22, Nominal ID: 0.028) | Component Supply Company | SWTT-22 | |
| Needle Assortment | Component Supply Company | NEKIT-1 | |
| Desiccator | HACH | 2238300 | |
| Lab Oven | Fisher Scientific | 13246516GAQ | |
| Nikon TE2000 microscope with 40X and 60X objective | Nikon | ||
| Zeiss Axio Observer Z1 with 40X and 60X objective | Zeiss | ||
| Syringe Pump | Longerpump | TS-1B |
References
- Mortimer, R. K., Johnston, J. R. Life span of individual yeast cells. Nature. 183 (4677), 1751-1752 (1959).
- Polymenis, M., Kennedy, B. K. Cell biology: High-tech yeast ageing. Nature. 486 (7401), 37-38 (2012).
- Xie, Z., et al. Molecular phenotyping of aging in single yeast cells using a novel microfluidic device. Aging Cell. 11 (4), 599-606 (2012).
- Zhang, Y., et al. Single cell analysis of yeast replicative aging using a new generation of microfluidic device. PLoS One. 7 (11), e48275 (2012).
- Chen, K. L., Crane, M. M., Kaeberlein, M. Microfluidic technologies for yeast replicative lifespan studies. Mech Ageing Dev. , (2016).
- Lee, S. S., Avalos Vizcarra, ., Huberts, I., H, D., Lee, L. P., Heinemann, M. Whole lifespan microscopic observation of budding yeast aging through a microfluidic dissection platform. Proc Natl Acad Sci U S A. 109 (13), 4916-4920 (2012).
- Huberts, D. H., Janssens, G. E., Lee, S. S., Vizcarra, I. A., Heinemann, M. Continuous high-resolution microscopic observation of replicative aging in budding yeast. J Vis Exp. (78), e50143 (2013).
- Jo, M. C., Liu, W., Gu, L., Dang, W., Qin, L. High-throughput analysis of yeast replicative aging using a microfluidic system. Proc Natl Acad Sci U S A. 112 (30), 9364-9369 (2015).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. Journal of Micromechanics and Microengineering. 16 (2), 276-284 (2006).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37 (5), 550-575 (1998).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Xie, Z., et al. Early telomerase inactivation accelerates aging independently of telomere length. Cell. 160 (5), 928-939 (2015).
- Boy-Marcotte, E., et al. The heat shock response in yeast: differential regulations and contributions of the Msn2p/Msn4p and Hsf1p regulons. Mol Microbiol. 33 (2), 274-283 (1999).
- Yang, X., Lau, K. Y., Sevim, V., Tang, C. Design principles of the yeast G1/S switch. PLoS Biol. 11 (10), e1001673 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved