Method Article
Uso di dispositivi microfluidici misurare la durata della vita e cellulare fenotipi in singole cellule di lievito in erba
In questo articolo
Riepilogo
Questo articolo presenta un protocollo ottimizzato per la produzione di chip microfluidici e la configurazione degli esperimenti microfluidici per misurare la durata di vita e fenotipi cellulari delle singole cellule di lievito.
Abstract
Budding yeast Saccharomyces cerevisiae is an important model organism in aging research. Genetic studies have revealed many genes with conserved effects on the lifespan across species. However, the molecular causes of aging and death remain elusive. To gain a systematic understanding of the molecular mechanisms underlying yeast aging, we need high-throughput methods to measure lifespan and to quantify various cellular and molecular phenotypes in single cells. Previously, we developed microfluidic devices to track budding yeast mother cells throughout their lifespan while flushing away newborn daughter cells. This article presents a method for preparing microfluidic chips and for setting up microfluidic experiments. Multiple channels can be used to simultaneously track cells under different conditions or from different yeast strains. A typical setup can track hundreds of cells per channel and allow for high-resolution microscope imaging throughout the lifespan of the cells. Our method also allows detailed characterization of the lifespan, molecular markers, cell morphology, and the cell cycle dynamics of single cells. In addition, our microfluidic device is able to trap a significant amount of fresh mother cells that can be identified by downstream image analysis, making it possible to measure the lifespan with higher accuracy.
Introduzione
Erba lievito è un potente organismo modello nella ricerca sull'invecchiamento. Tuttavia, un test di durata della vita convenzionale nel lievito si basa su microdissezione, che non è solo lavoro intensivo, ma anche a basso throughput di 1, 2. Inoltre, l'approccio tradizionale microdissezione non fornisce una vista dettagliata di varie caratteristiche cellulari e molecolari nelle cellule madri singole che invecchiano. Lo sviluppo di dispositivi microfluidici ha permesso una procedura automatizzata per misurare durata lievito nonché a seguire marcatori molecolari e diversi fenotipi cellulari per tutta la durata delle cellule madri 3, 4, 5, 6, 7, 8. Dopo che le cellule di lievito vengono caricati in un dispositivo microfluidico, possono essere monitorati sotto un microscopio utilizzando temporali giri automaticie di imaging. Con l'aiuto di strumenti di elaborazione di imaging, diversi fenotipi cellulari e molecolari possono essere estratti 3, 6, 8, compresa durata, dimensioni, reporter fluorescente, morfologia cellulare, le dinamiche del ciclo cellulare, ecc, molti dei quali sono difficili o impossibili da ottenere utilizzando il metodo microdissezione tradizionale. Dispositivi microfluidici hanno assunto un rilievo nella ricerca affinamento sui lieviti in quanto il loro sviluppo di successo di qualche anno fa 3, 4, 6, 7. Diversi gruppi hanno pubblicato successivamente sulle variazioni dei disegni precedenti 5, e molti laboratori di lievito hanno impiegato dispositivi microfluidici per il loro studio.
In una cultura di cellule in fase di crescita esponenziale, il numero di cellule madri di età compresa tra che sono disponibili per l'osservazione è miniscule. Pertanto, il principio di progettazione generale del dispositivo microfluidica per le misure di durata della vita è quello di mantenere le cellule madre e per rimuovere le cellule figlie. Uno di questi disegni si avvale del fatto che il lievito subisce divisione cellulare asimmetrica. Le strutture a cellule madri trappola dispositivo volontà grandi e permettono cellule figlie piccole per essere lavato via. Il chip microfluidico descritto in questo articolo utilizza un tampone morbido polidimetilsilossano (PDMS) (colonne pensili verticali) per intrappolare cellule madri (Figura 1). Dispositivi di tipo analogo sono stati riportati precedentemente 3, 4, 6, 7. Questo protocollo utilizza una procedura semplice da fabbricare dispositivi microfluidici e un metodo cella di carico semplice che è ottimizzato per gli esperimenti time-lapse imaging. Uno dei parametri chiave del dispositivo microfluidico è la larghezza delle pastiglie PDMS utilizzati per cellule madri trappola. Il nostro device usa pastiglie più ampi che possono tenere più cellule madri sotto ogni pad, tra cui una frazione significativa di cellule madri fresche che possono essere monitorati per tutta la loro durata di vita. Oltre alle misurazioni durata della vita, questo protocollo è utile per esperimenti di imaging singola cellula time lapse quando le cellule devono essere monitorati per molte generazioni o quando un'osservazione tutta la durata della vita è necessaria.
Protocollo
1. Silicon Wafer Mold Fabrication
NOTA: La fotomaschera è stato progettato con il software AutoCAD e prodotto da una società commerciale. Questo disegno contiene tre strati di diversi modelli ( File supplementare 1 ). Le altezze di primo, secondo, e terzo strato sono circa 4 pm, 10 pm e 50 um, rispettivamente. Lo stampo wafer di silicio è stata creata dalla fotomaschera mediante litografia soft 9, 10.
- Cuocere un wafer di silicio a 200 ° C per 10 minuti per evaporare il vapore acqueo. cappotto centrifuga fotoresist negativo SU-8 sul wafer di silicio.
NOTA: coat Spin SU-8 3005 a 5.000 giri al minuto per 30 s per generare il primo strato, SU-8 2010 a 3.000 rpm per 30 s per generare il secondo strato, e SU-8 3025 a 2.000 giri al minuto per 30 s per generare il terzo strato. - Soft-cuocere il wafer rivestito prima di tegli trasferimento modello. Allineare e esporre il wafer in modalità "contatto diretto" utilizzando un allineatore maschera.
NOTA: Soft-cuocere il wafer per 2 min a 95 ° C per il primo strato, 3 min a 95 ° C per il secondo strato, e 15 min a 95 ° C per il terzo strato. Utilizzare la dose di esposizione a 100 mJ / cm 2 per il primo strato, 130 mJ / cm 2 per il secondo strato, e 200 mJ / cm 2 per il terzo strato. - Dopo l'esposizione, post-cuocere il wafer e sviluppare utilizzando SU-8 sviluppatore. Essiccare il wafer utilizza una pistola N 2 e duro-cuocere il wafer a 200 ° C per 30 min.
NOTA: Lo stampo wafer di silicio è fissata a 15 cm di diametro plastica Petri piatto con del nastro adesivo, con il lato rivolto verso l'alto modello. Solitamente, abbiamo messo diverse strutture identiche di chip sullo stesso stampo che permette a più chip microfluidici per essere fabbricati contemporaneamente. Ogni stampo può essere riutilizzato molte volte per fabbricare chip microfluidici.
2. Microfluidicfabbricazione di chip
- Mettere una barca pesa pulita su una bilancia e tarare la bilancia. Versare 50 g di base di PDMS nella barca pesare.
- Aggiungere 5 g di PDMS agente di indurimento alla barca pesare (w / w rapporto di 1:10 alla base PDMS).
NOTA: Questo volume è basato su 15 cm con piastra Petri con lo stampo. Regolare la quantità di reagente se si utilizza una piastra di Petri di dimensioni diverse. - Mescolare la base PDMS e l'agente di indurimento con una pipetta monouso. Iniziare dal bordo della barca di pesatura e si muovono lentamente verso l'interno. Mescolare accuratamente per alcuni minuti fino formano piccole bolle nella miscela; accurata miscelazione è essenziale per PDMS polimerizzazione.
- Versare il composto lentamente nella capsula di Petri; la miscela deve coprire completamente lo stampo wafer di silicio.
- Porre la capsula di Petri in un vuoto per 10 minuti per rimuovere tutte le bolle d'aria dalla miscela PDMS. Se le bolle rimangono sulla superficie della miscela, utilizzare una pipetta per far saltare fuori.
- Incubare il siliciostampo wafer con PDMS in un forno a 75 ° C per circa 2 ore.
- buccia delicatamente lo strato di PDMS polimerizzate fuori stampo wafer di silicio, evitando danni alla costruzione dello stampo wafer. In alternativa, tagliare il PDMS direttamente dallo stampo wafer di silicio con un margine minimo di 5 mm intorno al pattern usando una lama di rasoio industriale singolo bordo; buccia delicatamente lo strato PDMS dallo stampo wafer.
- Posizionare il livello PDMS sul banco con il lato rivolto verso l'alto modello. Asportare accuratamente il chip individuo con una lama di rasoio industriale singolo bordo, mantenendo un adeguato margine dal bordo di ogni singolo chip per evitare danni costruzione.
- Con il lato rivolto verso l'alto modello, utilizzare una penna punzone (ID 0,75 mm) per perforare verso il basso attraverso i cerchi ingresso e di uscita su ciascun lato dei canali.
NOTA: Questi fori creano il percorso per il passaggio del fluido. Pertanto, è fondamentale passare attraverso i cerchi e punzone tutto il percorso attraverso lo strato PDMS. Assicurati cherimuovere le colonne PDMS dal foro. - Controllare ogni buco perforato inserendo di nuovo l'ago penna pugno nel foro. Assicurarsi che l'ago può uscire dall'altra parte, che indica che non v'è alcun blocco. Applicare del nastro alla superficie del modello, quindi rimuovere delicatamente il nastro per pulire le particelle di polvere. Ripetere questa operazione almeno tre volte. Lascia un pezzo pulito di nastro adesivo sui PDMS per mantenere la sterilizzazione.
- Ripetere questa procedura sul lato opposto delle PDMS e lasciare l'ultimo pezzo di nastro adesivo sulla pure.
- Preparare un vetro di copertura 24 mm x 30 mm con uno spessore di 0.13-0.17 mm. Spruzzare etanolo al 70% sul vetro e secco con depolveratore per sterilizzare la superficie; Inoltre, il vetro può essere lavato con acqua ed essiccato in autoclave con depolveratore.
- Trasferire il vetrino coprioggetto e PDMS ad una piastra di plastica. Rimuovere il nastro adesivo dal PDMS e posizionare il lato modello rivolto verso l'alto. Evitare il contatto con la superficie del modello durante il trasferimento.
- Posizionare la piastra di plastica nella macchina plasma. Applicare un trattamento al plasma di ossigeno per il PDMS e il vetrino coprioggetto per rendere le superfici idrofile con i seguenti parametri di funzionamento: esposizione, 75 s; stabilizzazione gas, 20 cc / min; pressione, 200; e potenza, 100 W.
- posizionare accuratamente il PDMS sul vetro di copertura, che collega entrambe le superfici idrofile (le superfici affrontate durante il trattamento al plasma). Assicurarsi che non ci siano bolle d'aria tra il PDMS e il vetro di copertura.
- Incubare il chip PDMS in un forno a 75 ° C per almeno 2 ore.
NOTA: microfluidica carenti possono causare perdite di liquido sul microscopio durante l'esperimento. Pertanto, è importante controllare il legame tra il PDMS e il vetro di copertura sollevando leggermente il PDMS dai bordi con pinzette. Delicatamente sollevando le PDMS non dovrebbero separarla dal vetro di copertura, che indica un legame di successo.
3. Preparazione per l'esperimento
- preparazione del tubo.
- Immergere i tubi di ingresso e uscita in soluzione di etanolo al 70% separatamente 1 giorno prima preparazione di chip PDMS.
- Riempire una siringa da 5 ml con acqua in autoclave per lavare i tubi. Lavare ciascun tubo collegando il tubo sulla siringa e il lavaggio del tubo con acqua.
- Ripetere la fase di lavaggio, almeno 3 volte per pulire residui etanolo.
- Esaminare i canali PDMS sotto un microscopio ottico con un obiettivo 10X per assicurarsi che la struttura è coerente e intatto. Stabilizzare il chip PDMS sulla piattaforma microscopio utilizzando nastro adesivo.
NOTA: Fare chip multipli in una sola volta in fase 2 per garantire che non ci sono chip di backup, soprattutto se rendendo il dispositivo per la prima volta. - Riempire una siringa da 5 ml con acqua in autoclave. Fissare la siringa ad una pompa a siringa e inserire i tubi di ingresso e uscita corrispondenti. Impostare la velocità di lavaggio a 750 microlitri / h per risciacquare il chip per circa 10 min. Le bolle d'aria sui canali ramodevono essere lavati via durante questo periodo; se vi sono bolle rimanenti, regolare manualmente la velocità per eliminare le bolle.
- Lievito preparazione del campione.
- Trasferire 1 ml di campione preparato lievito (OD 600 0,6-0,8) in due provette da 1,5 ml microcentrifuga e centrifugare per 5 min a 3000 x g.
- Rimuovere la maggioranza del surnatante da ogni provetta e combinare il resto per formare un campione da 0,5 mL.
- Sospendere la pompa a siringa e rimuovere i tubi di ingresso dal chip PDMS.
- invertire manualmente la pompa a siringa per aspirare una piccola bolla d'aria (1 a 2 cm di lunghezza) in ogni provetta di ingresso. Passare a succhiare nel campione di lievito; la bolla d'aria mostrerà il confine campione e indicare la quantità di campione è stato elaborato.
NOTA: Evitare di succhiare il campione nella siringa. - Inserire il tubo di ingresso posteriore nel chip PDMS e riavviare la pompa per caricare le cellule ad una velocità di 750 ml / h.
- Lasciare la siringa pompa per 10 min lan ed esamina la progressione carico cella sotto il microscopio; un carico di successo sarà cellule intrappolare inferiore più del 60% di sospendere pilastro.
- Passare alla soluzione di alimentazione e regolare la velocità a 400 microlitri / h per la coltura delle cellule.
- posizioni di osservazione Select per il microscopio.
NOTA: Per le misure di durata della vita, le immagini sono state scattate una volta ogni 15 minuti da un microscopio ottico con un obiettivo 40x. Per l'analisi reporter fluorescente, immagini sono state prese una volta ogni 15 minuti con un microscopio a fluorescenza con un obiettivo olio 60X.
Risultati
Dopo gli esperimenti, le durate di vita di cellule e molti fenotipi cellulari e molecolari possono essere estratti dalle immagini time-lapse registrate. Poiché ci sono un certo numero di diverse caratteristiche che possono essere estratti da ciascuna cella, il primo passo dell'analisi è di annotare le cellule ed eventi, tra le posizioni ei confini delle celle e la tempistica dei vari eventi che vengono monitorati, quali come gli eventi in erba. Queste annotazioni che renderà più facile per tornare lo stesso insieme di cellule e analizzare caratteristiche diverse in futuro. Utilizzando software di analisi di immagini, come ImageJ 11 ei plugin associati, un elenco dei fenotipi può quindi essere estratta dai dati di immagine utilizzando le annotazioni registrate delle celle.
Di seguito sono riportati alcuni esempi di fenotipi misurata con il dispositivo microfluidico. Il fenotipo durata di lievitopuò essere ottenuto contando il numero di gemme prodotte da ciascuna cellula madre intrappolata e stimare con lo stimatore di Kaplan-Meier. Le cellule inizialmente intrappolati nei dispositivi microfluidica sono di età sconosciuti. Per ridurre al minimo la distorsione delle misurazioni durata della vita provenienti da queste età sconosciuti, i metodi precedenti utilizzati il numero medio di cicatrici gemma sulle cellule intrappolati per calibrare la durata della vita 4, 7. Tuttavia, le misure bocciolo cicatrice richiedono la colorazione addizionale di cellule e di fornire solo una stima indiretta della polarizzazione. Usando questo protocollo, il dispositivo intrappola spesso cellule figlie freschi che sbocciato fuori dalle cellule già intrappolati. Queste cellule poi si trasformano in cellule madri. Tali cellule possono essere identificati utilizzando il software di analisi di immagine a valle (Film 1). Queste cellule madre freschi forniscono una misurazione durata della vita più accurata. Come mostrato in figura 2, le curve di durata delle cellule madri freschi erano comparosso con quelli delle cellule di età sconosciuta. In questo esperimento, la vita media delle cellule madri fresche era leggermente più lungo (circa 2 generazioni di differenza di durata della vita media).
Oltre al numero di gemme, altri fenotipi interessanti, come l'intervallo di tempo tra due eventi in erba successive, come mostrato in figura 3, può essere estratto dai dati di immagini 3, 7, 8. Le cellule entrati in un periodo di germogliamento più veloce a seguito di un paio di lenti buddings iniziali. Il germogliamento rallentato drasticamente verso la fine della loro vita, che indica lo stato malsano di queste cellule di età. Le dinamiche del ciclo cellulare contiene informazioni molto utili per quanto riguarda lo stato cellulare delle cellule giovani e vecchie ed è stato utilizzato, per esempio, a caratterizzare mutanti telomerasi 12. Importante, questo dispositivo può essereutilizzato per misurare i segnali di fluorescenza tutta la durata (Figura 4), consentendo il rilevamento di marcatori molecolari che possono essere il conducente del processo di invecchiamento.

Figura 1: schema del disegno del dispositivo microfluidico. Il dispositivo è costituito da 6 moduli funzionali indipendenti che possono operare in parallelo. Ogni modulo è costituito da un canale principale collegato a due canali laterali. Ogni canale lato ha 113 colonne pensili. Un ponte supplementare viene aggiunto al mezzo per collegare il canale principale con i due canali laterali. cellule madri sono intrappolati sotto le colonne pensili, mentre le cellule figlie più piccole vengono lavate via dal flusso. Si prega di cliccare qui per vedere una versione più grande di questa figura.
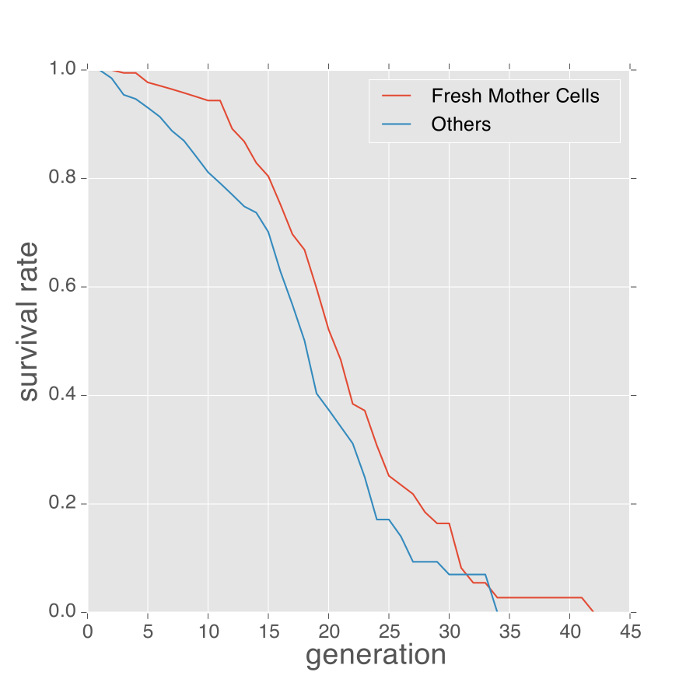
Figura 2: cellule madri freschi vivono più a lungo rispetto alle cellule con la storia sconosciuta. La durata della vita replicativa delle cellule madri Fresco contro le cellule di storia sconosciuta (cellule intrappolata dall'inizio dell'esperimento) nei media SD, 30 gradi. In media, cellule madri freschi vivono circa 2 generazioni più a lungo. Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 3: La lunghezza di erba intervalli cambia come cellule invecchiato. intervalli in erba misurato come intervalli di tempo tra buddings erano color-coded, le cellule sono state ordinate per la loro durata di vita di replica, e cellule madri freschi erano settembrearated da cellule di storia sconosciuta. Si prega di cliccare qui per vedere una versione più grande di questa figura.
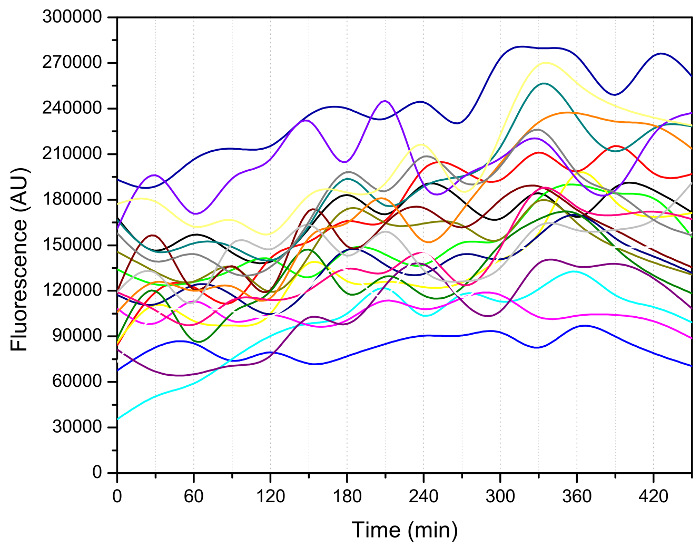
Figura 4: Misurazione dell'attività di Heat Shock Factor 1 (HSF1) utilizzando un dispositivo microfluidico. Il reporter HSF1-attività è costruito da una proteina fluorescente verde (GFP) fuso ad un promotore CYC1 storpio con HSE monte 13. immagini di fluorescenza sono state scattate ogni 30 min. Intensità GFP è stato poi quantificato utilizzando un codice MATLAB personalizzato 14. dati per ciascun singola cella sono collegati e indicati con una linea colorata. In questo esperimento, il ceppo è stato coltivato in terreno SD con 2% di glucosio (peso / volume) a 30 ° C per una notte; è stato poi diluito con lo stesso mezzo per il recupero. In seguito,terreno SD con 0,05% di glucosio (p / v) è stato usato per coltivare le cellule nel chip microfluidico durante la misurazione della fluorescenza. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Film 1: Un esempio di cellule madri fresche di essere intrappolato all'interno del dispositivo per tutta la durata della vita. Il filmato mostra una cellula madre fresco nata da una cellula in trappola. La freccia rossa, all'inizio del film segna la posizione della cellula madre fresca e la sua prima in erba. Questa cellula madre era intrappolata nel dispositivo microfluidica per tutta la sua durata di vita. Clicca qui per visualizzare questo video. (Tasto destro del mouse per scaricare).
Discussione
Il dispositivo PDMS deve essere preparata. Altrimenti, le bolle d'aria causate inserendo tubi nel dispositivo saranno difficili da rimuovere. Fase 3.4 è importante per migliorare l'efficienza di carico delle cellule concentrando le cellule. Per aumentare la velocità dell'esperimento, da 4 a 6 moduli sullo stesso chip PDMS collegati a pompe indipendentemente operativi sono tipicamente utilizzati per eseguire 4 a 6 diversi esperimenti (ceppi diversi o composizioni media) simultaneamente.
Rispetto al test di invecchiamento replicativo lievito convenzionale (che utilizza microdissezione), il metodo di microfluidica presentato qui è meno faticoso e richiede molto tempo. Inoltre, il dispositivo microfluidico consente la quantificazione dettagliata dei vari parametri cellulari o molecolari, tra cui la dimensione cellulare, la dinamica del ciclo cellulare, morfologia cellulare, e vari marcatori molecolari. Questo metodo microfluidica raggiunge cella a lungo termine di monitoraggio con la microscopia ad alta risoluzione mantenendocellule madri sotto PDMS micro-pad come cellule figlie sono lavata automaticamente.
Questo dispositivo utilizza PDMS morbide micro-pad per cellule madri trappola 4, con la struttura di base simile, come Huberts et al. descritto nel suo lavoro 7. Ci sono una serie di differenze nella progettazione del dispositivo e protocolli sperimentali. Il pad PDMS più ampio in questo dispositivo permette alcune cellule figlie neonato per essere intrappolati e analizzati (figure 2 e 3, Film 1). Per identificare tali cellule, abbiamo annotato le cellule figlie sbocciati da cellule madri già intrappolati, ignorando le cellule figlie che lavati via senza erba. In media, abbiamo ottenuto circa 2 cellule madri fresche per blocco PDMS. Il rapporto tra queste cellule madri fresche alle cellule della storia sconosciuta era di circa 1: 2, tra i quali circa un terzo sono stati tenuti nel dispositivo per tutta la durata della vita. Queste cellule permettono una più precisa una misura durata della vitad permettono di analizzare le correlazioni tra le cellule madre e figlia. In questo dispositivo, un canale profondo principale è collegato a due canali laterali profonde in cui vengono effettuate le osservazioni; questo motivo contribuisce a ridurre la possibilità dei canali laterali essendo bloccata da grandi bolle d'aria. Per la produzione di chip microfluidico, questo protocollo utilizza anche un metodo semplice per legare il PDMS e vetro di copertura, usando solo l'esposizione al plasma e forno di cottura, che aumenta il tasso di successo.
Con questo protocollo, il dispositivo microfluidico è in grado di intrappolare robusto almeno una cella (3-5 mesi in media) per pad PDMS all'inizio dell'esperimento per wild-type ceppi di lievito aploide (cioè, BY4741 o BY4742). Circa il 30% delle cellule può essere mantenuto durante tutta la loro vita. Vale la pena notare che le prestazioni del dispositivo PDMS dipende dalla dimensione spazio tra le colonne pensili e il vetro e la dimensione delle cellule di lievito. Per wild-type ceppi di lievito aploidi, ilformato adatto per il divario è 3,5-4,5 um. Fuori di questo intervallo, l'efficienza di carico e flessione percentuale di ritenzione della cellula nettamente. Pertanto, i nuovi dispositivi per ceppi di lievito con celle di dimensioni molto più grandi o più piccoli 7 devono essere fabbricate modificando l'altezza del primo strato realizzato in passaggio 1.
In sintesi, il dispositivo e il protocollo descritto in questo articolo non sono adatti solo per gli studi di affinamento sui lieviti, ma sono applicabili anche ad altri esperimenti che richiedono il monitoraggio delle cellule madri e il monitoraggio di marcatori molecolari per molte generazioni o per tutta la durata della vita.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
This research was supported by NIH Grant AG043080 and the National Natural Science Foundation of China (NSFC), No. 11434001. We thank Lucas Waldburger for proofreading the manuscript.
Materiali
| Name | Company | Catalog Number | Comments |
| 3'' <111> silicon wafer | Addison Engineering | ||
| SU-8 2000 and 3000 Series | MicroChem | ||
| Sylgard® 184 Silicone Elastomer Kit | ellsworth | 2065622 | Include Sylgard® silicone elastomer base and curing agent |
| Petri dishes | VWR | 391-1502 | |
| Harris Uni-core™ punch (I.D. 0.75 mm) | Sigma-Aldrich | 29002513 | |
| 24 mm x 40 mm SLIP-RITE® cover glass | Thermo Fisher Scientific | 102440 | |
| 3M Scotch Tape | ULINE | S-10223 | |
| VWR® Razor Blades | VWR | 55411-050 | |
| Pure Ethanol, Koptec | VWR | 64-17-5 | |
| Whoosh-Duster™ | VWR | 16650-027 | |
| 5 mL BD Syringe (Luer-Lock™ Tip) | Becton, Dickinson and Company | 309646 | |
| PTFE Standard Wall Tubing (100 ft, AWG Size: 22, Nominal ID: 0.028) | Component Supply Company | SWTT-22 | |
| Needle Assortment | Component Supply Company | NEKIT-1 | |
| Desiccator | HACH | 2238300 | |
| Lab Oven | Fisher Scientific | 13246516GAQ | |
| Nikon TE2000 microscope with 40X and 60X objective | Nikon | ||
| Zeiss Axio Observer Z1 with 40X and 60X objective | Zeiss | ||
| Syringe Pump | Longerpump | TS-1B |
Riferimenti
- Mortimer, R. K., Johnston, J. R. Life span of individual yeast cells. Nature. 183 (4677), 1751-1752 (1959).
- Polymenis, M., Kennedy, B. K. Cell biology: High-tech yeast ageing. Nature. 486 (7401), 37-38 (2012).
- Xie, Z., et al. Molecular phenotyping of aging in single yeast cells using a novel microfluidic device. Aging Cell. 11 (4), 599-606 (2012).
- Zhang, Y., et al. Single cell analysis of yeast replicative aging using a new generation of microfluidic device. PLoS One. 7 (11), e48275 (2012).
- Chen, K. L., Crane, M. M., Kaeberlein, M. Microfluidic technologies for yeast replicative lifespan studies. Mech Ageing Dev. , (2016).
- Lee, S. S., Avalos Vizcarra, ., Huberts, I., H, D., Lee, L. P., Heinemann, M. Whole lifespan microscopic observation of budding yeast aging through a microfluidic dissection platform. Proc Natl Acad Sci U S A. 109 (13), 4916-4920 (2012).
- Huberts, D. H., Janssens, G. E., Lee, S. S., Vizcarra, I. A., Heinemann, M. Continuous high-resolution microscopic observation of replicative aging in budding yeast. J Vis Exp. (78), e50143 (2013).
- Jo, M. C., Liu, W., Gu, L., Dang, W., Qin, L. High-throughput analysis of yeast replicative aging using a microfluidic system. Proc Natl Acad Sci U S A. 112 (30), 9364-9369 (2015).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. Journal of Micromechanics and Microengineering. 16 (2), 276-284 (2006).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37 (5), 550-575 (1998).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Xie, Z., et al. Early telomerase inactivation accelerates aging independently of telomere length. Cell. 160 (5), 928-939 (2015).
- Boy-Marcotte, E., et al. The heat shock response in yeast: differential regulations and contributions of the Msn2p/Msn4p and Hsf1p regulons. Mol Microbiol. 33 (2), 274-283 (1999).
- Yang, X., Lau, K. Y., Sevim, V., Tang, C. Design principles of the yeast G1/S switch. PLoS Biol. 11 (10), e1001673 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon