Method Article
L'utilisation des dispositifs microfluidiques pour mesurer et cellulaire Lifespan dans Phenotypes simples cellules de levure de bourgeonnement
Dans cet article
Résumé
Cet article présente un protocole optimisé pour la production de puces microfluidiques et la mise en place d'expériences microfluidique pour mesurer la durée de vie et phénotypes cellulaires de cellules de levure unique.
Résumé
Budding yeast Saccharomyces cerevisiae is an important model organism in aging research. Genetic studies have revealed many genes with conserved effects on the lifespan across species. However, the molecular causes of aging and death remain elusive. To gain a systematic understanding of the molecular mechanisms underlying yeast aging, we need high-throughput methods to measure lifespan and to quantify various cellular and molecular phenotypes in single cells. Previously, we developed microfluidic devices to track budding yeast mother cells throughout their lifespan while flushing away newborn daughter cells. This article presents a method for preparing microfluidic chips and for setting up microfluidic experiments. Multiple channels can be used to simultaneously track cells under different conditions or from different yeast strains. A typical setup can track hundreds of cells per channel and allow for high-resolution microscope imaging throughout the lifespan of the cells. Our method also allows detailed characterization of the lifespan, molecular markers, cell morphology, and the cell cycle dynamics of single cells. In addition, our microfluidic device is able to trap a significant amount of fresh mother cells that can be identified by downstream image analysis, making it possible to measure the lifespan with higher accuracy.
Introduction
levure bourgeonnante est un organisme modèle puissant recherche sur le vieillissement. Cependant, un essai de durée de vie classique dans la levure repose sur microdissection, qui est non seulement de main - d'œuvre , mais aussi faible débit 1, 2. De plus, l'approche traditionnelle microdissection ne fournit pas une vue détaillée de diverses fonctions cellulaires et moléculaires dans les cellules mère seule à mesure qu'ils vieillissent. Le développement de dispositifs microfluidiques a permis une procédure automatisée pour mesurer la durée de vie de la levure ainsi que de suivre les marqueurs moléculaires et différents phénotypes cellulaires pendant toute la durée de vie des cellules mères 3, 4, 5, 6, 7, 8. Après que les cellules de levure sont chargés dans un dispositif microfluidique, ils peuvent être suivis au microscope en utilisant automatique Time-toursImagerie e. Avec l'aide d'outils de traitement d' imagerie, divers phénotypes cellulaires et moléculaires peuvent être extraits 3, 6, 8, y compris la durée de vie, la taille, le reporter fluorescent, la morphologie cellulaire, la dynamique du cycle cellulaire, etc., dont beaucoup sont difficiles ou impossibles à obtenir en utilisant la méthode de microdissection traditionnelle. Les dispositifs microfluidiques ont pris de l' importance dans la recherche sur le vieillissement de la levure depuis leur développement réussi il y a quelques années 3, 4, 6, 7. Plusieurs groupes ont ensuite publié sur les variations des conceptions antérieures 5, et de nombreux laboratoires de levure ont utilisé des dispositifs microfluidiques pour leur étude.
Dans une culture de cellules en croissance exponentielle, le nombre de cellules âgées mères qui sont disponibles pour l'observation est miniscule. Par conséquent, le principe de la conception générale du dispositif microfluidique pour les mesures de durée de vie est de conserver les cellules mères et pour éliminer les cellules filles. L'un de ces modèles utilise le fait que la levure subit la division cellulaire asymétrique. Les structures dans le piège de la volonté de l'appareil plus grandes cellules mères et permettre aux petites cellules filles à être éliminés par lavage. La puce microfluidique décrit dans cet article utilise un tampon doux polydiméthylsiloxane (PDMS) (colonnes verticales de Pensile) pour piéger des cellules mères (figure 1). Des dispositifs de conception similaire ont été signalés précédemment 3, 4, 6, 7. Ce protocole utilise une procédure plus simple pour fabriquer des dispositifs microfluidiques et un procédé de chargement de cellule simple qui est optimisé pour les expériences d'imagerie time-lapse. L'un des principaux paramètres du dispositif microfluidique est la largeur des plots PDMS utilisés à des cellules mères de piège. notre dériphérique utilise des tampons plus larges qui peuvent garder plus de cellules mères dans chaque tampon, y compris une fraction significative de cellules fraîches mères qui peuvent être suivis tout au long de leur durée de vie. En plus des mesures de durée de vie, ce protocole est utile pour des expériences d'imagerie time-lapse de cellule lorsque les cellules doivent être suivis pendant plusieurs générations ou quand une observation tout au long de la durée de vie entière est nécessaire.
Protocole
1. Silicon Wafer Fabrication de moules
REMARQUE: Le photomasque est conçu avec le logiciel AutoCAD et fabriqué par une société commerciale. Cette conception contient trois couches de différents motifs ( Fichier supplémentaire 1 ). Les hauteurs des première, deuxième, et troisième couches sont d'environ 4 um, 10 um et 50 um, respectivement. Le moule de la tranche de silicium a été créé à partir du photomasque en utilisant la lithographie douce 9, 10.
- Faire cuire au four une plaquette de silicium à 200 ° C pendant 10 min pour évaporer la vapeur d'eau. couche de photorésist négatif Spin SU-8 sur la plaquette de silicium.
REMARQUE: revêtement centrifuge SU-8 3005 à 5000 tours par minute pendant 30 s pour produire la première couche, SU-8 2010 à 3000 tours par minute pendant 30 s pour générer la seconde couche, et SU-8 3025 à 2000 tours par minute pendant 30 s pour générer le troisième couche. - Soft-cuire la plaquette revêtue avant til transfert de motif. Aligner et à exposer la plaquette en mode « contact direct » en utilisant un aligneur de masque.
NOTE: Soft-cuire la plaquette pendant 2 min à 95 ° C pour la première couche, 3 min à 95 ° C pour la seconde couche, et 15 min à 95 ° C pour la troisième couche. Utiliser la dose d'exposition de 100 mJ / cm 2 pour la première couche, 130 mJ / cm 2 pour la seconde couche, et 200 mJ / cm 2 pour la troisième couche. - Après l'exposition, la tranche post-cuire et de le développer en utilisant développeur SU-8. Sécher la plaquette en utilisant un pistolet N 2 et dur cuire la tranche à 200 ° C pendant 30 min.
REMARQUE: le moule de pastille de silicium est fixé à une boîte de Petri en plastique de 15 cm de diamètre en utilisant du ruban adhésif, la face de motif orientée vers le haut. Habituellement, on met plusieurs structures de puces identiques sur le même moule, ce qui permet à plusieurs puces microfluidiques à être fabriqués en même temps. Chaque moule peut être réutilisé plusieurs fois pour fabriquer des puces microfluidiques.
2. microfluidiqueFabrication à puce
- Placez un bateau propre qui pèse sur une balance et tarer la balance. Verser 50 g de base PDMS dans le bateau peser.
- Ajouter 5 g d'agent de durcissement PDMS à la pesée bateau (w / w rapport de 1:10 à la base PDMS).
NOTE: Ce volume est basé sur une boîte de Petri de 15 cm de diamètre avec le moule. Ajuster la quantité de réactif si l'on utilise une boîte de Petri d'une taille différente. - Incorporer la base PDMS et l'agent de durcissement avec une pipette jetable. Commencez à partir du bord du bateau de pesage et de se déplacer lentement vers l'intérieur. Bien remuer pendant plusieurs minutes jusqu'à ce que de petites bulles se forment dans le mélange; un mélange intime est essentiel pour la polymérisation PDMS.
- Verser le mélange lentement dans la boîte de Pétri; le mélange doit couvrir complètement le moule de pastille de silicium.
- Placer la boîte de Petri dans un vide pendant 10 min pour éliminer toutes les bulles d'air du mélange PDMS. Si des bulles restent à la surface du mélange, utiliser une pipette pour les souffler.
- Incuber le siliciummoule tranche avec PDMS dans un four à 75 ° C pendant environ 2 h.
- peler doucement la couche de PDMS polymérisés hors du moule de pastille de silicium, ce qui évite tout dommage à la construction du moule de pastille. En variante, couper les PDMS directement à partir du moule de pastille de silicium avec une marge de 5 mm minimum autour du modèle en utilisant un seul bord lame de rasoir industrielle; peler doucement la couche PDMS hors du moule de pastille.
- Placer la couche PDMS sur le banc avec le côté du motif vers le haut. Découper soigneusement la puce individuelle avec une lame de rasoir industriel d'un bord, tout en conservant une marge suffisante du bord de chaque puce unique pour éviter d'endommager la construction.
- Avec la face de motif orientée vers le haut, en utilisant un stylo à poinçon (ID-0,75 mm) pour percer des trous vers le bas à travers les cercles d'entrée et de sortie de chaque côté des canaux.
NOTE: Ces trous créent la voie pour l'écoulement du fluide. Il est donc essentiel de passer par les cercles et de punch tout le chemin à travers la couche PDMS. Assurez-vous desupprimer les colonnes PDMS du trou. - Vérifiez chaque trou perforé en insérant l'aiguille de nouveau stylo poinçon dans le trou. Assurez-vous que l'aiguille peut sortir de l'autre côté, ce qui indique qu'il n'y a pas de blocage. Appliquer du ruban à la surface du modèle, puis peler délicatement la bande pour nettoyer les particules de poussière. Répétez cette étape au moins trois fois. Laisser un morceau propre de ruban adhésif sur les PDMS pour maintenir la stérilisation.
- Répétez cette procédure sur le côté opposé du PDMS et laisser le dernier morceau de ruban adhésif sur aussi bien.
- Préparer un cache de verre 24 mm x 30 mm avec une épaisseur de 0.13-0.17 mm. Vaporisateur 70% d'éthanol sur le verre et sécher avec dépoussiéreur pour stériliser la surface; En outre, le verre peut être lavé avec de l'eau autoclavée et séchée avec du dépoussiéreur.
- Transférer le verre de protection et PDMS à une plaque en matière plastique. Retirez le ruban adhésif des PDMS et placez le côté du motif vers le haut. Éviter tout contact avec la surface du motif pendant le transfert.
- Placer la plaque en matière plastique dans la machine à plasma. Appliquer un traitement au plasma d'oxygène pour les PDMS et le couvercle en verre pour rendre les surfaces hydrophiles avec les paramètres de fonctionnement suivants: exposition, 75 s; stabilisation des gaz, 20 cc / min; pression, 200; et de la puissance, 100 W.
- Placez soigneusement les PDMS sur le verre de recouvrement, reliant les deux surfaces hydrophiles (les surfaces qui fait face au cours du traitement par plasma). Assurez-vous qu'il n'y ait pas de bulles d'air entre le PDMS et le verre de couverture.
- Incuber la puce PDMS dans un four à 75 ° C pendant au moins 2 h.
REMARQUE: microfluidique peut provoquer des fuites insuffisantes liquide sur le microscope pendant l'expérience. Par conséquent, il est important de vérifier le lien entre le PDMS et le verre de couverture en soulevant légèrement les PDMS des bords avec des pincettes. soulevant doucement les PDMS ne doit pas le séparer du verre de couverture, ce qui indique une liaison réussie.
3. Préparation de l'expérience
- Préparation du tube.
- Immerger les tubes d'entrée et de sortie dans 70% de solution d'éthanol séparément 1 jour avant la préparation de la puce PDMS.
- Remplir une seringue de 5 ml avec de l'eau autoclavée pour laver les tubes. Laver chaque tube en branchant le tube de la seringue et le tube de rinçage à l'eau.
- Répéter l'étape de lavage au moins 3 fois pour nettoyer les résidus de l'éthanol.
- Examiner les canaux PDMS sous un microscope optique avec un objectif 10X pour vous assurer que la structure est cohérente et intacte. Stabiliser la puce PDMS sur la plate-forme de microscope en utilisant du ruban adhésif.
REMARQUE: Faire plusieurs jetons à un moment donné à l'étape 2 pour assurer qu'il y a des puces de sauvegarde, surtout si la réalisation du dispositif pour la première fois. - Remplir une seringue de 5 ml avec de l'eau autoclavé. Fixer la seringue à une pompe à seringue et insérer les tubes d'entrée et de sortie correspondants. Régler la vitesse de lavage et 750 ul / h pour rincer la puce pendant environ 10 min. Les bulles d'air sur les canaux de ramificationdoit être lavé au cours de cette période; s'il y a des bulles restantes, régler manuellement la vitesse pour éliminer les bulles.
- La levure préparation des échantillons.
- Transfer 1 ml d'échantillon préparé de levure (DO 600 de 0,6 à 0,8) dans deux tubes à microcentrifugation de 1,5 ml et on centrifuge pendant 5 min à 3000 x g.
- Éliminer la majeure partie du surnageant de chaque tube et mélanger le reste pour former un échantillon de 0,5 ml.
- Pause la pompe à seringue et retirer les tubes d'entrée de la puce PDMS.
- inverser manuellement la pompe à seringue pour aspirer une petite bulle d'air (1 à 2 cm de longueur) dans chaque tube d'entrée. Passez à sucer dans l'échantillon de levure; la bulle d'air montrera les limites de l'échantillon et indiquer la quantité échantillon a été sélectionné.
REMARQUE: Evitez d'aspirer l'échantillon dans la seringue. - Insérer le tube d'entrée avant dans la puce PDMS et redémarrer la pompe pour charger les cellules à une vitesse de 750 pl / h.
- Laisser la pompe à seringue sur 10 min pour lan et examiner la progression du chargement des cellules au microscope; une charge réussie sera cellules piège sous plus de 60% du montant de suspension.
- Passer à la solution de nutrition et d'ajuster la vitesse à 400 pi / h pour la culture cellulaire.
- Sélectionnez les positions d'observation pour le microscope.
REMARQUE: Pour des mesures de durée de vie, les images ont été prises une fois toutes les 15 min par un microscope optique avec un objectif 40x. Pour l'analyse de rapporteur fluorescent, les images ont été prises une fois toutes les 15 min par un microscope à fluorescence avec un objectif d'huile 60X.
Résultats
Après les expériences, les cellules des durées de vie et de nombreux phénotypes cellulaires et moléculaires peuvent être extraites des images en accéléré enregistrées. Comme il existe un certain nombre de caractéristiques qui peuvent être extraits à partir de chaque cellule, la première étape de l'analyse consiste à annoter les cellules et les événements, y compris les positions et les limites des cellules et la synchronisation des différents événements qui sont suivis, par exemple comme les événements naissants. Ces annotations plus facile de revenir au même ensemble de cellules et d'analyser les différentes caractéristiques à l'avenir. En utilisant un logiciel d'analyse d'images, tels que ImageJ 11 et les plugins associés, une liste de phénotypes peut alors être extrait à partir des données d'image en utilisant les annotations enregistrées des cellules.
Voici quelques exemples de phénotypes mesurés avec le dispositif microfluidique. Le phénotype de la durée de vie de la levurepeut être obtenu en comptant le nombre de bourgeons produites par chaque cellule mère piégée et l'estimation de l'estimateur de Kaplan-Meier. Les cellules initialement piégés dans les dispositifs microfluidiques sont des âges inconnus. Pour minimiser le biais de mesures de durée de vie provenant de ces âges inconnus, les méthodes précédentes ont utilisé le nombre moyen de cicatrices de bourgeons sur les cellules piégées pour calibrer la durée de vie 4, 7. Cependant, les mesures de cicatrice bourgeon nécessitent la coloration supplémentaire de cellules et ne donnent qu'une estimation indirecte du biais. En utilisant ce protocole, l'appareil emprisonne fréquemment des cellules fraîches fille qui avait fleuri hors des cellules déjà piégés. Ces cellules ont ensuite transformées en cellules mères. De telles cellules peuvent être identifiées à l' aide de notre logiciel d'analyse d'images aval (film 1). Ces nouvelles cellules mères fournissent une mesure de la durée de vie plus précis. Comme le montre la figure 2, les courbes de durée de vie des cellules fraîches mères ont été comparouge avec ceux des cellules d'âge inconnu. Dans cette expérience, la durée de vie moyenne des cellules mères fraîches était légèrement plus longue (environ 2 générations de différence dans la durée de vie médiane).
En plus du nombre de bourgeons, d' autres phénotypes intéressants, tels que l'intervalle de temps entre deux événements successifs en herbe, comme le montre la figure 3, peut être extraite à partir des données d'imagerie 3, 7, 8. Les cellules sont entrées dans une période de bourgeonnement plus rapide qui suit quelques écussonnages initiales plus lent. Le bourgeonnement a ralenti considérablement vers la fin de leur durée de vie, ce qui indique l'état malsain de ces cellules âgées. La dynamique du cycle cellulaire contient des informations très utiles en ce qui concerne l'état cellulaire des cellules jeunes et vieux et a été utilisé, par exemple, pour caractériser des mutants de 12 télomérase. Il est important, ce dispositif peut êtreutilisé pour mesurer les signaux de fluorescence tout au long de la durée de vie (Figure 4), ce qui permet le suivi de marqueurs moléculaires qui peuvent être le conducteur du processus de vieillissement.

Figure 1: Un schéma de la conception du dispositif microfluidique. Le dispositif est constitué de 6 modules fonctionnels indépendants qui peuvent fonctionner en parallèle. Chaque module est constitué d'un canal principal relié à deux canaux latéraux. Chaque canal latéral possède 113 colonnes Pensile. Un pont supplémentaire est ajouté au milieu pour relier le canal principal avec les deux canaux latéraux. les cellules mères sont piégés sous les colonnes Pensile, tandis que les plus petites cellules filles sont emportées par le courant. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
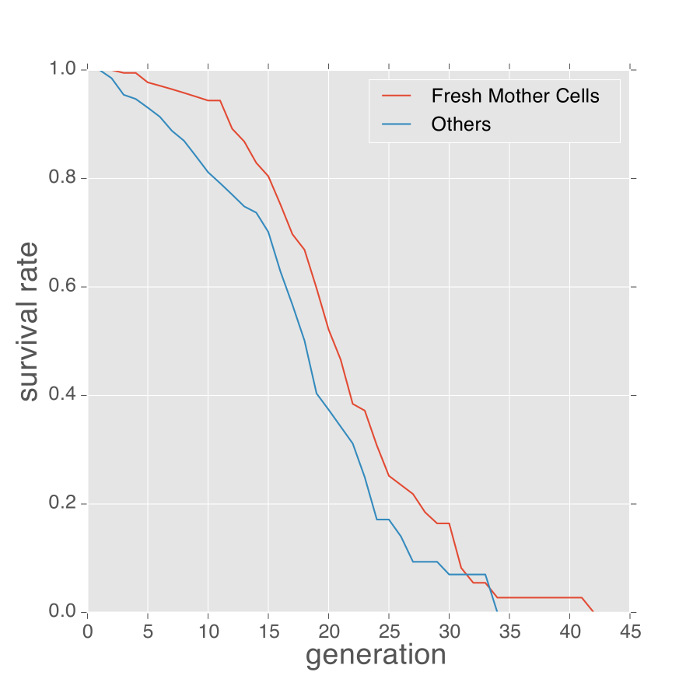
Figure 2: cellules mères fraîches vivent plus longtemps que les cellules avec l' histoire inconnue. La durée de vie réplicative des cellules fraîches mères par rapport aux cellules de l'histoire inconnue (cellules pris au piège du début de l'expérience) dans les médias SD, 30 degrés. En moyenne, les cellules fraîches mères vivent environ 2 générations plus. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3: La longueur des intervalles bourgeonnement changements que la cellule d' âge. intervalles mesurés en bourgeonnement les délais entre écussonnages ont été codés par couleur, les cellules ont été commandées par leur durée de vie de réplication et de nouvelles cellules mères étaient septembrearated à partir de cellules de l'histoire inconnue. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
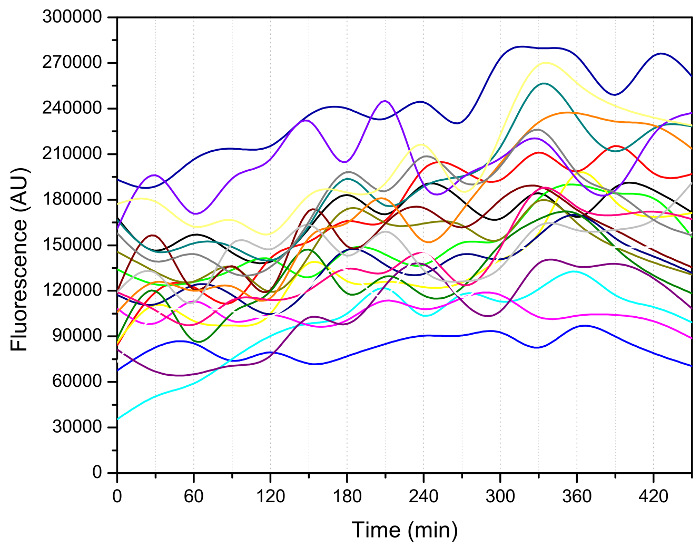
Figure 4: Mesure de l'activité du facteur de choc thermique 1 (HSF1) au moyen d' un dispositif microfluidique. Le rapporteur Hsf1-activité est réalisée par une protéine fluorescente verte (GFP) fusionnée à un promoteur CYC1 infirme avec amont HSE 13. Les images de fluorescence ont été prises toutes les 30 minutes. L' intensité de la GFP a été ensuite quantifié en utilisant un code personnalisé 14 Matlab. Les points de données pour chaque cellule sont connectées et indiquées par une ligne de couleur. Dans cette expérience, la souche a été cultivée dans du milieu SD avec 2% de glucose (poids / volume) à 30 ° C pendant une nuit; il a ensuite été dilué avec le même milieu pour la récupération. Après,milieu SD avec du glucose à 0,05% (poids / volume) a été utilisé pour cultiver des cellules dans la puce microfluidique pendant la mesure de fluorescence. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Film 1: Un exemple de cellules fraîches mère emprisonnée dans le dispositif pour la durée de vie entière. Le film montre une cellule nouvelle mère née d'une cellule piégée. La flèche rouge au début du film marque la position de la cellule mère fraîche et son premier bourgeonnement. Cette cellule mère a été emprisonnée dans le dispositif microfluidique pour sa durée de vie entière. S'il vous plaît cliquer ici pour voir cette vidéo. (Faites un clic droit pour télécharger.)
Discussion
Le dispositif PDMS doit être fraîchement préparé. Sinon, les bulles d'air provoquées par l'insertion des tubes dans le dispositif sera difficile à enlever. Étape 3.4 est important d'améliorer l'efficacité de chargement des cellules en concentrant les cellules. Pour augmenter le débit de l'expérience, quatre à six modules sur la même puce de PDMS reliés à des pompes fonctionnant indépendamment sont généralement utilisés pour effectuer 4 à 6 expériences différentes (souches différentes ou des compositions multimédias) simultanément.
Par rapport à l'essai de vieillissement réplicatif de levure classique (qui utilise microdissection), le procédé microfluidique présenté ici est moins laborieux et prend du temps. De plus, le dispositif microfluidique permet la quantification détaillée des différents paramètres cellulaires et moléculaires, y compris la taille des cellules, la dynamique du cycle cellulaire, la morphologie cellulaire, et divers marqueurs moléculaires. Cette méthode microfluidique réalise le suivi des cellules à long terme avec la microscopie à haute résolution en conservantles cellules mères de moins de micro-plaquettes PDMS que les cellules filles sont rincées automatiquement.
Ce dispositif utilise des micro-plaquettes PDMS souples pour piéger les cellules mères 4, avec la structure de base similaire, comme Huberts et al. décrit dans son travail 7. Il y a un certain nombre de différences dans la conception de l'appareil et les protocoles expérimentaux. Le tampon de PDMS plus large dans ce dispositif permet à certaines cellules filles nouveau - nés à être piégés et analysés (figures 2 et 3, film 1). Pour identifier ces cellules, nous annotés les cellules filles bourgeonné à partir de cellules mères déjà piégés, en ignorant les cellules filles qui Flushed Away sans herbe. En moyenne, nous avons eu environ 2 cellules fraîches mère par bloc de PDMS. Le rapport de ces nouvelles cellules mères aux cellules de l'histoire inconnue était d'environ 1: 2, parmi lesquels environ un tiers ont été conservés dans l'appareil pour la durée de vie entière. Ces cellules permettent une durée de vie d'une plus précise de mesured permettent d'analyser les corrélations entre les cellules mères et filles. Dans ce dispositif, un canal plus profond principal est connecté à deux canaux latéraux peu profonds où les observations sont faites; cette conception permet de réduire les risques des canaux latéraux étant bloqués par de grosses bulles d'air. Pour la production de puce microfluidique, ce protocole utilise également une méthode simple pour lier les PDMS et le verre de recouvrement, tout en utilisant l'exposition au plasma et cuisson au four, ce qui augmente le taux de succès.
Avec ce protocole, le dispositif microfluidique est capable de piéger solidement au moins une des cellules (3-5 cellules en moyenne) par plot de PDMS au début de l'expérience pour les souches de levure haploïdes de type sauvage (c. -à- BY4741 ou BY4742). Environ 30% des cellules peuvent être conservés tout au long de leur durée de vie entière. Il convient de noter que les performances du dispositif PDMS dépend de la taille de l'espace entre les colonnes de Pensile et le verre et la taille des cellules de levure. Pour souches de type sauvage de levure haploïdes, lataille appropriée pour l'écart est 3.5 à 4.5 um. En dehors de cette plage, l'efficacité de chargement et baisse du taux de rétention des cellules fortement. Ainsi, de nouveaux dispositifs de souches de levure avec beaucoup plus grandes ou plus petites tailles de cellules 7 doivent être fabriquées en modifiant la hauteur de la première couche réalisée dans l' étape 1.
En résumé, le dispositif et le protocole décrit dans cet article ne sont pas seulement approprié pour les études de vieillissement de levure, mais sont également applicables à d'autres expériences qui nécessitent le suivi des cellules mères et le suivi des marqueurs moléculaires pour plusieurs générations ou tout au long de la durée de vie.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
This research was supported by NIH Grant AG043080 and the National Natural Science Foundation of China (NSFC), No. 11434001. We thank Lucas Waldburger for proofreading the manuscript.
matériels
| Name | Company | Catalog Number | Comments |
| 3'' <111> silicon wafer | Addison Engineering | ||
| SU-8 2000 and 3000 Series | MicroChem | ||
| Sylgard® 184 Silicone Elastomer Kit | ellsworth | 2065622 | Include Sylgard® silicone elastomer base and curing agent |
| Petri dishes | VWR | 391-1502 | |
| Harris Uni-core™ punch (I.D. 0.75 mm) | Sigma-Aldrich | 29002513 | |
| 24 mm x 40 mm SLIP-RITE® cover glass | Thermo Fisher Scientific | 102440 | |
| 3M Scotch Tape | ULINE | S-10223 | |
| VWR® Razor Blades | VWR | 55411-050 | |
| Pure Ethanol, Koptec | VWR | 64-17-5 | |
| Whoosh-Duster™ | VWR | 16650-027 | |
| 5 mL BD Syringe (Luer-Lock™ Tip) | Becton, Dickinson and Company | 309646 | |
| PTFE Standard Wall Tubing (100 ft, AWG Size: 22, Nominal ID: 0.028) | Component Supply Company | SWTT-22 | |
| Needle Assortment | Component Supply Company | NEKIT-1 | |
| Desiccator | HACH | 2238300 | |
| Lab Oven | Fisher Scientific | 13246516GAQ | |
| Nikon TE2000 microscope with 40X and 60X objective | Nikon | ||
| Zeiss Axio Observer Z1 with 40X and 60X objective | Zeiss | ||
| Syringe Pump | Longerpump | TS-1B |
Références
- Mortimer, R. K., Johnston, J. R. Life span of individual yeast cells. Nature. 183 (4677), 1751-1752 (1959).
- Polymenis, M., Kennedy, B. K. Cell biology: High-tech yeast ageing. Nature. 486 (7401), 37-38 (2012).
- Xie, Z., et al. Molecular phenotyping of aging in single yeast cells using a novel microfluidic device. Aging Cell. 11 (4), 599-606 (2012).
- Zhang, Y., et al. Single cell analysis of yeast replicative aging using a new generation of microfluidic device. PLoS One. 7 (11), e48275 (2012).
- Chen, K. L., Crane, M. M., Kaeberlein, M. Microfluidic technologies for yeast replicative lifespan studies. Mech Ageing Dev. , (2016).
- Lee, S. S., Avalos Vizcarra, ., Huberts, I., H, D., Lee, L. P., Heinemann, M. Whole lifespan microscopic observation of budding yeast aging through a microfluidic dissection platform. Proc Natl Acad Sci U S A. 109 (13), 4916-4920 (2012).
- Huberts, D. H., Janssens, G. E., Lee, S. S., Vizcarra, I. A., Heinemann, M. Continuous high-resolution microscopic observation of replicative aging in budding yeast. J Vis Exp. (78), e50143 (2013).
- Jo, M. C., Liu, W., Gu, L., Dang, W., Qin, L. High-throughput analysis of yeast replicative aging using a microfluidic system. Proc Natl Acad Sci U S A. 112 (30), 9364-9369 (2015).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. Journal of Micromechanics and Microengineering. 16 (2), 276-284 (2006).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37 (5), 550-575 (1998).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Xie, Z., et al. Early telomerase inactivation accelerates aging independently of telomere length. Cell. 160 (5), 928-939 (2015).
- Boy-Marcotte, E., et al. The heat shock response in yeast: differential regulations and contributions of the Msn2p/Msn4p and Hsf1p regulons. Mol Microbiol. 33 (2), 274-283 (1999).
- Yang, X., Lau, K. Y., Sevim, V., Tang, C. Design principles of the yeast G1/S switch. PLoS Biol. 11 (10), e1001673 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.