Method Article
El uso de dispositivos de microfluidos para Medir Lifespan y Celular fenotipos en células individuales levadura en ciernes
En este artículo
Resumen
Este artículo presenta un protocolo optimizado para la producción de chips de microfluidos y la configuración de los experimentos de microfluidos para medir la vida útil y los fenotipos celulares de células de levadura individuales.
Resumen
Budding yeast Saccharomyces cerevisiae is an important model organism in aging research. Genetic studies have revealed many genes with conserved effects on the lifespan across species. However, the molecular causes of aging and death remain elusive. To gain a systematic understanding of the molecular mechanisms underlying yeast aging, we need high-throughput methods to measure lifespan and to quantify various cellular and molecular phenotypes in single cells. Previously, we developed microfluidic devices to track budding yeast mother cells throughout their lifespan while flushing away newborn daughter cells. This article presents a method for preparing microfluidic chips and for setting up microfluidic experiments. Multiple channels can be used to simultaneously track cells under different conditions or from different yeast strains. A typical setup can track hundreds of cells per channel and allow for high-resolution microscope imaging throughout the lifespan of the cells. Our method also allows detailed characterization of the lifespan, molecular markers, cell morphology, and the cell cycle dynamics of single cells. In addition, our microfluidic device is able to trap a significant amount of fresh mother cells that can be identified by downstream image analysis, making it possible to measure the lifespan with higher accuracy.
Introducción
La levadura en ciernes es un poderoso organismo modelo en la investigación del envejecimiento. Sin embargo, un ensayo de vida útil convencional en levaduras se basa en la microdisección, que no sólo es un trabajo intensivo sino también bajo rendimiento 1, 2. Además, el enfoque de microdisección tradicional no proporciona una vista detallada de diversas características celulares y moleculares en las células madre individuales a medida que envejecen. El desarrollo de dispositivos microfluídicos ha permitido un procedimiento automatizado para medir la vida útil de la levadura, así como de seguir los marcadores moleculares y diferentes fenotipos celulares a lo largo de la vida útil de las células madre 3, 4, 5, 6, 7, 8. Después de células de levadura se cargan en un dispositivo de microfluidos, pueden ser rastreados bajo un microscopio usando el tiempo-vueltas automáticase imágenes. Con la ayuda de la formación de imágenes herramientas de procesamiento, diferentes fenotipos celulares y moleculares se pueden extraer 3, 6, 8, incluyendo la vida útil, el tamaño, el reportero fluorescente, la morfología celular, la dinámica del ciclo celular, etc., muchos de los cuales son difíciles o imposibles de obtener mediante el método tradicional de microdisección. Dispositivos de microfluidos han ganado importancia en la investigación de levadura envejecimiento, ya que su desarrollo con éxito hace unos años, 3, 4, 6, 7. Varios grupos han publicado posteriormente en variaciones de los diseños anteriores 5, y muchos laboratorios de levadura han empleado dispositivos de microfluidos para su estudio.
En un cultivo de células sometidos a crecimiento exponencial, el número de células madre de edad que están disponibles para la observación es miniscuLe. Por lo tanto, el principio de diseño general del dispositivo de microfluidos para mediciones de vida útil es conservar las células madre y para eliminar las células hijas. Uno de estos diseños hace uso del hecho de que la levadura se somete a la división celular asimétrica. Las estructuras de las células madre de la trampa voluntad dispositivo más grandes y permitir que las células hijas más pequeñas para ser lavados. El chip microfluídico descrito en este artículo utiliza una almohadilla de polidimetilsiloxano suave (PDMS) (columnas Pensile verticales) a las células madre trampa (Figura 1). Dispositivos de diseño similar se ha informado anteriormente 3, 4, 6, 7. Este protocolo utiliza un procedimiento más sencillo para fabricar dispositivos microfluídicos y un método de la celda de carga sencilla que está optimizado para los experimentos de imagen de lapso de tiempo. Uno de los parámetros clave en el dispositivo de microfluidos es la anchura de las almohadillas de PDMS utilizados para células trampa madre. nuestra device utiliza almohadillas más amplios que pueden mantener más células madre en cada almohadilla, incluyendo una fracción significativa de células madre frescas que pueden rastrearse a lo largo de su vida útil. Además de las mediciones de vida útil, este protocolo es útil para los experimentos de imagen única célula de lapso de tiempo cuando las células necesitan ser rastreado por muchas generaciones o cuando una observación a lo largo de toda la vida útil es necesario.
Protocolo
1. Molde de fabricación de obleas de silicio
NOTA: La fotomáscara se ha diseñado con el software AutoCAD y fabricado por una empresa comercial. Este diseño contiene tres capas de diferentes patrones ( Archivo 1 ). Las alturas de la primera, segunda, y tercera capas son aproximadamente 4! M, 10 m, y 50! M, respectivamente. El molde oblea de silicio se ha creado a partir de la fotomáscara mediante litografía blanda 9, 10.
- Hornear una oblea de silicio a 200 ° C durante 10 min para evaporar el vapor de agua. revestimiento por centrifugación fotorresistente negativo SU-8 sobre la oblea de silicio.
NOTA: revestimiento por centrifugación SU-8 3.005 a 5.000 rpm durante 30 s para generar la primera capa, SU-8 de 2010 a 3000 rpm durante 30 s para generar la segunda capa, y SU-8 3.025 a 2.000 rpm durante 30 s para generar el tercera capa. - Soft-hornear la oblea revestida antes de tque la transferencia de patrones. Alinear y exponer la oblea en el modo de "contacto directo" utilizando un alineador de máscara.
NOTA: Soft-hornear la oblea durante 2 min a 95 ° C para la primera capa, 3 min a 95 ° C para la segunda capa, y 15 min a 95 ° C para la tercera capa. Utilice la dosis de exposición a 100 mJ / cm 2 para la primera capa, 130 mJ / cm 2 para la segunda capa, y 200 mJ / cm 2 para la tercera capa. - Después de la exposición, post-hornear la oblea y desarrollarla utilizando SU-8 desarrollador. Se seca la oblea usando una pistola de N 2 y difíciles de hornear la oblea a 200 ° C durante 30 min.
NOTA: El molde oblea de silicio se fija a una placa de plástico 15 cm de diámetro Petri utilizando cinta scotch, con el lado de patrón hacia arriba. Por lo general, ponemos varias estructuras de chips idénticos en el mismo molde, lo que permite que varios chips de microfluidos para fabricar al mismo tiempo. Cada molde puede ser reutilizado muchas veces para fabricar chips de microfluidos.
2. microfluidosLa fabricación de chips
- Colocar un recipiente pesado limpia en una balanza y tarar la balanza. Verter 50 g de base de PDMS en la barca de pesaje.
- Añadir 5 g de agente de curado PDMS a la embarcación pesaje (w / w proporción de 1:10 a la base de PDMS).
NOTA: Este volumen se basa en un plato de 15 cm de diámetro Petri con el molde. Ajustar la cantidad de reactivo si se utiliza una placa de Petri de un tamaño diferente. - Se agita la base de PDMS y el agente de curado con una pipeta desechable. Comience desde el borde del recipiente pesado y poco a poco avanzar hacia el interior. Se agita a fondo durante varios minutos hasta pequeñas burbujas se forman en toda la mezcla; la mezcla completa es esencial para la polimerización de PDMS.
- Verter la mezcla lentamente en la placa de Petri; la mezcla debe cubrir completamente el molde oblea de silicio.
- Coloque la placa de Petri en un vacío durante 10 minutos para eliminar todas las burbujas de aire de la mezcla de PDMS. Si las burbujas permanecen en la superficie de la mezcla, utilizar una pipeta para apagarlas.
- Incubar el siliciomolde oblea con PDMS en un horno a 75 ° C durante aproximadamente 2 h.
- Con cuidado, la capa de PDMS polimerizadas fuera del molde oblea de silicio, evitando cualquier daño a la construcción del molde oblea. Alternativamente, cortar los PDMS directamente desde el molde oblea de silicio con un mínimo margen de 5 mm alrededor del patrón usando una hoja de afeitar industrial de un solo borde; suavemente pelar la capa de PDMS fuera del molde oblea.
- Coloque la capa de PDMS en el banco con el lado patrón hacia arriba. Extraer con cuidado el chip individuo con una hoja de afeitar industrial de un solo borde, manteniendo un margen adecuado desde el borde de cada solo chip para evitar el daño de la construcción.
- Con el lado de patrón hacia arriba, utilizar una pluma punzón (0,75 mm ID) para perforar agujeros directamente hacia abajo a través de los círculos de entrada y de salida en cada lado de los canales.
NOTA: Estos agujeros crean la vía para el flujo del medio. Por lo tanto, es crucial que pasar por los círculos y perforar todo el camino a través de la capa de PDMS. Asegurate quequitar las columnas de PDMS del agujero. - Comprobar cada agujero perforado mediante la inserción de la aguja de pluma punzón de nuevo en el agujero. Asegúrese de que la aguja pueda salir por el otro lado, lo que indica que no hay ninguna obstrucción. Aplique cinta a la superficie de patrón, a continuación, pelar suavemente de la cinta para limpiar las partículas de polvo. Repita este paso al menos tres veces. Deja un trozo limpio de cinta adhesiva sobre el PDMS para mantener la esterilización.
- Repita este procedimiento en el lado opuesto del PDMS y dejar el último trozo de cinta en también.
- Preparar una cubierta de vidrio 24 mm x 30 mm con un espesor de 0.13-0.17 mm. Pulverizar 70% de etanol en el cristal y seco con eliminador de polvo para esterilizar la superficie; Además, el vidrio se puede lavar con agua esterilizada en autoclave y se secó con eliminador de polvo.
- Transferir el vidrio de cubierta y PDMS a una placa de plástico. Retire la cinta adhesiva desde el PDMS y colocar la superficie con el dibujo hacia arriba. Evitar cualquier contacto con la superficie de patrón durante la transferencia.
- Coloque la placa de plástico en la máquina de plasma. Aplicar el tratamiento con plasma de oxígeno a los PDMS y el vidrio de cubierta para hacer que las superficies hidrófilas con los siguientes parámetros de operación: la exposición, 75 s; estabilización de los gases, 20 cc / min; presión, 200; y el poder, 100 W.
- Colocar con cuidado el PDMS en el cristal de cubierta, que conecta las dos superficies hidrófilas (las superficies que se enfrentan hacia arriba durante el tratamiento de plasma). Asegúrese de que no hay burbujas de aire entre el PDMS y la cubierta de vidrio.
- Incubar el chip de PDMS en un horno a 75 ° C durante al menos 2 h.
NOTA: microfluídica deficientes pueden causar fugas de líquido en el microscopio durante el experimento. Por lo tanto, es importante comprobar el enlace entre el PDMS y el vidrio de cubierta levantando ligeramente el PDMS de los bordes con pinzas. levantando suavemente el PDMS no debe separarlo de la cubierta de vidrio, lo que indica una unión exitosa.
3. Preparación para el Experimento
- Preparación del tubo.
- Sumergir los tubos de entrada y salida en solución de etanol al 70% por separado 1 día antes de la preparación de chips PDMS.
- Llene una jeringa de 5 ml con agua tratada en autoclave para lavar los tubos. Lavar cada tubo conectando el tubo de la jeringa y el lavado del tubo con agua.
- Repetir la etapa de lavado al menos 3 veces para limpiar los residuos de etanol.
- Examinar los canales de PDMS bajo un microscopio óptico con un objetivo de 10X para asegurarse de que la estructura es coherente e intacto. Estabilizar el chip de PDMS en la plataforma de microscopio usando cinta adhesiva.
NOTA: Haga varias fichas en un momento en el paso 2 para asegurar que no son chips de copia de seguridad, especialmente si haciendo que el dispositivo por primera vez. - Llene una jeringa de 5 ml con agua tratada en autoclave. Fije la jeringa a una bomba de jeringa e insertar los tubos de entrada y salida correspondientes. Ajuste la velocidad de lavado a 750 l / h para enjuagar el chip durante aproximadamente 10 min. Las burbujas de aire en los canales de ramificacióndeben ser lavados durante este período; Si hay burbujas restantes, ajustar manualmente la velocidad para eliminar las burbujas.
- preparación de la muestra de levadura.
- Transferencia de 1 ml de muestra de levadura preparada (OD 600 0.6-0.8) en dos tubos de 1,5 ml de microcentrífuga y se centrifuga durante 5 min a 3.000 x g.
- Eliminar la mayoría del sobrenadante de cada tubo y combinar el resto para formar una muestra de 0,5 ml.
- Pausa la bomba de jeringa y retirar los tubos de entrada del chip PDMS.
- retroceder manualmente la bomba de jeringa para aspirar una pequeña burbuja de aire (1 a 2 cm de longitud) en cada tubo de entrada. Pasar a aspirar la muestra de levadura; la burbuja de aire se mostrará el límite de la muestra e indicar la cantidad de muestra que se ha dibujado.
NOTA: Evitar que aspira la muestra en la jeringa. - Introducir el tubo de entrada de nuevo en el chip de PDMS y reinicie la bomba para cargar las células a una velocidad de 750 l / h.
- Deje la jeringa bomba durante 10 min lan y examinar la progresión carga de las células bajo el microscopio; una carga exitoso células trampa bajo más de un 60% de suspender pilar.
- Cambiar a solución nutrición y ajustar la velocidad de 400 l / h para el cultivo celular.
- Seleccione posiciones de observación para el microscopio.
NOTA: Para las mediciones de vida útil, las imágenes fueron tomadas una vez cada 15 minutos mediante un microscopio óptico con un objetivo de 40x. Para el análisis informador fluorescente, imágenes fueron tomadas una vez cada 15 min por un microscopio de fluorescencia con un objetivo de aceite 60X.
Resultados
Después de los experimentos, la vida útil de las células y muchos fenotipos celulares y moleculares se pueden extraer de las imágenes de lapso de tiempo grabados. Puesto que hay un número de diferentes características que se pueden extraer de cada celda, el primer paso del análisis es para anotar las células y eventos, incluyendo las posiciones y los límites de las células y la sincronización de los diversos eventos que se está realizando el seguimiento, tales como los acontecimientos en ciernes. Estas anotaciones harán que sea más fácil para volver al mismo conjunto de células y analizar diferentes características en el futuro. Usando el software de análisis de imágenes, tales como ImageJ 11 y los plugins asociados, una lista de fenotipos entonces se puede extraer de los datos de imagen utilizando las anotaciones registradas de las células.
Los siguientes son algunos ejemplos de fenotipos medidos con el dispositivo de microfluidos. El fenotipo vida útil de levadurase puede obtener contando el número de brotes producidos por cada célula madre atrapada y la estimación con el estimador de Kaplan-Meier. Las células inicialmente atrapados en los dispositivos de microfluidos son de edades desconocidas. Para minimizar el sesgo de las mediciones de vida útil procedentes de estas edades desconocidas, los métodos anteriores utilizan el número medio de cicatrices brote sobre las células atrapadas para calibrar la vida útil 4, 7. Sin embargo, las mediciones de brote de la cicatriz requieren la tinción adicional de las células y proporcionan solamente una estimación indirecta de la polarización. El uso de este protocolo, el dispositivo con frecuencia atrapa células hijas frescas que floreció fuera de las células ya atrapados. Estas células se convierten en células madre. Tales células se pueden identificar usando nuestro software de análisis de imágenes aguas abajo (Película 1). Estas células madre frescas proporcionan una medición más precisa vida útil. Como se muestra en la Figura 2, las curvas de vida de las células madre frescas eran comparojo con las de las células de edad desconocida. En este experimento, el promedio de vida de las células madre fresca fue ligeramente más largo (alrededor de 2 generaciones de diferencia en esperanza de vida media).
Además del número de brotes, otros fenotipos interesantes, como el intervalo de tiempo entre dos eventos en ciernes sucesivas, como se muestra en la Figura 3, se puede extraer de los datos de imagen 3, 7, 8. Las células entraron en un período de florecimiento más rápido después de un lento unos injertos iniciales. La brotación se ralentizó drásticamente hacia el final de su vida útil, lo que indica el estado saludable de estas células envejecidas. La dinámica del ciclo celular contiene información muy útil sobre el estado celular de las células jóvenes y viejos, y se ha utilizado, por ejemplo, para caracterizar los mutantes telomerasa 12. Es importante destacar que este dispositivo puede serusado para medir las señales de fluorescencia durante toda la vida (Figura 4), lo que permite el seguimiento de los marcadores moleculares que pueden ser el conductor del proceso de envejecimiento.

Figura 1: un esquema del diseño del dispositivo de microfluidos. El dispositivo consta de 6 módulos funcionales independientes que pueden operar en paralelo. Cada módulo está hecho de un canal principal conectado a dos canales secundarios. Cada canal lateral tiene 113 columnas Pensile. Un puente adicional se añade en el medio para conectar el canal principal con los dos canales secundarios. Las células madre se encuentran atrapados debajo de las columnas Pensile, mientras que las células hijas más pequeñas son arrastradas por la corriente. Haga clic aquí para ver una versión más grande de esta figura.
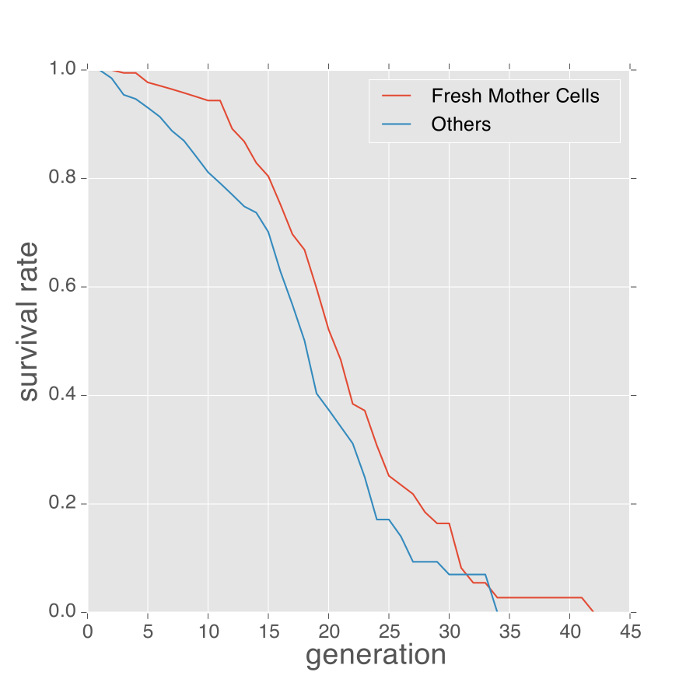
Figura 2: células madre frescas viven más tiempo que las células con historia desconocida. La esperanza de vida replicativa de las células madre frescos frente a las células de la historia desconocida (células atrapado desde el principio del experimento) en medios SD, 30 grados. En promedio, las células madre dulce viven cerca de 2 generaciones más tiempo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: La longitud de gemación intervalos de cambios como célula de edad. intervalos de florecimiento medidos como marcos de tiempo entre injertos fueron un código de colores, las células fueron clasificadas por su vida útil de replicación, y las células madre frescas eran septiembrearated a partir de células de la historia desconocida. Haga clic aquí para ver una versión más grande de esta figura.
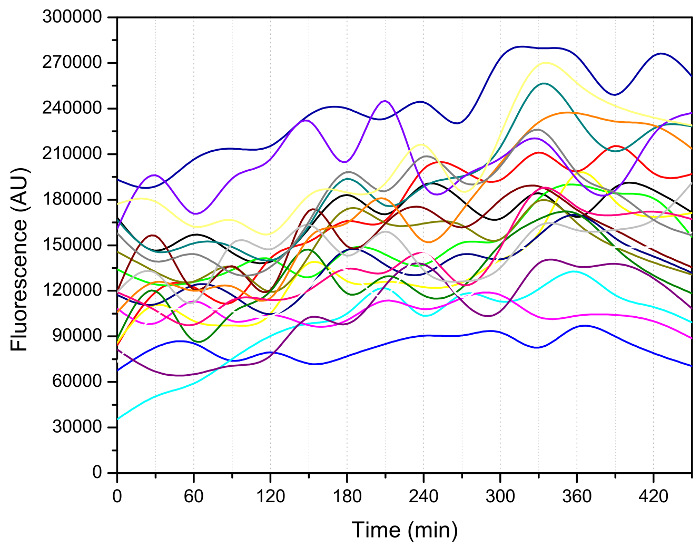
Figura 4: Medición de la actividad de factor de choque térmico 1 (HSF1) utilizando un dispositivo de microfluidos. El reportero Hsf1-actividad se construye mediante una proteína fluorescente verde (GFP) fusionada a un promotor CYC1 lisiado con HSE aguas arriba 13. Las imágenes de fluorescencia se tomaron cada 30 minutos. Intensidad de GFP fue entonces cuantifica usando un código MATLAB personalizado 14. Los puntos de datos para cada celda única se conectan y se indican con una línea de color. En este experimento, la cepa se cultivó en medio SD con glucosa al 2% (peso / vol) a 30 ° C durante la noche; después se diluyó con el mismo medio para la recuperación. Después,medio SD con 0,05% de glucosa (peso / vol) se utilizó para cultivar células en el chip microfluídico durante la medición de fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
Película 1: Un ejemplo de células madre frescos estar atrapado dentro del dispositivo durante toda la vida útil. La película muestra una célula madre recién nacida de una célula atrapada. La flecha roja en el principio de la película marca la posición de la célula madre fresca y su primer ciernes. Esta célula madre estaba atrapada en el dispositivo de microfluidos para toda su vida útil. Haga clic aquí para ver el vídeo. (Haga clic aquí para descargar.)
Discusión
El dispositivo de PDMS necesita ser recién hecho. De lo contrario, las burbujas de aire causadas por la inserción de tubos en el dispositivo serán difíciles de eliminar. Paso 3.4 es importante para mejorar la eficiencia de carga de células mediante la concentración de las células. Para aumentar el rendimiento del experimento, de 4 a 6 módulos en el mismo chip PDMS conectados a independiente bombas que operan normalmente se utilizan para realizar de 4 a 6 experimentos diferentes (diferentes cepas o composiciones de medios) simultáneamente.
En comparación con el ensayo de envejecimiento replicativo de levadura convencional (que utiliza microdisección), el método de microfluidos se presenta aquí es menos laborioso y consume mucho tiempo. Además, el dispositivo microfluídico permite la cuantificación detallada de varios parámetros celulares o moleculares, incluyendo el tamaño celular, la dinámica del ciclo celular, la morfología celular, y diversos marcadores moleculares. Este método de microfluidos logra celular a largo plazo de seguimiento con microscopía de alta resolución mediante la retención decélulas madre bajo PDMS micro-almohadillas como células hijas se vacían automáticamente.
Este dispositivo utiliza PDMS suaves micro-almohadillas a las células madre trampa 4, con la estructura básica similar, como Huberts et al. describe en su obra 7. Hay una serie de diferencias en el diseño de dispositivos y protocolos experimentales. La almohadilla de PDMS más amplio en este dispositivo permite que algunas células hijas recién nacidos para ser atrapados y se analizaron (Figuras 2 y 3, Película 1). Para identificar estas células, se anotaron las células hijas a partir de células madre injertadas ya atrapados, haciendo caso omiso de las células hijas que arrastrada sin ciernes. En promedio, tenemos cerca de 2 células madre frescos por bloc de PDMS. La relación de estas células madre fresco a las células de la historia desconocido fue de aproximadamente 1: 2, entre las que aproximadamente un tercio fueron mantenidos en el dispositivo para toda la vida útil. Estas células permiten una más precisa una medición de la vida útild hacer posible el análisis de las correlaciones entre las células madre y la hija. En este dispositivo, un canal más profundo principal está conectado a dos canales laterales poco profundas en las que se hicieron las observaciones; Este diseño ayuda a reducir la posibilidad de los canales laterales ser bloqueado por las burbujas de aire grandes. Para la producción de chips de microfluidos, este protocolo también utiliza un método simple para unir las PDMS y vidrio de cubierta, simplemente utilizando la exposición de plasma y la hornada del horno, lo que aumenta la tasa de éxito.
Con este protocolo, el dispositivo de microfluidos es capaz de robustamente trampa al menos una célula (3-5 células de media) por almohadilla PDMS al comienzo del experimento para de tipo salvaje cepas de levadura haploide (es decir, BY4741 o BY4742). Alrededor del 30% de las células se puede conservar durante toda su vida útil. Vale la pena señalar que el rendimiento del dispositivo de PDMS depende del tamaño de la separación entre las columnas Pensile y el vidrio y el tamaño de las células de levadura. Para de tipo salvaje cepas de levadura haploides, latamaño adecuado para la brecha es 3.5 a 4.5 m. Fuera de este rango, la eficacia de carga y la disminución de la tasa de retención celular bruscamente. Por lo tanto, los nuevos dispositivos para las cepas de levadura con tamaños de celda mucho más grandes o más pequeñas 7 deben ser fabricados mediante la modificación de la altura de la primera capa hecha en el paso 1.
En resumen, el dispositivo y protocolo descrito en este artículo no sólo son adecuados para estudios de envejecimiento de levadura, pero también son aplicables a otros experimentos que requieren el seguimiento de las células madre y el seguimiento de los marcadores moleculares para muchas generaciones o durante toda la vida.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
This research was supported by NIH Grant AG043080 and the National Natural Science Foundation of China (NSFC), No. 11434001. We thank Lucas Waldburger for proofreading the manuscript.
Materiales
| Name | Company | Catalog Number | Comments |
| 3'' <111> silicon wafer | Addison Engineering | ||
| SU-8 2000 and 3000 Series | MicroChem | ||
| Sylgard® 184 Silicone Elastomer Kit | ellsworth | 2065622 | Include Sylgard® silicone elastomer base and curing agent |
| Petri dishes | VWR | 391-1502 | |
| Harris Uni-core™ punch (I.D. 0.75 mm) | Sigma-Aldrich | 29002513 | |
| 24 mm x 40 mm SLIP-RITE® cover glass | Thermo Fisher Scientific | 102440 | |
| 3M Scotch Tape | ULINE | S-10223 | |
| VWR® Razor Blades | VWR | 55411-050 | |
| Pure Ethanol, Koptec | VWR | 64-17-5 | |
| Whoosh-Duster™ | VWR | 16650-027 | |
| 5 mL BD Syringe (Luer-Lock™ Tip) | Becton, Dickinson and Company | 309646 | |
| PTFE Standard Wall Tubing (100 ft, AWG Size: 22, Nominal ID: 0.028) | Component Supply Company | SWTT-22 | |
| Needle Assortment | Component Supply Company | NEKIT-1 | |
| Desiccator | HACH | 2238300 | |
| Lab Oven | Fisher Scientific | 13246516GAQ | |
| Nikon TE2000 microscope with 40X and 60X objective | Nikon | ||
| Zeiss Axio Observer Z1 with 40X and 60X objective | Zeiss | ||
| Syringe Pump | Longerpump | TS-1B |
Referencias
- Mortimer, R. K., Johnston, J. R. Life span of individual yeast cells. Nature. 183 (4677), 1751-1752 (1959).
- Polymenis, M., Kennedy, B. K. Cell biology: High-tech yeast ageing. Nature. 486 (7401), 37-38 (2012).
- Xie, Z., et al. Molecular phenotyping of aging in single yeast cells using a novel microfluidic device. Aging Cell. 11 (4), 599-606 (2012).
- Zhang, Y., et al. Single cell analysis of yeast replicative aging using a new generation of microfluidic device. PLoS One. 7 (11), e48275(2012).
- Chen, K. L., Crane, M. M., Kaeberlein, M. Microfluidic technologies for yeast replicative lifespan studies. Mech Ageing Dev. , (2016).
- Lee, S. S., Avalos Vizcarra,, Huberts, I., H, D., Lee, L. P., Heinemann, M. Whole lifespan microscopic observation of budding yeast aging through a microfluidic dissection platform. Proc Natl Acad Sci U S A. 109 (13), 4916-4920 (2012).
- Huberts, D. H., Janssens, G. E., Lee, S. S., Vizcarra, I. A., Heinemann, M. Continuous high-resolution microscopic observation of replicative aging in budding yeast. J Vis Exp. (78), e50143(2013).
- Jo, M. C., Liu, W., Gu, L., Dang, W., Qin, L. High-throughput analysis of yeast replicative aging using a microfluidic system. Proc Natl Acad Sci U S A. 112 (30), 9364-9369 (2015).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. Journal of Micromechanics and Microengineering. 16 (2), 276-284 (2006).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37 (5), 550-575 (1998).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Xie, Z., et al. Early telomerase inactivation accelerates aging independently of telomere length. Cell. 160 (5), 928-939 (2015).
- Boy-Marcotte, E., et al. The heat shock response in yeast: differential regulations and contributions of the Msn2p/Msn4p and Hsf1p regulons. Mol Microbiol. 33 (2), 274-283 (1999).
- Yang, X., Lau, K. Y., Sevim, V., Tang, C. Design principles of the yeast G1/S switch. PLoS Biol. 11 (10), e1001673(2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados