Method Article
استخدام أجهزة ميكروفلويديك لقياس عمر والخلوية الظواهر في خلايا الخميرة في مهدها واحدة
In This Article
Summary
تقدم هذه المقالة بروتوكول الأمثل لإنتاج رقائق ميكروفلويديك وإعداد التجارب الموائع الدقيقة لقياس عمر والظواهر الخلوية من خلايا الخميرة واحدة.
Abstract
Budding yeast Saccharomyces cerevisiae is an important model organism in aging research. Genetic studies have revealed many genes with conserved effects on the lifespan across species. However, the molecular causes of aging and death remain elusive. To gain a systematic understanding of the molecular mechanisms underlying yeast aging, we need high-throughput methods to measure lifespan and to quantify various cellular and molecular phenotypes in single cells. Previously, we developed microfluidic devices to track budding yeast mother cells throughout their lifespan while flushing away newborn daughter cells. This article presents a method for preparing microfluidic chips and for setting up microfluidic experiments. Multiple channels can be used to simultaneously track cells under different conditions or from different yeast strains. A typical setup can track hundreds of cells per channel and allow for high-resolution microscope imaging throughout the lifespan of the cells. Our method also allows detailed characterization of the lifespan, molecular markers, cell morphology, and the cell cycle dynamics of single cells. In addition, our microfluidic device is able to trap a significant amount of fresh mother cells that can be identified by downstream image analysis, making it possible to measure the lifespan with higher accuracy.
Introduction
في مهدها الخميرة يعد مصدرا قويا لنموذج حي في الشيخوخة البحوث. ومع ذلك، فحص عمر التقليدية في الخميرة يعتمد على تسليخ مجهري، وهو عمل ليس فقط المكثف ولكن أيضا انخفاض الإنتاجية 1 و 2. وبالإضافة إلى ذلك، فإن النهج التقليدي تسليخ مجهري لا يقدم على عرض تفصيلي لمختلف الخصائص الخلوية والجزيئية في الخلايا الأم واحدة مع تقدمهم في السن. وقد مكن تطوير أجهزة ميكروفلويديك إجراء الآلي لقياس الخميرة عمر وكذلك لمتابعة الواسمات الجزيئية ومختلف الظواهر الخلوية في مختلف مراحل العمر من الخلايا الأم 3، 4، 5، 6، 7، 8. بعد تحميل خلايا الخميرة في جهاز ميكروفلويديك، فإنها يمكن تتبع تحت المجهر باستخدام التلقائي الوقت فاتالبريد التصوير. مع مساعدة من التصوير تجهيز الأدوات، ومختلف الظواهر الخلوية والجزيئية يمكن استخراج 3، 6، 8، بما في ذلك عمر، حجم، مراسل فلوري، مورفولوجيا الخلايا، وديناميات دورة الخلية، وما إلى ذلك، وكثير منها يصعب أو يستحيل الحصول باستخدام طريقة تسليخ مجهري التقليدي. اكتسبت أجهزة ميكروفلويديك مكانة بارزة في البحوث الخميرة الشيخوخة منذ التطوير الناجح من قبل بضع سنوات 3 و 4 و 6 و 7. وقد نشرت عدة مجموعات في وقت لاحق على أشكال مختلفة من التصاميم السابقة 5، والعديد من معامل الخميرة قد استخدمت أجهزة ميكروفلويديك لدراستهم.
في ثقافة خلية تشهد نموا مطردا، وعدد الخلايا الأم في سن المتوفرة للمراقبة هو miniscuجنيه. ولذلك، فإن مبدأ التصميم العام للجهاز ميكروفلويديك لقياس عمر هو الإبقاء الخلايا الأم ولإزالة الخلايا الوليدة. واحدة من هذه التصاميم يستفيد من حقيقة أن الخميرة يخضع انقسام الخلايا غير المتماثلة. الهياكل في الخلايا الأم إرادة جهاز فخ اكبر وتسمح للخلايا ابنته الصغيرة التي يجب غسلها بعيدا. يستخدم رقاقة ميكروفلويديك الموصوفة في هذه المقالة polydimethylsiloxane لينة (PDMS) لوحة (الأعمدة متدل العمودي) إلى خلايا فخ الأم (الشكل 1). وقد تم الإبلاغ عن الأجهزة من تصميم مماثل سابقا 3 و 4 و 6 و 7. يستخدم هذا البروتوكول إجراء أبسط لصنع أجهزة ميكروفلويديك واضحة طريقة خلية التحميل التي يتم أمثل للتجارب الوقت الفاصل بين التصوير. واحدة من المعالم الرئيسية في الجهاز ميكروفلويديك هو العرض من منصات PDMS تستخدم لخلايا فخ الأم. لدينا ديستخدم evice منصات أوسع يمكن أن تبقي أكثر من الخلايا الأم تحت كل لوحة، بما في ذلك جزء كبير من الخلايا الأم العذبة التي يمكن تتبعها طيلة حياتها. بالإضافة إلى قياسات عمر، وهذا البروتوكول هو مفيد لتجارب التصوير وحيد الخلية مرور الزمن عندما تحتاج لتعقبها لأجيال عديدة أو عند ملاحظة طوال العمر كله ضروري الخلايا.
Protocol
1. رقاقة السيليكون قالب التصنيع
ملاحظة: تم تصميم الضوئية الرئيسية مع برنامج أوتوكاد وتصنيعها من قبل شركة تجارية. هذا التصميم يحتوي على ثلاث طبقات من أنماط مختلفة ( ملف التكميلي 1 ). مرتفعات الطبقات الأولى والثانية، والثالثة هي حوالي 4 ميكرون، 10 ميكرون، و 50 ميكرون، على التوالي. تم إنشاء قالب السيليكون رقاقة من الضوئية الرئيسية باستخدام الطباعة الحجرية الناعمة 9 و 10.
- خبز رقاقة السيليكون على حرارة 200 درجة مئوية لمدة 10 دقيقة لتتبخر بخار الماء. معطف تدور مقاومة للضوء سلبي SU-8 على رقاقة السيليكون.
ملاحظة: معطف سبين SU-8 3005 في 5000 دورة في الدقيقة لمدة 30 ثانية لتوليد الطبقة الأولى، SU-8 2010 في 3000 دورة في الدقيقة لمدة 30 ثانية لتوليد الطبقة الثانية، وSU-8 3025 في 2000 دورة في الدقيقة لمدة 30 ثانية لتوليد الطبقة الثالثة. - لينة خبز الرقاقة المغلفة قبل روقال انه نقل نمط. محاذاة وفضح الرقاقة في وضع "الاتصال المباشر" باستخدام اليجنر قناع.
ملاحظة: لينة خبز الرقاقة لمدة 2 دقيقة في درجة حرارة 95 درجة مئوية لمدة الطبقة الأولى، 3 دقيقة في درجة حرارة 95 درجة مئوية لمدة الطبقة الثانية، و 15 دقيقة في درجة حرارة 95 درجة مئوية لمدة الطبقة الثالثة. استخدام جرعة التعرض للفي 100 ميغا جول / سم 2 للطبقة الأولى، 130 ميغا جول / سم 2 للطبقة الثانية، و 200 ميغا جول / سم 2 للطبقة الثالثة. - بعد التعرض، بعد خبز الرقاقة وتطويره باستخدام SU-8 المطور. تجفيف الرقاقة باستخدام مدفع N 2 ويصعب خبز الرقاقة على حرارة 200 درجة مئوية لمدة 30 دقيقة.
ملاحظة: تم إصلاح العفن رقاقة السيليكون إلى 15 سم القطر البلاستيك طبق بتري باستخدام الشريط سكوتش، مع الجانب نمط مواجهة. عادة، وضعنا العديد من الهياكل رقاقة متطابقة على نفس القالب، والذي يسمح متعددة رقائق ميكروفلويديك لتكون ملفقة في نفس الوقت. يمكن لكل قالب إعادة استخدامها مرات عديدة لصنع رقائق ميكروفلويديك.
2. ميكروفلويديكتصنيع رقاقة
- ضع قارب وزنها نظيف على التوازن والفارغة التوازن. صب 50 غ من قاعدة PDMS في وزن القارب.
- إضافة 5 غرام من PDMS كيل علاج للوزن القارب (ث / ث نسبة من 01:10 إلى قاعدة PDMS).
ملاحظة: يعتمد هذا الكتاب على 15 سم القطر طبق بيتري مع القالب. ضبط كمية من كاشف في حالة استخدام طبق بتري من حجم مختلف. - تحريك قاعدة PDMS وكيل علاج مع ماصة المتاح. بدء من على حافة القارب وزنها والتحرك ببطء الى الداخل. يقلب جيدا لعدة دقائق حتى تتشكل فقاعات صغيرة على مدار الخليط. خلط دقيق أمر ضروري لPDMS البلمرة.
- يصب الخليط ببطء في طبق بيتري. الخليط يجب أن تغطي تماما العفن رقاقة السيليكون.
- وضع طبق بتري في فراغ لمدة 10 دقيقة لإزالة جميع فقاعات الهواء من خليط PDMS. إذا بقيت فقاعات على سطح الخليط، واستخدام ماصة لتفجير بها.
- احتضان السيليكونرقاقة القالب مع PDMS في فرن عند 75 درجة مئوية لمدة 2 ساعة.
- قشر بلطف طبقة PDMS بلمرة قبالة العفن رقاقة السيليكون، وتجنب أي ضرر للبناء العفن رقاقة. بدلا من ذلك، وقطع PDMS مباشرة من العفن رقاقة السيليكون مع الحد الأدنى من هامش 5 ملم حول نمط استخدام حافة واحدة حلاقة الصناعية شفرة. قشر بلطف طبقة PDMS قبالة العفن رقاقة.
- وضع طبقة PDMS على مقاعد البدلاء مع الجانب نمط مواجهة. قطع بعناية شريحة الأفراد مع حافة واحدة حلاقة الصناعية شفرة، والإبقاء على هامش كاف من حافة كل شريحة واحدة لتجنب الضرر البناء.
- مع الجانب نمط مواجهة، استخدم القلم لكمة (ID 0.75 ملم) لكمة ثقوب أسفل على التوالي من خلال الدوائر مدخل ومخرج على كل جانب من القنوات.
ملاحظة: هذه الثقوب خلق مسار لتدفق المتوسطة. ولذلك، من المهم أن تذهب من خلال الدوائر ولكمة على طول الطريق من خلال طبقة PDMS. تاكد منإزالة أعمدة PDMS من الحفرة. - تحقق كل ثقب اللكم من قبل إدخال الإبرة لكمة ركلة جزاء ثانية في حفرة. تأكد من الإبرة يمكن أن يخرج من الجانب الآخر، مشيرا إلى أنه لا يوجد انسداد. تطبيق الشريط إلى سطح النمط، ثم تقشر بلطف الشريط لتنظيف الغبار والجسيمات. كرر هذه الخطوة ثلاث مرات على الأقل. ترك قطعة نظيفة من لاصق شفاف على PDMS للحفاظ على التعقيم.
- كرر هذا الإجراء على الجانب الآخر من PDMS وترك آخر قطعة من الشريط على كذلك.
- إعداد 24 مم × 30 مم غطاء زجاجي مع سمك 0،13-0،17 ملم. رذاذ الايثانول 70٪ على الزجاج والجافة مع مزيل الغبار لتعقيم السطح؛ بالإضافة إلى ذلك، والزجاج يمكن غسلها بالماء تعقيمها وتجفيفها مع مزيل الغبار.
- نقل الغطاء الزجاجي وPDMS لوحة من البلاستيك. إزالة الشريط سكوتش من PDMS ووضع الجانب نمط مواجهة. تجنب أي اتصال مع سطح نمط أثناء عملية النقل.
- وضع لوحة من البلاستيك في آلة البلازما. تطبيق العلاج الأكسجين البلازما إلى PDMS وغطاء زجاجي لجعل الأسطح المائية مع المعلمات العملية التالية: التعرض، 75 ثانية؛ تثبيت غازات، 20 سم مكعب / دقيقة. ضغط، 200. والسلطة، و 100 W.
- وضع بعناية PDMS على الزجاج غطاء، وربط كل السطوح المائية (السطوح التي واجهت حتى أثناء العلاج البلازما). تأكد من عدم وجود أي فقاعات الهواء بين PDMS والزجاج غطاء.
- احتضان شريحة PDMS في فرن عند 75 درجة مئوية لمدة 2 ساعة على الأقل.
ملاحظة: على microfluidics ناقص قد يسبب تسرب السائل على المجهر خلال التجربة. ولذلك، فمن المهم للتحقق من السندات بين PDMS والزجاج غطاء من خلال رفع قليلا من PDMS من الحواف مع ملاقط. رفع بلطف PDMS لا ينبغي فصلها عن غطاء زجاجي، مما يدل على السندات الناجح.
3. الاستعداد للتجربة
- إعداد أنبوب.
- غمر المدخلات والمخرجات الأنابيب في 70٪ من محلول الإيثانول بشكل منفصل 1 يوم قبل إعداد PDMS رقاقة.
- ملء حقنة 5 مل مع الماء تعقيمها لغسل الأنابيب. يغسل كل أنبوب عن طريق توصيل أنبوب على حقنة والتنظيف الأنبوب بالماء.
- كرر الخطوة الغسيل 3 مرات على الأقل لتنظيف بقايا الايثانول.
- دراسة قنوات PDMS تحت المجهر الضوئي مع الهدف 10X للتأكد من أن هيكل ثابت وسليمة. استقرار رقاقة PDMS على منصة باستخدام المجهر الاسكتلندي.
ملاحظة: جعل رقائق متعددة في وقت واحد في الخطوة 2 لضمان عدم وجود رقائق النسخ الاحتياطي، وخاصة إذا جعل الجهاز لأول مرة. - ملء حقنة 5 مل مع الماء تعقيمها. تأمين حقنة إلى ضخ حقنة وادخال المدخلات والمخرجات أنابيب المقابلة. ضبط سرعة غسل إلى 750 ميكرولتر / ساعة لشطف رقاقة لحوالي 10 دقيقة. فقاعات الهواء على القنوات فرعيجب أن جرفت خلال هذه الفترة؛ إذا كانت هناك فقاعات المتبقية، يدويا ضبط سرعة للقضاء على فقاعات.
- إعداد نموذج الخميرة.
- نقل 1 مل من عينة الخميرة المعدة (OD 600 0،6-0،8) إلى قسمين أنابيب 1.5 مل microcentrifuge لوأجهزة الطرد المركزي لمدة 5 دقائق في 3000 ز س.
- إزالة معظم طاف من كل أنبوب والجمع بين ما تبقى لتشكيل عينة 0.5 مل.
- إيقاف ضخ حقنة وإزالة أنابيب مدخلات من رقاقة PDMS.
- يدويا عكس ضخ حقنة لامتصاص فقاعة الهواء الصغيرة (1-2 سم في الطول) في كل أنبوب الإدخال. الانتقال إلى مص في العينة الخميرة. سوف فقاعة الهواء تظهر حدود عينة وتبين مقدار عينة تم استخلاصها.
ملاحظة: تجنب امتصاص العينة إلى الحقنة. - إدراج أنبوب الإدخال مرة أخرى إلى رقاقة PDMS وإعادة تشغيل مضخة لتحميل الخلايا بسرعة 750 ميكرولتر / ساعة.
- ترك حقنة لضخ لمدة 10 دقيقة لن ودراسة تطور الخلايا تحميل تحت المجهر. سوف تحميل الناجح خلايا فخ تحت أكثر من 60٪ من تعليق دعامة.
- التبديل إلى حل التغذية وضبط السرعة إلى 400 ميكرولتر / ساعة لزراعة الخلايا.
- مواقع المراقبة الاختيار للمجهر.
ملاحظة: للحصول على قياسات عمر، واتخذت صورة مرة واحدة كل 15 دقيقة بواسطة المجهر الضوئي مع الهدف 40X. لتحليل مراسل فلوري، واتخذت صورة مرة واحدة كل 15 دقيقة بواسطة المجهر مضان مع الهدف النفط 60X.
النتائج
بعد التجارب، وأعمار من الخلايا والعديد من الظواهر الخلوية والجزيئية يمكن استخراجها من تسجيل الصور مرور الزمن. وبما أن هناك عددا من الميزات المختلفة التي يمكن استخلاصها من كل خلية، فإن الخطوة الأولى من التحليل هي لتعليم الخلايا والأحداث، بما في ذلك مواقف وحدود الخلايا وتوقيت مختلف الأحداث التي يجري تعقب مثل هذه كما الأحداث في مهدها. وهذه الشروح جعلها أسهل للعودة إلى نفس مجموعة من الخلايا وتحليل ميزات مختلفة في المستقبل. استخدام صورة برامج التحليل مثل يماغيج 11 و الإضافات المرتبطة بها، قائمة من الظواهر ومن ثم يمكن استخلاصها من بيانات الصورة باستخدام الشروح المسجلة للخلايا.
وفيما يلي بعض الأمثلة من الظواهر قياس مع الجهاز ميكروفلويديك. النمط الظاهري عمر الخميرةويمكن الحصول على حساب عدد من البراعم التي تنتجها كل خلية الأم المحاصرين وتقدير مع مقدر كابلان ماير. الخلايا المحاصرين في البداية في أجهزة ميكروفلويديك هي من عصور سحيقة. للحد من التحيز القياسات عمر النابعة من هذه عصور سحيقة، وتستخدم الطرق السابقة متوسط عدد الندوب برعم على الخلايا المحاصرين لمعايرة عمر 4 و 7. ومع ذلك، والقياسات برعم ندبة تتطلب تلطيخ إضافية من الخلايا وتوفر سوى تقدير غير مباشر من التحيز. باستخدام هذا البروتوكول، والجهاز كثيرا الفخاخ الخلايا الوليدة الجديدة التي المبرعمة الخروج من خلايا المحاصرين بالفعل. ثم تتحول هذه الخلايا إلى خلايا الأم. يمكن التعرف على هذه الخلايا باستخدام لدينا المصب برمجيات تحليل الصور (فيلم 1). توفر هذه الخلايا الأم جديدة لقياس عمر أكثر دقة. كما هو مبين في الشكل 2، كانت منحنيات عمر الخلايا الأم جديدة المقارنةالأحمر مع تلك الخلايا من العمر مجهول. في هذه التجربة، وكان متوسط عمر الخلايا الأم طازجا لفترة أطول قليلا (حوالي 2 أجيال من الفرق في عمر متوسط).
بالإضافة إلى عدد من البراعم، وغيرها من الظواهر المثيرة للاهتمام، مثل الفاصل الزمني بين حدثين في مهدها المتعاقبة، كما هو مبين في الشكل 3، يمكن استخلاصها من البيانات التصوير 3 و 7 و 8. دخلت خلايا فترة من أسرع مهدها بعد قليل أبطأ buddings الأولي. تباطأ مهدها انخفاضا كبيرا في نهاية حياتها، مما يدل على حالة غير صحية من هذه الخلايا تتراوح أعمارهم. ديناميات دورة الخلية يحتوي على معلومات مفيدة للغاية فيما يتعلق الدولة الخلوية للخلايا الصغار والكبار، واستخدمت، على سبيل المثال، لتوصيف المسوخ التيلوميراز 12. الأهم من ذلك، يمكن أن يكون هذا الجهاز تستخدم لقياس إشارات مضان في مختلف مراحل العمر (الشكل 4)، والسماح لتتبع الواسمات الجزيئية التي قد تكون سائق عملية الشيخوخة.

الشكل 1: رسم تخطيطي لتصميم الجهاز ميكروفلويديك. يتكون الجهاز من 6 وحدات وظيفية مستقلة التي يمكن أن تعمل بشكل متواز. تتكون كل وحدة من قناة رئيسية واحدة متصلة قناتين الجانب. كل قناة لديها جانب 113 الأعمدة متدل. يضاف جسر إضافي في الوسط لربط القناة الرئيسية مع القنوات الجانبين. محاصرون الخلايا الأم تحت الأعمدة متدل، بينما يتم غسل الخلايا الوليدة الصغيرة بعيدا عن التدفق. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الحمار = "jove_content" FO: المحافظة على together.within الصفحات = "1"> 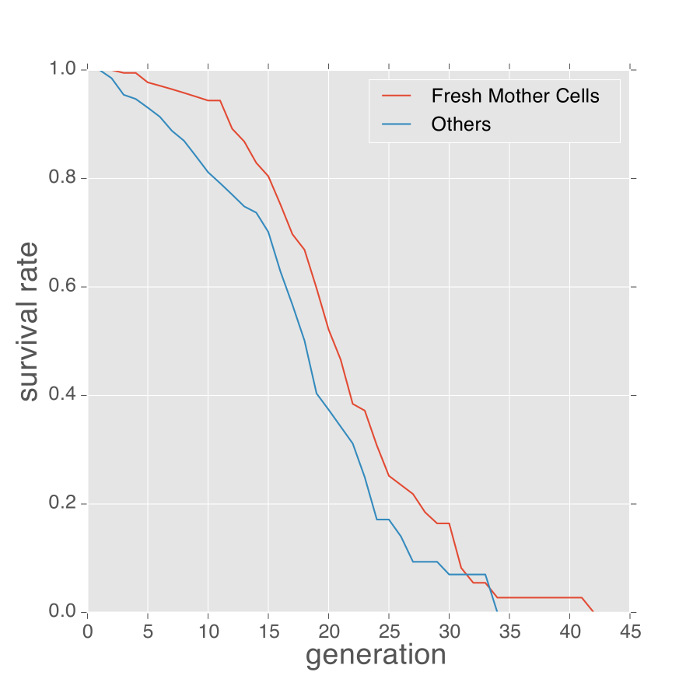
الشكل 2: خلايا الأم الطازجة يعيشون أطول من الخلايا التي تحتوي على تاريخ غير معروف. عمر تنسخي الخلايا الأم جديدة مقابل خلايا التاريخ غير معروف (خلايا المحاصرين من بداية التجربة) في SD وسائل الإعلام، و 30 درجة. في المتوسط، والخلايا الأم العذبة يعيش حوالي 2 أجيال لفترة أطول. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: طول فترات مهدها التغييرات حسب خلية المسنين. ومرمزة، صدرت أوامر فترات مهدها يقاس الأطر الزمنية بين buddings الخلايا عن طريق عمر تكرارها، وكانت الخلايا الأم الطازج سبتمبرarated من خلايا التاريخ غير معروف. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
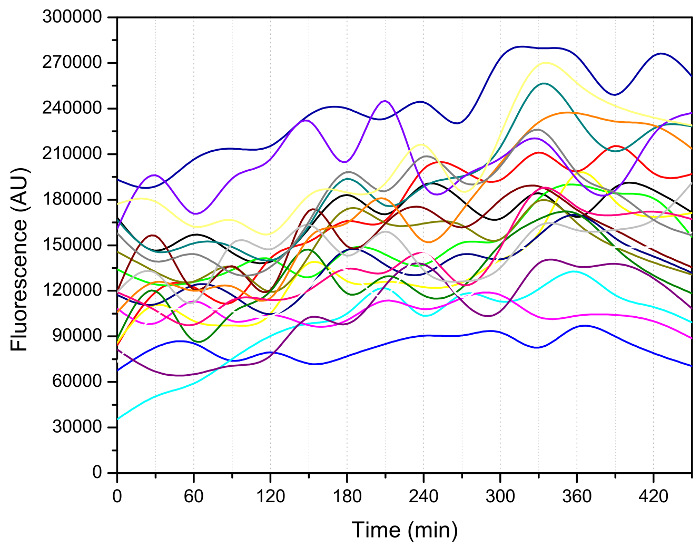
الشكل (4): قياس النشاط الحرارة صدمة عامل 1 (HSF1) باستخدام جهاز ميكروفلويديك. هي التي شيدت مراسل Hsf1 النشاط من البروتين الفلوري الأخضر (GFP) تنصهر إلى مروج CYC1 بالشلل مع HSE المنبع 13. واتخذت صورة مضان كل 30 دقيقة. وكانت كثافة GFP ثم كميا باستخدام رمز MATLAB مخصصة 14. وترتبط نقاط البيانات لكل خلية واحدة، وأشار مع خط ملون. في هذه التجربة، كانت تزرع سلالة في SD متوسطة مع 2٪ الجلوكوز (وزن / المجلد) عند 30 درجة مئوية خلال الليل. ثم تم تخفيفه مع نفس المتوسطة لتحقيق الانتعاش. بعد ذلك،وقد استخدم SD المتوسطة مع 0.05٪ جلوكوز (وزن / المجلد) لزراعة الخلايا في رقاقة ميكروفلويديك خلال قياس مضان. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
فيلم 1: مثال على الخلايا الأم جديدة يجري محاصرين داخل الجهاز للعمر كله. ويظهر الفيلم خلية الأم جديدة ولدت من خلية المحاصرين. السهم الأحمر في بداية الفيلم يمثل موضع الخلية الأم الطازجة وأول مهدها لها. كان محاصرا هذه الخلية الأم في الجهاز ميكروفلويديك لبقائه كله. الرجاء انقر هنا لمشاهدة هذا الفيديو. (انقر بزر الماوس الأيمن للتحميل.)
Discussion
يحتاج إلى أن تقدم طازجة الجهاز PDMS. وإلا فإن فقاعات الهواء الناجم عن إدخال الأنابيب في الجهاز يكون من الصعب إزالتها. الخطوة 3.4 هامة لتحسين كفاءة الخلايا تحميل من خلال التركيز الخلايا. لزيادة سرعة نقل التجربة، من 4 إلى 6 وحدات على الشريحة نفسها PDMS متصلة تستخدم مضخات تعمل بشكل مستقل عادة لأداء 4-6 التجارب المختلفة (سلالات مختلفة أو التراكيب وسائل الاعلام) في وقت واحد.
بالمقارنة مع الخميرة التقليدية تنسخي فحص الشيخوخة (والذي يستخدم تسليخ مجهري)، وطريقة ميكروفلويديك المقدمة هنا هو أقل شاقة وتستغرق وقتا طويلا. وعلاوة على ذلك، يسمح الجهاز ميكروفلويديك لتقدير مفصل لمختلف المعالم الخلوية أو الجزيئية، بما في ذلك حجم الخلية، وديناميات دورة الخلية، مورفولوجيا الخلايا، ومختلف الواسمات الجزيئية. هذه الطريقة ميكروفلويديك يحقق الخلايا على المدى الطويل تتبع مع عالية الدقة المجهر عن طريق الاحتفاظيتم مسح الخلايا الأم تحت PDMS منصات الصغرى كما الخلايا الوليدة تلقائيا.
يستخدم هذا الجهاز PDMS الناعمة منصات صغيرة لخلايا فخ أم 4، مع البنية الأساسية مماثل، كما Huberts وآخرون. ووصف في عمله (7). وهناك عدد من الاختلافات في تصميم الجهاز والبروتوكولات التجريبية. لوحة PDMS أوسع في هذا الجهاز يسمح بعض الخلايا الوليدة حديثي الولادة إلى أن المحاصرين وتحليلها (أرقام 2 و 3، فيلم 1). لتحديد هذه الخلايا، نحن المشروح الخلايا الوليدة المبرعمة من خلايا الأم المحاصرين بالفعل، وتجاهل الخلايا الوليدة أن مسح بعيدا دون مهدها. في المتوسط، وحصلنا على حوالي 2 الخلايا الأم جديدة في لوحة PDMS. كانت نسبة هذه الخلايا الأم جديدة لخلايا التاريخ غير معروف حوالي 1: 2، من بينها حوالي ثلث تم الاحتفاظ بها في الجهاز للعمر كله. هذه الخلايا تسمح أكثر دقة لقياس عمرد تجعل من الممكن لتحليل الارتباطات بين الخلايا الأم وابنتها. في هذا الجهاز، يتم توصيل قناة أعمق الرئيسية للقناتين الجانب ضحالة حيث يتم إجراء الملاحظات. هذا التصميم يساعد على تقليل فرصة قنوات جانبية يتم حظره من قبل فقاعات الهواء الكبيرة. لإنتاج رقاقة ميكروفلويديك، يستخدم هذا البروتوكول أيضا طريقة بسيطة لسندات PDMS وغطاء زجاجي، فقط باستخدام التعرض البلازما والخبز الفرن، مما يزيد من معدل النجاح.
مع هذا البروتوكول، والجهاز ميكروفلويديك قادر على بقوة فخ خلية واحدة على الأقل (3-5 خلايا في المتوسط) في لوحة PDMS في بداية التجربة لمن النوع البري سلالات الخميرة فرداني (أي BY4741 أو BY4742). حوالي 30٪ من الخلايا يمكن الاحتفاظ بها طيلة حياتها كله. ومن الجدير بالذكر أن أداء الجهاز PDMS يعتمد على حجم الفجوة بين الأعمدة متدل والزجاج وحجم خلايا الخميرة. لمن النوع البري سلالات الخميرة فرداني، وحجم مناسب للفجوة هو 3.5-4.5 ميكرومتر. خارج هذا النطاق، وكفاءة التحميل وانخفاض معدل الاحتفاظ الخلايا بشكل حاد. وهكذا، وأجهزة جديدة لسلالات الخميرة مع أكبر أو أصغر بكثير أحجام الخلية 7 يجب أن تكون ملفقة عن طريق تعديل الارتفاع من الطبقة الأولى في الخطوة 1.
وباختصار، فإن الجهاز وبروتوكول الموضحة في هذه المقالة ليست مناسبة فقط للدراسات الشيخوخة الخميرة ولكن تنطبق أيضا على التجارب الأخرى التي تتطلب تتبع الخلايا الأم ورصد المؤشرات الجزيئية لأجيال عديدة أو طوال العمر.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This research was supported by NIH Grant AG043080 and the National Natural Science Foundation of China (NSFC), No. 11434001. We thank Lucas Waldburger for proofreading the manuscript.
Materials
| Name | Company | Catalog Number | Comments |
| 3'' <111> silicon wafer | Addison Engineering | ||
| SU-8 2000 and 3000 Series | MicroChem | ||
| Sylgard® 184 Silicone Elastomer Kit | ellsworth | 2065622 | Include Sylgard® silicone elastomer base and curing agent |
| Petri dishes | VWR | 391-1502 | |
| Harris Uni-core™ punch (I.D. 0.75 mm) | Sigma-Aldrich | 29002513 | |
| 24 mm x 40 mm SLIP-RITE® cover glass | Thermo Fisher Scientific | 102440 | |
| 3M Scotch Tape | ULINE | S-10223 | |
| VWR® Razor Blades | VWR | 55411-050 | |
| Pure Ethanol, Koptec | VWR | 64-17-5 | |
| Whoosh-Duster™ | VWR | 16650-027 | |
| 5 mL BD Syringe (Luer-Lock™ Tip) | Becton, Dickinson and Company | 309646 | |
| PTFE Standard Wall Tubing (100 ft, AWG Size: 22, Nominal ID: 0.028) | Component Supply Company | SWTT-22 | |
| Needle Assortment | Component Supply Company | NEKIT-1 | |
| Desiccator | HACH | 2238300 | |
| Lab Oven | Fisher Scientific | 13246516GAQ | |
| Nikon TE2000 microscope with 40X and 60X objective | Nikon | ||
| Zeiss Axio Observer Z1 with 40X and 60X objective | Zeiss | ||
| Syringe Pump | Longerpump | TS-1B |
References
- Mortimer, R. K., Johnston, J. R. Life span of individual yeast cells. Nature. 183 (4677), 1751-1752 (1959).
- Polymenis, M., Kennedy, B. K. Cell biology: High-tech yeast ageing. Nature. 486 (7401), 37-38 (2012).
- Xie, Z., et al. Molecular phenotyping of aging in single yeast cells using a novel microfluidic device. Aging Cell. 11 (4), 599-606 (2012).
- Zhang, Y., et al. Single cell analysis of yeast replicative aging using a new generation of microfluidic device. PLoS One. 7 (11), e48275 (2012).
- Chen, K. L., Crane, M. M., Kaeberlein, M. Microfluidic technologies for yeast replicative lifespan studies. Mech Ageing Dev. , (2016).
- Lee, S. S., Avalos Vizcarra, ., Huberts, I., H, D., Lee, L. P., Heinemann, M. Whole lifespan microscopic observation of budding yeast aging through a microfluidic dissection platform. Proc Natl Acad Sci U S A. 109 (13), 4916-4920 (2012).
- Huberts, D. H., Janssens, G. E., Lee, S. S., Vizcarra, I. A., Heinemann, M. Continuous high-resolution microscopic observation of replicative aging in budding yeast. J Vis Exp. (78), e50143 (2013).
- Jo, M. C., Liu, W., Gu, L., Dang, W., Qin, L. High-throughput analysis of yeast replicative aging using a microfluidic system. Proc Natl Acad Sci U S A. 112 (30), 9364-9369 (2015).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. Journal of Micromechanics and Microengineering. 16 (2), 276-284 (2006).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Angewandte Chemie-International Edition. 37 (5), 550-575 (1998).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Xie, Z., et al. Early telomerase inactivation accelerates aging independently of telomere length. Cell. 160 (5), 928-939 (2015).
- Boy-Marcotte, E., et al. The heat shock response in yeast: differential regulations and contributions of the Msn2p/Msn4p and Hsf1p regulons. Mol Microbiol. 33 (2), 274-283 (1999).
- Yang, X., Lau, K. Y., Sevim, V., Tang, C. Design principles of the yeast G1/S switch. PLoS Biol. 11 (10), e1001673 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved