Method Article
示差同位体で標識された姉妹ヒストンとヌクレオソームの再構成
要約
このプロトコルは、示差的に同位体標識姉妹ヒストンを含むヌクレオソームの再構成を説明します。これと同時に、非対称的に翻訳後修飾ヌクレオソームはpremodifiedヒストンのコピーを使用した後に発生することができます。これらの製剤は、容易に高分解能NMR分光法を用いて、同時に両方の姉妹ヒストンに、修正クロストークのメカニズムを研究するために使用することができます。
要約
非対称的に変更されたヌクレオソームは、翻訳後修飾(PTMを)の別個のセットが飾らヒストンの2つのコピー(姉妹ヒストン)が含まれています。彼らは、新たに設立し、機能的な意味合いの未知の手段で種を同定しています。現在の分析方法は、ヌクレオソーム姉妹ヒストン上のPTMのコピー固有の発生を検出するには不十分です。このプロトコルは、示差的に同位体標識姉妹ヒストンを含むヌクレオソームのin vitro再構成のための生化学的方法を提示します。生成された複合体はまた、非対称ヒストンsubcomplexesのリフォールディング時premodifiedヒストンプールを含めた後に、変更することができます。これらの非対称のヌクレオソームの調製物は、容易に、核磁気共鳴(NMR)分光法を用いて非対称的に事前に組み込まPTMによって課さ修正クロストークのメカニズムを研究するためのヒストン修飾酵素と反応させることができます。で、特に、修飾反応リアルタイムは、それぞれの同位体の種類に合わせNMR相関実験の種類を行うことにより、2つの姉妹ヒストンに独立してマッピングすることができます。この方法論は、ヌクレオソーム複合体上の不斉PTMパターンの形成および伝播に貢献するクロストークのメカニズムを研究するための手段を提供します。
概要
真核生物のDNAはしっかりとクロマチンに細胞核内にパッケージされています。クロマチンの基本的なビルディングブロックは、二つのコピー4つのコアヒストン(H3、H4、H2A、H2B)のそれぞれの構成された八量複雑に巻き付けDNAの〜147塩基対が含まれているヌクレオソームコア粒子です。ヒストンタンパク質は、翻訳後修飾(PTMを)の過多を抱きます。これらの共有結合の置換は、両方の直接システムの物理化学的性質に影響することによって間接的にクロマチンリモデリング活性1、2、3を補充することによって、クロマチン構造の変化を誘導します。これらの手段によって、ヒストンのPTMは、したがって、すべてのDNAに基づく細胞機能4を調節し 、クロマチンのアクセシビリティを制御します。
PTMは、主にヌクレオソーム内蔵コアヒストの構造化されていないN末端セグメント(尾部)上のヒストン修飾酵素システムによってインストールされていますファミコン。ヒストン尾部の比較的短い配列上の多くの修飾部位に、PTMのは、誘導またはその後の修飾反応、修正クロストーク5として知られる効果をブロックすることにより、相互に影響を与えます。そのためヌクレオソームの全体的な対称アーキテクチャにより、修飾反応やクロストークメカニズムは、各ヌクレオヒストン(姉妹ヒストン)の2つのコピーにも同様に起こると考えられていました。この概念は、最近に挑戦し、その後反証ました。特に、無料のヒストンH3テールペプチド上とヌクレオソーム上のインビトロ酵素アッセイは、H3キナーゼのセットが非対称に6でリン酸化を導入することを実証しました。さらに、アフィニティー精製系のLC-MS / MS分析は、真核細胞7のいくつかのタイプの非対称H3メチル化ヌクレオソームの存在を明らかにしました。このように、非対称的に変更されたヌクレオソームは、新規種を構成し、ツールは、それらの形成を制御するメカニズムを明らかにし、この非対称性を発揮する可能性があるクロストークの影響を分析するために必要とされます。
一般に、ウェスタンブロット(WB)および質量分析(MS)分析は、ヒストンのPTMを検出するために使用されてきました。その簡単なアプリケーションにもかかわらず、WBは、特異性/交差反応性の問題があります。その上、それは同時マルチPTM分析および修飾反応8の直接の定量化を行うことができません。一方、MS分析は、高レベルのトレーニングを必要とする高度な機器を使用するが、複数のPTM 9の同時マッピングおよび定量ならびに高い特異性を提供します。 しかし、両方の方法は破壊的であり、ヌクレオソーム複合体は、ヒストンおよび/またはヒストン由来ペプチドの混合物を生じる、分析前に分離されています。この操作は、独立し区別する能力を削除しますヌクレオヒストンのコピー特異的修飾の状況を報告するために、2つの姉妹ヒストンのそれぞれで発生し、修飾反応。
核磁気共鳴(NMR)分光法は、PTM反応をマッピングする別の方法として発展しました。 NMRは、11無停止であるため、再構成された混合物中のリアルタイムでPTMイベントの監視を可能にし、さらに完全なセル10で。同位体標識の2次元ヘテロ核相関法に基づいて、高速データ取得のためだけでなく、高解像度のマッピングのためのルーチンの開発(15 Nおよび/または13 C)試料12は、例えば、のPTMの異なるタイプの同時マッピングを可能にセリン/スレオニン/チロシンリン酸化、リジンのアセチル化/メチル化、およびアルギニンのメチル化13など。調査中のPTMに応じて、15 N-または13 C標識PRotocolsは変更レポーターとして機能するタンパク質の官能基をマークするために使用することができます。したがって、PTMマッピングは、化学的環境の変化を「感知」に対応する官能基の特徴的な化学シフトの変位に追従して行うことができます。ほとんどの場合、NHおよびCHの化学基の両方は、対象のPTMの発生を報告するために使用することができます。
現在のプロトコルは、示差同位体標識姉妹ヒストンを含むヌクレオソームの生成を説明しています。これは、NMR分光法の柔軟性が選択された再構成されたヒストン複合体の精製のための異なるタンパク質アフィニティータグを利用して両方の1 H- 15 Nと1 H- 13 C相関スペクトルを用いたPTMをマッピングするために組み合わせます。特に、プロトコルは、ヌクレオソーム再構成のための特定のヒストンの二つの異なるプールを採用しています。これらのプールは、差別的同位体標識(1であります 15 N、13 Cとその他)、これらはそれぞれ、ポリヒスチジンおよびストレプトアビジンアフィニティタグに融合されています。 Ni-NTAおよびストレプトアビジンに基づくクロマトグラフィータンデムアフィニティ精製スキームは、最初フォークトら使用します。 7は、対称の対応( 図1A)から非対称種を精製するために使用されます。非対称ヒストン八量体は、標準的な塩透析法14を使用して、同等のヌクレオソーム複合体( 図1B)を再構成するために、その後使用されています。さらに、同様の手順を介して、プリ修飾ヒストンプールの1つを有することによって、PTMが得ヌクレオソームに非対称的に組み込むことができます。ヒストン修飾酵素と変更イベントのその後のNMR-マッピングによるこれらの基質の反応が(両方でシス (premodifiedヒストンコピー)とでトランス unmodifiをクロストークメカニズムの特徴付けを可能にしますエドヒストンコピー)( 図1C)。
プロトコル
示差同位体標識(および非対称変更された)シスターヒストンとヌクレオソームの1再構成
注:現在のプロトコルは、示差同位体標識ヒストンH3とのヌクレオソームの再構成を説明します。このため、ヒストンH3の2つのプールが使用されました。一つは、15 Nは標識であり、N末端での6xHisタグを含有し、第二には、13 Cで標識し、N末端で融合した連鎖球菌ペプチド(WSHPQFEK)を含有しました。両方のタグは、タバコエッチウイルス(TEV)プロテアーゼの認識部位を有する天然のH3配列から分離しました。追加の非対称修飾ヌクレオソームを調製するために、2つのH3のプールの一つはpremodified形で含まれています。ヒストンのプールの前置修飾反応補因子/ PTMドナー1の種類毎に必要なの存在下でそれぞれのヒストン修飾酵素を用いて、目的の同位体標識されたヒストンを反応させることによって行うことができます6。それぞれのPTMの効率的な配置は、NMR分光法または質量分析法によって評価することができます。ここで使用されるヒストン/ DNAの量は、(260nmでDNA濃度として測定)、10μMのおよその濃度.This最終収率が比較的短い取得時間との良好な品質のNMRスペクトルを記録するのに十分であるとのヌクレオソーム調製物を得るためにラフ推奨事項です。
- 示差的に同位体標識(および非対称的に修飾された)ヒストンH3とヒストン八量体の再構成
注:組換えヒストンタンパク質をBL21(DE3)plysSをセル14中のMg量で製造することができます。同位体標識されたヒストンを得るために、同一の発現/精製プロトコルは、15 Nまたは13のために、窒素および炭素源としての細菌の増殖のために15 NH 4 Clおよび/または13 Cグルコースを含む最小培地を用いた以外は続きますC標識respectively。精製されたヒストンは、広範囲の5mMβメルカプトエタノールに対して透析し、使用前に凍結乾燥保存されます。- バッファを展開1mLの各ヒストンの〜5ミリグラムを含む、凍結乾燥したヒストンのアリコートを溶解させる(7 Mグアニジン塩酸、20mMトリスpH7.5の、10mMのDTT)。ヒストンH3の両方のタイプが含まれます。ピペッティングにより混合し、ボルテックスしないでください。完全に展開できるように、30分間氷上でチューブを保管してください。
- バッファを展開し、ExPASyポータルのProtParamツールを使用して計算した吸光係数を使用しないように、280nmでの吸光度を測定することにより、各ヒストンの正確な濃度を決定します。 15
- 50%2ヒストンH3プールのそれぞれを含むことを念頭に置いて、等モル比のコアヒストンを混ぜます。より低濃度のヒストンの全体の内容を使用して開始し、それに応じて、他のすべてを追加します。
- 約1mg / mlの展開バッファを使用して最終タンパク質濃度を調整します。
- TransfeR 6 kDaのカットオフの透析膜に混合し、4℃で冷却したリフォールディング緩衝液(10 mMトリスpHが7.5、2 MのNaCl、1mMのEDTA、2mMのDTT)の1-2 Lに対して透析します。透析は最低3時間のために進行した後に少なくとも一度バッファを変更します。 4℃での最終的な透析O / Nを実行します。
- 透析材料を収集し、最大速度での4℃で5分間、微量遠心分離することにより、任意の沈殿物を除去(通常は沈殿は観察されないはずです)。 280 nmの吸光度を測定することにより、八量体の濃度を決定します。計算では、それぞれの値を倍増することを念頭に置いて、ヒストンの追加吸光係数を使用します。
- 10 kDaのカットオフ遠心フィルターユニットを用いて約2 mLの最終容量まで濃縮します。八量体濃度と推定損失を再計算します。この時点で、50の間の八量体濃度 - 100μMが得られるはずです。
- に( 材料の表に記載された)ゲル濾過カラムを接続しますFPLCシステムおよび0.22μmのろ過及び1mL /分の流速および圧力0.5MPaの圧力限界でリフォールディング緩衝液脱気し、2カラム容量(CV)で平衡化。
注:ゲル濾過ランは低温室でまたは低温キャビネットに行われるべきです。 - 1mL /分の流速を使用して濃縮された物質を注入し、1.0収集 - 1.5 mLの画分。
- クロマトグラフィープロフィールに従って、〜65でヒストン八量体の溶出を観察 - 68ミリリットル。
注:溶出ピークの小さな肩や〜80 mLのピークはそれぞれ、自由H3-H4四量体とH2A-H2B二量体の存在を示します。 - 18%SDS-PAGEゲルに収集された各画分の20μLを実行します。
注記:高塩濃度を減少させ、従って、歪みを避けるために、ゲル上にロードする前に、水で少なくとも2倍のサンプルを希釈します。同じことが、再折り畳み緩衝液中のサンプルのその後のSDS-PAGE分析のために適用されます。 - プール関連するfra染色したゲル上の4ヒストンの均等分布によって判断する(ステップ1.1.7)以前のように濃度を決定純粋な八量体を含むctions。
- FPLCシステムに1ミリリットルのNi-NTAカラム( 材料の表)を接続して、0.22の10 CVで平衡ミクロン濾過及び1mL /分の流速で緩衝液をリフォールディング脱気。
注:のNi-NTAクロマトグラフィーは低温室でまたは低温キャビネットに行われるべきです。 - 1mL /分の流速を用いたNi-NTAで精製オクタマーを渡します。
- フロースルーを収集し、SDS-PAGE / WB分析用のサンプル(それぞれ20μLと4μLを、)保ちます。続いて、緩衝液またはベースライン信号が到達するまで、リフォールディングの10 CVでカラムを洗浄します。
- 1mL /分の流速を用いて250mMのイミダゾールを含有するリフォールディング緩衝液の10 CVで溶出。 (20μLと4μL、それぞれ)をSDS-PAGE / WB分析用のサンプルを保管してください。
- 交流の1 mLのアフィニティーカラムを平衡化バッチ/重力流のセットアップを使用して、250 mMイミダゾールを含む10 CVリフォールディングバッファーとommercialストレプトアビジン( 材料表 )。
注:このクロマトグラフィー工程は、低温室で行われるべきです。 - 商業ストレプトアビジンアフィニティーカラムを通してのNi-NTA溶出を渡します。
- フロースルーを収集し、SDS-PAGE / WB分析用のサンプル(それぞれ20μLと4μLを、)保ちます。その後、再折り畳み緩衝液の10 CVで洗浄します。
- 2.5ミリモルのデスチオビオチンを含むリフォールディング緩衝液の10 CVで溶出。 (それぞれ20と4μL)SDS-PAGE / WB分析用のサンプルを保管してください。
- 、八量体濃度を測定10倍少ないTEVプロテアーゼを追加し、反応は、標準的なプラスチック製遠心管中で4℃で一晩進行させます。
注:TEVの必要量は、完全な消化(親和性タグの除去)を得るためには、(構築)との活動に起源に依存して(たて、組換えTEVはもっとありますアクティブで長期間保存1と比較して - 80°C)。 (タンパク質濃度として推定)八量体に比べて少ないTEVを10回を追加し、最初に試してみて、それに応じて調整します。 - 前と18%SDS-PAGEゲル上のTEV添加後、混合物の20μLを実行することにより、効率的な消化のために確認してください。消化が完了していない場合は、より多くのTEVプロテアーゼを追加し、別の3〜4時間のインキュベーションを継続します。
- TEVプロテアーゼを除去し、緩衝液組成を調整する50 kDaのカットオフの透析膜を用いてリフォールディング緩衝液に対して試料を透析します。
- 1.0〜2.0ミリリットルの体積に(も使用することができるステップ1.1.7からの同じフィルタ部)10 kDaのカットオフ遠心フィルターユニットを用いて精製した非対称の八量体を濃縮します。最終濃度を測定します。どちらか長い期間のために-20℃で保存するために(v / v)のグリセロールをヌクレオソーム再構成するためのすぐ後に使用するか、または50%に調整します。この時点で、と前の手順の間に少なくとも70%の損失を期待して、目50μM - 電子八量体の濃度は、20の範囲内であるべきです。
- ヌクレオソーム再構成
- 八量体を50%グリセロール中に保存した場合は、ヌクレオソーム再構築を進める前にリフォールディング緩衝液に対して4℃で一晩透析します。
- 5 MのNaClストック溶液を用いて2 MのNaClにDNA(ヌクレオソーム位置決めの配列を含む)の塩濃度を調整します。
注:所望の配列の複数のコピーを含んでいるか、またはPCR増幅によって合成されたプラスミドの精製後の精製されたDNAのいずれか単離された水中での濃縮に〜50μMまたは標準のTris-EDTA緩衝液保存する必要があります。 - 小規模試験から決定された最適比を用いオクタマーとDNAを混合します。 〜3.0 mLで最終容量を調整するためにリフォールディングバッファーを使用してください。常に<2 M塩濃度で八量体とDNAの混合のいずれかの可能性を防ぐために、最後の八量体を追加します。
- 最初の小さな-SCを実行します八量体を決定するために、エールの再構成は:最適なヌクレオソームの利回りにつながるDNA比。 50-100μLの間の体積に比八量:1.0、1.0:1.0、および1.1:1.0 DNAこのため、0.9の3つの反応を組み立てます。一般的に、5μMのDNAの濃度を使用します。
- (ステップ1.2.4-1.2.8)以下に説明するように再構成を続行し、最後に、260nmでのDNA濃度を測定することにより、6%ネイティブPAGEのDNAゲルを実行することにより、可溶性と良質再構成ヌクレオソームの量を推定、臭化エチジウム、それぞれ( 図5A)で染色しました。
- 6 kDaのカットオフの透析膜にミックスを移し、4℃で一晩リフォールディング緩衝液1リットルに対して透析します。
- 0.85、0.64に、2から段階的に透析緩衝液の塩濃度を低減し、それぞれ0.2 MのNaCl。少なくとも3時間、各バッファ内のサンプルを保管してください。時々、沈殿物を最後の遷移の後に形成されています。この場合、Cで計画通りに透析をontinueし、次のステップの終わりにマイクロフュージ遠心分離により沈殿物を除去。
- アッセイ緩衝液(25mMののNaH 2 PO 4 / の Na 2 HPO 4 pH6.8の、25mMの塩化ナトリウム、2mMのDTT)、4℃で透析O / Nを継続1Lでビーカー内の転送透析膜。
- サンプルを収集し、いずれかが最大速度に4℃で5分間の微量遠心分離することにより、ステップ1.2.5に形成され、〜300μLの最終容量に30kDaのカットオフ遠心フィルターユニットを使用して集中沈殿除去します。
- 、260nmでDNA濃度を測定し、数週間のために4℃で18%SDS-PAGEタンパク質ゲル(サンプルの4μL)および6%ネイティブPAGEのDNAゲル(サンプルの0.2μL)とストアサンプルを実行します。最終濃度は、10〜20μMの範囲内であるべきです。
二つの姉妹ヒストン上の修飾反応の2 NMR分析
注:の割り当てヌクレオソームのヒストン尾部の2次元1 H- 15 N相関スペクトルは、参照16、17、18で見ることができます。さらに、CHの割り当ては、スペクトルは、参照16で発見することができ、2D 1 H- 13 C相関にリジン、セリンおよびスレオニンのグループ数 。
- NMRの設定と参照スペクトルの記録
注:他のサンプル量を用いることも可能で酵素アッセイを300 K.異なるNMR管に3 mmのNMRチューブにアッセイ緩衝液でヌクレオソームのサンプル140μLを用いて行きました。前述の温度は良い品質をヌクレオソームのヒストン尾部との良好な酵素活性の1 H- 15 N相関スペクトルを取得することが適切です。 1 H- 13 Cスペクトルをセットアップトンでそれぞれ記録した2D-SOFAST-HMQC 1 H- 15 Nおよび2D-HSQC帽子は同様の取得時間を与えます。典型的な取得パラメータは、1.024(1 H)128のトランジェントは、128(15 N)の複雑なポイントと相関スペクトルの二つの異なるタイプのための1.024(1 H)×64(13 C)複雑なポイントで32トランジェントをxはされています。 2Dスペクトルの両方のために、取得時間は〜30分でした。- 分光計で試料の温度として300 Kを設定します。 10%D 2 O(V / V)は、分光計の周波数ロックのために使用されるサンプルに加えます。
- 分光計にサンプルを置き、基本的な操作(ロック、チューニング、シム)を行います。さらに、最適なパルス長と一般的な収集パラメータを決定します。
- 録音1Dおよび2D 1 H- 15 N及び1 H- 13 Cの参照スペクトル。
- プロセスの基準スペクトルと信号が修飾反応をマッピングするために使用されることを確実に十分に解決され、良好な強度を有しています。
- サンプルを回収し、私を転送マイクロチューブにトン。
- 酵素反応、NMR監視および定量分析のセットアップ
- インターリーブされた2Dの一連の1 H- 15 N及び1 H- 13 Cスペクトルをコピーして配置します。数時間の合計取得時間を目指すと最初の反応から得られた酵素の速度に基づいて、新規実行に応じて調整します。
- 修飾反応のそれぞれのタイプについては、サンプルに必要な補因子を追加します(1mMのATP / 2 mMのリン酸化のためのMgCl 2、アセチル化のために1 mMのアセチルCoA、メチル化のために1 mMのSAM、 など 。)。
- 、ピペッティングにより混合し、目的の酵素を追加し、分光計(迅速にこれらの操作を実行)に戻ってNMRチューブ中で、その後、サンプルを転送します。
注:1:予想される酵素活性についてのデータがない場合は、10に基板対酵素のモル比を調整します。最初の試運転を行い、ためにそれに応じて調整します実走。 - 高速自動シミングを実行し、参照スペクトルから残りのパラメータを使用します。
- インターリーブされた2D 1 H- 15 N及び1 H- 13 Cスペクトルのシリーズを開始します。
- リアルタイムで反応の進行に従って、反応が完了または所望のレベルに達したときに、取得を停止します。
- まったく同じパラメータを持つ前とプロセスのスペクトル。
- 相関スペクトルの2つのタイプごとに異なる取得順序を使用して全体の実行を繰り返します。最初の実験では1 H- 15 N相関はシリーズの最初だった場合、1 H- 13 C相関で今すぐ開始。これとスペクトルの両方に同じ収集時間を有することで、同じ時間スケールの両方の示差同位体標識されたヒストンのPTM反応をプロットし、比較することができます。加えて、平均プロットエラーバーを計算することが可能です。
注:thorougNMR信号解析および酵素反応のその後の定量化のための方法論の時間の説明はここでは19見つけることができます。 - 反応の進行を報告し、NMRスペクトルのための可視化および分析ソフトウェアを使用して、それらの相対的な信号強度を計算するたびにコースNMRスペクトルからのNMR信号を選択します。変更されていないだけでなく、変更された状態を報告する信号のためにこれを行います。修正レベルを抽出します。
- 反応時間に対して修正レベルの計算値をプロットします。
結果
適切にリフォールディング八量体種は、ゲルろ過カラムを通して再構成混合物のラン( 図2)の後に分離されています。八量体の3つの異なるタイプを含む再構成八量プールをタンデムアフィニティ精製スキームに供されます。サンプルは、すべてのステップから収集し、SDS-PAGE、続いてWBによって分析されます。非対称種の単離をもたらすプロトコルの正しい実行の検証は、異なる試料( 図3)に2つの親和性タグ(HIS-とStrep-)の存在を、以下のことにより達成されます。続いて、親和性タグは、TEVプロテアーゼ消化( 図4)の後に除去されます。親和性タグで配置された非対称八量体は、非対称ヌクレオソームを再構成するために使用されています。高もたらすオクタマー:最初に、小テストスケール再構成は、DNAの最適なモル比を決定するために使用されます単分散複合体の形成をもたらします。続いて、最適化された混合比が大規模にヌクレオソームを再構成するために使用されます。ヌクレオソーム再構成は、適切なアセンブリとそれぞれ示差同位体標識姉妹H3ヒストンの存在( 図5)のためのタンパク質/ DNAゲルおよびNMR分光法によって分析されます。応用例は、 図6に示されています。特に、差別的同位体標識とH3S10ヌクレオソーム上の非対称リン酸化は、GCN5アセチルトランスフェラーゼと反応させて、両方のH3コピーにH3K14のアセチル化は、NMR分光法によるリアルタイムで追跡します。分析はH3S10のリン酸化は、 トランスでに比べてシスで GCN5によりH3K14アセチル化を刺激することが明らかになりました。

図1:示差同位体リットルの調製のためのフローチャートabeledヌクレオソーム(および非対称変更されました)。 (A)再構成および示差同位体標識のタンデムアフィニティー精製(及び非対称的に修飾された)ヒストン八量体。 (B)精製非対称八量体とDNAヌクレオソーム位置決めシーケンスを組み合わせることにより、ヌクレオソーム再構築。ヒストン修飾酵素非対称に修飾され、差別的同位体標識されたヌクレオソームを混合した後、シスと イントランス修正クロストークの(C)NMRモニタリング。 この図の拡大版をご覧になるにはこちらをクリックしてください。
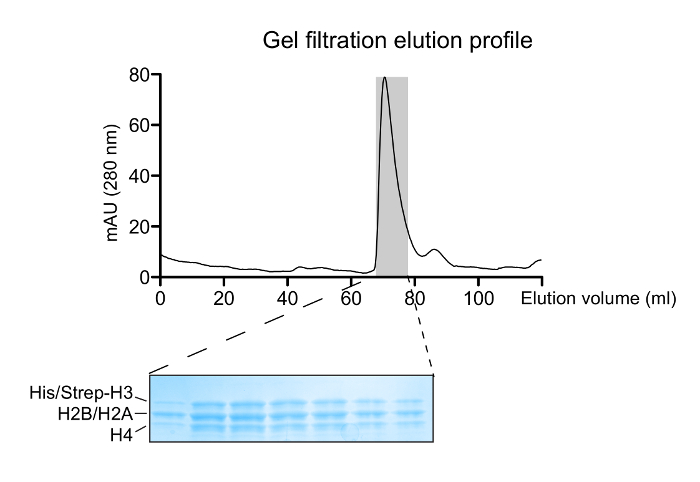
図2: ヒストン八量体の再構成。リフォールディングヒストン混合物のゲル濾過溶出プロフィール。 〜70 mLの主要なピークは、ヒストン八量体に相当します。 14 - オクタマーピークに対応する溶出画分の20%勾配SDS-PAGEゲル(クーマシーブルー染色)が正しいヒストンの化学量論を示しています。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3: 非対称ヒストン八量体の精製。タンデムアフィニティ精製スキームの異なる段階からのサンプルのHIS-とStrep-親和性タグに対する百分の14から20の勾配SDS-PAGEゲル(クーマシー染色)とWB。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4: アフィニティタグの除去。精製された非対称のヒストン八量体の18%SDS-PAGEゲル(クーマシー染色)の前及びTEVプロテアーゼと混合した後。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図5: 示差同位体で標識されたヌクレオソームの生化学的およびNMRキャラクタリゼーション。八量体(左):DNAの異なるモル比を用いて、小テスト規模ヌクレオソーム再構成の(A)6%ネイティブPAGEのDNAゲル(エチジウムブロマイド染色)。八量体のモル比(右:最適化されたDNAを用いた大規模なヌクレオソーム再構成の6%ネイティブPAGEのDNAゲル(エチジウムブロマイド染色))。再構成ヌクレオソームの(B)18%SDS-PAGEタンパク質ゲル(クーマシー染色)は、4つのコアヒストンの正確な化学量論を示しています。 (C)示差的に同位体標識されたヌクレオソームの15 N標識H3コピーの1 H- 15 N SOFAST-HMQCスペクトルは、(のみH3は、テール残基が表示されている-タンパク質コアが原因で遅いタンブリングレートには見えません)。 (D)示差的に同位体標識されたヌクレオソームの13 C標識H3コピーの1 H- 13 C HSQCスペクトル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
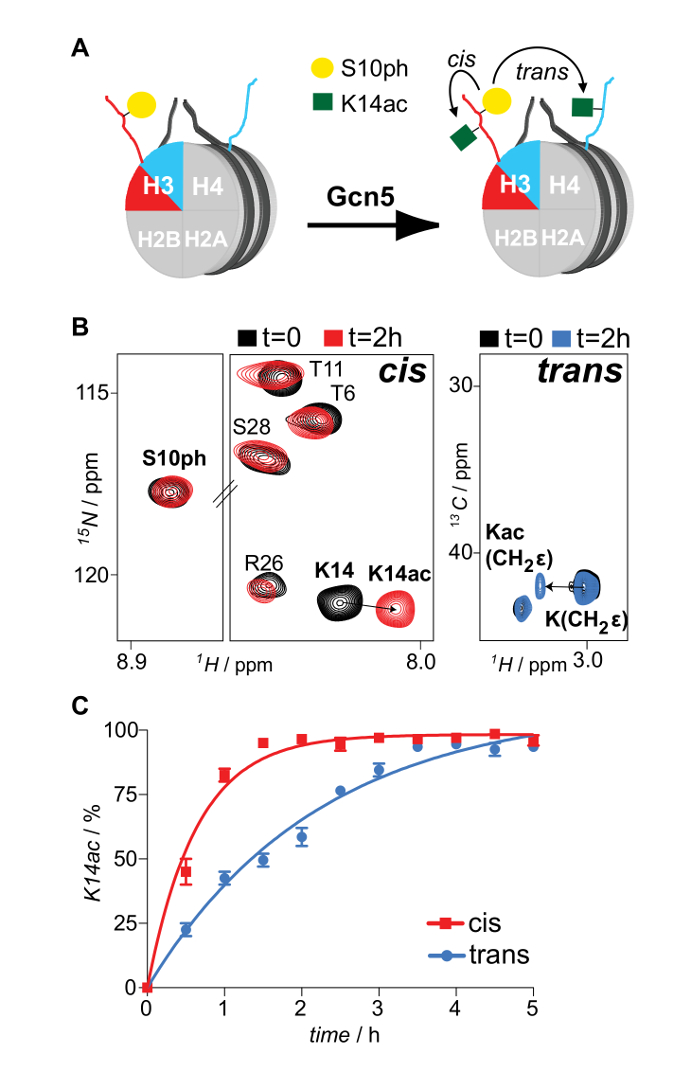
図6: シスIn と トランスで のNMRの監視 GCN5アセチルトランスフェラーゼのH3K14アセチル化活動にH3S10の非対称リン酸化によって課さグラム> 変更クロストーク。 (A)の模式図で示差的に同位体標識および非対称リン酸化H3S10上のヌクレオソームは、 シスおよびトランスで 、GCN5アセチルトランスフェラーゼとH3K14のアセチル化マッピングと反応させました。 (B)1 H- 15 N SOFAST-HMQC前とGCN5との反応後の非対称ヌクレオソームの1 H- 13 C HSQCスペクトル(選択された領域)。 (C)非対称H3S10リン酸化されたヌクレオソームにGCN5によりH3K14のアセチル化の時間分解NMRモニタリング。 2つの独立した実験からの平均変動(エラーバー)が示されています。許可16で再現。 の拡大版をご覧になるにはこちらをクリックしてください。この図。
ディスカッション
ヌクレオソーム再構成のために、現在のプロトコルは、601-Widomヌクレオソーム位置決めシーケンス20を含む165 bpの長さのDNAテンプレートを利用したが、同様の性能は、DNAテンプレートの様々な長さを使用して期待されています。プロトコルは、ヒストンH3の非対称型を使用して設計し、使用しました。同じ原理で、この方法は、他のコアのヒストンのためにも適用することができ、さらに、異なる同位体標識を有する2つの別個のコアヒストンを担持する複合体を再構成するために使用することができます。プロトコルはまた、わずかに最初にヒストンサブ複合体と直接ではなく、ヒストン八量体を再構成するように修正することができます。この修正の後、非対称H3-H4四量体は同じタンデム精製スキームを使用することによって再構成することができます。後者は、ヌクレオソーム16を組み立てるために別々に再構成されたH2A-H2B二量体とDNAと混合されます。最終的な収率および修正protocの全体的なパフォーマンスオールは、元の1に似ています。
プロトコルは、効率的に関連する種と結合するので、最後に高純度の非対称複合体を得るために2アフィニティーカラムの能力に強く依存しています。最終的に精製された複合体が実際にのみ非対称であることを直接かつ具体的な証拠を提供するために面倒です。しかし、関連する抗体を用いたすべての精製工程からのサンプルのWB分析は、タンデム精製スキーム( 図3)の成功のための信頼性の指標を提供します。同じ結果を、したがって追加の安心感は、NMR法16によって親和性タグの存在について同じ試料を分析することによって得ました。 WB分析は、対称のものと非対称種の汚染を示している場合、まだ、小さい変化が結果を改善することができる第一の精製工程ニッケル(Ni-NTA)で採用することができます。特に、代わりに定組成溶離、イミダゾールgradienの T溶出(10〜250 mM)を使用することができ、その後、唯一の非常に非対称な種で富化された第1の溶出画分をプールし、アフィニティカラムに通します。これは、連鎖球菌の親和性タグの存在について溶出画分のWB分析によって評価することができます。
ほとんどの場合、NMRは両方の1 H- 15 N及び1 H- 13 Ccorrelationスペクトルを使用して、同じPTMをマッピングすることが可能なので、興味のあるPTMとの関係で同位体ラベルの選択はかなり柔軟です。しかしながら、特定のアミノ酸を、リジンのような側鎖の1 H- 13 C共鳴の化学シフトの分散がかなり限られています。リジン修飾酵素の標的部位が不明である場合に加えて、リジンのPTMの部位特異的読み出しは簡単ではありません。これらの場合には、別の方法は、半合成ヒストン生産と組み合わされ、部位選択的な13 C標識を使用します「> 21または選択励起を介して修飾状態の特異的検出を可能に新設NMRパルスシーケンスの使用は、22ルーチン 。NMR分光法は、かなり低い感受性を付与する。この点で、ヌクレオソームの比較的高い量(μM範囲の)を実行するために必要とされます酵素反応は、これは、高スループットのセットアップの方法の発展を防止します。
同時に、新たな化学的方法は、定義されたPTM 23運ぶ、高い収率で、化学的に純粋な、非対称的に修飾されたヌクレオソームの合成のために導入されています。このアプローチは、PTMのクロストークのメカニズムを研究するために、透視と組み合わせて、使用されています。原因のPTMを検出する透視法の低分解能に、結論はなく、対称および非対称のPTMの異なる組合せを運ぶヌクレオソームの集合の全体的な酵素活性を比較することによって間接的に誘導されました各姉妹ヒストンの対応する部位にPTM反応の直接観察することによってより。しかし、同位体標識されたヒストンの取り込みとPTMの読み出しのためのNMR分光法の使用は、前述の方法に非対称的に変更されたヌクレオソームの高解像度PTM分析のための追加のツールを構成することができます。
将来的には非対称に変更されたヌクレオソームの新しいタイプの識別に関連して、現在の方法は、 シスおよびヌクレオソーム基板上のトランス PTMクロストーク反応に分析するための高解像度のツールを構成することを目指しています。特に、非常に重要で、非対称の両方の転写活性及び抑圧のPTMを含む二価ヌクレオソーム24を生じるクロストーク機構の復号です。
開示事項
The author has nothing to disclose.
謝辞
研究助成金(LI 2402 / 2-1)を介して作業に資金を提供するための実験とドイツ学術協会(DFG)を実行するためにウェットラボスペースとインフラを提供するための作者のおかげで博士フィリップSelenko(FMP-ベルリン)。
資料
| Name | Company | Catalog Number | Comments |
| Guanidinium HCl | Applichem | A14199 | Use high quality Gu-HCl |
| Tris | Roth | 4855.2 | |
| DTT | Applichem | A1101 | |
| NaCl | VWR chemicals | 27810.364 | |
| EDTA | Roth | 8043.2 | |
| Na2H2PO4 | Applichem | A1046 | |
| NaH2PO4 | Applichem | A3902 | |
| Imidazole | Applichem | A1073 | |
| d-Desthiobiotin | Sigma | D1411 | |
| Ni-NTA Superflow | Qiagen | 1034557 | |
| Strep-Tactin Superflow | IBA | 2-1207-001 | |
| His-probe antibody | Santa Cruz | sc-8036 | |
| Strep-tactin conjugated HRP | IBA | 2-1502-001 | |
| Hi-Load 16/600 Superdex 200 pg | GE Healthcare | 28-9893-35 | |
| 6 - 8 kDa dialysis membrane | Spectrumlabs | spectra/por 1, 132650 | |
| 50 kDa dialysis membrane | Spectrumlabs | spectra/por 7, 132129 | |
| 10 kDa centrigugal filter unit | Merck Millipore | UFC901024 | |
| 30 kDa centrigugal filter unit | Merck Millipore | UFC903024 | |
| Solution-state NMR spectrometer | at least 500 MHz operating frequency, equipped with a triple-resonance cryoprobe | ||
| Buffer name | Component | ||
| Unfolding Buffer | 7 M Guanidinium HCl | ||
| 20 mM Tris, pH 7.5 | |||
| 10 mM DTT | |||
| Refolding Buffer | 10 mM Tris, pH 7.5 | ||
| 2 M NaCl | |||
| 1 mM EDTA | |||
| 2 mM DTT | |||
| Assay Buffer | 25 mM Na2H2PO4, pH 6.8 | ||
| 25 mM NaCl | |||
| 2 mM DTT |
参考文献
- Hansen, J. C. Conformational Dynamics of the Chromatin Fiber in Solution: Determinants, Mechanisms, and Functions. Annu. Rev. Biophys. Biomol. Struct. 31, 361-392 (2002).
- Clapier, C. R., Cairns, B. R. The Biology of Chromatin Remodeling Complexes. Annu. Rev. Biochem. 78, 273-304 (2009).
- Musselman, C. A., Lalonde, M., Cote, J., Kutateladze, T. G. Perceiving the epigenetic landscape through histone readers. Nat. Struct. Mol. Biol. 19 (12), 1218-1227 (2012).
- Suganuma, T., Workman, J. L. Signals and Combinatorial Functions of Histone Modifications. Annu. Rev. Biochem. 80, 473-499 (2011).
- Lee, J. S., Smith, E., Shilatifard, A. The Language of Histone Crosstalk. Cell. 142 (5), 682-685 (2010).
- Liokatis, S., et al. Phosphorylation of histone H3 Ser10 establishes a hierarchy for subsequent intramolecular modification events. Nat. Struct. Mol. Biol. 19 (8), 819-823 (2012).
- Voigt, P., et al. Asymmetrically Modified Nucleosomes. Cell. 151 (1), 181-193 (2012).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nat. Struct. Mol. Biol. 18 (1), 91-93 (2011).
- Huang, H., Lin, S., Garcia, B. A., Zhao, Y. Quantitative Proteomic Analysis of Histone Modifications. Chem. Rev. 115 (6), 2376-2418 (2015).
- Liokatis, S., Dose, A., Schwarzer, D., Selenko, P. Simultaneous Detection, of Protein Phosphorylation and Acetylation by High-Resolution NMR Spectroscopy. J. Am. Chem. Soc. 132 (42), 14704-14705 (2010).
- Binolfi, A., et al. Intracellular repair of oxidation-damaged α-synuclein fails to target C-terminal modification sites. Nat. Commun. 7, 10251 (2016).
- Schanda, P., Kupce, E., Brutscher, B. SOFAST-HMQC experiments for recording two-dimensional heteronuclear correlation spectra of proteins within a few seconds. J. Biomol. NMR. 33 (4), 199-211 (2005).
- Theillet, F. X., et al. Cell signaling, post-translational protein modifications and NMR spectroscopy. J. Biomol. NMR. 54 (3), 217-236 (2012).
- Dyer, P. N., et al. Reconstitution of Nucleosome Core Particles from Recombinant Histones and DNA. Methods Enzymol. 375, 23-43 (2004).
- Artimo, P., et al. ExPASy :SIB bioinformatics resource portal. Nucleic Acids Res. 40 (W1), 597-603 (2012).
- Liokatis, S., klingberg, R., Tan, S., Schwarzer, D. Differentially Isotope-Labeled Nucleosomes to Study Asymmetric Histone Modification Crosstalk by Time-Resolved NMR Spectroscopy. Angew. Chem. Int. Ed. 55 (29), 8262-8265 (2016).
- Stützer, A., et al. Modulations of DNA Contacts by Linker Histones and Post-translational Modifications Determine the Mobility and Modifiability of Nucleosomal H3 Tails. Mol. Cell. 61 (2), 247-259 (2016).
- Zhou, B. R., et al. Histone H4 K16Q Mutation, an Acetylation Mimic, Causes Structural Disorder of Its N-terminal Basic Patch in the Nucleosome. J. Mol. Biol. 421 (1), 30-37 (2012).
- Theillet, F. X., et al. Site-specific NMR mapping and time-resolved monitoring of serine and threonine phosphorylation in reconstituted kinase reactions and mammalian cell extracts. Nat. Protoc. 8 (7), 1416-1432 (2013).
- Lowary, P. T., Widom, J. New DNA sequence rules for high affinity binding to histone octamer and sequence-directed nucleosome positioning. J. Mol. Biol. 276 (1), 19-42 (1998).
- Hackenberger, C. P., Schwarzer, D. Chemoselective ligation and modification strategies for peptides and proteins. Angew. Chem. Int. Ed. 47 (52), 10030-10074 (2008).
- Theillet, F. X., et al. Site-specific mapping and time-resolved monitoring of lysine methylation by high-resolution NMR spectroscopy. J. Am. Chem. Soc. 134 (18), 7616-7619 (2012).
- Lechner, C. C., Agashe, N. D., Fierz, B. Traceless Synthesis of Asymmetrically Modified Bivalent Nucleosomes. Angew. Chem. Int. Ed. 55 (8), 2903-2906 (2016).
- Bernstein, B. E., et al. A bivalent chromatin structure marks key developmental genes in embryonic stem cells. Cell. 125 (2), 315-326 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved