Method Article
La reconstitución de los nucleosomas con histonas hermanas marcadas con isótopos diferencialmente
En este artículo
Resumen
Este protocolo describe la reconstitución de los nucleosomas que contienen histonas hermana marcados con isótopos diferencialmente. Al mismo tiempo, los nucleosomas asimétricamente después de la traducción modificados pueden ser generados después de usar una copia de la histona premodified. Estas preparaciones se pueden utilizar fácilmente para estudiar los mecanismos de modificación de diafonía, simultáneamente en ambos histonas hermanas, mediante el uso de la espectroscopia de RMN de alta resolución.
Resumen
nucleosomas asimétricamente modificados contienen las dos copias de una histona (histonas hermana) decoradas con distintos conjuntos de modificaciones post-traduccionales (PTMs). Son especies recién identificadas con medios desconocidos de establecimiento y consecuencias funcionales. métodos analíticos actuales son insuficientes para detectar la aparición-copia específica del PTM de las histonas del nucleosoma hermanas. Este protocolo presenta un método bioquímico para la reconstitución in vitro de los nucleosomas que contienen histonas hermanas marcados con isótopos diferencialmente. El complejo generada puede ser también modificado de forma asimétrica, después de que incluye una piscina de histonas premodified durante el replegamiento de Subcomplejos histonas. Estas preparaciones de nucleosomas asimétricos pueden ser fácilmente reaccionar con enzimas modificadoras de histonas para estudiar los mecanismos de modificación de diafonía impuestas por el PTM asimétricamente pre-constituida mediante espectroscopia de resonancia magnética nuclear (RMN). En particular, las reacciones de modificación enEn tiempo real se puede asignar de forma independiente en los dos histonas hermanas mediante la realización de diferentes tipos de experimentos de correlación de RMN, adaptados para el tipo de isótopo. Esta metodología proporciona los medios para estudiar los mecanismos de diafonía que contribuyen a la formación y propagación de los patrones de PTM asimétricos en complejos nucleosomal.
Introducción
DNA eucariótico está estrechamente empaquetados dentro de los núcleos celulares en la cromatina. El bloque de construcción fundamental de la cromatina es la partícula de núcleo nucleosoma que contiene ~ 147 pb de ADN envuelto alrededor de un complejo de octameric formado por dos copias de cada uno de los cuatro histonas del núcleo (H3, H4, H2A, H2B). Las proteínas histonas albergan una gran cantidad de modificaciones post-traduccionales (PTMs). Estas sustituciones covalentes inducen alteraciones en la estructura de la cromatina, tanto directamente al afectar a la química física del sistema e indirectamente mediante el reclutamiento de las actividades de remodelación de la cromatina 1, 2, 3. Por estos medios, PTMs histonas controlan la accesibilidad de la cromatina y, por lo tanto, regular todas las funciones celulares 4 basadas en ADN.
Las PTM se instalan de sistemas de enzimas modificadoras de histonas, principalmente en los segmentos N-terminal no estructurados (colas) de histo-nucleosoma incorporadones. Debido a los muchos sitios de modificación en la relativamente corta secuencia de las colas de las histonas, PTM influyen entre sí mediante la inducción o el bloqueo de reacciones de modificación posteriores, un efecto conocido como modificación de la diafonía 5. Debido a la arquitectura simétrica global del nucleosoma, se pensaba que reacciones de modificación y mecanismos de diafonía que se produzca de manera similar en las dos copias de cada histona nucleosomal (histonas hermana). Este concepto ha sido recientemente cuestionado y posteriormente refutada. En particular, los ensayos enzimáticos in vitro sobre las histonas H3 libre de péptidos de la cola y en nucleosomas demostraron que un conjunto de quinasas H3 fosforilación introdujo de forma asimétrica 6. Además, el análisis LC-MS / MS basados en purificación por afinidad reveló la existencia de nucleosomas asimétricamente H3-metilado en varios tipos de células eucariotas 7. Por lo tanto, los nucleosomas modificados de forma asimétrica constituyen nuevas especies, ySe necesitan herramientas para descubrir los mecanismos que controlan su formación y para analizar los efectos de diafonía que esta asimetría podría ejercer.
Comúnmente, Western Blotting (WB) y el análisis de espectrometría de masas (MS) se han utilizado para detectar PTM histonas. A pesar de su fácil aplicación, WB sufre de problemas de especificidad / reactividad cruzada. Además de eso, es incapaz de realizar simultáneamente el análisis multi-PTM y cuantificación directa de las reacciones de modificación 8. Por otro lado, el análisis de MS emplea instrumentación sofisticada que requiere una formación de alto nivel, sino que proporciona una alta especificidad, así como la cartografía y cuantificación simultánea de múltiples PTM 9. Sin embargo, ambos métodos son perjudiciales y los complejos se disocian nucleosomal antes del análisis, dando lugar a una mezcla de histonas y / o péptidos de histona-derivado. Esta manipulación elimina la capacidad de distinguir independientereacciones de modificación que se producen en cada una de las dos hermanas histonas y para informar sobre el estado de variación de la copia específica de las histonas del nucleosoma.
espectroscopia de resonancia magnética nuclear (RMN) desarrollado como un método alternativo para asignar reacciones PTM. NMR es sin interrupciones y por lo tanto permite el seguimiento de eventos PTM de una manera en tiempo real en las mezclas reconstituidas, e incluso en células intactas 10, 11. El desarrollo de las rutinas para la adquisición rápida de datos, así como para la cartografía de alta resolución basado en 2D métodos de correlación hetero-nuclear de muestras marcados con isótopos (15 N y / o 13 C) 12 permitió el mapeo simultánea de diferentes tipos de PTM, tales como serina / treonina / tirosina fosforilación, acetilación de lisina / metilación, y la metilación de arginina 13. Dependiendo de la PTM bajo investigación, 15 N- o C-13 etiquetado protocols se pueden emplear para marcar el grupo funcional de proteína que sirve como un reportero de modificación. En consecuencia, PTM cartografía puede llevarse a cabo siguiendo la característica de desplazamiento del desplazamiento químico del grupo funcional correspondiente 'detección' la alteración en el ambiente químico. En la mayoría de los casos, tanto grupos químicos CH NH y se pueden utilizar para informar de la evolución de la PTM de interés.
El protocolo actual describe la generación de nucleosomas que contienen histonas hermanas marcados con isótopos diferencialmente. Se combina la flexibilidad de la espectroscopía de RMN a mapa PTM utilizando tanto 1 H- 15 N y 1 H- 13 C espectros de correlación con la utilización de diferentes etiquetas de afinidad para la purificación de proteínas de los complejos histona reconstituidas seleccionados. En particular, el protocolo emplea dos piscinas diferentes de una histona particular para la reconstitución nucleosoma. Estas piscinas son diferencialmente marcado con isótopos (uno con 15 N, el otro con 13 C), y se fusiona a una de polihistidina y una etiqueta de afinidad de estreptavidina, respectivamente. Un esquema de purificación por afinidad en tándem con Ni-NTA y cromatografía a base de estreptavidina utilizado inicialmente por Voigt et al. 7 se emplea para purificar especies asimétrica de homólogos simétricos (Figura 1A). Octámeros histonas asimétricas se utilizan posteriormente para reconstituir los complejos nucleosomal equivalentes (Figura 1b), utilizando el método de diálisis de sal estándar 14. Además, por el mismo procedimiento y por tener una de las piscinas histonas pre-modificado, un PTM puede ser incorporado de forma asimétrica en los nucleosomas resultantes. La reacción de estos sustratos con enzimas modificadoras de histonas y la posterior RMN-mapeo de eventos de modificación permite la caracterización de los mecanismos de diafonía tanto en cis (premodified copia de histonas) y en trans (unmodified copia de histonas) (Figura 1C).
Protocolo
1. Reconstitución de los nucleosomas con marcado con isótopo diferencialmente (y asimétricamente modificado) de la hermana histonas
NOTA: El protocolo actual describe la reconstitución de los nucleosomas con diferencialmente histona H3 marcada con isótopo. Con este fin, se utilizaron dos piscinas de la histona H3; uno era 15 N-etiquetados y contenía una 6xHis-tag en el extremo N-terminal y el segundo fue 13 C-etiquetados y contenía el péptido Strep (WSHPQFEK) fusionada en el extremo N-terminal. Ambas marcas fueron separados de la secuencia nativa H3 con un sitio de reconocimiento de la proteasa del virus del grabado del tabaco (TEV). Para preparar nucleosomas adicionales asimétricamente modificados, una de las dos piscinas H3 está incluido en una forma premodified. Premodification de una piscina de histona se puede realizar haciendo reaccionar el histona marcado con isótopo de interés con la respectiva enzima histona modificadores en presencia de la necesaria para cada tipo de cofactores de reacción / donantes PTM 16. La colocación eficiente de la respectiva PTM puede evaluarse mediante espectroscopia de RMN o espectrometría de masas. Las cantidades de histonas / ADN utilizados aquí son recomendaciones en bruto para obtener una preparación nucleosoma con una concentración aproximada de 10 m (medida como concentración de ADN a 260 nm) .Este rendimiento final es suficiente para registrar los espectros NMR de buena calidad con tiempos de adquisición relativamente cortos.
- La reconstitución de un octámero de histona con diferencialmente marcado isotópicamente (y asimétricamente modificado) histona H3
NOTA: recombinante proteínas histonas se pueden producir en cantidades mg en BL21 (DE3) pLysS 14. Para obtener histonas marcados con isótopos, el mismo protocolo de expresión / purificación se siguió con la excepción de usar para el crecimiento bacteriano un medio mínimo que contenía 15 NH 4 Cl y / o 13 C-glucosa como fuentes de nitrógeno y de carbono, por 15 N- o 13 respecti-C etiquetadovamente. histonas purificadas son ampliamente dializaron contra 5 mM β-mercaptoetanol y se almacenaron liofilizadas antes de su uso.- Disolver alícuotas liofilizadas de las histonas, que contiene ~ 5 mg de cada histona en 1 ml de tampón de desarrollo (7 M de guanidinio-HCl, 20 mM Tris pH 7,5, DTT 10 mM). Incluir ambos tipos de histona H3. Mezclar con la pipeta y no hacer vórtice. Mantener los tubos en hielo durante 30 min para permitir despliegue completo.
- Determinar la concentración exacta de cada histona mediante la medición de la absorbancia a 280 nm contra el despliegue de tampón y el uso de coeficientes de extinción calculados con la herramienta ProtParam del portal de ExPASy. 15
- Mezclar las histonas nucleares a relaciones equimolares, teniendo en cuenta para incluir 50% cada una de las dos piscinas de la histona H3. Empieza por usar todo el contenido de la histona menos concentrado y añadir todos los demás en consecuencia.
- Ajuste concentración final de proteína de aproximadamente 1 mg / ml usando tampón de despliegue.
- transfer la mezcla a una membrana de diálisis 6 kDa-corte y dializar contra 1-2 L de tampón de replegamiento enfriado (10 mM Tris pH 7,5, 2 M de NaCl, 1 mM EDTA, DTT 2 mM) a 4 ° C. Cambiar el tampón al menos una vez después de la diálisis ha procedido durante un mínimo de 3 h. Realizar una final de la diálisis O / N a 4 ° C.
- Recoger material dializado y eliminar cualquier precipitado por centrifugación en una microcentrífuga durante 5 min a 4 ° C en la velocidad máxima (normalmente debe observarse sin precipitación). Determinar la concentración de octámero por la medición de la absorbancia a 280 nm. En los cálculos, utilizar los coeficientes de extinción añadidos de las histonas, teniendo en cuenta que cada valor doble.
- Se concentra hasta un volumen final de ~ 2 ml usando una unidad de filtro centrífugo 10 kDa-corte. Volver a calcular la concentración octámero y la pérdida de estimación. En este punto, una concentración octámero entre 50 - Se debe obtener 100 mM.
- Conectar la columna de filtración en gel (se indica en la Tabla de Materiales) a unasistema y FPLC equilibre con 2 volúmenes de columna (CV) de 0,22 m-filtrada y desgasificada tampón de replegamiento a una velocidad de flujo de 1 ml / min y un límite de presión de 0,5 MPa.
NOTA: El gel filtración debe realizarse en la cámara fría o en un armario frío. - Inyectar material concentrado usando una velocidad de flujo de 1 ml / min y recoger 1.0 - 1.5 fracciones de un ml.
- Sigue el perfil cromatográfico y observar la elución de la histona octámero en ~ 65 - 68 ml.
NOTA: Un pequeño hombro del pico de elución y un pico a ~ 80 ml indica la existencia del libre tetrámeros H3-H4 y dímeros H2A-H2B, respectivamente. - Ejecutar 20 l de cada fracción recogida en un gel de SDS-PAGE 18%.
NOTA: Diluir las muestras en un factor de al menos 2 con agua antes de cargarlas en el gel para reducir la alta concentración de sal y por lo tanto, evitar distorsiones. Lo mismo se aplica para posteriores análisis SDS-PAGE de muestras en tampón de replegamiento. - Piscina fra relevantecciones que contienen octámeros puros juzgados por la distribución equitativa de los 4 histonas en el gel teñido y determinar la concentración como antes (paso 1.1.7).
- Conectar una columna de 1 ml de Ni-NTA (Tabla de Materiales) a un sistema de FPLC y equilibre con 10 CV de 0,22 micras-filtrada y desgasificada tampón de replegamiento a una velocidad de flujo de 1 ml / min.
NOTA: La cromatografía de Ni-NTA se debe realizar en la cámara fría o en un armario frío. - Pase octámero purificada a través de la Ni-NTA usando una velocidad de flujo de 1 ml / min.
- Recoger el filtrado y mantener las muestras para el análisis de SDS-PAGE / WB (20 l y 4 l, respectivamente). Posteriormente, lavar la columna con 10 CV de tampón de replegamiento o hasta que se alcanza una señal de línea de base.
- Eluir con 10 CV de tampón que contiene imidazol 250 mM utilizando una velocidad de flujo de 1 ml / min replegamiento. Mantener las muestras para el análisis de SDS-PAGE / WB (20 l y 4 l, respectivamente).
- Equilibrar una columna de afinidad de 1 ml de acestreptavidina ommercial (Tabla de Materiales) con tampón de replegamiento de 10 CV que contenía imidazol 250 mM utilizando una configuración de flujo de proceso por lotes / gravedad.
Nota: Este paso cromatográfico debe ser realizada en la sala de frío. - Pasar de Ni-NTA elución a través de la columna de afinidad de estreptavidina comercial.
- Recoger el flujo a través y mantener las muestras para el análisis de SDS-PAGE / WB (20 l y 4 l, respectivamente). Posteriormente, lavar con 10 CV de tampón de replegamiento.
- Eluir con 10 CV de tampón que contenía destiobiotina 2,5 mM replegamiento. Mantener las muestras para el análisis de SDS-PAGE / WB (20 y 4 l, respectivamente).
- Medir la concentración de octámero, añadir 10 veces menos proteasa TEV y dejar que la reacción continúe durante la noche a 4 ° C en un tubo de plástico centrífuga estándar.
NOTA: La cantidad necesaria de TEV para obtener la digestión completa (eliminación de las etiquetas de afinidad) depende del origen (construcción) y en la actividad (recién hecho, TEV recombinante es másactivo en comparación con la almacenada durante períodos prolongados a - 80 ° C). Pruebe inicialmente la adición de 10 veces menos TEV en comparación con el octámero (estimadas como las concentraciones de proteína) y ajustar en consecuencia. - Compruebe para la digestión eficiente mediante la ejecución de 20 l de la mezcla antes y después de TEV además en un gel de SDS-PAGE 18%. Si la digestión no es completa, añada más proteasa TEV y continuar la incubación durante otras 3-4 h.
- Se dializa la muestra contra tampón de replegamiento usando una membrana de diálisis 50 kDa-corte para eliminar la proteasa TEV y ajustar la composición del tampón.
- Se concentra el octámero asimétrica se purificó usando una unidad de 10 kDa de corte del filtro de centrífuga (la misma unidad de filtro de la etapa 1.1.7 puede utilizarse también) a un volumen de 1,0 a 2,0 ml. Medir la concentración final. O bien utilizar poco después de la reconstitución para nucleosoma o ajustar a 50% (v / v) de glicerol para almacenar a -20 ° C durante períodos más largos. En este punto y esperando la pérdida de al menos 70% durante los pasos anteriores, THconcentración octámero e debe estar en el rango de 20 - 50 mM.
- reconstitución nucleosoma
- Si octámero se almacenó en glicerol al 50%, se dializa durante la noche a 4 ° C contra tampón de replegamiento antes de proceder a la reconstitución nucleosoma.
- Ajuste de ADN (que contiene una secuencia de nucleosoma posicionamiento) concentración de sal a 2 M NaCl utilizando un M NaCl solución madre 5.
NOTA: El ADN purificado ya sea aislado después de la purificación de un plásmido que contiene múltiples copias de la secuencia deseada o sintetizado mediante amplificación por PCR deben ser almacenados concentrada a ~ 50 M en agua o en un tampón de Tris-EDTA estándar. - Mezclar octámero y ADN utilizando la relación óptima determinada a partir de una prueba a pequeña escala. Utilizar tampón de replegamiento para ajustar el volumen final a ~ 3,0 ml. Siempre añadir el octámero pasado para evitar cualquier posibilidad de mezclar el octámero y el ADN en concentraciones <2 M de sal.
- Realizar inicial pequeña screconstituciones ale para determinar el octámero: relación de ADN que conduce a rendimientos óptimos de nucleosomas. Para esto, montar tres reacciones de 0,9: 1,0, 1,0: 1,0, y 1,1: 1,0 de ADN: octamer proporciones en un volumen de entre 50 a 100 mL. Típicamente, usar una concentración de ADN de 5 mM.
- Proceder con la reconstitución como se describe a continuación (pasos 1.2.4-1.2.8) y al final, estimar la cantidad de nucleosoma reconstituido calidad soluble y buena mediante la medición de la concentración de ADN a 260 nm y mediante la ejecución de un gel de ADN-PAGE nativa 6% , teñido con bromuro de etidio, respectivamente (Figura 5A).
- Transferir la mezcla a una membrana de diálisis 6 kDa-corte y dializar contra 1 L de tampón de replegamiento durante la noche a 4 ° C.
- Reducir la concentración de sal del tampón de diálisis de una manera paso a paso de 2, a 0,85, 0,64 y 0,2 M NaCl, respectivamente. Mantenga la muestra en cada tampón durante al menos 3 h. A veces precipitado se formó después de la última transición. En este caso continuac diálisis como estaba previsto y eliminar el precipitado por centrifugación de microcentrífuga al final de la etapa siguiente.
- Transferencia membrana de diálisis en un vaso de precipitados con 1 L de tampón de ensayo (25 mM NaH 2 PO 4 / Na 2 HPO 4 pH 6,8, NaCl 25 mM, DTT 2 mM) y se continúa la diálisis O / N a 4 ° C.
- Recoger la muestra, eliminar cualquier precipitado formado en la etapa 1.2.5 mediante centrifugación en una microcentrífuga durante 5 min a 4 ° C en la velocidad máxima y se concentran usando una unidad de filtración centrífuga de 30 kDa de corte en un volumen final de ~ 300 mL.
- Medir la concentración de ADN a 260 nm, correr un gel de 18% de proteínas SDS-PAGE (4 l de la muestra) y un gel de 6%-PAGE nativa de ADN (0,2 l de la muestra) y la muestra se almacena a 4 ° C durante varias semanas. La concentración final debe estar en el rango de 10 a 20 mM.
2. Análisis de RMN de reacciones de modificación de las histonas Dos hermanas
NOTA: La asignación de2D espectros de 1 H-15 N correlación de colas de las histonas del nucleosoma se puede encontrar en las referencias 16, 17, 18. Además, las asignaciones de CH x grupos de lisinas, serinas y treoninas en 2D espectros de correlación 1 H- 13 C se puede encontrar en la referencia 16.
- RMN de configuración y registro de los espectros de referencia
NOTA: los ensayos enzimáticos se realizaron con 140 l de la muestra de nucleosoma en tampón de ensayo en un tubo de RMN de 3 mm a 300 K. Los diferentes tubos de RMN con otros volúmenes de muestra puede también ser utilizado. La temperatura mencionada es adecuada para obtener una buena calidad de 1 H-15 N espectros de correlación de colas de las histonas del nucleosoma y buenas actividades enzimáticas. Los espectros 2D-SOFAST-HMQC 1 H-15 N y 2D HSQC 1H-13C se registraron, respectivamente, con una configuración de tsombrero confiere tiempos de adquisición similares. Parámetros de adquisición típicos son 128 transitorios con 1,024 (1 H) x 128 (15 N) puntos complejos y 32 transitorios con 1,024 (1 H) x 64 (13 C) puntos complejos para los dos tipos diferentes de los espectros de correlación. Para ambos espectros 2D, el tiempo de adquisición fue de ~ 30 min.- Ajuste 300 K como la temperatura de la muestra en el espectrómetro. Añadir 10% D 2 O (v / v) a la muestra a ser utilizada para el bloqueo de frecuencia del espectrómetro.
- Colocar la muestra en el espectrómetro y realizar operaciones básicas (de bloqueo, ajuste, de engrosamiento). Además, determinar longitudes de impulso óptimas y parámetros generales de adquisición.
- Registro 1D y 2D 1 H-15 N y 1 H- 13 C espectros de referencia.
- Los espectros de referencia de proceso y asegurar que las señales que se utilizan para el mapeo de las reacciones de modificación están bien resueltos y tienen buenas intensidades.
- Recuperar la muestra y transferir iT a un tubo de microcentrífuga.
- Configuración de la reacción enzimática, de vigilancia RMN y el análisis cuantitativo
- Copia y organizar una serie de 2D intercalado 1 H-15 N y 1 H- 13 C espectros. Objetivo para un tiempo total de adquisición de varias horas y ajustar en consecuencia en una nueva ejecución en base a las tasas enzimáticas obtenidas a partir de la primera reacción.
- Añadir a la muestra de los cofactores necesarios para el tipo respectivo de reacción de modificación (1 mM ATP / 2 mM de MgCl 2 para la fosforilación, 1 mM acetil-CoA para acetilación, SAM 1 mM para la metilación, etc.).
- Añadir la enzima de interés, mezclar mediante pipeteo, transferir la muestra de nuevo en el tubo de RMN y posteriormente en el espectrómetro (realizar estas operaciones rápidamente).
NOTA: Si no hay datos sobre la actividad enzimática era de esperar, ajustar el substrato a la enzima relación molar de 10: 1. Realizar una primera prueba y ajustar en consecuencia parala carrera real. - Realizar un calce automático rápido y utilizar el resto de los parámetros de los espectros de referencia.
- Iniciar la serie de la 2D intercalado 1 H-15 N y 1 H- 13 C espectros.
- Seguir la progresión de la reacción en tiempo real y dejar de adquisición cuando la reacción llega a su cumplimiento o un nivel deseado.
- espectros de proceso como antes con exactamente los mismos parámetros.
- Repita toda la ejecución mediante una orden de adquisición diferentes para los dos tipos de espectros de correlación. Si en el primer experimento una correlación 1 H-15 N fue por primera vez en la serie, empezar ahora con una correlación 1H-13C. Por esta y que tiene mismo tiempo de adquisición para los dos espectros, es posible trazar y comparar reacciones PTM en ambos histonas marcados con isótopos diferencialmente en la misma escala de tiempo. Además, es posible calcular los promedios y las barras de error trama.
NOTA: Una thorougDescripción h de las metodologías para el análisis de la señal de RMN y posterior cuantificación de las reacciones enzimáticas se puede encontrar aquí 19. - Seleccionar señales de RMN de cada espectro de RMN del curso del tiempo que informan de la progresión de la reacción y calcular sus intensidades de señal relativas usando un software de visualización y análisis de espectros de RMN. Haga esto para las señales que informan de la no modificada, así como el estado modificado. Extraer niveles de modificación.
- Colocar los valores calculados de niveles de modificación en función del tiempo de reacción.
Resultados
Octameric especies replegadas adecuadamente son aislados después de una carrera de la mezcla de la reconstitución través de una columna de filtración en gel (Figura 2). La piscina reconstituido octameric que contiene los tres tipos diferentes de octámeros se somete al esquema de purificación por afinidad en tándem. Las muestras se recogen a partir de todos los pasos y se analizaron por SDS-PAGE y posteriormente WB. La verificación de la correcta ejecución del protocolo que da como resultado el aislamiento de especies asimétricas se consigue después de la presencia de los dos marcadores de afinidad (His- y estreptomicina) en las diferentes muestras (Figura 3). Posteriormente, las etiquetas de afinidad se retiran después de la digestión con proteasas TEV (Figura 4). octámeros asimétricas dispuestas de etiquetas de afinidad se usan para reconstituir nucleosomas asimétricos. Inicialmente, un pequeño reconstitución prueba a gran escala se utiliza para determinar la relación molar óptima de ADN: octámero que resulta en un altoproducir formación de un complejo monodispersa. Posteriormente, se emplea la relación de mezcla optimizado para reconstituir los nucleosomas en una gran escala. Reconstituciones nucleosoma se analizan por la proteína / geles de ADN y la espectroscopía de RMN para el montaje correcto y la presencia de las histonas H3 hermanas marcados con isótopos diferencialmente respectivamente (Figura 5). Un ejemplo de aplicación se representa en la Figura 6. En particular, marcado isotópicamente diferencialmente y asimétricamente fosforilados en H3S10 nucleosomas se hacen reaccionar con Gcn5 acetiltransferasa, y la acetilación de H3K14 en ambas copias H3 se sigue en tiempo real por espectroscopía de RMN. El análisis revela que H3S10 fosforilación estimula H3K14 acetilación por Gcn5 en cis en comparación con en trans.

Figura 1: Diagrama de flujo para la preparación de diferencialmente Isótopos-labeled (y asimétricamente Modificado) Los nucleosomas. (A) La reconstitución y la afinidad de purificación de tándem diferencialmente octámeros histona marcada con isótopo (y de forma asimétrica modificada). (B) la reconstitución Nucleosoma combinando los octámeros asimétricos purificadas y una secuencia de ADN nucleosoma-posicionamiento. (C) RMN seguimiento de en-cis-trans y en la diafonía modificación después de mezclar los nucleosomas marcados con isótopos de forma asimétrica y modificados diferencialmente con enzimas modificadoras de histonas. Haga clic aquí para ver una versión más grande de esta figura.
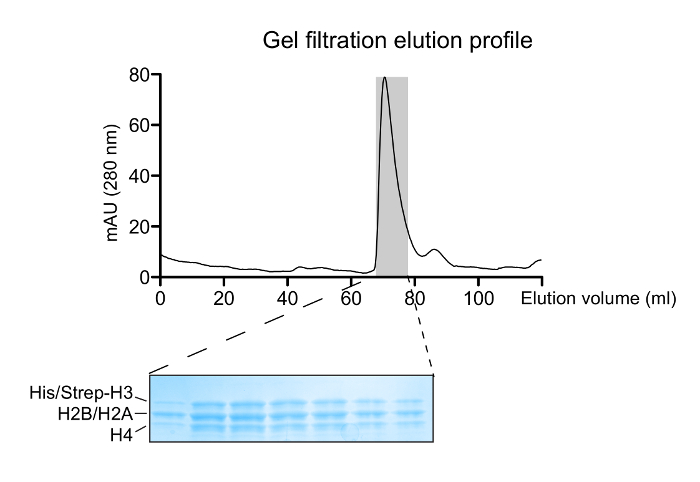
Figura 2: La reconstitución de las histonas octámeros. Un perfil de elución de filtración en gel de la mezcla de la histona replegada. El pico principal a ~ 70 ml corresponde a los octámeros histonas. A 14 - 20% gel de gradiente de SDS-PAGE (tinción con azul Coomassie) de las fracciones eluidas correspondientes al pico octámero muestra la estequiometría de la histona correcta. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Purificación de la histona asimétricas octámeros. gel de gradiente de 14-20% de SDS-PAGE (tinción de Coomassie) y el Banco Mundial en contra de las etiquetas de afinidad His- y estreptomicina de las muestras de las diferentes etapas del esquema de purificación por afinidad en tándem. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: La eliminación de las etiquetas de afinidad. 18% de gel de SDS-PAGE (tinción de Coomassie) de octámeros histonas asimétrica purificados antes y después de la mezcla con la proteasa TEV. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Bioquímica y NMR Caracterización de los nucleosomas marcado con isótopos diferencialmente. (A) 6% de gel de ADN-PAGE nativa (tinción de bromuro de etidio) de una reconstitución nucleosoma pequeña prueba a gran escala usando diferentes relaciones molares de DNA: octámero (izquierda). gel de 6%-PAGE nativa de ADN (tinción de bromuro de etidio) la reconstitución de un nucleosoma a gran escala usando el ADN optimizada: octámero relación molar (a la derecha). (B) 18% de gel de proteína de SDS-PAGE (tinción de Coomassie) de los nucleosomas reconstituidas muestra la estequiometría correcta de las cuatro histonas del núcleo. (C) 1 H-15 N espectro SOFAST-HMQC de la copia H3 15 N-etiquetado de los nucleosomas marcados con isótopos diferencialmente (sólo H3 residuos de cola son visibles - el núcleo de la proteína es invisible debido a la tasa de volteo lenta). (D) 1 H-13 C HSQC espectro de la copia H3 13 C-etiquetado de los nucleosomas marcados con isótopos diferencialmente. Haga clic aquí para ver una versión más grande de esta figura.
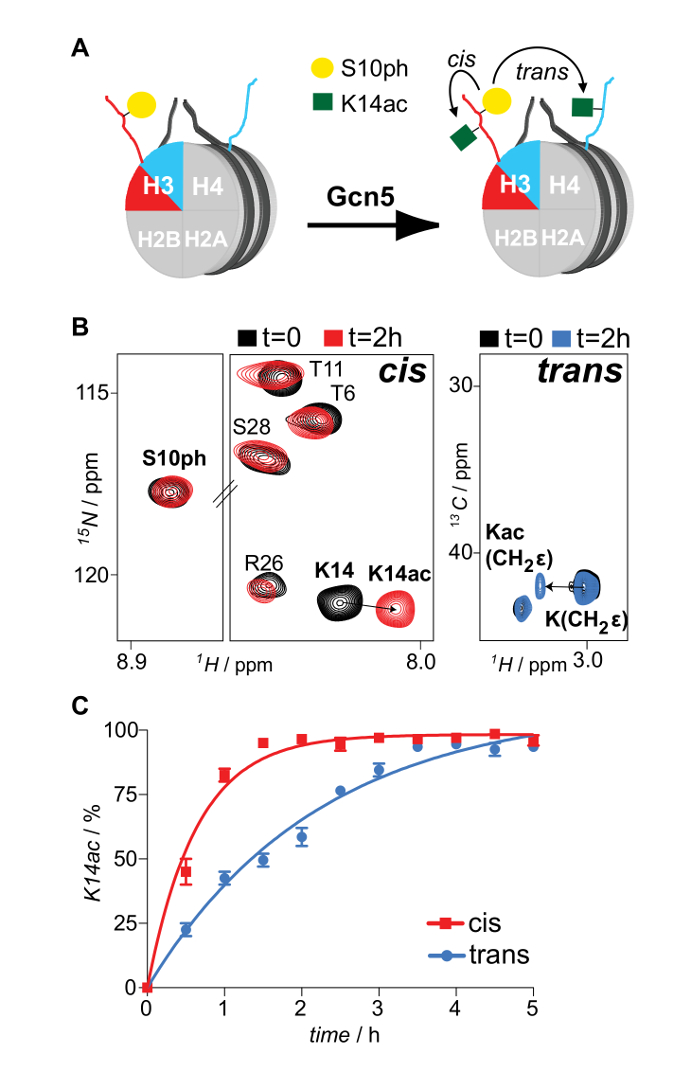
Figura 6: Seguimiento de RMN en cis y en trans Modificación de diálogo transversal asimétrica impuesto por fosforilación de H3S10 en la acetilación H3K14 Actividad de Gcn5 acetiltransferasa. (A) Representación esquemática de diferencialmente marcados con isótopos y asimétricamente fosforilada en H3S10 nucleosomas reaccionaron con Gcn5 acetiltransferasa y la cartografía de la acetilación de H3K14, en cis y en trans. (B) 1 H-15 N-SOFAST HMQC y 1 H- 13 C espectros HSQC (regiones seleccionadas) de los nucleosomas asimétricos antes y después de la reacción con Gcn5. (C) de vigilancia RMN resuelta en el tiempo de H3K14 acetilación por Gcn5 en nucleosomas asimétricamente H3S10 fosforilados. Se muestran los promedios y la variación (barras de error) de dos experimentos independientes. Reproducido con permiso 16. Haga clic aquí para ver una versión más grande deesta figura.
Discusión
Para la reconstitución de nucleosomas, el protocolo actual utiliza un molde de ADN largo de 165 pb que contenía la secuencia de posicionamiento de nucleosomas 601-Widom 20, pero un rendimiento similar se espera que el uso de diferentes longitudes de moldes de ADN. El protocolo fue diseñado y emplea el uso de tipos asimétricas de la histona H3. Con el mismo principio, el método se puede aplicar también para los otros histonas del núcleo y, además, puede ser utilizado para reconstituir los complejos que llevan dos histonas de núcleo distintos con diferentes etiquetas de isótopos. El protocolo puede ser también ligeramente modificado para reconstituir inicialmente histonas sub-complejos y no histona directamente octámeros. Después de esta modificación, tetrámeros H3-H4 asimétricos pueden reconstituirse mediante el empleo de la misma esquema de purificación tándem. Este último se mezclan con dímeros H2A-H2B reconstituidas por separado y el ADN para ensamblar nucleosomas 16. Los rendimientos finales y el rendimiento global de la protoc modificadool son similares a la original.
El protocolo es fuertemente dependiente de la capacidad de las dos columnas de afinidad para unirse de manera eficiente las especies en cuestión y por lo tanto para producir al final los complejos asimétricos de alta pureza. Es engorroso para proporcionar una prueba directa y concreta que el complejo purificado final es de hecho y sólo asimétrica. Sin embargo, el análisis del BM muestras de todas las etapas de purificación con los anticuerpos relevantes proporciona indicaciones fiables para el éxito del esquema de purificación tándem (Figura 3). Los mismos resultados, y por lo tanto garantías adicionales, se obtuvieron mediante el análisis de las mismas muestras para la presencia de los marcadores de afinidad por métodos de RMN 16. Aún así, si el análisis del Banco Mundial revela que la contaminación de las especies asimétricas con los simétricos, una pequeña variación puede ser aprobada en la primera etapa de purificación (Ni-NTA) que puede mejorar el resultado. En particular, en lugar de una elución isocrática, un gradien imidazol t de elución (10 a 250 mM) y se puede emplear entonces, sólo se agruparon las primeras fracciones de elución que están altamente enriquecidas en las especies asimétricos y ejecutar a través de la columna de afinidad. Esto se puede evaluar por análisis WB de las fracciones de elución de la presencia de la etiqueta de afinidad por estreptococos.
La selección del isótopo de la etiqueta en relación con la PTM de interés es más bien flexible, ya que para la mayoría de los casos, RMN es capaz de asignar el mismo PTM utilizando tanto 1 H- 15 N y 1 H- 13 espectros Ccorrelation. Sin embargo, para ciertos aminoácidos, como lisinas, la dispersión del desplazamiento químico de las resonancias 1 H- 13 laterales de cadena C es bastante limitado. Además, cuando los sitios diana de una enzima lisina modificadores son desconocidos, lectura de salida específica de sitio de lisina PTM no es sencillo. En estos casos, los métodos alternativos emplean 13 C-etiquetado selectiva de sitio, combinada con la producción de la histona semi-sintético"> 21 o el uso de secuencias de pulsos de RMN de nueva creación que permite la detección específica de estados de modificación a través de la excitación selectiva rutinas 22. Espectroscopía de RMN confiere más bien baja sensibilidad. En este sentido, se necesitan cantidades relativamente altas de nucleosomas (rango mu M) para llevar a cabo la reacciones enzimáticas. Esto evita que la evolución del método a una configuración de alto rendimiento.
Al mismo tiempo, un nuevo método químico ha sido introducido para la síntesis de los nucleosomas químicamente puros, asimétricamente modificados, con altos rendimientos, llevando definido PTM 23. Este enfoque ha sido utilizado, en combinación con fluorografía, para estudiar los mecanismos de diafonía PTM. Debido a la capacidad de baja resolución de los métodos de fluorografía en la detección de PTM, las conclusiones se derivaron indirectamente mediante la comparación de las actividades enzimáticas en general en un conjunto de nucleosomas que llevan diferentes combinaciones de PTM simétricos y asimétricos, en vezque por la observación directa de las reacciones PTM en los sitios correspondientes de cada una de las histonas hermana. Sin embargo, la incorporación de las histonas marcados isotópicamente y el uso de espectroscopía de RMN para PTM lectura podrían constituir el método antes mencionado una herramienta adicional para el análisis de PTM de alta resolución de los nucleosomas modificados de forma asimétrica.
En relación con la identificación de nuevos tipos de nucleosomas modificados de forma asimétrica en el futuro, el método actual pretende constituir una herramienta de alta resolución para el análisis de cis y trans en las reacciones de diafonía PTM sobre sustratos nucleosomal. En particular, de gran importancia es la decodificación de los mecanismos de diafonía que dan lugar a nucleosomas bivalentes 24 que contienen de forma asimétrica, ambos PTM transcripcionalmente activos y represivas.
Divulgaciones
The author has nothing to disclose.
Agradecimientos
El Dr. Philipp Selenko (FMP-Berlín) autor agradece a proporcionar un espacio laboratorio húmedo y la infraestructura para llevar a cabo experimentos y Deutsche Forschungsgemeinschaft (DFG) para financiar el trabajo a través de una beca de investigación (LI 2402 / 2-1).
Materiales
| Name | Company | Catalog Number | Comments |
| Guanidinium HCl | Applichem | A14199 | Use high quality Gu-HCl |
| Tris | Roth | 4855.2 | |
| DTT | Applichem | A1101 | |
| NaCl | VWR chemicals | 27810.364 | |
| EDTA | Roth | 8043.2 | |
| Na2H2PO4 | Applichem | A1046 | |
| NaH2PO4 | Applichem | A3902 | |
| Imidazole | Applichem | A1073 | |
| d-Desthiobiotin | Sigma | D1411 | |
| Ni-NTA Superflow | Qiagen | 1034557 | |
| Strep-Tactin Superflow | IBA | 2-1207-001 | |
| His-probe antibody | Santa Cruz | sc-8036 | |
| Strep-tactin conjugated HRP | IBA | 2-1502-001 | |
| Hi-Load 16/600 Superdex 200 pg | GE Healthcare | 28-9893-35 | |
| 6 - 8 kDa dialysis membrane | Spectrumlabs | spectra/por 1, 132650 | |
| 50 kDa dialysis membrane | Spectrumlabs | spectra/por 7, 132129 | |
| 10 kDa centrigugal filter unit | Merck Millipore | UFC901024 | |
| 30 kDa centrigugal filter unit | Merck Millipore | UFC903024 | |
| Solution-state NMR spectrometer | at least 500 MHz operating frequency, equipped with a triple-resonance cryoprobe | ||
| Buffer name | Component | ||
| Unfolding Buffer | 7 M Guanidinium HCl | ||
| 20 mM Tris, pH 7.5 | |||
| 10 mM DTT | |||
| Refolding Buffer | 10 mM Tris, pH 7.5 | ||
| 2 M NaCl | |||
| 1 mM EDTA | |||
| 2 mM DTT | |||
| Assay Buffer | 25 mM Na2H2PO4, pH 6.8 | ||
| 25 mM NaCl | |||
| 2 mM DTT |
Referencias
- Hansen, J. C. Conformational Dynamics of the Chromatin Fiber in Solution: Determinants, Mechanisms, and Functions. Annu. Rev. Biophys. Biomol. Struct. 31, 361-392 (2002).
- Clapier, C. R., Cairns, B. R. The Biology of Chromatin Remodeling Complexes. Annu. Rev. Biochem. 78, 273-304 (2009).
- Musselman, C. A., Lalonde, M., Cote, J., Kutateladze, T. G. Perceiving the epigenetic landscape through histone readers. Nat. Struct. Mol. Biol. 19 (12), 1218-1227 (2012).
- Suganuma, T., Workman, J. L. Signals and Combinatorial Functions of Histone Modifications. Annu. Rev. Biochem. 80, 473-499 (2011).
- Lee, J. S., Smith, E., Shilatifard, A. The Language of Histone Crosstalk. Cell. 142 (5), 682-685 (2010).
- Liokatis, S., et al. Phosphorylation of histone H3 Ser10 establishes a hierarchy for subsequent intramolecular modification events. Nat. Struct. Mol. Biol. 19 (8), 819-823 (2012).
- Voigt, P., et al. Asymmetrically Modified Nucleosomes. Cell. 151 (1), 181-193 (2012).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nat. Struct. Mol. Biol. 18 (1), 91-93 (2011).
- Huang, H., Lin, S., Garcia, B. A., Zhao, Y. Quantitative Proteomic Analysis of Histone Modifications. Chem. Rev. 115 (6), 2376-2418 (2015).
- Liokatis, S., Dose, A., Schwarzer, D., Selenko, P. Simultaneous Detection, of Protein Phosphorylation and Acetylation by High-Resolution NMR Spectroscopy. J. Am. Chem. Soc. 132 (42), 14704-14705 (2010).
- Binolfi, A., et al. Intracellular repair of oxidation-damaged α-synuclein fails to target C-terminal modification sites. Nat. Commun. 7, 10251 (2016).
- Schanda, P., Kupce, E., Brutscher, B. SOFAST-HMQC experiments for recording two-dimensional heteronuclear correlation spectra of proteins within a few seconds. J. Biomol. NMR. 33 (4), 199-211 (2005).
- Theillet, F. X., et al. Cell signaling, post-translational protein modifications and NMR spectroscopy. J. Biomol. NMR. 54 (3), 217-236 (2012).
- Dyer, P. N., et al. Reconstitution of Nucleosome Core Particles from Recombinant Histones and DNA. Methods Enzymol. 375, 23-43 (2004).
- Artimo, P., et al. ExPASy :SIB bioinformatics resource portal. Nucleic Acids Res. 40 (W1), 597-603 (2012).
- Liokatis, S., klingberg, R., Tan, S., Schwarzer, D. Differentially Isotope-Labeled Nucleosomes to Study Asymmetric Histone Modification Crosstalk by Time-Resolved NMR Spectroscopy. Angew. Chem. Int. Ed. 55 (29), 8262-8265 (2016).
- Stützer, A., et al. Modulations of DNA Contacts by Linker Histones and Post-translational Modifications Determine the Mobility and Modifiability of Nucleosomal H3 Tails. Mol. Cell. 61 (2), 247-259 (2016).
- Zhou, B. R., et al. Histone H4 K16Q Mutation, an Acetylation Mimic, Causes Structural Disorder of Its N-terminal Basic Patch in the Nucleosome. J. Mol. Biol. 421 (1), 30-37 (2012).
- Theillet, F. X., et al. Site-specific NMR mapping and time-resolved monitoring of serine and threonine phosphorylation in reconstituted kinase reactions and mammalian cell extracts. Nat. Protoc. 8 (7), 1416-1432 (2013).
- Lowary, P. T., Widom, J. New DNA sequence rules for high affinity binding to histone octamer and sequence-directed nucleosome positioning. J. Mol. Biol. 276 (1), 19-42 (1998).
- Hackenberger, C. P., Schwarzer, D. Chemoselective ligation and modification strategies for peptides and proteins. Angew. Chem. Int. Ed. 47 (52), 10030-10074 (2008).
- Theillet, F. X., et al. Site-specific mapping and time-resolved monitoring of lysine methylation by high-resolution NMR spectroscopy. J. Am. Chem. Soc. 134 (18), 7616-7619 (2012).
- Lechner, C. C., Agashe, N. D., Fierz, B. Traceless Synthesis of Asymmetrically Modified Bivalent Nucleosomes. Angew. Chem. Int. Ed. 55 (8), 2903-2906 (2016).
- Bernstein, B. E., et al. A bivalent chromatin structure marks key developmental genes in embryonic stem cells. Cell. 125 (2), 315-326 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados