Method Article
細胞外マトリックスを視覚化するために浸軟組織の電子顕微鏡をスキャンします
要約
Shown here is a method for visualizing extracellular matrix ultrastructure in decellularized cardiac tissues.
要約
Fibrosis is a component of all forms of heart disease regardless of etiology, and while much progress has been made in the field of cardiac matrix biology, there are still major gaps related to how the matrix is formed, how physiological and pathological remodeling differ, and most importantly how matrix dynamics might be manipulated to promote healing and inhibit fibrosis. There is currently no treatment option for controlling, preventing, or reversing cardiac fibrosis. Part of the reason is likely the sheer complexity of cardiac scar formation, such as occurs after myocardial infarction to immediately replace dead or dying cardiomyocytes. The extracellular matrix itself participates in remodeling by activating resident cells and also by helping to guide infiltrating cells to the defunct lesion. The matrix is also a storage locker of sorts for matricellular proteins that are crucial to normal matrix turnover, as well as fibrotic signaling. The matrix has additionally been demonstrated to play an electromechanical role in cardiac tissue. Most techniques for assessing fibrosis are not qualitative in nature, but rather provide quantitative results that are useful for comparing two groups but that do not provide information related to the underlying matrix structure. Highlighted here is a technique for visualizing cardiac matrix ultrastructure. Scanning electron microscopy of decellularized heart tissue reveals striking differences in structure that might otherwise be missed using traditional quantitative research methods.
概要
Fibrosis disrupts the normal myocardial collagen network, which is critical for normal mechanistic functions of cardiomyocytes 1,2 as well as for inter-cellular communication, intracellular signaling, and cell survival 3. The development of fibrosis is a major determinant of cardiac function, and fibrotic remodeling of the cardiac interstitium arising from a variety of etiologies leads to increased left ventricular stiffness and diastolic dysfunction 4. Myocardial fibrosis may also lead to arrhythmias, and whether the progression of fibrotic remodeling is a general or local phenomenon, it is highly associated with a poor prognosis in patients with ischemic and non-ischemic cardiomyopathy 5. Likewise, the absence of myocardial fibrosis is a strong predictor of ventricular functional recovery and long-term survival 6.
The hallmark of fibrosis is the deposition of excess collagen, which has the tensile strength of steel 7 and can adversely affect cardiomyocyte function on multiple levels. Mechanical forces resulting from an excessively collagenous matrix can lead to cardiomyocyte atrophy 8,9, passive tissue stiffness 10, tonic contraction-induced myocardial stiffness 11-13, and reduced delivery of oxygen to the remaining population of cardiomyocytes. Gap junction coupling of cardiomyocytes and myoFbs can also compromise the heart's electrical characteristics, creating a greater risk for the development of arrhythmias 14-16. Perivascular fibrosis alters vasomotor reactivity of intramural coronary arteries and arterioles 17 and contributes to luminal narrowing that reduces the supply of oxygen and thus the survival of cardiomyocytes 17-22. Pathogenic fibrotic and electrical remodeling, emanating from an initial site of ischemic injury or energy imbalance, inevitably progresses to heart failure.
Cardiomyocyte necrosis initiates the fibrotic response, and subsequent adverse fibrotic remodeling can occur irrespective of etiology. Finding a way to control cardiac fibrosis would be clinically beneficial for the treatment of ischemic and idiopathic cardiomyopathies, hypertensive heart disease, hypertrophic cardiomyopathy, valvular heart disease and dystrophinopathies 23-42. Regardless of how the fibrotic disease process begins, soluble, profibrotic factors can cross the interstitial space and provoke activation of interstitial and adventitial fibroblasts at sites remote to the initial fibrotic scar, creating a cascade effect that ultimately leads to heart failure. The optimum scenario would be to exploit the fibrillogenic process using a targeted therapeutic that can be applied during the compensative hypertrophic stage of cardiomyopathy before it progresses to systolic pump failure, diastolic heart failure, or other end-stage outcomes. The ultimate goal would be to reverse fibrosis so that dead cardiomyocytes can be replaced and heart function restored completely.
The importance of the matrix is widely understood, yet methods to study the matrix are limited mainly to quantitative measurements of major structural components, particularly collagen, and relative levels of different matrix and matricellular proteins. This protocol highlights a rarely used technique that is useful for assessing qualitative differences in the cardiac matrix. This technique has been recently used to compare and contrast fundamental differences in heart matrices from different etiologies of heart disease (in human explants), to examine hearts from post-infarcted pigs treated with the glial growth factor (GGF) isoform of neuregulin-1β, relative to untreated animals 43, and to probe for differences in the matrices of cardiac tissues from mdx mice (a commonly used animal model of Duchenne Muscular Dystrophy) at different ages and compared to wild-type controls. This technique was first introduced by Drs. Caulfield and Borg in 1979 44, but few studies have since employed this powerful technique 45-47, re-introduced here with only slight modification. This methodology is a valuable research tool, because it provides qualitative information about extracellular matrix ultrastructure that might otherwise be overlooked when simply measuring matrix component content and/or level of fibrosis.
プロトコル
倫理文:動物取扱プロトコルはヴァンダービルト施設内動物管理使用委員会(IACUCによって承認されたが数M / 117分の10(豚)とM / 219分の10(マウス)プロトコルとAAALACインターナショナルの基準に従って行いました。バンクヒト心筋組織の使用法は、ヴァンダービルト大学医療センターIRB(プロトコル番号100887)によって承認されました。
1.サンプルの収集と保管
- 0.1Mリン酸緩衝液(PB)溶液中の新鮮な4%グルタルアルデヒドを行います。
注意:グルタルアルデヒドは毒性があり、ヒュームフード内で手袋や作業を着用してください。- 千ミリリットルのdH 2 Oに21.8グラムの Na 2 HPO 4および6.4グラムののNaH 2 PO 4。 量子サティス (適量)を使用して、PB、pH7.4の0.2Mの原液を作ります
- PBストック溶液の2.5ミリリットルと2.1ミリリットルのdH 2 Oに50%グルタルアルデヒドの400μLを追加
- 2 cより(も大きくチャンクを浸していません4%グルタルアルデヒド溶液中に組織のM 2)。注:より小さな断片も使用することができるが、簡単にプロトコルの後工程を容易にするために、眼によって視覚化されるのに十分なサイズ(無5mm未満2)であるべきです。
- 4℃で無期限に保存した後、1時間室温でインキュベートします。
心臓組織の脱細胞化2。
- 10gのNaOHペレット/ 100mlでのdH 2 Oを用いて新鮮な10%NaOH水溶液を加えます
注意:NaOHのソリューションは、腐食性であり、アルカリ火傷を引き起こす可能性があり、手袋を着用してください。 - dH 2 Oに組織をすすぎます
- (オフホワイトや白に赤茶色から組織変化まで)10日 - 6のために室温で10%NaOH溶液中でインキュベートします。
- 組織が 透明になるまでの dH 2 Oですすいでください。
- 室温で4時間、1%タンニン酸で組織を浸し。 4ミリリットルのdH 2 Oあたり1ミリリットル5%原液を使用して
注意:タンニン酸強い刺激で、手袋を着用してください。 - 一晩のdH 2 Oですすいでください。
3.オスミウム酸染色法と(安全のためのドラフトチャンバー内)心臓組織の脱水
- 21.4グラムのカコジル酸ナトリウム、10.0グラムの塩化カルシウムと450ミリリットルのdH 2 Oを使用してカコジル酸ナトリウム緩衝液の0.2Mの原液を作りますpHを7.4に調整するために必要な混合物は、その後、塩酸を加える。Qsを500 mlまでのdH 2 Oで
注意:ナトリウムカコジル酸および塩酸がヒュームフードに手袋や作業を着用し、有毒です。 - 50ミリリットルのdH 2 O中に1グラム四酸化オスミウム結晶を溶解することにより、安全性のためのヒュームフード内で四酸化オスミウムの2%水性原液を作ります
注意:四酸化オスミウムが厳しい吸入の危険性です。粘膜や眼球の蒸気固定が可能であり、それゆえにのみ手袋とドラフト内で取り扱います。スプラッシュガードをお勧めします。 - dHで1:(原液1を混ぜ、0.1Mカコジル酸ナトリウム緩衝液中で組織をすすぎます 2 O))。
- 3バッファリンス、合計二回前の手順を繰り返します。
- 回転子に1時間:(1株カコジル酸ナトリウムおよび株式四酸化オスミウム1を混ぜる)、0.1Mカコジル酸ナトリウム緩衝液中の1%四酸化オスミウムで組織を浸し。
- 0.1 Mカコジル酸ナトリウム緩衝液中で回転体上で5分間、3回組織をすすぎます。
- ローテーター上で15分ごとに、エタノールの増加濃度(30%、50%、75%、85%、95%、および最終的に100%)を用いて組織をすすぎます。
SEM 4.断面表面の準備
- また、100%のエタノールを含む浅いペトリ皿に100%エタノール中に組織を移します。
- 両側の平坦部が互いに接触していると、切刃が試料上等辺三角形の二辺を形成するように交差するように2つの非常に鋭利なカミソリ刃を保持します。これを達成するために、試料の右端側つのブレードを配置するために左手を使用してカットが左方向。同時に、これまでのサンプルとスライス右方向の左側の2番目のブレードを配置するために右手を使用しています。このように、ブレードは、単一の滑らかなカットを作るために、反対方向から互いに対してスライドさせることになります。
- 好ましくは、試料を損傷することなく、可能な限り大きな表面積を露出し、最小限の歪みや引き裂く力で試料の非常にきれいにカットを作るためにお互いに対してフラットブレード側面をスライドさせます。
- SEMでの検査のために可能な限りクリーンな断面の表面を露出するために、各試験片について、この手順を繰り返します。
心臓組織の5臨界点乾燥(CPD)
- 組織は常に100%エタノールに残っていることを確認して、臨界点乾燥機(CPD)のサンプルホルダーに組織を転送するためにへらやピンセットを使用してください。ホルダーをエタノールに浸漬し、転送は数秒を超えない空気に露出した組織で達成されていることをされていることを確認してください。
- 私たち当たりのCPDを操作液体二酸化炭素とエタノールを置き換えるために3パージ・アンド・フィルサイクルを完了するために、小胞体のマニュアル。
- サンプルの臨界点乾燥を達成し、CO 2の制御されたガス抜きで大気圧に戻すことユーザーズマニュアル当たりのCPDを操作します。
SEMのための心臓組織標本の6取付
- アルミスタブの上面にカーボン接着剤タブを付着させることにより、各検体のためのSEMの試料スタブを準備します。
- 実体顕微鏡の助けを借りて、慎重に関心の断面表面が(離れてタブから、目に見える)上に向けて接着剤タブに試料を付着し、サンプルのスタブ表面の平面に平行にできるだけ近いです。プローブまたは関心の表面に触れないでください。
- ペイントアプリケーションのための理想的な、テーパー状のブラシを達成するために木製のアプリケータースティックを破ります。スタブへの密着性を向上させるために、ベースと試料の側面に銀やカーボン塗料を適用します。
- 地面に目的物の表面からの電荷の経路を提供するために、関心の表面の端部に銀やカーボンペイントまでの非常に細い線を拡張します。
- 地面にこのように金属スタブの炭素タブ表面から導電性経路を提供するために、炭素タブの周囲に銀やカーボン塗料の2または3小さな描点を適用し、。
- 導電性塗料は2時間乾燥することができます。
- 金 - パラジウム合金または金の - 比較的重いコーティング(40〜30nm程度の目標範囲)を適用するユーザのマニュアルあたりのスパッタコーターを操作します。約0.1ミリバールに試料室ポンプ。 40秒にタイマーを設定します。 8時位置(中程度のアルゴンガス流量)にオープンセットバルブ。 Startを押し30mAでスパッタコーティングを開始します。パープルグロー放電は、試料室に表示されるはずです。
ハートの組織標本の7 SEM検査
- イメージングpを最小にするために比較的低加速電圧での走査型電子顕微鏡を行いますサンプル(充電)に乏しい電荷散逸に関連したroblems。推奨初期撮像条件である:加速電圧が5kV、10ミリメートル作動距離。
- 経験豊富なオペレータの支援を受けて、採用は、z次元でかなりの長さのために延びた複数の焦点面における繊維、または繊維のフォーカスを必要とする撮影条件で被写界深度を拡張するために作動距離の増加しました。
- ここで使用される顕微鏡のためのユーザインタフェースへのアクセスで、右上の[ナビゲーション]タブを( 材料の表を参照してください)。
- ステージ]メニューから[座標]タブにアクセスします。 、作動距離を増加させるZ座標のためのミリメートルで、より大きな値を入力するには、次に入力された作動距離に試料ステージを移動するタブに移動をクリックします。
- 経験豊富なオペレータの支援を受けて、電子ビームに関心直交の表面を配置するために、試料の傾きや回転を採用しています。 10〜30 DEGRの追加の傾きEESこの位置からマトリクス構造の観察やドキュメントを改善することができます。
- フォーカスされた作動距離に注意して、ここで使用される顕微鏡のために、( 材料の表を参照)ユーザーインターフェイスで、関心の調製された表面面の外周付近の標本を集中するために、その後、左または右にスライドをクリックし、マウスの右ボタンを押したまま。
- 表面の反対側の端部付近に移動し、フォーカスを繰り返すマニュアルユーザーインターフェースのジョイスティックで移動します。作動距離が第一の位置にほぼ等しくない場合には、傾斜試料を(7.2を参照)、Tにおける傾き値が座標入力ステージメニューの座標タブを使用して、両方の場所に近似合意を達成します。
- 試料を90度回転(フィールド座標Rに値を入力します)と、すべての位置はほぼ同じ作動距離に集束されるまで、プロセスを繰り返します。
注:可変圧力SEMは、電荷散逸を改善するために使用することができます可能な場合は。高真空走査電子顕微鏡のための標準的な動作モードです。
結果
強調表示された技術は、ブタから未使用のヒト心臓移植ドナーからの心臓組織( 図1)は 、移植レシピエントからの外植組織を、野生型およびジストロフィーマウスの心臓( 図3)に、および心筋梗塞後の心臓サンプルにおいて適用されました心臓傷害のモデル( 図2)。 図1に示すように 、人間の心臓のマトリックスは、断面で見たときに、ハニカム状のパターンを表示する架橋されたタンパク質の複雑な織り方です。 図1の平面図を検討する際に各「ハニカム」構造は、通常、単一の筋細胞を回避し、約40μmの幅である。介在板で接続されたときに、いくつかの心筋細胞はメタファー「トンネル」を通って縦方向に実行されているロッドとして想定することができます三次元に拡張される。また、1ハイライト図切断工程( 図1、右上)の間に「強打」されたセクションよりも高い精度がより多くの啓示地形的なデータが得られると切断手順の重要性、( 図1、左上)。
常駐心臓細胞、血管、およびSEMの処理の前に、循環細胞の除去は、全体の心臓組織ブロックをSEMにより少ないかなりあろう追加の超構造の詳細が明らかに。各個々のコラーゲン「ストラット」は、例えば( 図1、下のパネル)が明らかに等間隔で整列しサルコメアを筋原線維に垂直です。この配置は、延伸に対して布体と形を維持するのに役立つ織物の「縦糸と横糸」に類似の収縮と弛緩のサイクルの間に及ぼされる反作用変形によって心臓構造を維持する助けにも適しています。
FO:= "1">キープtogether.withinページ
図1:未使用のヒトドナー心臓から得られた脱細胞化左心室組織における細胞外マトリックスの三次元配置の代表的な走査型電子顕微鏡写真は、上の2つのパネルは、低倍率(バー= 500μm)とで断面の行列を示します正常なヒト心臓組織のアーキテクチャの空中写真を提供します。より高い倍率では、人はよりよい規則的な間隔の筋線維(中央左と右のパネルバー=100μmから50μmで、それぞれ)のための機械的支持を提供支え繊維の典型的なハニカム状の構造を観察することができます。精密検査の際に、それぞれの「ハニカム」居住者心筋細胞(底がそれぞれ、= 10ミクロンと5ミクロンを左と右のパネルバー)に垂直に互いにしばらくと並行して編成された繊維で構成されています。ttps://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/54005/54005fig1large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
構造情報の提供に加えて、脱細胞化組織のSEMは、心筋の損傷又は非有害な形態に応じて、細胞外マトリックスの変化の意味のある、定性的評価を可能にすることができます。例えば、この技術は、最近後梗塞ブタ心臓組織43の細胞外マトリックスを調べました。この大動物実験の過程で、心臓マトリックスの変化を打つ呈し、心不全、静脈内NRG-1β投与した後の梗塞豚のための潜在的な治療として、NRG-1βのGGF2アイソフォームの有効性を評価するために特別に設計されました、ポスト梗塞動物の未処理の心臓組織に比べ。これらの結果は、その後、43を発表し、TEましたchniqueはこの最初の、偶然の発見時に構築するための貴重なツールとなってきた。 図2は、未処理とNRG-1βで処理した行列間の抜本的な行列の違いを強調表示し、その研究の過程で生成され例の顕微鏡写真を含みます。
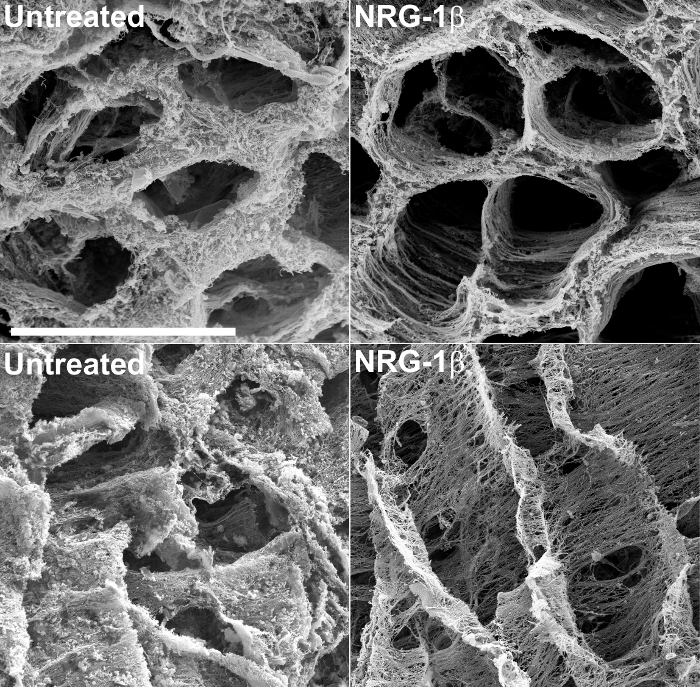
図2:未処理及びNRG-1β -処置豚 における左心室細胞外マトリックスの代表的な走査型電子顕微鏡写真は 、NaOHのマセラシオン後 、断面がマトリックスは、未処理、心筋梗塞後における繊維の定期的な空間的配置を強調(MI後)豚(左上)、(右上)、MI後NRG-1βで処理した動物と比較。経度で表示すると、未処理のブタにおけるマトリックスは、NRG-1βで処理した豚の行列に対し、厚く、マット状の外観(左下)を示します繊維の定期的な空間的配置(右下)が表示されます。ホワイトバー=40μmの(すべての4つのパネル)。より詳細な結果および図面は、関連原稿43に含まれている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ジストロフィーの心の中に起こるマトリックスの変化の探査もデュシェンヌ型筋ジストロフィーの心筋症(DMD)の動物モデルの進行と開発に定性的な洞察をもたらしました。 mdxマウス、DMDの一般的に使用されるマウスモデルでは、野生型および固定及びNaOH処理後のSEMによって観察MDX心間で有意な年齢依存性の違いがあります。 図3に示すように 、マトリックス成 分は、正常マウスに機能的なジストロフィンを相対的に欠く6週齢のmdx心臓比較的正常でした。もっとint型eresting、細胞外マトリクス組織は、心臓内のDMDの進行性の性質を示す、明確に破壊または若いmdxマウスと比較して、古いジストロフィン欠損マウスでは、おそらく劣化しました。 mdxマウスは、それらが多くのより穏やかな心筋症の表現型とDMD 48を有するヒトよりも遅い死亡率を示すという事実に人間のDMD心筋症の不十分代表的なものであるため、このような深遠な違いは、予想されませんでした。これは、心臓機能の小さな変化が本稿で示さ可視化技術を使用してキャプチャすることができることを示唆しています。この方法論はまた、全く現在、同様に利用可能な線維症を標的とする治療法が存在しないいる他の器官の細胞外マトリックス、に容易に適合すべきです。

図3:左ヴェンの代表的な走査型電子顕微鏡写真mdx マウス 対野生型tricular細胞外マトリックスは 、野生型マウスにおける左心室心臓マトリックス(上部パネル)は、他の種で観察されたものと同様です。外観(中央のパネル)で、わずかに「ふわふわ」が、生後6週でmdxマウスにおけるマトリックスは、比較的正常に見えます。逆に、より古いmdxマウスの心臓のマトリックスは、ジストロフィープロセスは定性的に固定、NaOHを、浸軟組織におけるSEMを用いて捕捉され得ることを示す(下のパネル)激しく変性現れます。ホワイトバー=10μmの(すべての3つのパネル)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
クロスセクションの表面調製は、プロトコル中に最も重要なステップです。臨界点乾燥工程に導入されるまで、微細構造を維持するために、脱水標本はすべての回で100%エタノールのままでなければなりません。標本は浅い皿にエタノールに浸されている間そこでEM検査のための表面を達成するための検体のスライスを行わなければなりません。露出面に触れたり、その後の取り扱い中にプローブされていないことも重要です。プロトコルのSEM部は関係なく、サンプル起源の基本的な電子顕微鏡のトラブルシューティングが必要な場合がありますが、重大な修正は、同様の行列観測のための他の組織タイプへのこの技術の適用のために予想されていません。繊維状のサンプルから収集した画像は、貧しい電荷散逸(「充電」)によって導入されたアーティファクトを起こしやすいです。充電の問題は、通常、走査速度を増加させる、加速電圧(別名滞留時間を減少させることによって最小化することができます)電子ビームのスポットサイズを小さくします。いくつかのスキャンの統合が遅くなり、より高品質な単一のスキャン画像内に存在する電荷アーティファクトなしでノイズの品質に匹敵する信号の画像を生成するチャージアーチファクトを回避するのに十分に迅速に収集しました。
この技術は、本質的に定性的であり、したがって、可視化の構造的な違いは、種々の発生または疾患状態に関連するかもしれない方法を確認するために( 例えば 、マッソンの三重またはpicoseriusレッド染色、ヒドロキシプロリン含量の測定、質量分析およびRNASeq)定量的測定と一緒に考えたときに補完します。細胞外マトリックスは、体内のほとんどすべての器官の必須成分であるため、この制限にもかかわらず、この方法は、特に心臓の線維症を超えて重要です。心臓では、心臓マトリックスは、ストレッチ複合体によって特徴付けられる連続ポンピングのための重要な機械的支持を提供ひねり、およびデフ人間の平均寿命にわたって発生> 25億ビートのための酸素と脱酸素化血液49の最適なエントリや流出を与えるormation、。心臓組織の極めて低い再生能力を考えると、文脈のニーズに応じて改造することができますダイナミック行列は論理的な意味があります。想像力のわずかな伸びで、一つの有害な線維症を制限しながら、治癒過程を強化するために、マトリックスのリモデリングを操作するための治療標的が存在することが推測かもしれません。最低でも実証された技術の適用は、心臓マトリックスの精巧さと美しさを紹介し、そうすることで、さらにその機能的重要性を強調しています。
定量的な測定値は、実質的にすべての実験的研究の評価のコア原則であるが、技術は、ここで強調表示されただけでなく、標準的な行列の測定を補完する定性的超微細構造の変化を明らかにするために使用することができしかし、質的な変化を強調する基本的な生化学的変化を理解するための代替調査パスを示唆している可能性があります。この技術の予想される将来のアプリケーションは、マトリックスの変化が疾患プロセスの構成要素であるため、他の臓器を研究するための心疾患モデルとマトリックスの変化を評価するための補完的なツールとしてのヒト組織における使用、ならびに広く使用されています。
開示事項
The authors have nothing to disclose.
謝辞
This study was funded by grants from the National Institutes of Health (NIH), Heart, Lung, and Blood Institute (NIHLB): K01-HL-121045, K08-HL-094703, 5T32HL007411-35, P20 HL101425, U01 HL100398.
Imaging and tissue processing (after NaOH maceration) were performed through the use of the Vanderbilt University Medical Center (VUMC) Cell Imaging Shared Resource (CISR) (supported by NIH grants CA68485, DK20593, DK58404, DK59637 and EY08126). We are especially grateful to the VUMC CISR core directors (Dr. Sam Wells and Dr. W. Gray (Jay) Jerome) for valuable technical advice and also for providing core space and resources for the purposes of filming the technique highlighted in this paper.
We would like to extend our deepest appreciation to Dr. Yan Ru Su and Ms. Kelsey Tomasek in the Cardiology Core Lab for Translational and Clinical Research at Vanderbilt University for providing technical expertise and for collecting human tissue samples used in this study.
資料
| Name | Company | Catalog Number | Comments |
| Calcium Chloride | Electron Microscopy Sciences | 12340 | 100 g |
| Carbon Adhesive | Electron Microscopy Sciences | 12664 | 30 g |
| Carbon Adhesive Tabs | Electron Microscopy Sciences | 77825 | order to fit stubs |
| Double Edge Razor Blades Stainless Steel | Ted Pella, Inc | 121-6 | 250/pkg |
| Ethanol | Electron Microscopy Sciences | 15055 | 450 ml |
| Gluteraldehyde, 50% Solution | Electron Microscopy Sciences | 16310 | EM grade, distillation purified |
| Hydrochloric Acid | Electron Microscopy Sciences | 16760 or 16770 | 100 ml |
| Monosodium Phosphate NaH2PO4 | Sigma-Aldrich | S9251-250G | 250 g |
| Osmium Tetroxide | Electron Microscopy Sciences | 19100 | 1 g |
| Silver Conductive Adhesive | Electron Microscopy Sciences | 12686-15 | 15 g |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S8045-1KG | 1 kg |
| Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S3264-500G | 500 g |
| Tannic Acid, 5% Aqueous | Electron Microscopy Sciences | 21702-5 | 500 ml |
| Trihydrate Sodium Cacodylate | Electron Microscopy Sciences | 12300 | 100 g |
| Gold-palladium Alloy or Gold | Refining Systems, Inc. | varies | specific to the sputter coater make and model |
| Critical Point Dryer | Electron Microscopy Sciences | 850 | |
| Plain Wooden Applicators | Fisher Scientific | 23-400-102 | |
| Quanta 250 Environmental SEM | FEI | Q250 SEM | |
| Sputter Coater | Cressington Scientific Instruments Ltd. | Model 108 | |
| Alluminum SEM Sample Stubs | Electron Microscopy Sciences | 75220-12 | specific to the miscroscope |
参考文献
- Robinson, T. F., Cohen-Gould, L., Factor, S. M., Eghbali, M., Blumenfeld, O. O. Structure and function of connective tissue in cardiac muscle: collagen types I and III in endomysial struts and pericellular fibers. Scanning Microsc. 2, 1005-1015 (1988).
- Robinson, T. F., Geraci, M. A., Sonnenblick, E. H., Factor, S. M. Coiled perimysial fibers of papillary muscle in rat heart: morphology, distribution, and changes in configuration. Circ Res. 63, 577-592 (1988).
- Lunkenheimer, P. P., et al. The myocardium and its fibrous matrix working in concert as a spatially netted mesh: a critical review of the purported tertiary structure of the ventricular mass. Eur J Cardiothorac Surg. 29 Suppl 2, S41-S49 (2006).
- Wu, K. C., et al. Late gadolinium enhancement by cardiovascular magnetic resonance heralds an adverse prognosis in nonischemic cardiomyopathy. J Am Coll Cardiol. 51, 2414-2421 (2008).
- Kramer, C. M. The expanding prognostic role of late gadolinium enhanced cardiac magnetic resonance. J Am Coll Cardiol. 48, 1986-1987 (2006).
- Park, S., et al. Delayed hyperenhancement magnetic resonance imaging is useful in predicting functional recovery of nonischemic left ventricular systolic dysfunction. J Card Fail. 12, 93-99 (2006).
- Weber, K. T. Cardiac interstitium in health and disease: the fibrillar collagen network. J Am Coll Cardiol. 13, 1637-1652 (1989).
- Jalil, J. E., Janicki, J. S., Pick, R., Abrahams, C., Weber, K. T. Fibrosis-induced reduction of endomyocardium in the rat after isoproterenol treatment. Circ Res. 65, 258-264 (1989).
- Fidzianska, A., Bilinska, Z. T., Walczak, E., Witkowski, A., Chojnowska, L. Autophagy in transition from hypertrophic cardiomyopathy to heart failure. J Electron Microsc (Tokyo). 59, 181-183 (2010).
- Lopez, B., Querejeta, R., Gonzalez, A., Larman, M., Diez, J. Collagen cross-linking but not collagen amount associates with elevated filling pressures in hypertensive patients with stage C heart failure: potential role of lysyl oxidase. Hypertension. 60, 677-683 (2012).
- Gabbiani, G., Ryan, G. B., Majne, G. Presence of modified fibroblasts in granulation tissue and their possible role in wound contraction. Experientia. 27, 549-550 (1971).
- Lorell, B. H. Diastolic dysfunction in pressure-overload hypertrophy and its modification by angiotensin II: current concepts. Basic Res Cardiol. 87 Suppl 2, 163-172 (1992).
- Friedrich, S. P., et al. Intracardiac angiotensin-converting enzyme inhibition improves diastolic function in patients with left ventricular hypertrophy due to aortic stenosis. Circulation. 90, 2761-2771 (1994).
- Rosker, C., Salvarani, N., Schmutz, S., Grand, T., Rohr, S. Abolishing myofibroblast arrhythmogeneicity by pharmacological ablation of alpha-smooth muscle actin containing stress fibers. Circ Res. 109, 1120-1131 (2011).
- Yue, L., Xie, J., Nattel, S. Molecular determinants of cardiac fibroblast electrical function and therapeutic implications for atrial fibrillation. Cardiovasc Res. 89, 744-753 (2011).
- Rohr, S. Myofibroblasts in diseased hearts: new players in cardiac arrhythmias? Heart Rhythm. 6, 848-856 (2009).
- Coen, M., Gabbiani, G., Bochaton-Piallat, M. L. Myofibroblast-mediated adventitial remodeling: an underestimated player in arterial pathology. Arterioscler Thromb Vasc Biol. 31, 2391-2396 (2011).
- Brilla, C. G., Janicki, J. S., Weber, K. T. Cardioreparative effects of lisinopril in rats with genetic hypertension and left ventricular hypertrophy. Circulation. 83, 1771-1779 (1991).
- Youn, H. J., et al. Relation between flow reserve capacity of penetrating intramyocardial coronary arteries and myocardial fibrosis in hypertension: study using transthoracic Doppler echocardiography. J Am Soc Echocardiogr. 19, 373-378 (2006).
- Warnes, C. A., Maron, B. J., Roberts, W. C. Massive cardiac ventricular scarring in first-degree relatives with hypertrophic cardiomyopathy. Am J Cardiol. 54, 1377-1379 (1984).
- Maron, B. J., Wolfson, J. K., Epstein, S. E., Roberts, W. C. Intramural ('small vessel') coronary artery disease in hypertrophic cardiomyopathy. J Am Coll Cardiol. 8, 545-557 (1986).
- Olivotto, I., et al. Microvascular function is selectively impaired in patients with hypertrophic cardiomyopathy and sarcomere myofilament gene mutations. J Am Coll Cardiol. 58, 839-848 (2011).
- Beltrami, C. A., et al. Structural basis of end-stage failure in ischemic cardiomyopathy in humans. Circulation. 89, 151-163 (1994).
- Factor, S. M., et al. Pathologic fibrosis and matrix connective tissue in the subaortic myocardium of patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 17, 1343-1351 (1991).
- Waller, T. A., Hiser, W. L., Capehart, J. E., Roberts, W. C. Comparison of clinical and morphologic cardiac findings in patients having cardiac transplantation for ischemic cardiomyopathy, idiopathic dilated cardiomyopathy, and dilated hypertrophic cardiomyopathy. Am J Cardiol. 81, 884-894 (1998).
- Schaper, J., Lorenz-Meyer, S., Suzuki, K. The role of apoptosis in dilated cardiomyopathy. Herz. 24, 219-224 (1999).
- de Leeuw, N., et al. Histopathologic findings in explanted heart tissue from patients with end-stage idiopathic dilated cardiomyopathy. Transpl Int. 14, 299-306 (2001).
- Yoshikane, H., et al. Collagen in dilated cardiomyopathy--scanning electron microscopic and immunohistochemical observations. Jpn Circ J. 56, 899-910 (1992).
- Marijianowski, M. M., Teeling, P., Mann, J., Becker, A. E. Dilated cardiomyopathy is associated with an increase in the type I/type III collagen ratio: a quantitative assessment. J Am Coll Cardiol. 25, 1263-1272 (1995).
- Pearlman, E. S., Weber, K. T., Janicki, J. S., Pietra, G. G., Fishman, A. P. Muscle fiber orientation and connective tissue content in the hypertrophied human heart. Lab Invest. 46, 158-164 (1982).
- Huysman, J. A., Vliegen, H. W., Van der Laarse, A., Eulderink, F. Changes in nonmyocyte tissue composition associated with pressure overload of hypertrophic human hearts. Pathol Res Pract. 184, 577-581 (1989).
- Rossi, M. A. Pathologic fibrosis and connective tissue matrix in left ventricular hypertrophy due to chronic arterial hypertension in humans. J Hypertens. 16, 1031-1041 (1998).
- Lopez, B., Gonzalez, A., Querejeta, R., Larman, M., Diez, J. Alterations in the pattern of collagen deposition may contribute to the deterioration of systolic function in hypertensive patients with heart failure. J Am Coll Cardiol. 48, 89-96 (2006).
- Krayenbuehl, H. P., et al. Left ventricular myocardial structure in aortic valve disease before, intermediate, and late after aortic valve replacement. Circulation. 79, 744-755 (1989).
- Schwarz, F., et al. Myocardial structure and function in patients with aortic valve disease and their relation to postoperative results. Am J Cardiol. 41, 661-669 (1978).
- Hein, S., et al. Progression from compensated hypertrophy to failure in the pressure-overloaded human heart: structural deterioration and compensatory mechanisms. Circulation. 107, 984-991 (2003).
- Brooks, W. W., Shen, S. S., Conrad, C. H., Goldstein, R. H., Bing, O. H. Transition from compensated hypertrophy to systolic heart failure in the spontaneously hypertensive rat: Structure, function, and transcript analysis. Genomics. 95, 84-92 (2010).
- O'Hanlon, R., et al. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy. J Am Coll Cardiol. 56, 867-874 (2010).
- Green, J. J., Berger, J. S., Kramer, C. M., Salerno, M. Prognostic value of late gadolinium enhancement in clinical outcomes for hypertrophic cardiomyopathy. JACC Cardiovasc Imaging. 5, 370-377 (2012).
- Frankel, K. A., Rosser, R. J. The pathology of the heart in progressive muscular dystrophy: epimyocardial fibrosis. Hum Pathol. 7, 375-386 (1976).
- Otto, R. K., Ferguson, M. R., Friedman, S. D. Cardiac MRI in muscular dystrophy: an overview and future directions. Phys Med Rehabil Clin N Am. 23, 123-132 (2012).
- Finsterer, J., Stollberger, C. The heart in human dystrophinopathies. Cardiology. 99, 1-19 (2003).
- Galindo, C. L., et al. Anti-remodeling and anti-fibrotic effects of the neuregulin-1beta glial growth factor 2 in a large animal model of heart failure. J Am Heart Assoc. 3, e000773(2014).
- Caulfield, J. B., Borg, T. K. The collagen network of the heart. Lab Invest. 40, 364-372 (1979).
- Ohtani, O. Three-dimensional organization of the connective tissue fibers of the human pancreas: a scanning electron microscopic study of NaOH treated-tissues. Arch Histol Jpn. 50, 557-566 (1987).
- Rossi, M. A., Abreu, M. A., Santoro, L. B. Images in cardiovascular medicine. Connective tissue skeleton of the human heart: a demonstration by cell-maceration scanning electron microscope method. Circulation. 97, 934-935 (1998).
- Icardo, J. M., Colvee, E. Collagenous skeleton of the human mitral papillary muscle. Anat Rec. 252, 509-518 (1998).
- McGreevy, J. W., Hakim, C. H., McIntosh, M. A., Duan, D. Animal models of Duchenne muscular dystrophy: from basic mechanisms to gene therapy. Dis Model Mech. 8, 195-213 (2015).
- Buckberg, G., Hoffman, J. I., Mahajan, A., Saleh, S., Coghlan, C. Cardiac mechanics revisited: the relationship of cardiac architecture to ventricular function. Circulation. 118, 2571-2587 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved