Method Article
Rasterelektronenmikroskopie von Mazerierte Gewebe zu visualisieren die extrazelluläre Matrix
In diesem Artikel
Zusammenfassung
Shown here is a method for visualizing extracellular matrix ultrastructure in decellularized cardiac tissues.
Zusammenfassung
Fibrosis is a component of all forms of heart disease regardless of etiology, and while much progress has been made in the field of cardiac matrix biology, there are still major gaps related to how the matrix is formed, how physiological and pathological remodeling differ, and most importantly how matrix dynamics might be manipulated to promote healing and inhibit fibrosis. There is currently no treatment option for controlling, preventing, or reversing cardiac fibrosis. Part of the reason is likely the sheer complexity of cardiac scar formation, such as occurs after myocardial infarction to immediately replace dead or dying cardiomyocytes. The extracellular matrix itself participates in remodeling by activating resident cells and also by helping to guide infiltrating cells to the defunct lesion. The matrix is also a storage locker of sorts for matricellular proteins that are crucial to normal matrix turnover, as well as fibrotic signaling. The matrix has additionally been demonstrated to play an electromechanical role in cardiac tissue. Most techniques for assessing fibrosis are not qualitative in nature, but rather provide quantitative results that are useful for comparing two groups but that do not provide information related to the underlying matrix structure. Highlighted here is a technique for visualizing cardiac matrix ultrastructure. Scanning electron microscopy of decellularized heart tissue reveals striking differences in structure that might otherwise be missed using traditional quantitative research methods.
Einleitung
Fibrosis disrupts the normal myocardial collagen network, which is critical for normal mechanistic functions of cardiomyocytes 1,2 as well as for inter-cellular communication, intracellular signaling, and cell survival 3. The development of fibrosis is a major determinant of cardiac function, and fibrotic remodeling of the cardiac interstitium arising from a variety of etiologies leads to increased left ventricular stiffness and diastolic dysfunction 4. Myocardial fibrosis may also lead to arrhythmias, and whether the progression of fibrotic remodeling is a general or local phenomenon, it is highly associated with a poor prognosis in patients with ischemic and non-ischemic cardiomyopathy 5. Likewise, the absence of myocardial fibrosis is a strong predictor of ventricular functional recovery and long-term survival 6.
The hallmark of fibrosis is the deposition of excess collagen, which has the tensile strength of steel 7 and can adversely affect cardiomyocyte function on multiple levels. Mechanical forces resulting from an excessively collagenous matrix can lead to cardiomyocyte atrophy 8,9, passive tissue stiffness 10, tonic contraction-induced myocardial stiffness 11-13, and reduced delivery of oxygen to the remaining population of cardiomyocytes. Gap junction coupling of cardiomyocytes and myoFbs can also compromise the heart's electrical characteristics, creating a greater risk for the development of arrhythmias 14-16. Perivascular fibrosis alters vasomotor reactivity of intramural coronary arteries and arterioles 17 and contributes to luminal narrowing that reduces the supply of oxygen and thus the survival of cardiomyocytes 17-22. Pathogenic fibrotic and electrical remodeling, emanating from an initial site of ischemic injury or energy imbalance, inevitably progresses to heart failure.
Cardiomyocyte necrosis initiates the fibrotic response, and subsequent adverse fibrotic remodeling can occur irrespective of etiology. Finding a way to control cardiac fibrosis would be clinically beneficial for the treatment of ischemic and idiopathic cardiomyopathies, hypertensive heart disease, hypertrophic cardiomyopathy, valvular heart disease and dystrophinopathies 23-42. Regardless of how the fibrotic disease process begins, soluble, profibrotic factors can cross the interstitial space and provoke activation of interstitial and adventitial fibroblasts at sites remote to the initial fibrotic scar, creating a cascade effect that ultimately leads to heart failure. The optimum scenario would be to exploit the fibrillogenic process using a targeted therapeutic that can be applied during the compensative hypertrophic stage of cardiomyopathy before it progresses to systolic pump failure, diastolic heart failure, or other end-stage outcomes. The ultimate goal would be to reverse fibrosis so that dead cardiomyocytes can be replaced and heart function restored completely.
The importance of the matrix is widely understood, yet methods to study the matrix are limited mainly to quantitative measurements of major structural components, particularly collagen, and relative levels of different matrix and matricellular proteins. This protocol highlights a rarely used technique that is useful for assessing qualitative differences in the cardiac matrix. This technique has been recently used to compare and contrast fundamental differences in heart matrices from different etiologies of heart disease (in human explants), to examine hearts from post-infarcted pigs treated with the glial growth factor (GGF) isoform of neuregulin-1β, relative to untreated animals 43, and to probe for differences in the matrices of cardiac tissues from mdx mice (a commonly used animal model of Duchenne Muscular Dystrophy) at different ages and compared to wild-type controls. This technique was first introduced by Drs. Caulfield and Borg in 1979 44, but few studies have since employed this powerful technique 45-47, re-introduced here with only slight modification. This methodology is a valuable research tool, because it provides qualitative information about extracellular matrix ultrastructure that might otherwise be overlooked when simply measuring matrix component content and/or level of fibrosis.
Protokoll
Ethik - Erklärung: Die Protokolle für die Behandlung der Tiere durch die Vanderbilt Institutional Animal Care und Use Committee (IACUC genehmigt wurden, Protokolle Nummer M / 10/117 (Schweine) und M / 10/219 (Mäuse) und führte nach AAALAC-International - Standards. die Verwendung von überhöhten menschlichen Herzgewebe wurde von der Vanderbilt University Medical Center IRB (Protokollnummer 100887) genehmigt.
1. Probenentnahme und Lagerung
- Machen Sie frisch 4% Glutaraldehyd in 0,1 M Phosphatpuffer (PB) Lösung.
ACHTUNG: Glutaraldehyd ist giftig, Handschuhe tragen und die Arbeit in einem Abzug.- Machen Sie eine 0,2 M Stammlösung von PB, pH 7,4 , unter Verwendung von 21,8 g Na 2 HPO 4 und 6,4 g NaH 2 PO 4. Quantum satis (Qs) bis 1000 ml dH 2 O.
- In 400 ul 50% Glutaraldehyd zu 2,5 ml PB - Stammlösung und 2,1 ml dH 2 O.
- Tauchen Sie ein Stück (nicht größer als 2 cm 2) von Gewebe in 4% Glutaraldehyd - Lösung. Hinweis: Kleinere Stücke können auch verwendet werden , aber von ausreichender Größe (nicht kleiner als 5 mm 2) sein sollte , leicht mit dem Auge , um sichtbar gemacht zu werden , um spätere Schritte des Protokolls erleichtern.
- Inkubieren bei Raumtemperatur für 1 Stunde, dann speichern Sie auf unbestimmte Zeit bei 4 ° C.
2. Dezellularisierung von Herzgewebe
- Machen Sie frische 10% ige wässrige NaOH - Lösung unter Verwendung von 10 g NaOH - Pellets / 100 ml dH 2 O.
ACHTUNG: NaOH-Lösungen sind korrosiv und kann Alkali-Verbrennungen verursachen, tragen Handschuhe. - Spülen Sie Gewebe in dH 2 O.
- Inkubieren in 10% NaOH-Lösung bei Raumtemperatur für 6 bis 10 Tage (bis Gewebsveränderungen von rötlich-braun bis weißliche oder weiß).
- Spülen Sie in dH 2 O bis Gewebe transparent wird.
- Tauchen Gewebe in 1% Gerbsäure 4 h bei Raumtemperatur. Verwenden Sie 1 ml 5% Stammlösung pro 4 ml dH 2 O.
ACHTUNG: Gerbsäurereizend ist eine starke, Handschuhe zu tragen. - Spülen Sie in dH 2 O über Nacht.
3. Osmication und Dehydration von Herzgewebe (in Dampf-Haube für Sicherheit)
- Machen Sie eine 0,2 M Stammlösung von Natriumcacodylatpuffer mit 21,4 g Natriumcacodylat, 10,0 g Calciumchlorid und 450 ml dH 2 O. Mix, dann Salzsäure nach Bedarf hinzufügen pH auf 7,4 einzustellen. Qs auf 500 ml mit dH 2 O.
ACHTUNG: Natriumcacodylat und Salzsäure sind giftig, Handschuhe tragen und die Arbeit in einem Abzug. - Machen Sie 2% igen wässrigen Stammlösung von Osmiumtetroxid in Abzug , der für die Sicherheit durch Lösen von 1 g Osmiumtetroxid Kristall in 50 ml dH 2 O.
ACHTUNG: Osmiumtetroxid ist eine schwere Gefahr beim Einatmen; Dampf Fixierung von Schleimhäuten oder Augäpfel ist möglich, also nur mit Handschuhen im Abzug handhaben. Ein Spritzschutz wird empfohlen. - Spülen Sie Gewebe in 0,1 M Natriumcacodylatpuffer (Mischungslösung Lager 1: 1 mit dH 2 O) für 5 min auf Rotator (oder leichtem Schütteln).
- Zweimal wiederholen vorherigen Schritt, für insgesamt drei Puffer Spülungen.
- Tauchen Gewebe in 1% Osmiumtetroxid in 0,1 M Natriumcacodylatpuffer (Lager Natriumcacodylat und Lager Osmiumtetroxid 1 mischen: 1) auf Rotator für 1 Stunde.
- Spülen Gewebe in 0,1 M Natriumkakodylat-Puffer 3 mal für jeweils 5 min auf Rotator.
- Spülen Gewebe unter Verwendung zunehmender Konzentrationen von Ethanol (30%, 50%, 75%, 85%, 95% und schließlich 100%) für 15 min auf jedem Rotator.
4. Querschnitt Oberflächenvorbereitung für SEM
- Übertragen Gewebe in 100% Ethanol auf eine flache Petrischale auch 100% Ethanol enthält.
- Halten Sie zwei sehr scharfe Rasierklingen, so dass die Wohnungen der Seiten in Kontakt miteinander stehen und die Schneidkanten Quer zwei Seiten eines gleichseitigen Dreiecks oberhalb der Probe zu bilden. Um dies zu erreichen, verwenden Sie die linke Hand ein Blatt auf der rechten Seite der Probe zu platzieren undSchnitt nach links. Zugleich mit der rechten Hand, um die zweite Klinge auf dem ganz links in der Probe und Scheibe nach rechts zu platzieren. Somit werden die Blätter aus entgegengesetzten Richtungen gegeneinander verschoben werden, um einen einzelnen glatten Schnitt.
- Schieben Sie die flache Klinge Seiten gegeneinander einen sehr sauberen Schnitt der Probe mit minimaler Verzerrung zu machen oder Reißkraft, vorzugsweise eine möglichst große Oberfläche wie möglich auszusetzen, ohne die Probe zu beschädigen.
- Wiederholen Sie für jede Probe die sauberste mögliche Querschnittsflächen für die Prüfung im SEM auszusetzen.
5. Trocknen am kritischen Punkt (CPD) von Herzgewebe
- Verwenden eines Spatels oder einer Pinzette Gewebe an den Probenhalter des kritischen Punktes Trockners (CPD) zu übertragen, um sicherzustellen, dass Gewebe zu jeder Zeit in 100% Ethanol bleibt. Stellen Sie sicher, dass der Halter in Ethanol eingetaucht wird, und dass die Übertragung mit dem Gewebe für nicht mehr als einige Sekunden an der Luft erreicht wird.
- Betreiben Sie CPD pro unser Anleitung zu vervollständigen 3 Purge-and-Fill-Zyklen Ethanol mit flüssigem Kohlendioxid zu ersetzen.
- Betreiben Sie CPD pro Bedienungsanleitung Trocknen am kritischen Punkt der Proben zu erreichen und bringt sie auf Atmosphärendruck mit kontrolliertes Ablassen von CO 2.
6. Montage von Herzgewebeproben für SEM
- Bereiten Sie eine SEM-Probe Stub für jede Probe, um eine Kohlenstofffolie auf der Oberfläche des Aluminium-Stub haften.
- Mit Hilfe eines Stereomikroskops, sich sorgfältig um die Probe auf die Klebelasche mit der Querschnittsfläche von Interesse nach oben (weg von der Registerkarte sichtbar), und so nah wie möglich mit der Ebene der Probe Stummel Oberfläche parallel. Sie nicht die Oberfläche von Interesse Sonde oder berühren.
- Brechen Sie einen hölzernen Applikatorstäbchen eine verjüngte Bürste, ideal für Farbauftrag zu erzielen. Bewerben Silber oder Kohlenstoff Farbe an der Basis und an den Seiten der Probe, die Einhaltung der Stummel zu verbessern.
- Erweitern Sie eine sehr dünne Linie von Silber oder Kohlenstoff, an einer Kante der Oberfläche von Interesse bemalen, einen Ladepfad von der Oberfläche von Interesse zu Boden zu schaffen.
- Übernehmen 2 oder 3 kleine dabs von Silber oder Kohlenstofffarbe um den Umfang der Kohlenstofflasche, einen leitenden Pfad von der Kohlenstofflaschenoberfläche an dem Metall stub zu bieten und somit zur Masse.
- Erlauben leitfähigen Farbe für zwei Stunden trocknen.
- Betreiben Sie Zerstäubungsbeschichter pro Bedienungsanleitung eine relativ schwere Beschichtung (Zielbereich von 30 - 40 nm) aufzubringen Gold-Palladium-Legierung oder Gold. Pumpe Probenkammer auf etwa 0,1 mbar; Zeitschaltuhr auf 40 sec. Offene Stellen Ventil in die Position 08.00 Uhr (moderate Argon Gasstrom). Drücken Sie auf Start Sputterbeschichtung bei 30 mA zu initiieren. Lila Glimmentladung sollte in der Probenkammer sichtbar sein.
7. REM-Untersuchung der Herzgewebeproben
- Führen Rasterelektronenmikroskopie bei relativ niedriger Beschleunigungsspannung Abbildungs p zu minimierenrobleme mit Verlust schlechten Ladung in der Probe zugeordnet ist (Laden). Empfohlene anfängliche Abbildungsbedingung sind: 5 kV Beschleunigungsspannung, 10 mm Arbeitsabstand.
- Mit Hilfe eines erfahrenen Bediener, erhöht beschäftigen Abstand Arbeitstiefe von Feldbedingungen in der Bildgebung Fokus der Fasern erstrecken sich in mehreren Fokusebenen erfordern, oder Fasern für beträchtliche Länge in z-Richtung erstrecken.
- Für das Mikroskop hier (siehe Tabelle der Materialien), in der Benutzeroberfläche Zugriff die Registerkarte Navigation oben rechts verwendet.
- Besuchen Sie das Register Koordinaten von der Bühne Menü. Zur Erhöhung der Arbeitsabstand, geben Sie einen größeren Wert in Millimetern für die Z-Koordinate dann, um auf die Registerkarte Gehen Sie auf die Probenbühne auf den eingegebenen Arbeitsabstand zu bewegen.
- Mit Hilfe eines erfahrenen Bediener, beschäftigen Probe Neigung und Drehung der Oberfläche von Interesse orthogonal zu dem Elektronenstrahl zu positionieren. Zusätzliche Neigung von 10 bis 30 degrees von dieser Position kann die Beobachtung und Dokumentation der Matrixstruktur zu verbessern.
- Für das Mikroskop hier (siehe Tabelle der Materialien), in der Benutzeroberfläche verwendet wird , klicken Sie mit der rechten Maustaste gedrückt halten, schieben Sie dann nach links oder rechts , um die Probe in der Nähe der Peripherie der vorbereiteten Oberfläche Ebene von Interesse zu konzentrieren, um den fokussierten Arbeitsabstand der Feststellung , .
- Navigieren Sie mit dem Handbuch Benutzeroberfläche Joystick in der Nähe der gegenüberliegenden Kante der Oberfläche und wiederholen Sie Fokus zu bewegen. Wenn der Abstand arbeiten in die erste Position nicht annähernd gleich ist, Neigung Probe an beiden Standorten ungefähre Vereinbarung zu erreichen, um die Register Koordinaten des Stage-Menü (siehe 7.2) und einem Neigungswert in der T-Koordinate eingeben.
- Drehen Probe neunzig Grad (Wert in R-Koordinatenfeld) und wiederholen Sie den Vorgang, bis alle Positionen bei etwa der gleichen Arbeitsabstand fokussiert sind.
Hinweis: Variable Druck SEM verwendet werden kann Ladungsdissipation zu verbessernwenn verfügbar. Hochvakuum ist der Standard-Betriebsmodus für die Rasterelektronenmikroskopie.
Ergebnisse
Der markierte Technik wurde zu Herzgewebe von einem nicht verwendeten menschlichen Herztransplantation Spender (Abbildung 1), explantiert Gewebe von Transplantatempfängern, Herzen von Wildtyp und dystrophischen Mäuse (Abbildung 3) aufgebracht wird , und in der Post-Myokardinfarkt Herzproben von einem Schwein Modell der Herzverletzung (Abbildung 2). Wie in 1 gezeigt ist , ist der menschliche Herz Matrix ein kompliziertes Geflecht von vernetzten Proteinen , die ein wabenartiges Muster anzuzeigen , wenn im Querschnitt betrachtet. Jede "Wabe" Struktur ist etwa 40 & mgr; m breit, in der Regel eine einzige myocyte Umgehen, wenn die planare Ansicht in Abbildung 1 unter Berücksichtigung. Wenn durch Glanzstreifen verbunden sind , können mehrere Kardiomyozyten in Betracht gezogen werden , wie ein Stab der Länge nach durch den "Tunnel" laufen , wenn die Metapher auf Dreidimensionalität wird erweitert. Abbildung 1 auch Highlightsdie Bedeutung des Schneidvorgangs, mit größerer Präzision mehr Offenbarungs topographischen Daten (Abbildung 1, oben links) als Abschnitte , die "zertrümmerte" während des Schneidprozesses (Abbildung 1, rechts oben) nachgiebig sind.
Entfernung von resident Herzzellen, Blutgefäße und zirkulierend Zellen vor der SEM-Verarbeitung deckt zusätzliche Ultrastrukturdetails, die weniger spürbar durch SEM wäre ganzer Herzgewebeblöcke. Jede einzelne kollagenen "strut" zum Beispiel (Abbildung 1, Bodenplatten) ist offenbar in regelmäßigen Abständen und senkrecht ausgerichtet Sarkomere zu Myofibrille. Diese Anordnung ist geeignet für die Unterstützung Herzstruktur durch Gegen wirkenden Verformungen während der Kontraktion und Entspannungszyklen, ähnlich der "Kette und Schuss" von Textilien ausgeübt aufrechtzuerhalten, die Gewebekörper und die Form gegen Dehnung zu erhalten hilft.
fo: keep-together.within-page = "1"> 
Abb . 1: Repräsentative Rasterelektronenmikroskopische Aufnahmen der dreidimensionalen Anordnung der extrazellulären Matrix in Dezellularisierte linksventrikulärer Gewebe erhalten von einem Nicht verwendete menschlichen Spender - Herz Die beiden oberen Felder zeigen die Matrix im Querschnitt bei geringer Vergrößerung (Balken = 500 & mgr; m), ein Luftbild der Architektur des normalen menschlichen Herzgewebe bereitstellt. Bei höherer Vergrößerung kann man besser die typische wabenartige Struktur von unterstützenden Fasern beobachten, die für regelmäßigen Abständen Muskelfasern mechanische Unterstützung (Mitte links und rechts Platte Balken = 100 & mgr; m und 50 & mgr; m, beziehungsweise). Bei näherer Betrachtung jeder "Wabe" besteht aus Fasern, die mit einem anderen, während die senkrecht zu resident Kardiomyozyten (unten links und rechts Platte Balken = 10 & mgr; m und 5 & mgr; m, jeweils) parallel organisiert sind.TGP: //www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/54005/54005fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Neben strukturellen Informationen, SEM von dezellularisierter Gewebe können sinnvoll, qualitative Bewertung der extrazellulären Matrix Veränderungen in Reaktion auf eine Verletzung oder nicht schädigenden Formen der Kardiomyopathie ermöglichen. Zum Beispiel wurde diese Technik kürzlich die extrazellulären Matrizen von post-Infarktschweineherzgewebe 43 zu untersuchen , verwendet. Im Laufe dieser großen Tierversuch, der speziell die Wirksamkeit der GGF2 Isoform von NRG-1β als potentielles Therapeutikum für Herzinsuffizienz, post-Infarkt swine die Verabreichung intravenöser NRG-1β empfangen zu beurteilen zeigten Veränderungen in der kardialen Matrix Schlag , im Vergleich zu unbehandelten Herzgewebe von Post-Infarkt-Tiere. Diese Ergebnisse wurden anschließend 43 veröffentlicht wurde , und die technique hat aufbauend auf diesem anfänglichen, zufälligen Entdeckung ein wertvolles Werkzeug blieb. Figur 2 enthält beispielsweise mikroskopische Aufnahmen im Verlauf dieser Studie erzeugt, die zwischen unbehandelten und NRG-1β-behandelten Matrices drastische Matrix Unterschiede hervorzuheben.
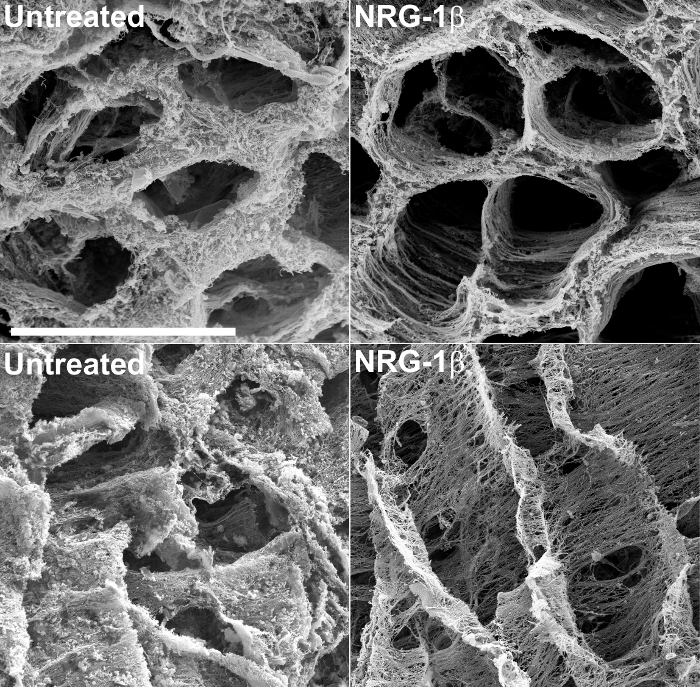
Abbildung 2:. Repräsentative Rasterelektronenmikroskopische Aufnahmen der linksventrikulären Extrazellulärmatrix in unbehandeltem und NRG-1 β behandelten Schweine nach NaOH Mazeration Die Matrix im Querschnitt unterstreicht die regelmäßige räumliche Anordnung der Fasern in unbehandeltem post-Myokardinfarkt (post-MI) Schweine (oben links), im Vergleich zu post-MI NRG-1β-behandelten Tieren (oben rechts). Wenn in der Länge betrachtet, zeigt die Matrix in unbehandelten Schweinen eine dicke, matte Aussehen (unten links), während die Matrix von NRG-1β behandelten Schweinezeigt regelmäßige räumliche Anordnung der Fasern (rechts unten). Weiß bar = 40 & mgr; m (alle vier Platten). Detailliertere Ergebnisse und Zahlen im zugehörigen Manuskript 43 enthalten sind. Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
Exploration von Matrix Änderungen, die in dystrophischen Herzen auftreten hat auch qualitative Einblicke in die Progression und die Entwicklung eines Tiermodells der Duchenne-Muskeldystrophie Kardiomyopathie (DMD) ergab. In mdx - Mäusen, sind eine häufig verwendete Mausmodell der DMD, es signifikante und altersabhängige Unterschiede zwischen Wildtyp und MDX - Herzen , wenn sie durch SEM nach der Fixierung und NaOH - Behandlung betrachtet. Wie in Figur 3 wurden Matrix gezeigten Komponenten relativ normal in 6 Wochen alte mdx Herzen fehlt funktionelle Dystrophin relativ zu normalen Mäusen. Mehr interesting, extrazelluläre Matrix - Organisation wurde deutlich gestört oder vielleicht degradiert bei älteren Dystrophin-defizienten Mäusen im Vergleich zu jüngeren mdx - Mäusen, im Herzen die progressive Natur der DMD darstellt. Eine solche grundlegende Unterschiede waren nicht zu erwarten, weil mdx Mäuse schlecht Vertreter der menschlichen DMD Kardiomyopathie aufgrund der Tatsache, dass sie eine viel mildere Kardiomyopathie Phänotyp und langsamer Mortalitätsrate als Menschen mit DMD 48 aufweisen. Dies deutet darauf hin, dass selbst kleine Veränderungen der Herzfunktion kann in diesem Manuskript vorgelegt mit der Visualisierungstechnik erfasst werden. Diese Methode sollte auch für den extrazellulären Matrizen anderer Organe leicht anpaßbar sein, für die es ebenfalls keine derzeit verfügbaren Fibrose-Targeting-Therapien.

Abbildung 3: Repräsentative Rasterelektronenmikroskopische Aufnahmen von links Ventricular Extrazellulärmatrix in Wildtyp im Vergleich zu mdx Mäuse. Die linksventrikuläre Herz Matrix in Wildtyp - Mäusen (oben) ist ähnlich wie bei anderen Spezies beobachtet. Die Matrix in mdx - Mäusen bei Alter von 6 Wochen sieht relativ normal, wenn auch etwas "fluffy" in Erscheinung (Mitte). Im Gegensatz dazu scheint die Herz Matrix älterer mdx - Mäusen stark degenerierten (unten), was darauf hinweist , dass der dystrophischen Prozess kann qualitativ SEM erfasst werden unter Verwendung von in festen, NaOH-Mazeration Gewebe. Weiß bar = 10 & mgr; m (alle drei Felder). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Querschnitt Oberflächenvorbereitung ist der kritischste Schritt während des Protokolls. Zur Erhaltung Feinstruktur, dehydriert Proben müssen zu jeder Zeit in 100% Ethanol bleiben bis zum kritischen Punkt Trocknungsprozess eingeführt. Deshalb ist die Slicing der Proben Flächen für EM Prüfung zu erreichen, müssen durchgeführt werden, während Proben in Ethanol in einer flachen Schale getaucht werden. Es ist auch wichtig, dass die freiliegende Oberfläche während der nachfolgenden Handhabung nicht berührt oder sondiert wird. Keine wesentlichen Modifikationen sind für die Anwendung dieser Technik auf andere Gewebetypen für ähnliche Matrix Beobachtungen erwartet, obwohl die SEM Teil des Protokollgrund Elektronenmikroskopie Fehlersuche unabhängig von Probe Ursprung erfordern. Bilder aus den Faserproben gesammelt sind anfällig für Artefakte, die durch schlechte Ladungsdissipation eingeführt ( "Laden"). Lade Probleme können in der Regel durch eine Verringerung Beschleunigungsspannung, die Erhöhung Scangeschwindigkeit (auch als Verweilzeit minimiert werden) Und Punktgröße des Elektronenstrahls zu verringern. Integration mehrerer Scans gesammelt schnell genug Ladung Artefakte zu vermeiden wird ein Bild vergleichbarer Signal-Rausch-Qualität, ohne dass die Ladung Artefakte in einem langsameren, höhere Qualität Single-Scan-Bild zu erzeugen.
Diese Technik ist inhärent qualitative und somit ergänzt , wenn neben quantitative Messungen berücksichtigt (beispielsweise Masson Trichrom oder picoserius Rotfärbung, Messung der Hydroxyprolin - Gehalt, Massenspektrometrie und RNA-Seq) zu ermitteln , wie visualisiert strukturelle Unterschiede könnten zu verschiedenen Entwicklungs oder Krankheitszuständen in Beziehung stehen. Trotz dieser Einschränkung ist die Methode signifikant über Herzfibrose spezifisch, weil die extrazelluläre Matrix ein wesentlicher Bestandteil nahezu jedes Organ im Körper. Im Herzen, liefert die Herz Matrix kritische mechanische Unterstützung für kontinuierliches Pumpen durch komplexe gekennzeichnet Dehnung, Zwirnen und deformationen, die 49 optimale Ein- und Ausstrom von Sauerstoff angereichertem und sauerstoffarmes Blut verleiht für die> 2,5 Milliarden Beats , die über die durchschnittliche Lebensspanne des Menschen auftreten. In Anbetracht der extrem niedrigen Regenerationsfähigkeit von Herzgewebe, eine dynamische Matrix, die nach kontextuellen Bedürfnissen umgebaut werden können, macht logischen Sinn. Mit nur einer leichten Ausdehnung der Phantasie, könnte man daraus schließen, dass es existieren therapeutische Ziele für Matrixremodulierung Manipulation der Heilungsprozess zu verstärken, während unerwünschte Fibrose zu begrenzen. Die Anwendung der Technik gezeigt, auf ein Minimum zeigt die Eleganz und Schönheit der Herz Matrix und dabei unterstreicht weiter ihre funktionelle Bedeutung.
Während der Wert der quantitativen Maßnahmen ein Grundprinzip für die Bewertung von praktisch allen experimentellen Studien ist, hob die Technik hier können qualitative ultrastrukturelle Variationen verwendet werden, um zeigen, dass nicht nur die Standard-Matrix-Messungen ergänzenaber vielleicht alternative Ermittlungswege vorschlagen, die grundlegenden biochemischen Veränderungen zu verstehen, die die qualitativen Veränderungen unterstreichen. Erwartete zukünftige Anwendungen dieser Technik sind seine Verwendung bei Herzkrankheitsmodellen und menschlichen Geweben als ergänzendes Instrument für Änderungen Matrix Beurteilung sowie verbreiterte Nutzung anderer Organe zu untersuchen, für die Matrix Änderungen Bestandteil des Krankheitsprozesses sind.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This study was funded by grants from the National Institutes of Health (NIH), Heart, Lung, and Blood Institute (NIHLB): K01-HL-121045, K08-HL-094703, 5T32HL007411-35, P20 HL101425, U01 HL100398.
Imaging and tissue processing (after NaOH maceration) were performed through the use of the Vanderbilt University Medical Center (VUMC) Cell Imaging Shared Resource (CISR) (supported by NIH grants CA68485, DK20593, DK58404, DK59637 and EY08126). We are especially grateful to the VUMC CISR core directors (Dr. Sam Wells and Dr. W. Gray (Jay) Jerome) for valuable technical advice and also for providing core space and resources for the purposes of filming the technique highlighted in this paper.
We would like to extend our deepest appreciation to Dr. Yan Ru Su and Ms. Kelsey Tomasek in the Cardiology Core Lab for Translational and Clinical Research at Vanderbilt University for providing technical expertise and for collecting human tissue samples used in this study.
Materialien
| Name | Company | Catalog Number | Comments |
| Calcium Chloride | Electron Microscopy Sciences | 12340 | 100 g |
| Carbon Adhesive | Electron Microscopy Sciences | 12664 | 30 g |
| Carbon Adhesive Tabs | Electron Microscopy Sciences | 77825 | order to fit stubs |
| Double Edge Razor Blades Stainless Steel | Ted Pella, Inc | 121-6 | 250/pkg |
| Ethanol | Electron Microscopy Sciences | 15055 | 450 ml |
| Gluteraldehyde, 50% Solution | Electron Microscopy Sciences | 16310 | EM grade, distillation purified |
| Hydrochloric Acid | Electron Microscopy Sciences | 16760 or 16770 | 100 ml |
| Monosodium Phosphate NaH2PO4 | Sigma-Aldrich | S9251-250G | 250 g |
| Osmium Tetroxide | Electron Microscopy Sciences | 19100 | 1 g |
| Silver Conductive Adhesive | Electron Microscopy Sciences | 12686-15 | 15 g |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S8045-1KG | 1 kg |
| Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S3264-500G | 500 g |
| Tannic Acid, 5% Aqueous | Electron Microscopy Sciences | 21702-5 | 500 ml |
| Trihydrate Sodium Cacodylate | Electron Microscopy Sciences | 12300 | 100 g |
| Gold-palladium Alloy or Gold | Refining Systems, Inc. | varies | specific to the sputter coater make and model |
| Critical Point Dryer | Electron Microscopy Sciences | 850 | |
| Plain Wooden Applicators | Fisher Scientific | 23-400-102 | |
| Quanta 250 Environmental SEM | FEI | Q250 SEM | |
| Sputter Coater | Cressington Scientific Instruments Ltd. | Model 108 | |
| Alluminum SEM Sample Stubs | Electron Microscopy Sciences | 75220-12 | specific to the miscroscope |
Referenzen
- Robinson, T. F., Cohen-Gould, L., Factor, S. M., Eghbali, M., Blumenfeld, O. O. Structure and function of connective tissue in cardiac muscle: collagen types I and III in endomysial struts and pericellular fibers. Scanning Microsc. 2, 1005-1015 (1988).
- Robinson, T. F., Geraci, M. A., Sonnenblick, E. H., Factor, S. M. Coiled perimysial fibers of papillary muscle in rat heart: morphology, distribution, and changes in configuration. Circ Res. 63, 577-592 (1988).
- Lunkenheimer, P. P., et al. The myocardium and its fibrous matrix working in concert as a spatially netted mesh: a critical review of the purported tertiary structure of the ventricular mass. Eur J Cardiothorac Surg. 29 Suppl 2, S41-S49 (2006).
- Wu, K. C., et al. Late gadolinium enhancement by cardiovascular magnetic resonance heralds an adverse prognosis in nonischemic cardiomyopathy. J Am Coll Cardiol. 51, 2414-2421 (2008).
- Kramer, C. M. The expanding prognostic role of late gadolinium enhanced cardiac magnetic resonance. J Am Coll Cardiol. 48, 1986-1987 (2006).
- Park, S., et al. Delayed hyperenhancement magnetic resonance imaging is useful in predicting functional recovery of nonischemic left ventricular systolic dysfunction. J Card Fail. 12, 93-99 (2006).
- Weber, K. T. Cardiac interstitium in health and disease: the fibrillar collagen network. J Am Coll Cardiol. 13, 1637-1652 (1989).
- Jalil, J. E., Janicki, J. S., Pick, R., Abrahams, C., Weber, K. T. Fibrosis-induced reduction of endomyocardium in the rat after isoproterenol treatment. Circ Res. 65, 258-264 (1989).
- Fidzianska, A., Bilinska, Z. T., Walczak, E., Witkowski, A., Chojnowska, L. Autophagy in transition from hypertrophic cardiomyopathy to heart failure. J Electron Microsc (Tokyo). 59, 181-183 (2010).
- Lopez, B., Querejeta, R., Gonzalez, A., Larman, M., Diez, J. Collagen cross-linking but not collagen amount associates with elevated filling pressures in hypertensive patients with stage C heart failure: potential role of lysyl oxidase. Hypertension. 60, 677-683 (2012).
- Gabbiani, G., Ryan, G. B., Majne, G. Presence of modified fibroblasts in granulation tissue and their possible role in wound contraction. Experientia. 27, 549-550 (1971).
- Lorell, B. H. Diastolic dysfunction in pressure-overload hypertrophy and its modification by angiotensin II: current concepts. Basic Res Cardiol. 87 Suppl 2, 163-172 (1992).
- Friedrich, S. P., et al. Intracardiac angiotensin-converting enzyme inhibition improves diastolic function in patients with left ventricular hypertrophy due to aortic stenosis. Circulation. 90, 2761-2771 (1994).
- Rosker, C., Salvarani, N., Schmutz, S., Grand, T., Rohr, S. Abolishing myofibroblast arrhythmogeneicity by pharmacological ablation of alpha-smooth muscle actin containing stress fibers. Circ Res. 109, 1120-1131 (2011).
- Yue, L., Xie, J., Nattel, S. Molecular determinants of cardiac fibroblast electrical function and therapeutic implications for atrial fibrillation. Cardiovasc Res. 89, 744-753 (2011).
- Rohr, S. Myofibroblasts in diseased hearts: new players in cardiac arrhythmias? Heart Rhythm. 6, 848-856 (2009).
- Coen, M., Gabbiani, G., Bochaton-Piallat, M. L. Myofibroblast-mediated adventitial remodeling: an underestimated player in arterial pathology. Arterioscler Thromb Vasc Biol. 31, 2391-2396 (2011).
- Brilla, C. G., Janicki, J. S., Weber, K. T. Cardioreparative effects of lisinopril in rats with genetic hypertension and left ventricular hypertrophy. Circulation. 83, 1771-1779 (1991).
- Youn, H. J., et al. Relation between flow reserve capacity of penetrating intramyocardial coronary arteries and myocardial fibrosis in hypertension: study using transthoracic Doppler echocardiography. J Am Soc Echocardiogr. 19, 373-378 (2006).
- Warnes, C. A., Maron, B. J., Roberts, W. C. Massive cardiac ventricular scarring in first-degree relatives with hypertrophic cardiomyopathy. Am J Cardiol. 54, 1377-1379 (1984).
- Maron, B. J., Wolfson, J. K., Epstein, S. E., Roberts, W. C. Intramural ('small vessel') coronary artery disease in hypertrophic cardiomyopathy. J Am Coll Cardiol. 8, 545-557 (1986).
- Olivotto, I., et al. Microvascular function is selectively impaired in patients with hypertrophic cardiomyopathy and sarcomere myofilament gene mutations. J Am Coll Cardiol. 58, 839-848 (2011).
- Beltrami, C. A., et al. Structural basis of end-stage failure in ischemic cardiomyopathy in humans. Circulation. 89, 151-163 (1994).
- Factor, S. M., et al. Pathologic fibrosis and matrix connective tissue in the subaortic myocardium of patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 17, 1343-1351 (1991).
- Waller, T. A., Hiser, W. L., Capehart, J. E., Roberts, W. C. Comparison of clinical and morphologic cardiac findings in patients having cardiac transplantation for ischemic cardiomyopathy, idiopathic dilated cardiomyopathy, and dilated hypertrophic cardiomyopathy. Am J Cardiol. 81, 884-894 (1998).
- Schaper, J., Lorenz-Meyer, S., Suzuki, K. The role of apoptosis in dilated cardiomyopathy. Herz. 24, 219-224 (1999).
- de Leeuw, N., et al. Histopathologic findings in explanted heart tissue from patients with end-stage idiopathic dilated cardiomyopathy. Transpl Int. 14, 299-306 (2001).
- Yoshikane, H., et al. Collagen in dilated cardiomyopathy--scanning electron microscopic and immunohistochemical observations. Jpn Circ J. 56, 899-910 (1992).
- Marijianowski, M. M., Teeling, P., Mann, J., Becker, A. E. Dilated cardiomyopathy is associated with an increase in the type I/type III collagen ratio: a quantitative assessment. J Am Coll Cardiol. 25, 1263-1272 (1995).
- Pearlman, E. S., Weber, K. T., Janicki, J. S., Pietra, G. G., Fishman, A. P. Muscle fiber orientation and connective tissue content in the hypertrophied human heart. Lab Invest. 46, 158-164 (1982).
- Huysman, J. A., Vliegen, H. W., Van der Laarse, A., Eulderink, F. Changes in nonmyocyte tissue composition associated with pressure overload of hypertrophic human hearts. Pathol Res Pract. 184, 577-581 (1989).
- Rossi, M. A. Pathologic fibrosis and connective tissue matrix in left ventricular hypertrophy due to chronic arterial hypertension in humans. J Hypertens. 16, 1031-1041 (1998).
- Lopez, B., Gonzalez, A., Querejeta, R., Larman, M., Diez, J. Alterations in the pattern of collagen deposition may contribute to the deterioration of systolic function in hypertensive patients with heart failure. J Am Coll Cardiol. 48, 89-96 (2006).
- Krayenbuehl, H. P., et al. Left ventricular myocardial structure in aortic valve disease before, intermediate, and late after aortic valve replacement. Circulation. 79, 744-755 (1989).
- Schwarz, F., et al. Myocardial structure and function in patients with aortic valve disease and their relation to postoperative results. Am J Cardiol. 41, 661-669 (1978).
- Hein, S., et al. Progression from compensated hypertrophy to failure in the pressure-overloaded human heart: structural deterioration and compensatory mechanisms. Circulation. 107, 984-991 (2003).
- Brooks, W. W., Shen, S. S., Conrad, C. H., Goldstein, R. H., Bing, O. H. Transition from compensated hypertrophy to systolic heart failure in the spontaneously hypertensive rat: Structure, function, and transcript analysis. Genomics. 95, 84-92 (2010).
- O'Hanlon, R., et al. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy. J Am Coll Cardiol. 56, 867-874 (2010).
- Green, J. J., Berger, J. S., Kramer, C. M., Salerno, M. Prognostic value of late gadolinium enhancement in clinical outcomes for hypertrophic cardiomyopathy. JACC Cardiovasc Imaging. 5, 370-377 (2012).
- Frankel, K. A., Rosser, R. J. The pathology of the heart in progressive muscular dystrophy: epimyocardial fibrosis. Hum Pathol. 7, 375-386 (1976).
- Otto, R. K., Ferguson, M. R., Friedman, S. D. Cardiac MRI in muscular dystrophy: an overview and future directions. Phys Med Rehabil Clin N Am. 23, 123-132 (2012).
- Finsterer, J., Stollberger, C. The heart in human dystrophinopathies. Cardiology. 99, 1-19 (2003).
- Galindo, C. L., et al. Anti-remodeling and anti-fibrotic effects of the neuregulin-1beta glial growth factor 2 in a large animal model of heart failure. J Am Heart Assoc. 3, e000773(2014).
- Caulfield, J. B., Borg, T. K. The collagen network of the heart. Lab Invest. 40, 364-372 (1979).
- Ohtani, O. Three-dimensional organization of the connective tissue fibers of the human pancreas: a scanning electron microscopic study of NaOH treated-tissues. Arch Histol Jpn. 50, 557-566 (1987).
- Rossi, M. A., Abreu, M. A., Santoro, L. B. Images in cardiovascular medicine. Connective tissue skeleton of the human heart: a demonstration by cell-maceration scanning electron microscope method. Circulation. 97, 934-935 (1998).
- Icardo, J. M., Colvee, E. Collagenous skeleton of the human mitral papillary muscle. Anat Rec. 252, 509-518 (1998).
- McGreevy, J. W., Hakim, C. H., McIntosh, M. A., Duan, D. Animal models of Duchenne muscular dystrophy: from basic mechanisms to gene therapy. Dis Model Mech. 8, 195-213 (2015).
- Buckberg, G., Hoffman, J. I., Mahajan, A., Saleh, S., Coghlan, C. Cardiac mechanics revisited: the relationship of cardiac architecture to ventricular function. Circulation. 118, 2571-2587 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten