Method Article
Microscopía Electrónica de Barrido de tejido macerado para visualizar la matriz extracelular
En este artículo
Resumen
Shown here is a method for visualizing extracellular matrix ultrastructure in decellularized cardiac tissues.
Resumen
Fibrosis is a component of all forms of heart disease regardless of etiology, and while much progress has been made in the field of cardiac matrix biology, there are still major gaps related to how the matrix is formed, how physiological and pathological remodeling differ, and most importantly how matrix dynamics might be manipulated to promote healing and inhibit fibrosis. There is currently no treatment option for controlling, preventing, or reversing cardiac fibrosis. Part of the reason is likely the sheer complexity of cardiac scar formation, such as occurs after myocardial infarction to immediately replace dead or dying cardiomyocytes. The extracellular matrix itself participates in remodeling by activating resident cells and also by helping to guide infiltrating cells to the defunct lesion. The matrix is also a storage locker of sorts for matricellular proteins that are crucial to normal matrix turnover, as well as fibrotic signaling. The matrix has additionally been demonstrated to play an electromechanical role in cardiac tissue. Most techniques for assessing fibrosis are not qualitative in nature, but rather provide quantitative results that are useful for comparing two groups but that do not provide information related to the underlying matrix structure. Highlighted here is a technique for visualizing cardiac matrix ultrastructure. Scanning electron microscopy of decellularized heart tissue reveals striking differences in structure that might otherwise be missed using traditional quantitative research methods.
Introducción
Fibrosis disrupts the normal myocardial collagen network, which is critical for normal mechanistic functions of cardiomyocytes 1,2 as well as for inter-cellular communication, intracellular signaling, and cell survival 3. The development of fibrosis is a major determinant of cardiac function, and fibrotic remodeling of the cardiac interstitium arising from a variety of etiologies leads to increased left ventricular stiffness and diastolic dysfunction 4. Myocardial fibrosis may also lead to arrhythmias, and whether the progression of fibrotic remodeling is a general or local phenomenon, it is highly associated with a poor prognosis in patients with ischemic and non-ischemic cardiomyopathy 5. Likewise, the absence of myocardial fibrosis is a strong predictor of ventricular functional recovery and long-term survival 6.
The hallmark of fibrosis is the deposition of excess collagen, which has the tensile strength of steel 7 and can adversely affect cardiomyocyte function on multiple levels. Mechanical forces resulting from an excessively collagenous matrix can lead to cardiomyocyte atrophy 8,9, passive tissue stiffness 10, tonic contraction-induced myocardial stiffness 11-13, and reduced delivery of oxygen to the remaining population of cardiomyocytes. Gap junction coupling of cardiomyocytes and myoFbs can also compromise the heart's electrical characteristics, creating a greater risk for the development of arrhythmias 14-16. Perivascular fibrosis alters vasomotor reactivity of intramural coronary arteries and arterioles 17 and contributes to luminal narrowing that reduces the supply of oxygen and thus the survival of cardiomyocytes 17-22. Pathogenic fibrotic and electrical remodeling, emanating from an initial site of ischemic injury or energy imbalance, inevitably progresses to heart failure.
Cardiomyocyte necrosis initiates the fibrotic response, and subsequent adverse fibrotic remodeling can occur irrespective of etiology. Finding a way to control cardiac fibrosis would be clinically beneficial for the treatment of ischemic and idiopathic cardiomyopathies, hypertensive heart disease, hypertrophic cardiomyopathy, valvular heart disease and dystrophinopathies 23-42. Regardless of how the fibrotic disease process begins, soluble, profibrotic factors can cross the interstitial space and provoke activation of interstitial and adventitial fibroblasts at sites remote to the initial fibrotic scar, creating a cascade effect that ultimately leads to heart failure. The optimum scenario would be to exploit the fibrillogenic process using a targeted therapeutic that can be applied during the compensative hypertrophic stage of cardiomyopathy before it progresses to systolic pump failure, diastolic heart failure, or other end-stage outcomes. The ultimate goal would be to reverse fibrosis so that dead cardiomyocytes can be replaced and heart function restored completely.
The importance of the matrix is widely understood, yet methods to study the matrix are limited mainly to quantitative measurements of major structural components, particularly collagen, and relative levels of different matrix and matricellular proteins. This protocol highlights a rarely used technique that is useful for assessing qualitative differences in the cardiac matrix. This technique has been recently used to compare and contrast fundamental differences in heart matrices from different etiologies of heart disease (in human explants), to examine hearts from post-infarcted pigs treated with the glial growth factor (GGF) isoform of neuregulin-1β, relative to untreated animals 43, and to probe for differences in the matrices of cardiac tissues from mdx mice (a commonly used animal model of Duchenne Muscular Dystrophy) at different ages and compared to wild-type controls. This technique was first introduced by Drs. Caulfield and Borg in 1979 44, but few studies have since employed this powerful technique 45-47, re-introduced here with only slight modification. This methodology is a valuable research tool, because it provides qualitative information about extracellular matrix ultrastructure that might otherwise be overlooked when simply measuring matrix component content and/or level of fibrosis.
Protocolo
Declaración de Ética: Los protocolos para el manejo de animales fueron aprobados por el Vanderbilt Institucional Cuidado de Animales y el empleo Comisión (IACUC, protocolos número M / 10/117 (porcina) y M / 10/219 (ratones) y llevado a cabo de acuerdo con las normas de AAALAC-International. el uso de tejidos cardíacos humanos peraltadas fue aprobado por la Universidad de Vanderbilt Medical Center IRB (número de protocolo 100887).
1. Recolección de muestras y almacenamiento
- Hacer fresco glutaraldehído 4% en solución tampón de fosfato 0,1 M (PB).
PRECAUCIÓN: El glutaraldehído es tóxico, lleve guantes y el trabajo en una campana de humos.- Hacer una solución 0,2 M social de PB, pH 7,4 usando 21,8 g de Na 2 HPO 4 y 6,4 g NaH 2 PO 4. Quantum satis (Qs) a 1.000 ml de dH2O
- Añadir 400 l de 50% de glutaraldehído a 2,5 ml de solución madre de PB y 2,1 ml de dH2O
- Sumergir un trozo (no más de 2 cm 2) de tejido en la solución de glutaraldehído al 4%. Nota: Las piezas más pequeñas se pueden utilizar también, pero deberían ser de tamaño suficiente (no más pequeña que 5 mm 2) para ser fácilmente visualizado por el ojo a fin de facilitar los pasos posteriores del protocolo.
- Se incuba a temperatura ambiente durante 1 hora, a continuación, almacenar indefinidamente a 4 ° C.
2. Descelularización de tejido cardíaco
- Hacer una solución de NaOH acuoso al 10% fresco usando 10 g de lentejas de NaOH / 100 ml de dH 2 O.
PRECAUCIÓN: soluciones de NaOH son corrosivos y pueden causar quemaduras a los álcalis, usar guantes. - Enjuague el tejido en dH2O
- Se incuba en una solución de NaOH al 10% a temperatura ambiente durante 6 - 10 días (hasta que los cambios de tejido de color marrón rojizo a grisáceo o blanco).
- Enjuague con H2O destilada hasta que el tejido se vuelve transparente.
- Sumergir el tejido en ácido tánico al 1% durante 4 horas a temperatura ambiente. Use 1 ml 5% solución de reserva por 4 ml de dH2O
PRECAUCIÓN: El ácido tánicoes un fuerte irritante, use guantes. - Enjuague en dH2O durante la noche.
3. Osmication y deshidratación de los tejidos del corazón (en la campana de humos para la Seguridad)
- Hacer una solución 0,2 M de stock de tampón de cacodilato de sodio utilizando 21,4 g de cacodilato de sodio, cloruro de calcio 10,0 g y 450 ml dH 2 O. Mezcla, a continuación, añadir ácido clorhídrico como sea necesario para ajustar el pH a 7,4. Qs a 500 ml con dH2O
PRECAUCIÓN: cacodilato de sodio y ácido clorhídrico son tóxicos, usar guantes y el trabajo en una campana de humos. - Hacer solución madre acuosa al 2% de tetróxido de osmio en campana de humos para la seguridad disolviendo 1 g de cristal de tetróxido de osmio en 50 ml de dH2O
PRECAUCIÓN: El tetróxido de osmio es un grave peligro de inhalación; la fijación de vapor de las membranas mucosas o los ojos es posible, por lo tanto, manejar sólo en la campana de humos con guantes. Se recomienda utilizar un protector contra salpicaduras. - Enjuague el tejido en tampón de cacodilato de sodio 0,1 M (de la mezcla de la solución 1: 1 con dH 2 O) durante 5 min en los rotadores (o agitación suave).
- Repita el paso anterior dos veces, para un total de tres enjuagues de amortiguamiento.
- Sumergir el tejido en el 1% tetróxido de osmio en tampón cacodilato de sodio 0,1 M (de la mezcla de cacodilato de sodio social y acciones de tetróxido de osmio 1: 1) en el rotador durante 1 hora.
- Enjuague el tejido en tampón cacodilato 0,1 M de sodio 3 veces durante 5 minutos cada uno en los rotadores.
- Enjuague tejido usando concentraciones crecientes de etanol (30%, 50%, 75%, 85%, 95%, y, finalmente, 100%) durante 15 minutos cada uno en los rotadores.
4. Corte transversal preparación de superficies para SEM
- Transferir el tejido en etanol al 100% a un plato poco profundo de Petri que contiene también 100% de etanol.
- Mantenga dos cuchillas de afeitar muy afilados de tal manera que los planos de los lados están en contacto uno con el otro y la cruz bordes de corte para formar dos lados de un triángulo equilátero por encima de la muestra. Para lograr esto, usar la mano izquierda para colocar una cuchilla en el extremo derecho de la muestra ycorte hacia la izquierda. Al mismo tiempo, usar la mano derecha para colocar la segunda hoja en el extremo izquierdo de la muestra y la rebanada hacia la derecha. Por lo tanto, las cuchillas se deslizan uno contra el otro desde direcciones opuestas para hacer un solo corte suave.
- Deslizar los lados de hoja plana uno contra el otro para hacer un corte muy limpio de la muestra con una distorsión mínima o fuerza de desgarro, preferiblemente exponiendo tan grande un área de superficie como sea posible sin dañar la muestra.
- Repita este procedimiento para cada muestra para exponer las posibles superficies de sección transversal más limpias para su examen en el SEM.
5. El punto crítico de secado (CPD) de tejido cardíaco
- Utilice una espátula o pinzas para transferir tejido para el soporte de muestra de la secadora punto crítico (CPD), asegurando que el tejido se mantiene en etanol al 100% en todo momento. Asegúrese de que el soporte se sumerge en etanol y que la transferencia se consigue con el tejido expuesto al aire durante no más de unos pocos segundos.
- Operar CPD por nosotrosmanual del er 3 para completar la purga y relleno para reemplazar los ciclos de etanol con dióxido de carbono líquido.
- CPD operar según el manual del usuario para lograr un secado punto crítico de las muestras y devolverlos a la presión atmosférica con ventilación controlada de CO2.
6. Montaje de muestras de tejido del corazón para SEM
- Preparar un trozo de muestra SEM para cada muestra, adhiriendo una lengüeta adhesiva de carbono a la superficie superior del tramo de aluminio.
- Con la ayuda de un microscopio estereoscópico, se adhieren cuidadosamente la muestra para el precinto adhesivo con la superficie de la sección transversal de interés hacia arriba (lejos de la pestaña, visible), y lo más cerca posible de manera paralela con el plano de la superficie de la muestra trozo. No introduzca ni toque la superficie de interés.
- Romper un aplicador de madera para lograr un cepillo cónico, ideal para la aplicación de pintura. Aplicar pintura de plata o de carbono en la base y los lados de la probeta, para mejorar la adherencia al trozo.
- Extender una línea muy fina de plata o de carbono pintar hasta un borde de la superficie de interés, para proporcionar un camino de carga de la superficie de interés a tierra.
- Aplicar 2 o 3 pequeños toques de plata o pintura de carbono alrededor del perímetro de la pestaña de carbono, para proporcionar una ruta conductora de la superficie de la aleta de carbono para el talón de metal y por lo tanto a tierra.
- Deje que se seque la pintura conductora durante dos horas.
- Operar revestidor de bombardeo iónico por el manual del usuario para aplicar un recubrimiento relativamente pesado (intervalo objetivo de 30 - 40 nm) de aleación de oro-paladio u oro. Bomba cámara de muestras a aproximadamente 0,1 mbar; programar el temporizador de 40 segundos. Conjunto de válvula abierta al (flujo de gas argón moderada) 08:00 posición. Pulse Iniciar para iniciar el revestimiento por bombardeo iónico a 30 mA. descarga luminiscente púrpura debe ser visible en la cámara de muestra.
7. SEM El examen de muestras de tejido del corazón
- Realizar microscopía electrónica de barrido relativamente bajo voltaje de aceleración para minimizar la formación de imágenes pos problemas asociados con la mala disipación de la carga en la muestra (carga). Sugerido condición de imagen inicial son: 5 kV voltaje de aceleración, distancia de trabajo de 10 mm.
- Con la asistencia de un operador con experiencia, empleo aumenta la distancia de trabajo para ampliar la profundidad de campo en condiciones de formación de imágenes que requieren foco de fibras en múltiples planos focales, o fibras que se extienden de considerable longitud en la dimensión z.
- Para el microscopio usado aquí (véase la Tabla de Materiales), en el acceso a la interfaz de usuario en la pestaña de navegación arriba a la derecha.
- Acceder a la ficha Coordenadas del menú escenario. Para aumentar la distancia de trabajo, introduzca un valor mayor en milímetros para la coordenada z continuación, haga clic en la pestaña Ir a la etapa de mover la muestra a la distancia de trabajo introducido.
- Con la ayuda de un operador experimentado, emplear inclinación espécimen y rotación para posicionar la superficie de ortogonal interés para el haz de electrones. la inclinación adicional de 10 a 30 grado dees de esta posición puede mejorar la observación y documentación de la estructura de la matriz.
- Para el microscopio usado aquí (véase la Tabla de Materiales), en la interfaz de usuario, haga clic y mantenga pulsado el botón derecho del ratón, a continuación, deslice hacia la izquierda o hacia la derecha para enfocar la muestra cerca de la periferia del plano de la superficie preparada de interés, teniendo en cuenta la distancia de trabajo enfocado .
- Navegar con el mando de control de interfaz de usuario Manual de moverse cerca del borde opuesto de la superficie y repita el enfoque. Si la distancia de trabajo no es aproximadamente igual a la primera posición, la muestra de inclinación para lograr la aproximación de acuerdo en ambos lugares mediante la ficha Coordenadas del menú de la etapa (véase el apartado 7.2) e introduzca un valor de inclinación en el T de coordenadas.
- Girar noventa grados espécimen (Anotar el valor en R Coordinar campo) y repetir el proceso hasta que todas las posiciones se concentran aproximadamente a la misma distancia de trabajo.
Nota: presión variable SEM se puede emplear para mejorar la disipación de la cargasi está disponible. De alto vacío es el modo de funcionamiento estándar para la microscopía electrónica de barrido.
Resultados
La técnica resaltado se aplicó a los tejidos cardíacos de un donante de trasplante de corazón humano no utilizado (Figura 1), tejidos explantados de los receptores de trasplante, los corazones de tipo salvaje y ratones distróficos (Figura 3), y en muestras de corazón post-infarto de miocardio de un cerdo modelo de lesión del corazón (Figura 2). Como se muestra en la Figura 1, la matriz cardíaco humano es un intrincado tejido de proteínas reticuladas que muestran un patrón de panal de abeja cuando se ve en sección transversal. Cada estructura de "nido de abeja" es de aproximadamente 40 micras de ancho, normalmente destinado a neutralizar una sola miocitos, al considerar la vista en planta en la Figura 1. Cuando está conectada mediante discos intercalados, varios cardiomiocitos se puede prever como una varilla en sentido longitudinal a través del "túnel" cuando la metáfora se extiende a la tridimensionalidad. La figura 1 también destacadosla importancia del proceso de corte, con mayor precisión produciendo datos topográficos más reveladoras (Figura 1, arriba a la izquierda) de secciones que se "rompieron" durante el proceso de corte (Figura 1, arriba a la derecha).
La eliminación de las células residentes cardiacas, vasos sanguíneos y células circulatorias antes de procesar SEM revela detalles ultra-estructurales adicionales que serían menos apreciable por SEM de bloques de tejido cardíaco enteros. Cada colágena "puntal" individuo, por ejemplo (Figura 1, paneles inferiores) es aparentemente alineados a intervalos regulares y perpendicular a las miofibrillas sarcómeros. Esta disposición es adecuada para ayudar a mantener la estructura del corazón por deformaciones de contador de acción ejercidas durante los ciclos de contracción y relajación, similar a la "urdimbre y la trama 'de textiles que ayuda a mantener el cuerpo de la tela y la forma en contra de estiramiento.
fo: keep-together.within-page = "1"> 
Figura 1:. Representativos de exploración Microscopio electrónico de la disposición tridimensional de la matriz extracelular en Descelularizado ventricular izquierda tejido obtenido de un donante de corazón humano desaprovechado Los dos paneles superiores muestran la matriz en la sección transversal a bajo aumento (bares = 500 micras), proporcionando una vista aérea de la arquitectura de los tejidos del corazón humano normal. A mayor aumento, se puede observar mejor la típica estructura en forma de panal de fibras de apoyo que proporcionan soporte mecánico para las miofibrillas regularmente espaciados (barras del panel izquierdo y derecho mediana = 100 micras y 50 micras, respectivamente). Tras una inspección más cercana, cada uno 'nido de abeja' se compone de fibras que se organizan en paralelo entre sí, mientras perpendicular a cardiomiocitos residentes (bares panel inferior izquierda y derecha = 10 micras y 5 micras, respectivamente).TTP: //www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/54005/54005fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
Además de proporcionar información estructural, SEM de tejidos descelularizados puede hacer una evaluación adecuada, cualitativa de los cambios de la matriz extracelular en respuesta a una lesión o formas no perjudiciales de la miocardiopatía. Por ejemplo, esta técnica se utilizó recientemente para examinar las matrices extracelulares de los tejidos cardíacos porcina post-infartados 43. Durante el curso de este experimento a gran animal, diseñado específicamente para evaluar la eficacia de la isoforma GGF2 de NRG-1β como un agente terapéutico potencial para la insuficiencia cardíaca, porcina post-infartada que recibió la administración de NRG-1β intravenosa exhibió golpear alteraciones en la matriz cardiaca , en comparación con los tejidos cardíacos no tratados de animales post-infartados. Estos resultados fueron publicados posteriormente 43, y el TEchnique ha seguido siendo una herramienta valiosa para la construcción en este descubrimiento inicial, fortuito. La figura 2 incluye micrografías ejemplo, producidos durante el curso de este estudio, que ponen de relieve las diferencias drásticas entre las matrices de matriz-tratados NRG-1β no tratada y.
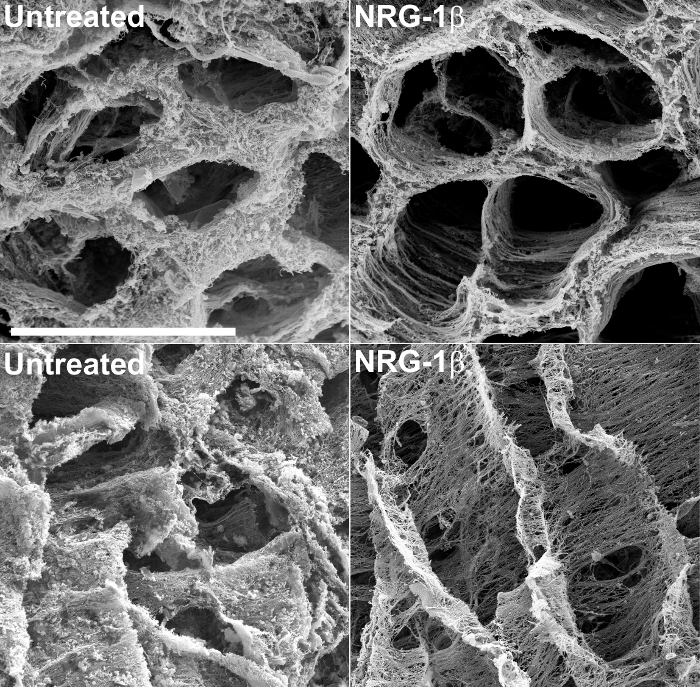
Figura 2:. Representativos de exploración Microscopio electrónico de ventrículo izquierdo de la matriz extracelular en no tratados y NRG-1 β cerdos tratados con, después de NaOH Maceración La matriz de la sección transversal destaca la disposición espacial regular de fibras en el infarto de miocardio post-tratamiento (post-IM) cerdos (arriba a la izquierda), en comparación con los animales tratados post-IM-NRG-1β (arriba a la derecha). Cuando se ve en longitud, la matriz en el ganado porcino sin tratar exhibe una apariencia gruesa, mate-como (parte inferior izquierda), mientras que la matriz de NRG-1ß tratados con cerdosmuestra la disposición espacial regular de fibras (abajo a la derecha). barra blanca = 40 micras (los cuatro paneles). Pueden encontrarse más detalles y cifras se incluyen en el manuscrito 43 asociado. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Exploración de los cambios de la matriz que se producen en los corazones distróficos también ha dado información cualitativa en la progresión y el desarrollo de un modelo animal de la distrofia muscular de cardiomiopatía distrofia (DMD). En ratones mdx, un modelo de ratón de uso común de la DMD, existen diferencias significativas y dependientes de la edad entre los de tipo salvaje y corazones mdx cuando se ve por SEM después de la fijación y el tratamiento NaOH. Como se muestra en la figura 3, componentes de la matriz eran relativamente normal en 6 semanas de edad, los corazones mdx que carecen de distrofina funcional con respecto a los ratones normales. más interesting, organización matriz extracelular estaba claramente perturbado o tal vez degradado en ratones de más edad con deficiencia de distrofina en comparación con los ratones mdx jóvenes, que ilustra la naturaleza progresiva de la DMD en el corazón. No se espera que tales diferencias profundas, porque los ratones mdx son poco representativas de la miocardiopatía DMD humana debido al hecho de que exhiben un fenotipo de cardiomiopatía mucho más suave y la tasa de mortalidad más lento que los seres humanos con DMD 48. Esto sugiere que incluso pequeños cambios en la función del corazón puede ser capturado utilizando la técnica de visualización presentada en este manuscrito. Esta metodología también debería ser fácilmente adaptable a las matrices extracelulares de otros órganos, para los que hay actualmente disponibles Asimismo, no hay terapias fibrosis de metas.

Figura 3: Micrografías representativas electrónicos de barrido de izquierda Venventricular matriz extracelular de tipo salvaje frente a ratones mdx. La matriz de la izquierda ventricular cardíaca en ratones de tipo salvaje (panel superior) es similar a la observada en otras especies. La matriz en ratones mdx a las 6 semanas de edad parece relativamente normal, aunque ligeramente "esponjoso" en apariencia (panel medio). A la inversa, la matriz cardiaco de ratones mdx de edad avanzada aparece gravemente degenerado (panel inferior), indicando que el proceso distrófico puede ser capturado cualitativamente usando SEM en, tejidos macerados-NaOH fijos. Barra blanca = 10 micras (los tres paneles). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Cruz preparación sección de superficie es el paso más crítico durante el protocolo. Para preservar la estructura fina, las muestras deshidratadas deben permanecer en etanol al 100% en todo momento hasta introducido en el proceso de secado de punto crítico. Por lo tanto el corte en lonchas de los especímenes para lograr superficies de exploración EM deben hacerse mientras las muestras se sumergieron en etanol en un plato poco profundo. También es fundamental que la superficie expuesta no se toca o sondeó durante la manipulación posterior. No hay grandes modificaciones se prevén para la aplicación de esta técnica a otros tipos de tejidos para las observaciones de matriz similares, aunque la parte SEM del protocolo podría requerir resolución de problemas básicos de microscopía electrónica independientemente del origen de la muestra. Imágenes recogidas de las muestras fibrosas son propensos a artefactos introducidos por la disipación de carga pobres ( "carga"). problemas de carga general pueden minimizarse mediante la reducción de voltaje de aceleración, el aumento de velocidad de barrido (también llamado tiempo de permanencia) Y la reducción de tamaño de punto del haz de electrones. La integración de varias exploraciones recogió la suficiente rapidez para evitar artefactos de carga producirá una imagen de señal comparable a la calidad del ruido y sin los artefactos de carga presentes en una mayor calidad de imagen de barrido lento, sola.
Esta técnica es intrínsecamente cualitativa y así complementa cuando se considera junto con mediciones cuantitativas (por ejemplo, tricrómico de Masson o picoserius tinción con rojo, la medición del contenido de hidroxiprolina, espectrometría de masas y RNASeq) para determinar cómo las diferencias estructurales visualizados podrían estar relacionados con diversos estados de desarrollo o enfermedades. Sin embargo, a pesar de esta limitación, el método es significativa más allá de la fibrosis cardiaca específicamente, debido a que la matriz extracelular es un componente esencial de casi todos los órganos en el cuerpo. En el corazón, la matriz cardíaca proporciona soporte mecánico crítico para el bombeo continuo caracterizado por el complejo de estiramiento, torsión, y deformación, lo que le confiere una óptima entrada y flujo de salida de la sangre oxigenada y desoxigenada 49 para los> 2.5 millones de latidos que se producen durante la vida humana promedio. Dada la capacidad de regeneración extremadamente bajo de tejido cardiaco, una matriz dinámica que puede ser remodelado de acuerdo a las necesidades contextuales tiene un sentido lógico. Con sólo una ligera extensión de la imaginación, se podría inferir que existen dianas terapéuticas para la manipulación de remodelación de la matriz para mejorar el proceso de curación, al tiempo que limita la fibrosis adverso. La aplicación de la técnica demostrada en un mínimo muestra la sofisticación y la belleza de la matriz cardíaca y, al hacerlo, subraya aún más su importancia funcional.
Mientras que el valor de las medidas cuantitativas es un principio básico para la evaluación de prácticamente todos los estudios experimentales, la técnica destacadas aquí se puede utilizar para revelar variaciones ultraestructurales cualitativos que no sólo complementan mediciones de matriz estándarpero podría sugerir caminos alternativos de investigación para comprender las alteraciones bioquímicas fundamentales que ponen de relieve los cambios cualitativos. Previstos de futuras aplicaciones de esta técnica son su uso en modelos de enfermedades cardiacas y tejidos humanos como una herramienta complementaria para evaluar los cambios de la matriz, así como el uso ampliado para estudiar otros órganos para que los cambios de la matriz son un componente de proceso de la enfermedad.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This study was funded by grants from the National Institutes of Health (NIH), Heart, Lung, and Blood Institute (NIHLB): K01-HL-121045, K08-HL-094703, 5T32HL007411-35, P20 HL101425, U01 HL100398.
Imaging and tissue processing (after NaOH maceration) were performed through the use of the Vanderbilt University Medical Center (VUMC) Cell Imaging Shared Resource (CISR) (supported by NIH grants CA68485, DK20593, DK58404, DK59637 and EY08126). We are especially grateful to the VUMC CISR core directors (Dr. Sam Wells and Dr. W. Gray (Jay) Jerome) for valuable technical advice and also for providing core space and resources for the purposes of filming the technique highlighted in this paper.
We would like to extend our deepest appreciation to Dr. Yan Ru Su and Ms. Kelsey Tomasek in the Cardiology Core Lab for Translational and Clinical Research at Vanderbilt University for providing technical expertise and for collecting human tissue samples used in this study.
Materiales
| Name | Company | Catalog Number | Comments |
| Calcium Chloride | Electron Microscopy Sciences | 12340 | 100 g |
| Carbon Adhesive | Electron Microscopy Sciences | 12664 | 30 g |
| Carbon Adhesive Tabs | Electron Microscopy Sciences | 77825 | order to fit stubs |
| Double Edge Razor Blades Stainless Steel | Ted Pella, Inc | 121-6 | 250/pkg |
| Ethanol | Electron Microscopy Sciences | 15055 | 450 ml |
| Gluteraldehyde, 50% Solution | Electron Microscopy Sciences | 16310 | EM grade, distillation purified |
| Hydrochloric Acid | Electron Microscopy Sciences | 16760 or 16770 | 100 ml |
| Monosodium Phosphate NaH2PO4 | Sigma-Aldrich | S9251-250G | 250 g |
| Osmium Tetroxide | Electron Microscopy Sciences | 19100 | 1 g |
| Silver Conductive Adhesive | Electron Microscopy Sciences | 12686-15 | 15 g |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S8045-1KG | 1 kg |
| Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S3264-500G | 500 g |
| Tannic Acid, 5% Aqueous | Electron Microscopy Sciences | 21702-5 | 500 ml |
| Trihydrate Sodium Cacodylate | Electron Microscopy Sciences | 12300 | 100 g |
| Gold-palladium Alloy or Gold | Refining Systems, Inc. | varies | specific to the sputter coater make and model |
| Critical Point Dryer | Electron Microscopy Sciences | 850 | |
| Plain Wooden Applicators | Fisher Scientific | 23-400-102 | |
| Quanta 250 Environmental SEM | FEI | Q250 SEM | |
| Sputter Coater | Cressington Scientific Instruments Ltd. | Model 108 | |
| Alluminum SEM Sample Stubs | Electron Microscopy Sciences | 75220-12 | specific to the miscroscope |
Referencias
- Robinson, T. F., Cohen-Gould, L., Factor, S. M., Eghbali, M., Blumenfeld, O. O. Structure and function of connective tissue in cardiac muscle: collagen types I and III in endomysial struts and pericellular fibers. Scanning Microsc. 2, 1005-1015 (1988).
- Robinson, T. F., Geraci, M. A., Sonnenblick, E. H., Factor, S. M. Coiled perimysial fibers of papillary muscle in rat heart: morphology, distribution, and changes in configuration. Circ Res. 63, 577-592 (1988).
- Lunkenheimer, P. P., et al. The myocardium and its fibrous matrix working in concert as a spatially netted mesh: a critical review of the purported tertiary structure of the ventricular mass. Eur J Cardiothorac Surg. 29 Suppl 2, S41-S49 (2006).
- Wu, K. C., et al. Late gadolinium enhancement by cardiovascular magnetic resonance heralds an adverse prognosis in nonischemic cardiomyopathy. J Am Coll Cardiol. 51, 2414-2421 (2008).
- Kramer, C. M. The expanding prognostic role of late gadolinium enhanced cardiac magnetic resonance. J Am Coll Cardiol. 48, 1986-1987 (2006).
- Park, S., et al. Delayed hyperenhancement magnetic resonance imaging is useful in predicting functional recovery of nonischemic left ventricular systolic dysfunction. J Card Fail. 12, 93-99 (2006).
- Weber, K. T. Cardiac interstitium in health and disease: the fibrillar collagen network. J Am Coll Cardiol. 13, 1637-1652 (1989).
- Jalil, J. E., Janicki, J. S., Pick, R., Abrahams, C., Weber, K. T. Fibrosis-induced reduction of endomyocardium in the rat after isoproterenol treatment. Circ Res. 65, 258-264 (1989).
- Fidzianska, A., Bilinska, Z. T., Walczak, E., Witkowski, A., Chojnowska, L. Autophagy in transition from hypertrophic cardiomyopathy to heart failure. J Electron Microsc (Tokyo). 59, 181-183 (2010).
- Lopez, B., Querejeta, R., Gonzalez, A., Larman, M., Diez, J. Collagen cross-linking but not collagen amount associates with elevated filling pressures in hypertensive patients with stage C heart failure: potential role of lysyl oxidase. Hypertension. 60, 677-683 (2012).
- Gabbiani, G., Ryan, G. B., Majne, G. Presence of modified fibroblasts in granulation tissue and their possible role in wound contraction. Experientia. 27, 549-550 (1971).
- Lorell, B. H. Diastolic dysfunction in pressure-overload hypertrophy and its modification by angiotensin II: current concepts. Basic Res Cardiol. 87 Suppl 2, 163-172 (1992).
- Friedrich, S. P., et al. Intracardiac angiotensin-converting enzyme inhibition improves diastolic function in patients with left ventricular hypertrophy due to aortic stenosis. Circulation. 90, 2761-2771 (1994).
- Rosker, C., Salvarani, N., Schmutz, S., Grand, T., Rohr, S. Abolishing myofibroblast arrhythmogeneicity by pharmacological ablation of alpha-smooth muscle actin containing stress fibers. Circ Res. 109, 1120-1131 (2011).
- Yue, L., Xie, J., Nattel, S. Molecular determinants of cardiac fibroblast electrical function and therapeutic implications for atrial fibrillation. Cardiovasc Res. 89, 744-753 (2011).
- Rohr, S. Myofibroblasts in diseased hearts: new players in cardiac arrhythmias? Heart Rhythm. 6, 848-856 (2009).
- Coen, M., Gabbiani, G., Bochaton-Piallat, M. L. Myofibroblast-mediated adventitial remodeling: an underestimated player in arterial pathology. Arterioscler Thromb Vasc Biol. 31, 2391-2396 (2011).
- Brilla, C. G., Janicki, J. S., Weber, K. T. Cardioreparative effects of lisinopril in rats with genetic hypertension and left ventricular hypertrophy. Circulation. 83, 1771-1779 (1991).
- Youn, H. J., et al. Relation between flow reserve capacity of penetrating intramyocardial coronary arteries and myocardial fibrosis in hypertension: study using transthoracic Doppler echocardiography. J Am Soc Echocardiogr. 19, 373-378 (2006).
- Warnes, C. A., Maron, B. J., Roberts, W. C. Massive cardiac ventricular scarring in first-degree relatives with hypertrophic cardiomyopathy. Am J Cardiol. 54, 1377-1379 (1984).
- Maron, B. J., Wolfson, J. K., Epstein, S. E., Roberts, W. C. Intramural ('small vessel') coronary artery disease in hypertrophic cardiomyopathy. J Am Coll Cardiol. 8, 545-557 (1986).
- Olivotto, I., et al. Microvascular function is selectively impaired in patients with hypertrophic cardiomyopathy and sarcomere myofilament gene mutations. J Am Coll Cardiol. 58, 839-848 (2011).
- Beltrami, C. A., et al. Structural basis of end-stage failure in ischemic cardiomyopathy in humans. Circulation. 89, 151-163 (1994).
- Factor, S. M., et al. Pathologic fibrosis and matrix connective tissue in the subaortic myocardium of patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 17, 1343-1351 (1991).
- Waller, T. A., Hiser, W. L., Capehart, J. E., Roberts, W. C. Comparison of clinical and morphologic cardiac findings in patients having cardiac transplantation for ischemic cardiomyopathy, idiopathic dilated cardiomyopathy, and dilated hypertrophic cardiomyopathy. Am J Cardiol. 81, 884-894 (1998).
- Schaper, J., Lorenz-Meyer, S., Suzuki, K. The role of apoptosis in dilated cardiomyopathy. Herz. 24, 219-224 (1999).
- de Leeuw, N., et al. Histopathologic findings in explanted heart tissue from patients with end-stage idiopathic dilated cardiomyopathy. Transpl Int. 14, 299-306 (2001).
- Yoshikane, H., et al. Collagen in dilated cardiomyopathy--scanning electron microscopic and immunohistochemical observations. Jpn Circ J. 56, 899-910 (1992).
- Marijianowski, M. M., Teeling, P., Mann, J., Becker, A. E. Dilated cardiomyopathy is associated with an increase in the type I/type III collagen ratio: a quantitative assessment. J Am Coll Cardiol. 25, 1263-1272 (1995).
- Pearlman, E. S., Weber, K. T., Janicki, J. S., Pietra, G. G., Fishman, A. P. Muscle fiber orientation and connective tissue content in the hypertrophied human heart. Lab Invest. 46, 158-164 (1982).
- Huysman, J. A., Vliegen, H. W., Van der Laarse, A., Eulderink, F. Changes in nonmyocyte tissue composition associated with pressure overload of hypertrophic human hearts. Pathol Res Pract. 184, 577-581 (1989).
- Rossi, M. A. Pathologic fibrosis and connective tissue matrix in left ventricular hypertrophy due to chronic arterial hypertension in humans. J Hypertens. 16, 1031-1041 (1998).
- Lopez, B., Gonzalez, A., Querejeta, R., Larman, M., Diez, J. Alterations in the pattern of collagen deposition may contribute to the deterioration of systolic function in hypertensive patients with heart failure. J Am Coll Cardiol. 48, 89-96 (2006).
- Krayenbuehl, H. P., et al. Left ventricular myocardial structure in aortic valve disease before, intermediate, and late after aortic valve replacement. Circulation. 79, 744-755 (1989).
- Schwarz, F., et al. Myocardial structure and function in patients with aortic valve disease and their relation to postoperative results. Am J Cardiol. 41, 661-669 (1978).
- Hein, S., et al. Progression from compensated hypertrophy to failure in the pressure-overloaded human heart: structural deterioration and compensatory mechanisms. Circulation. 107, 984-991 (2003).
- Brooks, W. W., Shen, S. S., Conrad, C. H., Goldstein, R. H., Bing, O. H. Transition from compensated hypertrophy to systolic heart failure in the spontaneously hypertensive rat: Structure, function, and transcript analysis. Genomics. 95, 84-92 (2010).
- O'Hanlon, R., et al. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy. J Am Coll Cardiol. 56, 867-874 (2010).
- Green, J. J., Berger, J. S., Kramer, C. M., Salerno, M. Prognostic value of late gadolinium enhancement in clinical outcomes for hypertrophic cardiomyopathy. JACC Cardiovasc Imaging. 5, 370-377 (2012).
- Frankel, K. A., Rosser, R. J. The pathology of the heart in progressive muscular dystrophy: epimyocardial fibrosis. Hum Pathol. 7, 375-386 (1976).
- Otto, R. K., Ferguson, M. R., Friedman, S. D. Cardiac MRI in muscular dystrophy: an overview and future directions. Phys Med Rehabil Clin N Am. 23, 123-132 (2012).
- Finsterer, J., Stollberger, C. The heart in human dystrophinopathies. Cardiology. 99, 1-19 (2003).
- Galindo, C. L., et al. Anti-remodeling and anti-fibrotic effects of the neuregulin-1beta glial growth factor 2 in a large animal model of heart failure. J Am Heart Assoc. 3, e000773(2014).
- Caulfield, J. B., Borg, T. K. The collagen network of the heart. Lab Invest. 40, 364-372 (1979).
- Ohtani, O. Three-dimensional organization of the connective tissue fibers of the human pancreas: a scanning electron microscopic study of NaOH treated-tissues. Arch Histol Jpn. 50, 557-566 (1987).
- Rossi, M. A., Abreu, M. A., Santoro, L. B. Images in cardiovascular medicine. Connective tissue skeleton of the human heart: a demonstration by cell-maceration scanning electron microscope method. Circulation. 97, 934-935 (1998).
- Icardo, J. M., Colvee, E. Collagenous skeleton of the human mitral papillary muscle. Anat Rec. 252, 509-518 (1998).
- McGreevy, J. W., Hakim, C. H., McIntosh, M. A., Duan, D. Animal models of Duchenne muscular dystrophy: from basic mechanisms to gene therapy. Dis Model Mech. 8, 195-213 (2015).
- Buckberg, G., Hoffman, J. I., Mahajan, A., Saleh, S., Coghlan, C. Cardiac mechanics revisited: the relationship of cardiac architecture to ventricular function. Circulation. 118, 2571-2587 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados