Method Article
複雑な生体試料から選択的グリコシル化ペプチドを豊かにするためにレクチンHPLC法
要約
レクチン抱合POROSビーズはHPLCに使用した。糖ペプチドの基準は、ポジティブとネガティブコントロールとして役立った。 MARS - 14欠乏、トリプシン消化したヒト血漿をクロマトグラフィー及びフロースルー(FT)と結合した分画はESI-LC-MS/MS分析のために収集された。 FTに比べて糖ペプチドを結合画分に濃縮した。
要約
糖鎖は翻訳後修飾の重要なクラスです。一般的に分泌し、細胞外分子に見られる、糖鎖構造は細胞の内部状態を通知。腫瘍細胞上の糖鎖は、豊富なシアル酸およびフコース部分を持っている傾向がある。我々は、これらの癌関連糖鎖の変異体は、初期段階の疾患の診断を目指したバイオマーカー開発のために利用されることを提案する。したがって、我々は、レクチン、特定の糖鎖構造に結合するタンパク質から形成された親和性のマトリックスでのクロマトグラフィーを組み込んだ質量分析ベースのワークフローを開発しました。それぞれ、シアル酸およびフコースに結合するレクチンニワトコ黒(SNA)とヒイロチャワンタケ(AAL)は、共有結合POROSビーズ(アプライドバイオシステムズ社)に結合し、高圧液体クロマトグラフィー(HPLC)用PEEK製カラムに充填した。 (;アジレントMARS - 14)簡単に言うと、プラズマは、マルチプルアフィニティ除去システムを使用してfourteen最も豊富な蛋白質の枯渇した。枯渇したプラズマは、SNAまたはAAL HPLCによるトリプシン消化し、フロースルーと結合した画分に分離した。画分をN -結合型グリカンを除去するPNGaseFで処理し、QSTARのエリートのLC-MS/MSで分析した。データは、マスコットのソフトウェアを用いて分析した。実験的なデザインは、サッカロマイセスセレビシエ-レクチンキャプチャの特異性を監視するために使用されてからポジティブコントロール-フコシル化とシアル酸ヒトラクトフェリンの糖ペプチドとコントロールの高マンノース糖陰性が含まれています。このワークフローの主な機能は、HPLCのフォーマット、それらの脱アミドAsn-Xxx-Ser/ThrのモチーフからキャプチャしたとPNGaseF処理糖ペプチドの正の同定、および糖タンパク質の標準を使用して、品質評価から得られる再現性が含まれています。プロトコル最適化はまた、カラムの容量に、出発物質の最も効率的なキャプチャと溶出バッファーを識別し、完全な脱グリコシル化を確保するためにPNGaseF処理を監視するのに適切な比率を決定するが含まれています。今後の方向性は、乳がん患者と対照個体からのプラズマの質量分析ベースの検出実験を実行するには、このワークフローを使用して含まれています。
プロトコル
1)レクチンコンジュゲートPOROSカラムを準備します。
- 1.2 - 手順1.1の間にPOROS - ALのビーズの吸入を防ぐためにマスクを着用します。 POROSビーズの所望の量(100 mgのbeads/300μlの最終容量)を秤量し、清潔なエッペンドルフチューブに移す。
- 1 mLのリン酸緩衝食塩水(PBS)を加えてビーズを洗浄してください。 3分、最高速度で遠心の遠心分離によってペレットのビーズ。上清を除去し、洗浄を繰り返します。
- 非抱合型レクチンの所望の量(1 - 4 mgの/ 200μlのビーズ)を秤量し、清潔なエッペンドルフチューブに移す。 5を形成するためにPBSを追加 - 20 mg / mLのソリューション。このソリューションの準備25μlの。
- POROSビーズに、残りのレクチン溶液を移す。最終濃度50mMに、シアノ水素化ホウ素ナトリウムを追加。ロッカー上にチューブを置き、一晩室温で反応する。 (注:シアノ水素化ホウ素ナトリウムは毒性があり、ドラフト内で処理する必要が汚染された廃棄物は適切に処分する必要があります。。)
- ステップ1.2のようにペレットPOROSビーズ。上清を除去し、後の共役ソリューションとして保存。
- 1 mLの焼入れバッファー(1 Mトリス- Cl、pH7.4)でビーズを洗浄する。ステップ1.2と安全にペレットのビーズは、上清を捨てる。
- 1 mLの焼入れBufferでPOROSビーズの残りの反応部位をブロックする。最終濃度50mMに、シアノ水素化ホウ素ナトリウムを追加。ロッカー上にチューブを置き、30分間室温でインキュベートする。
- ステップ1.2のようにペレットのビーズと上清を捨てる。
- 1 mLの1 M NaClでビーズを洗浄してください。ペレットは、ビーズと上清を捨てる。 5回の洗浄の合計4回を繰り返します。ビーズは今パックする準備が整いました。
- POROSビーズに結合させたタンパク質の量を決定するために、事前にコンジュゲートとポスト共役レクチンソリューションのタンパク質濃度のアッセイを行います。濃度の違いは、ビーズに結合させたタンパク質の量です。ビーズ体積あたりの結合タンパク質の量は、ビーズ上のレクチンの濃度に等しい。ターゲットのレクチンの濃度は2 -20 mg / mLの間です。
2)PEEK製カラムにレクチンコンジュゲートPOROSビーズパッキング
- 包装システムを組み立て(説明が続く)と金属製のリングスタンドでそれをサポートしています。パッキングシステムは、エンドカラムカプラー1、フリット、カラム(2 × 50 mm)の、最後のカラムカプラ2、列のコネクタ、エンドカラムカプラー3カラム(4.5 × 50 mm)を、圧力制限器、下から上に、構成されています最後のカラムカプラ4とエンドフィッティング。上部の列には、梱包材のための貯水池として機能します。
- バッファの任意のボリューム(10mMトリス緩衝液、pH7.4、150mM塩化ナトリウム、10mMの塩化カルシウム、10mMの塩化マグネシウム)でPOROSビーズを再懸濁します。つの列(〜200μlのベッドボリューム)を梱包の場合、400μlのBuffer Aに懸濁する
- アッパーカラム(リザーバー)に共役POROSビーズを転送する。バッファーがカラムの上部に到達するまで貯留するバッファに追加します。ゆっくりとカラムに気泡を回避しよう、列の一番上にエンドフィッティングを置きます。 HPLCシステムに上部のカラムのエンドフィッティングを接続します。
- システムを介してバッファを流してカラムをパック。 0.5mL /分の流速で始まります。 4mL /分または最大圧力(3000 psi)のどちらかに達するまで、0.5mL /分毎分によって流量を増加させる。バッファの少なくとも35 mLをカラムを通過するまで、可能な最大流量で継続する。
- ポンプの電源をオフにし、カラムの圧力が<20 psiにドロップすることができます。
- ゆっくりと、上から、包装システムを分解。最後のカラムカプラ2に達したときに、慎重に取り外します。いくつかのパックされた材料は、塔頂から押出されるべきである。かみそりの刃または類似の鋭いエッジで、静かに列の最上部でさえあるビーズ表面を残して、押し出しビーズを拭き取ってください。これを行う間、ビーズに圧力をかけないでください。
- リングスタンドから充填したカラムを外します。新しいエンドのカプラーに新しいフリットを置き、オープン(旧トップ)コラムの端にフリット/エンドカプラーでこれを接続するための充填カラムを裏返します。
- 適切な列にラベルを付けます。それを使用する準備が整いました。使用しないときは、列を4で0.02%のアジ化ナトリウム℃で6ヶ月までのCを含むPBSに格納されていない可能性があります。
3)プログラムのHPLC法
- あなたのHPLCのプログラミングの詳細については、製造元のソフトウェアの仕様に応じて異なります。我々はMichromパラダイムMG4 HPLCを使用してください。このマシン上で、メソッドは画面の上部にある"設定"タブの下に構築され、アクセスされます。次のメソッドをプログラム:
タイム 流量(μL/分) % %のB 午後12時 50 100 0 午前9時00分 50 100 0 9時01 500 0 100 13時50分 500 0 100 夜01時51分 3000 100 0 午前19時50分 3000 100 0
10mMトリス緩衝液(pH7.4)、150mMの塩化ナトリウム、10mMの塩化カルシウム、10mMの塩化マグネシウム:バッファ
バッファーB:0.5 M酢酸
UV検出器は、0:00から午前19時50分に280 nmで読み込むようにプログラムする必要があります。 。50 AU - y軸は低吸光度レベルが、 例えば 、0を検出するために調整する必要があります。 - オートサンプラが使用可能な場合は、フラクションコレクションのための次のスケジュールをプログラムする。クロマトグラフィーを行うときに示されるようにそうでなければ、手で画分を集めた。
分数 試料注入から収集するまでの遅延 コレクションの持続時間(分) フロースルー 2.8 4.1 バインド 9 2.6
4)HPLC用サンプルを調製
- このプロトコルで使用する前に、ヒト血漿は、MARSの列(;サンタクララ、カリフォルニア州アジレント)を用いて14最も豊富なタンパク質の枯渇してください。枯渇した血漿、ヒトラクトフェリンおよび酵母インベルターゼは、前述の1としてトリプシン消化し 、脱塩し、個別にする必要があります。
- レクチン特異ラクトフェリン標準を準備するには、第3の方法を使用してAALまたはSNAの列のいずれかを介してラクトフェリンをトリプシン消化50μgの上でクロマトグラフィーを行う。結合画分は、レクチン固有のラクトフェリンの糖ペプチドが含まれます。パート6のようにパート4.4のようなサンプル、および脱塩を中和する。得られた試料の使用準備が整う1 mLの緩衝液Aでサンプルを再懸濁します。
- 3つの実験が実行される複製。三人複製用にサンプルを準備するには、30μlのMARS枯渇、トリプシン消化、プラズマ同等物(PE)のトリプシン消化インベルターゼとレクチン特異ラクトフェリン(どちらAAL - LACまたはSNA - LAC)を1μlの3 pmolのを追加。 PEは、処理血漿(MARS欠乏およびトリプシン消化)の所定量が由来するnon-processed/intact/originalプラズマの体積として定義されています。 330μlの最終容量に到達するためのサンプルにバッファに追加します。
- 溶出液を収集するサンプルバイアルに、中和バッファー(1 MトリスpH8.0)を追加します。作業対象とバイアルの数とボリュームは、オートサンプラの制約に依存するであろう。 MG4パラダイムの場合は、1バイアルは、フロースルーと二人溶出液を収集する収集します。それは、約1.5 mLのトリス緩衝液で溶出液を1 mLを中和するために必要になります。ターゲット中和pHが7.0から8.0であり、pH指示薬の紙でテストのテストの最終pH。
5)クロマトグラフィーを実行
- 続くすべてのブランクとサンプルの実行は、パート1に記載の方法を使用します。列とバッファが使用中に室温でいます。バッファーは室温で保存されている間、列は、4℃で保存されています。
- HPLCシステムのいずれかにAALまたはSNAレクチンカラムを取り付けて2行の空のメソッドを(のみバッファを注入する)を実行します。レクチンカラムはレクチン固有のラクトフェリン(パート2)に対応していることを確認してください。
- HPLCの実行7の合計のために、各注入試料との間に空白を注入し、3つのプラズマのサンプルをクロマトグラフ。ブランクランからの画分は、収集する必要はありません。
6)脱塩画分を集め
各分画のために次のように1つ1 mLのウォーターズオアシスHLB SPEカートリッジを使用します。
- 真空マニホールドに必要なカートリッジの数を取り付けます。
- 1%ギ酸( - 20 lnHgマニホールド上に真空計が5をお読みください)に1 mLの80%ACNで各カートリッジを濡らす。
- 1.5 mLの0.1%ギ酸( - 20 lnHgマニホールド上に真空計が5をお読みください)でカートリッジを平衡化する
- つのカートリッジの上に一つのサンプルのボリューム全体をロードする(マニホールド上に真空ゲージは2をお読みください - 2.5 lnHgを、と流速は1 mL /分を超えないようにしてください)
- 3 × 1 mLの0.1%ギ酸でカートリッジを洗浄してください(マニホールド上に真空計が5をお読みください - 20 lnHgを)
- 0.1%ギ酸で1 × 1 mLの80%アセトニトリルで標識したエッペンドルフチューブに溶出ペプチド/糖ペプチド。シングルコレクションチューブが各カートリッジに使用されるべきである - (2.5 lnHgを、そして流速は1mL /分を超えないようにしてくださいマニホールド上の真空計は、2をお読みください。)。
- それぞれのコレクションチューブに60μlの0.5 M炭酸水素アンモニウムを添加することにより溶出液を中和する。ターゲットneutralized pHは7.0から8.0です。pH指示薬の紙でテスト最終pH。
- 〜2時 間@ 35℃のために( 例えば、サーモSavantのSpeedVac)真空遠心分離でそれらを実行することによって溶出されたペプチド/〜50μLの糖ペプチドを濃縮する
7)PNGase F消化
- それを確実にするために、テストサンプルのpHは7.0の間です - 8.0。必要に応じて、pHを上げるために50 mM重炭酸アンモニウムを追加。それは50〜100μlの間になるまでであれば、最終的なサンプル量は> 100μlを、speedvacサンプルです。
- 37℃で一晩各サンプルチューブとインキュベートする0.5μlの(250 U)グリセロールフリーPNGase Fを追加します。
8)郵便番号のヒントのサンプル
- PNGase F消化サンプルから始めて、次のようにそれぞれをziptip。
- 10μlの100%アセトニトリル、10μlの80%アセトニトリル、0.1%ギ酸が続くとウェットziptip。
- 20μlの0.1%ギ酸でziptipを平衡化させます。
- ziptipの行列を上下に10回、それをピペッティングすることによりziptipにサンプルをロードします。
- 10μlの0.1%ギ酸、5回ピペッティングしてziptipを洗ってください。
- 10μlの80%アセトニトリル、0.1%ギ酸できれいなエッペンドルフチューブにサンプルを溶出させる。
- 溶出を繰り返すと、同じチューブに次の10μlを加える。
- <2μlのためにサンプルをSpeedvac。
- 20μlの0.1%ギ酸でサンプルを再懸濁します。現在、サンプルLC-MS/MSによる分析のための準備が整いました。
9)代表的な結果:
20 mg / mlの - POROSの接合は、通常2の範囲内で、ビーズレクチン濃度が得られます。これは、アフィニティークロマトグラフィーに最適です。
トリプシン消化MARS欠乏ヒト血漿のレクチンクロマトグラフィーが一般的に結合画分の糖ペプチドを豊かに。糖ペプチドがPNGase前LC-MS/MSにF -扱われるように、それらはアスパラギンがに変換されているN -結合コンセンサス配列、NXS / T(Xは任意の残留物がプロリンである)、を有するペプチドとして同定されていますこれらの特性を持つPNGase Fのペプチドの作用によってアスパラギン酸は、脱グリコシル化ペプチド(または"deglycopeptides")とみなされます。結合画分に回収されたペプチドの30〜50%がdeglycopeptidesであるのに対し、平均でAALまたはSNAクロマトグラフィーからのフロースルー(FT)割合は、2〜4%のdeglycopeptidesが含まれています。通常は、QSTARエリートを使用して、1000年から1300年のペプチドは、FTの割合で識別される、および200から400ペプチドを結合画分で識別されます。二つ以上の別個のインベルターゼdeglycopeptidesは、FTフラクションと結合画分(表1)、2つ以上の別々のラクトフェリンのdeglycopeptidesで観察されるべきである。
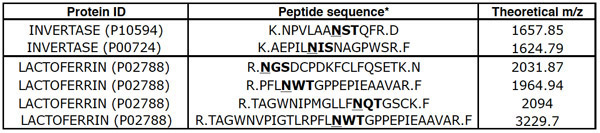
表1。
ディスカッション
このプロトコルは糖鎖特異的に糖ペプチドを単離および同定するための迅速な方法を提供する。グリコシル化は、特に開発や病態の間に、生体内で広範囲に変化するにつれ、この手法は、質問の様々な対処するために必要となる場合があります。特に、我々は選択的バイオマーカー探索への第一歩として、癌関連エピトープで変更された糖ペプチドを豊かにする方法を使用しています。
謝辞
この作品は、がんイニシアティブ、5U24CA126477 - 04の臨床プロテオミクス技術によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Human plasma | We make this in house | ||
| Human lactoferrin | Sigma-Aldrich | L0520 | Trypsin-digest before use |
| Yeast invertase | Sigma-Aldrich | I0408 | Trypsin-digest before use |
| Oass HLB SPE cartridges | Waters | WAT094225 | 1 cc volume |
| ZipTip pipet tips | Fisher Scientific | ZTC1 8M0 96 | Millipore, C18 for 10 ml pipette |
| Tris | Fisher Scientific | BP154-1 | 99% |
| Ammonium bicarbonate | Sigma-Aldrich | A6141 | 99% |
| Calcium chloride | Sigma-Aldrich | C4901 | 96% |
| Magnesium chloride | Sigma-Aldrich | M8266 | 98% |
| Acetic acid | Sigma-Aldrich | 242853 | 99.7% |
| pH indicator paper | Fisher Scientific | M95903 | Range 0-14 |
| Acetonitrile | Fisher Scientific | A998 | 99.9% |
| Formic acid | Pierce, Thermo Scientific | 28905 | 99% |
| Phosphate-buffered saline | Invitrogen | 14190-136 | Without calcium and magnesium |
| Sodium azide | Sigma-Aldrich | 71289 | 99.5% |
| PNGase F | New England Biolabs | P0705L | Glycerol-free |
| Vacuum-filter flasks | Fisher Scientific | SCGVU05RE | 0.2 mm pores |
| POROS-AL beads | Applied Biosystems | 1-6028-02 | |
| Aleuria aurantia lectin | Vector Laboratories | L-1390 | |
| Sambucus nigra agglutinin | Vector Laboratories | L-1300 | |
| Sodium cyanoborohydride | Sigma-Aldrich | 296945 | 5.0 M solution |
参考文献
- Keshishian, H. multiplexed assays for low abundance proteins in plasma by targeted mass spectrometry and stable isotope dilution. Mol Cell Proteomics. 6, 2212-2229 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved