Method Article
Une méthode CLHP lectine pour enrichir sélectivement peptides glycosylés d'échantillons biologiques complexes
Dans cet article
Résumé
Lectine conjuguée perles POROS étaient employés pour la HPLC. Normes glycopeptides ont servi de contrôles positifs et négatifs. MARS-14 appauvri, digérés par la trypsine plasma humain a été chromatographié et accréditives (FT) et les fractions collectées liés à des analyses ESI-LC-MS/MS. Glycopeptides ont été enrichis dans la fraction liée par rapport à FT.
Résumé
Glycanes sont une classe importante de modifications post-traductionnelles. On trouve généralement sur sécrétées et les molécules extracellulaires, structures glycanniques de signal du statut interne de la cellule. Glycanes sur les cellules tumorales ont tendance à avoir en abondance des fragments d'acide sialique et le fucose. Nous proposons que ces variantes associées au cancer glycane être exploité pour le développement de biomarqueurs visant à diagnostiquer à un stade précoce de la maladie. En conséquence, nous avons développé un spectromètre de masse à base de workflow qui intègre une chromatographie sur des matrices d'affinité formé à partir des lectines, des protéines qui se lient structures glycanniques spécifiques. Les lectines Sambucus nigra (SNA) et Aleuria aurantia (AAL), qui lient l'acide sialique et le fucose, respectivement, ont été couplés de manière covalente à des billes Poros (Applied Biosystems) et emballés dans des colonnes PEEK pour la chromatographie liquide à haute pression (CLHP). Brièvement, le plasma était appauvri des quatorze protéines les plus abondantes en utilisant un système d'affinité plusieurs retrait (MARS-14; Agilent). Plasma appauvri a été digérés par la trypsine et séparés en flux continu et des fractions lié par SNA ou AAD HPLC. Les fractions ont été traitées avec PNGaseF pour enlever N-glycanes, et analysés par LC-MS/MS sur une Elite QStar. Les données ont été analysées en utilisant le logiciel Mascot. Le dispositif expérimental comprenait contrôles positifs-fucosylé et sialylées humaine glycopeptides et la lactoferrine négatifs des contrôles de haut glycopeptides mannose à partir de Saccharomyces cerevisiae, qui ont été utilisés pour contrôler la spécificité de la capture lectine. Les principales caractéristiques de ce flux de travail comprennent la reproductibilité dérivé du format HPLC, l'identification positive des glycopeptides capturé et PNGaseF traités de leurs motifs Asn-Xxx-Ser/Thr désamidés, et évaluation de la qualité selon les normes glycoprotéine. Protocole d'optimisation comprenait également déterminer le ratio approprié de matériau de départ à la capacité de la colonne, l'identification de la capture la plus efficace et tampons d'élution, et le suivi des traitements PNGaseF pour assurer déglycosylation plein. Les orientations futures comprennent l'utilisation de ce flux de travail pour effectuer des expériences de masse de découverte basée sur la spectrométrie de plasma de patients du cancer du sein et les individus de contrôle.
Protocole
1) Préparer lectine conjuguée colonnes POROS
- Mettez un masque pour se protéger contre l'inhalation de Poros-AL perles au cours des étapes 1.1 à 1.2. Peser la quantité désirée de perles POROS (100 mg beads/300 volumes ul finale) et transférer dans un tube propre Eppendorf.
- Lavez perles avec addition de 1 ml de tampon phosphate salin (PBS). Perles par centrifugation dans une microcentrifugeuse à vitesse maximale pendant 3 minutes. Enlever le surnageant et répéter le lavage.
- Peser la quantité désirée de lectine non conjuguée (1 - 4 mg / 200 perles ul) et transférer dans un tube propre Eppendorf. Ajouter PBS pour former un 5 - 20 mg / ml solution. Réserve 25 ul de cette solution.
- Transférer la solution de lectine restantes aux billes Poros. Ajouter cyanoborohydrure de sodium à une concentration finale de 50 mM. Placer le tube sur une bascule et réagir une nuit à température ambiante. (Remarque:. Cyanoborohydrure de sodium est toxique et doit être manipulé sous une hotte de déchets contaminés doivent être éliminés de façon appropriée.)
- Pellet les perles POROS comme à l'étape 1.2. Retirer le surnageant et enregistrer en tant que solution de post-conjugaison.
- Lavez perles avec une mémoire tampon Trempe ml (1 M de Tris-Cl, pH 7,4). Perles Pellet comme à l'étape 1.2 et jetez le surnageant.
- Bloquer les sites restants réactive sur les perles POROS avec 1 ml de tampon trempe. Ajouter cyanoborohydrure de sodium à une concentration finale de 50 mM. Placer le tube sur une bascule et incuber à température ambiante pendant 30 min.
- Perles Pellet comme à l'étape 1.2 et éliminer le surnageant.
- Lavez perles avec 1 ml de NaCl 1 M. Perles Pellet et éliminer le surnageant. Répétez quatre fois pour un total de cinq lavages. Les perles sont maintenant prêtes à emballer.
- Pour déterminer la quantité de protéine qui a été conjugué à des perles Poros, effectuer un dosage de la concentration de protéines sur les solutions pré-conjugués lectine et post-conjugué. La différence dans les concentrations est la quantité de protéine qui a été conjugué à des billes. La quantité de protéines conjuguées par volume est égal à billes de la concentration de lectine sur les billes. Les concentrations cibles sont lectine entre 2 à 20 mg / mL.
2) Emballage des perles lectine conjuguée POROS dans une colonne en PEEK
- Assemblez le système d'emballage (description ci-dessous) et l'appuyer sur un stand anneau de métal. Le système d'emballage se compose, de bas en haut, limiteur de pression, colonne de fin coupleur 1, fritte, la colonne (2 x 50 mm), coupleur colonne de fin 2, connecteur colonne, colonne de fin coupleur 3, colonne (4,5 x 50 mm), 4 coupleur extrémité de colonne et de raccord d'extrémité. La colonne supérieure sert de réservoir pour les matériaux d'emballage.
- Resuspendre les perles POROS au volume désiré de tampon A. (10 mM tampon Tris, pH 7,4, chlorure de sodium 150 mM, 10 mM de chlorure de calcium, chlorure de magnésium 10 mM) Si l'emballage d'une colonne (~ 200 ul volume de lit), remettre en suspension dans 400 pi de tampon A.
- Transfert conjugué perles POROS dans la colonne supérieure (réservoir). Ajouter le tampon A au réservoir jusqu'à ce que la mémoire tampon atteint le sommet de la colonne. Placez délicatement l'embout sur le haut de la colonne, en essayant d'éviter les bulles d'air dans la colonne. Branchez le raccord d'extrémité de la colonne supérieure pour le système HPLC.
- Pack de la colonne par l'écoulement tampon A travers le système. Commencez avec un débit de 0,5 mL / min. Augmenter le débit de 0,5 ml / min jusqu'à ce chaque minute soit 4 mL / min ou la pression maximale (3000 psi) a été atteint. Continuer au débit maximum possible au moins jusqu'à 35 ml de tampon A sont passés par la colonne.
- Éteignez les pompes et laisser la pression sur la colonne pour tomber à <20 psi.
- Doucement, démonter le système d'emballage, en commençant par le haut. Lorsque le coupleur 2 extrémité de colonne est atteinte, retirez-le soigneusement. Certains documents doivent être emballés extrusion à partir du haut de la colonne. Avec une lame de rasoir ou semblable tranchant, doucement essuyer les perles extrusion, laissant une surface perles qui est encore avec le haut de la colonne. Ne pas appliquer de pression sur les billes pendant cette opération.
- Dégagez la colonne remplie du stand anneau. Placez une fritte nouveau dans un coupleur nouvelle fin et tournez la colonne à garnissage plus se connecter cela avec le coupleur fritte / Fin de la fin de colonne (anciennement haut) ouvert.
- Étiquette de la colonne appropriée. Il est maintenant prêt à l'emploi. Lorsqu'il n'est pas utilisé, la colonne peut être stockée dans du PBS avec 0,02% d'azide de sodium à 4 ° C pour un maximum de 6 mois.
3) Programme de la méthode HPLC
- Les détails de la programmation de votre HPLC varient selon les spécificités du logiciel du fabricant. Nous utilisons un paradigme Michrom MG4 HPLC. Sur cette machine, les méthodes sont construites et sont accessibles sous la rubrique "Configuration" onglet en haut de l'écran. Programme de la méthode suivante:
Temps Débit (l / min) % A % B 00:00 50 100 0 09:00 50 100 0 09:01 500 0 100 13:50 500 0 100 13:51 3000 100 0 19:50 3000 100 0
Tampon A: 10 mM tampon Tris, pH 7,4, chlorure de sodium 150 mM, 10 mM de chlorure de calcium, chlorure de magnésium 10 mM
Tampon B: 0,5 M d'acide acétique
Le détecteur UV doit être programmé pour lire à 280 nm 0h00-19h50. L'axe des y doit être ajustée afin de détecter des niveaux faibles d'absorbance, par exemple, 0 -. 50 UA. - Si un échantillonneur automatique est disponible, le programme le calendrier suivant pour la collecte de fractions. Sinon, collecter les fractions par la main comme indiqué lors de l'exécution de chromatographie.
Fraction Retard à la collecte d'injection de l'échantillon Durée de la collecte (min) Accréditives 2.8 4.1 Liés 9 2.6
4) Préparer les échantillons pour HPLC
- Avant d'utiliser ce protocole, le plasma humain doit être appauvri sur les 14 protéines les plus abondantes en utilisant une colonne MARS (Agilent, Santa Clara, CA). Plasma appauvri, la lactoferrine humaine et l'invertase de la levure doit être individuellement digérés par la trypsine et dessalé comme décrit précédemment 1.
- Pour préparer la lectine spécifique lactoferrine standard, effectuer une chromatographie sur 50 ug digérés par la trypsine lactoferrine ni sur la AAD ou la colonne SNA en utilisant la méthode dans la partie 3. La fraction liée contiendra lectine spécifique glycopeptides lactoferrine. Neutraliser les échantillons que dans la partie 4.4, et dessaler comme dans la Partie 6. Resuspendre l'échantillon dans une mémoire tampon A. mL L'échantillon résultant est prêt à l'emploi.
- Trois expérimentale reproduit sera effectuée. Pour préparer l'échantillon pour trois répétitions, ajouter 3 pmol de trypsine digère invertase et 1 pl de la lectine spécifique lactoferrine (AAD soit-ALC ou SNA-ALC) à 30 ul MARS appauvri, digérés par la trypsine équivalents à plasma, (PE). Un PE est définie comme le volume de plasma non-processed/intact/original partir de laquelle une quantité donnée de traitement du plasma (MARS-appauvri et la trypsine digéré) a été dérivé. Ajouter le tampon A à l'échantillon pour atteindre un volume final de 330 pl.
- Ajouter tampon de neutralisation (Tris 1 M pH 8,0), les flacons d'échantillon qui permettra de recueillir l'éluat. Le nombre et le volume des flacons que vous travaillez avec dépendra des contraintes de votre échantillonneur automatique. Pour le paradigme MG4, un flacon recueille les accréditives et deux recueillir l'éluat. Il aura besoin d'environ 1,5 ml de tampon Tris pour neutraliser 1 ml d'éluat. PH cible neutralisée est de 7,0 à 8,0; pH test de test final avec un papier indicateur de pH.
5) Effectuer la chromatographie
- Toutes les pistes vierges et de l'échantillon qui suivent utiliseront la méthode décrite dans la Partie 1. La colonne et les tampons sont à température ambiante pendant son utilisation. Les colonnes sont stockées à 4 ° C, tandis que les tampons sont stockés à température ambiante.
- Fixez soit l'AAL ou la colonne de lectine SNA au système HPLC et exécuter deux méthodes vierge (injection de tampon que A). Assurez-vous que la colonne de lectine correspond à la lactoferrine lectine spécifique (Partie 2).
- Chromatographe les trois échantillons de plasma, l'injection d'un vide entre chaque échantillon injecté, pour un total de pistes HPLC 7. Les fractions de passe vierge ne pas être collectées.
6) Dessaler fractions collectées
Pour chaque fraction utiliser un 1 ml Eaux Oasis HLB cartouche SPE comme suit:
- Fixer le nombre de cartouches nécessaires pour collecteur à vide.
- Mouiller chaque cartouche avec une ACN ml à 80% dans l'acide formique 1% (indicateur de vide sur le collecteur doit lire 5 à 20 lnHg).
- Equilibrer les cartouches avec 1,5 ml d'acide formique à 0,1% (jauge à vide sur le collecteur doit lire 5 à 20 lnHg)
- Chargez le volume entier d'un échantillon sur une cartouche (Vacuomètre sur le collecteur doit lire 2 - 2.5. LnHg, et le débit ne doit pas dépasser 1 mL / min)
- Lavez les cartouches avec 3 x 1 ml d'acide formique à 0,1% (Vacuomètre sur le collecteur doit lire 5 à 20 lnHg)
- Peptides Eluer / glycopeptides dans des tubes Eppendorf étiqueté avec 1 x 1 ml d'acétonitrile de 80% dans l'acide formique à 0,1%. (Vacuomètre sur le collecteur doit lire de 2 à 2,5 lnHg, et le débit ne doit pas dépasser 1 mL / min.) Un tube de prélèvement unique devrait être utilisé pour chaque cartouche.
- Neutraliser éluat en ajoutant 60 pl 0,5 M de bicarbonate d'ammonium dans chaque tube de collecte. Target neutrpH de 7.0 à 8.0 est croissante est; pH test final avec un papier indicateur de pH.
- Concentré de peptides élués / glycopeptides à ~ 50 pl en les exécutant sur une centrifugeuse sous vide (par exemple, un Thermo Savant SpeedVac) pour ~ 2 hrs @ 35 ° C.
7) PNGase F-digestion
- PH de l'échantillon de test pour s'assurer qu'elle se situe entre 7,0 à 8,0. Si nécessaire, ajoutez du bicarbonate d'ammonium 50 mM pour augmenter le pH. Si le volume de l'échantillon final est> 100 pi, l'échantillon speedvac jusqu'à ce qu'il soit entre 50-100 ul.
- Ajouter 0,5 ul (250 U) de glycérol sans PNGase F à chaque tube d'échantillon et incuber à 37 ° C pendant la nuit.
8) échantillons Astuce Zip
- En commençant par la PNGase F-digérée échantillons, ZipTip chacun comme suit.
- ZipTip humide avec 10 ul d'acétonitrile 100%, suivie par 10 à 80% d'acétonitrile ul, 0,1% d'acide formique.
- Equilibrer ZipTip avec 20 ul d'acide formique 0,1%.
- Chargez l'échantillon sur l'ZipTip en le pipetage haut et en bas à travers la matrice ZipTip 10 fois.
- Laver les ZipTip par pipetage 10 ul d'acide formique 0,1%, 5 fois.
- Eluer l'échantillon dans un tube propre eppendorf avec 10 ul d'acétonitrile 80%, 0,1% d'acide formique.
- Répéter l'élution et ajouter le second 10 ul dans le même tube.
- Speedvac les échantillons d'un volume de <2 pl.
- Remettre en suspension dans les échantillons d'acide formique 20 ul de 0,1%. Les échantillons sont maintenant prêtes pour l'analyse par LC-MS/MS.
9) Les résultats représentatifs:
La conjugaison POROS rendements généralement sur-perle concentrations lectine dans la gamme de 2 - 20 mg / mL. Ceci est optimal pour la chromatographie d'affinité.
Chromatographie lectine de digérés par la trypsine plasmatique MARS appauvri humaine enrichit généralement glycopeptides dans la fraction liée. Comme les glycopeptides sont PNGase F-traités avant LC-MS/MS, ils sont identifiés comme des peptides avec la séquence consensus N-liés, NXS / T (où X est un résidu, mais la proline), dans laquelle l'asparagine a été converti en un acide aspartique par l'action des peptides de F. PNGase avec ces caractéristiques sont considérées comme des peptides déglycosylé (ou "deglycopeptides"). En moyenne, le flux continu (FT) fraction d'AAL ou SNA chromatographie contient deglycopeptides 2-4%, alors que 30-50% des peptides récupérés dans la fraction liée sont deglycopeptides. Généralement, l'aide d'une élite QStar, 1000-1300 peptides seront identifiés dans la fraction FT, et 200-400 peptides seront identifiés dans la fraction liée. Deux ou plusieurs deglycopeptides invertase distinctes doit être observée dans la fraction FT et deux ou plus distinctes deglycopeptides lactoferrine dans la fraction liée (tableau 1).
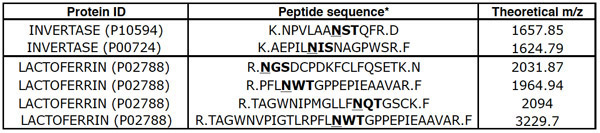
Tableau 1.
Discussion
Ce protocole fournit une méthode rapide pour isoler et identifier les glycopeptides de manière glycane-spécifiques. Comme glycosylation varie largement au sein d'un organisme, en particulier pendant le développement et la pathogenèse, cette technique peut être applicable à aborder un large éventail de questions. En particulier, nous utilisons la méthode de façon sélective d'enrichir glycopeptides qui ont été modifiés avec le cancer associés à des épitopes comme une première étape vers la découverte de biomarqueurs.
Remerciements
Ce travail a été soutenu par le Clinical Technologies protéomiques pour le cancer initiative, 5U24CA126477-04.
matériels
| Name | Company | Catalog Number | Comments |
| Human plasma | We make this in house | ||
| Human lactoferrin | Sigma-Aldrich | L0520 | Trypsin-digest before use |
| Yeast invertase | Sigma-Aldrich | I0408 | Trypsin-digest before use |
| Oass HLB SPE cartridges | Waters | WAT094225 | 1 cc volume |
| ZipTip pipet tips | Fisher Scientific | ZTC1 8M0 96 | Millipore, C18 for 10 ml pipette |
| Tris | Fisher Scientific | BP154-1 | 99% |
| Ammonium bicarbonate | Sigma-Aldrich | A6141 | 99% |
| Calcium chloride | Sigma-Aldrich | C4901 | 96% |
| Magnesium chloride | Sigma-Aldrich | M8266 | 98% |
| Acetic acid | Sigma-Aldrich | 242853 | 99.7% |
| pH indicator paper | Fisher Scientific | M95903 | Range 0-14 |
| Acetonitrile | Fisher Scientific | A998 | 99.9% |
| Formic acid | Pierce, Thermo Scientific | 28905 | 99% |
| Phosphate-buffered saline | Invitrogen | 14190-136 | Without calcium and magnesium |
| Sodium azide | Sigma-Aldrich | 71289 | 99.5% |
| PNGase F | New England Biolabs | P0705L | Glycerol-free |
| Vacuum-filter flasks | Fisher Scientific | SCGVU05RE | 0.2 mm pores |
| POROS-AL beads | Applied Biosystems | 1-6028-02 | |
| Aleuria aurantia lectin | Vector Laboratories | L-1390 | |
| Sambucus nigra agglutinin | Vector Laboratories | L-1300 | |
| Sodium cyanoborohydride | Sigma-Aldrich | 296945 | 5.0 M solution |
Références
- Keshishian, H. multiplexed assays for low abundance proteins in plasma by targeted mass spectrometry and stable isotope dilution. Mol Cell Proteomics. 6, 2212-2229 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon