Reattore in fase liquida: inversione del saccarosio
Panoramica
Fonte: Kerry M. Dooley e Michael G. Benton, Dipartimento di Ingegneria Chimica, Louisiana State University, Baton Rouge, LA
Sia i reattori batch che i reattori a flusso continuo sono utilizzati nelle reazioni catalitiche. I letti imballati, che utilizzano catalizzatori solidi e un flusso continuo, sono la configurazione più comune. In assenza di un ampio flusso di riciclaggio, tali reattori a letto imballato sono in genere modellati come "flusso di spina". L'altro reattore continuo più comune è un serbatoio agitato, che si presume sia perfettamente miscelato. 1 Una delle ragioni della prevalenza dei reattori a letto imballato è che, a differenza della maggior parte dei progetti di serbatoi agitati, un ampio rapporto tra area della parete e volume del reattore promuove un trasferimento di calore più rapido. Per quasi tutti i reattori, il calore deve essere aggiunto o ritirato per controllare la temperatura affinché avvenga la reazione desiderata.
La cinetica delle reazioni catalitiche è spesso più complessa della semplice cinetica di 1° ordine,2 ° ordine, ecc. che si trova nei libri di testo. Le velocità di reazione possono anche essere influenzate dalle velocità di trasferimento di massa - la reazione non può avvenire più velocemente della velocità con cui i reagenti vengono forniti alla superficie o dalla velocità con cui i prodotti vengono rimossi - e dal trasferimento di calore. Per questi motivi, la sperimentazione è quasi sempre necessaria per determinare la cinetica di reazione prima di progettare apparecchiature su larga scala. In questo esperimento, esploriamo come condurre tali esperimenti e come interpretarli trovando un'espressione della velocità di reazione e una costante di velocità apparente.
Questo esperimento esplora l'uso di un reattore a letto imballato per determinare la cinetica dell'inversione del saccarosio. Questa reazione è tipica di quelle caratterizzate da un catalizzatore solido con reagenti e prodotti in fase liquida.
saccarosio → glucosio (destrosio) + fruttosio(1)
Un reattore a letto imballato sarà azionato a diverse portate per controllare lo spazio-tempo, che è correlato al tempo di residenza ed è analogo al tempo trascorso in un reattore batch. Il catalizzatore, un acido solido, sarà prima preparato scambiando protoni con qualsiasi altro catione presente. Quindi, il reattore verrà riscaldato alla temperatura desiderata (funzionamento isotermico) con il flusso di reagenti. Quando la temperatura si è equilibrata, inizierà il campionamento del prodotto. I campioni saranno analizzati da un polarimetro, che misura la rotazione ottica. La rotazione ottica della miscela può essere correlata alla conversione del saccarosio, che può quindi essere utilizzata nelle analisi cinetiche standard per determinare l'ordine della reazione, rispetto al saccarosio reagente, e la costante di velocità apparente. Verranno analizzati anche gli effetti della meccanica dei fluidi - nessuna miscelazione assiale (flusso di spina) rispetto ad alcune miscelazioni assiali (serbatoi agitati in serie) - sulla cinetica.
Principi
Rispetto ai reattori a serbatoio agitato continuo (CSTR), i reattori a flusso a spina (PFR) sono solitamente più adatti per reazioni veloci e grandi effetti di calore. 2 Tuttavia, la caduta di pressione e lo sviluppo di "punti caldi" possono essere problematici. Pertanto, le dimensioni delle particelle del catalizzatore non possono essere troppo piccole e devono essere seguite attente procedure di avvio.
Un PFR è matematicamente equivalente a un gran numero di CRST di piccole dimensioni uguali in serie il cui volume totale o peso del catalizzatore corrisponde a quello del sistema. Quando la miscelazione avviene nella direzione assiale, il numero di serbatoi, N, necessari per descrivere il funzionamento del reattore diminuisce. Il modello è chiamato il modello "Tanks in Series". I parametri N e τ (spazio-tempo) del modello possono talvolta essere ottenuti dalla media e dalla varianza della distribuzione del tempo di residenza (curva E) del reattore. Per un PFR, la media può essere calcolata esattamente e la varianza è zero. Per un reattore reale, τ è solitamente stimato, e N è regredito dal modello (Equazione 2):
 (2)
(2)
dove " i" è il numero del reattore, CAo è la concentrazione di alimentazione del reagente limitante (in questo caso, saccarosio), ΔfAi è la variazione della conversione frazionaria di "A" nel serbatoio agitato e rAi è la velocità di reazione valutata alle concentrazioni di uscita del serbatoio. Questo tasso deve essere positivo. La risoluzione del bilancio di massa per CSTR di uguali dimensioni in serie può anche essere utilizzata per determinare l'ordine di reazione per "A" utilizzando i dati di un reattore reale e assumendo che la temperatura possa essere mantenuta ragionevolmente costante e che N sia noto.
L'equazione della velocità in avanti per una reazione catalitica è quasi sempre 1° ordine nella concentrazione del catalizzatore e un certo ordine positivo ≤2 in qualsiasi concentrazione di reagente. I prodotti a volte possono inibire il catalizzatore, facendo apparire l'ordine del reagente meno di quanto non sia in realtà. Anche i reagenti possono inibire il catalizzatore, con conseguenti ordini per un reagente più vicino allo zero. Per questi motivi, le reazioni catalitiche sono spesso espresse da un modello di "legge di potenza":2
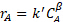 (3)
(3)
dove  è la concentrazione del reagente limitante, k' è la costante di velocità apparente e
è la concentrazione del reagente limitante, k' è la costante di velocità apparente e  è l'ordine di reazione apparente. Questo modello presuppone che la concentrazione del catalizzatore sia costante (viene assorbita nella vera costante di velocità per dare k'). Nella vita reale, i catalizzatori spesso si disattivano, cioè ilgatto C [nei siti di acido mmol / gcat] diminuisce a causa dell'accumulo di veleni catalizzatori. Per questo motivo si deve tenere conto della disattivazione (esprimere Ccat in funzione del tempo onstream) o (preferibilmente) raccogliere dati in un periodo di tempo in cui il catalizzatore è relativamente stabile.
è l'ordine di reazione apparente. Questo modello presuppone che la concentrazione del catalizzatore sia costante (viene assorbita nella vera costante di velocità per dare k'). Nella vita reale, i catalizzatori spesso si disattivano, cioè ilgatto C [nei siti di acido mmol / gcat] diminuisce a causa dell'accumulo di veleni catalizzatori. Per questo motivo si deve tenere conto della disattivazione (esprimere Ccat in funzione del tempo onstream) o (preferibilmente) raccogliere dati in un periodo di tempo in cui il catalizzatore è relativamente stabile.
La cinetica dell'inversione del saccarosio si trova di solito al primo ordine nella concentrazione di saccarosio e al primo ordine nella concentrazione dei siti catalizzatori. Lifshutz e Dranoff riportano una costante di velocità di secondo ordine k di ~ 0,029 mL / (siti di acido mmol • min) per un catalizzatore simile a quello usato qui a 60 °C con un'energia di attivazione di 77 kJ / mol.4 Gilliland et al. riportano ~ 1,21 mL / (siti di acido mmol • min) con un'energia di attivazione di 84 kJ / mol per un catalizzatore simile a queste condizioni. 4 Le differenze significative in k possono derivare da diversi fattori: (a) effetti del trasferimento di calore e massa sulla cinetica; b) scarsa distribuzione dei flussi; c) scarso controllo della temperatura; e (d) stati variabili di attivazione del catalizzatore.
Lo spazio-tempo (analogo al tempo di residenza) per un reattore catalitico è solitamente espresso come  = W/Q, dove W è il peso del catalizzatore e Q è la portata volumetrica dell'alimentazione. Le unità sulla costante di velocità sono regolate per tenere conto delle unità sullo spazio-tempo (cioè, per una reazione di1° ordine le unità su k' sarebbero le stesse di 1/
= W/Q, dove W è il peso del catalizzatore e Q è la portata volumetrica dell'alimentazione. Le unità sulla costante di velocità sono regolate per tenere conto delle unità sullo spazio-tempo (cioè, per una reazione di1° ordine le unità su k' sarebbero le stesse di 1/  ). La Figura 1 illustra il comportamento delle reazioni di vari ordini cinetici sia in un PFR che in un modello di serbatoi in serie costituito da due serbatoi. Si noti che per gli ordini positivi, il PFR è sempre superiore.
). La Figura 1 illustra il comportamento delle reazioni di vari ordini cinetici sia in un PFR che in un modello di serbatoi in serie costituito da due serbatoi. Si noti che per gli ordini positivi, il PFR è sempre superiore.
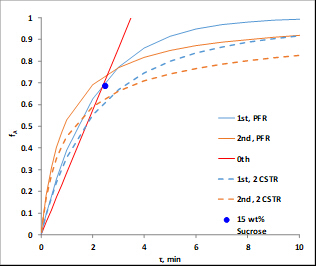
Figura 1. Conversioni frazionarie calcolate (rispetto allo spazio-tempo) del saccarosio utilizzando costanti di velocità derivate dai dati per diversi mangimi di saccarosio a 60 °C.
Per determinare la quantità di zucchero, viene utilizzato un polarimetro, che misura il grado di rotazione della luce polarizzata dal composto analita. Gli zuccheri sono esempi di composti con enantiomeri che possono essere differenziati per la loro attività ottica, la capacità di ruotare la luce. Un polarimetro è particolarmente adatto per la misurazione delle concentrazioni in questo esperimento perché il reagente saccarosio ruota la luce a destra (rotazione ottica positiva), mentre i prodotti glucosio e fruttosio ruotano a sinistra (rotazione ottica negativa).
Procedura
Le proprietà del catalizzatore sono: dimensione = 20 - 40 mesh; peso = 223 g; tenore di acqua = 30 wt. %; densità apparente (apparente) = 1,01 g/mL; concentrazione del sito acido = 4,6 mmol siti acidi/g peso secco; superficie = 50 m2/g; macroporosità (volume macroporo/volume totale di cat.) = 0,34; dimensione media dei macropori = 80 nm. Un diagramma P&ID dell'unità è mostrato nella Figura 2. Per questo esperimento, vengono utilizzati solo #1 letto, il serbatoio organico, la pompa e il rotametro. I campioni vengono raccolti nello scarico superiore. T505 è il regolatore di temperatura.
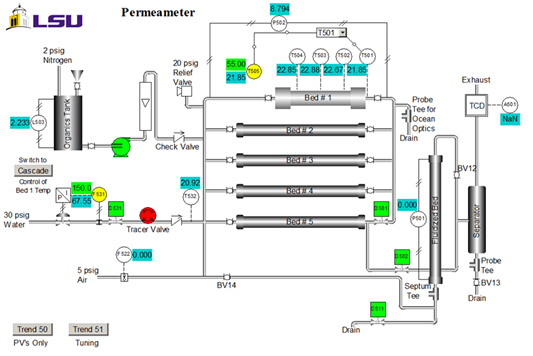
Figura 2. Rappresentazione P&ID dell'apparato (interfaccia del sistema di controllo).
1. Avvio del reattore
- Accedere all'interfaccia del sistema di controllo distribuito. Dalla voce Unità del menu, selezionate Perm. Apparirà lo schema P&ID di Perm (Figura 2). Tutti i dati possono essere raccolti in un foglio di calcolo Excel. Fare clic su "Trend 50" sull'interfaccia per ottenere le variabili chiave del processo rispetto al tempo.
- Aprire le valvole di ingresso e di uscita sul letto del reattore catalitico (Bed #1). Assicurarsi che le valvole di ingresso e di uscita verso gli altri letti siano chiuse e che anche la valvola di controllo (F531) e la valvola on-off (D531) sull'approvvigionamento idrico della città siano chiuse.
- Aggiungere acido diluito (0,25 M H2SO4) al serbatoio di alimentazione (2 L).
- Accendere la pompa di alimentazione a una velocità costante (almeno 3 sul quadrante) e impostare il rotametro per dare la portata desiderata (40 - 70 ml / min). Se il rotametro non è in grado di controllare il flusso in questo intervallo, aumentare la velocità della pompa fino all'impostazione successiva più alta.
- Una volta che l'acido è stato alimentato, aggiungere 200 ml o più di acqua DI al serbatoio di alimentazione. I protoni acidi si scambieranno con qualsiasi altro ione (Na+, Ca2 +) attaccato agli anioni dell'acido solfonico. Questo perché anche l'acqua DI contiene impurità e l'acqua comunale ne contiene ancora di più. Questo si chiama "rigenerare" il catalizzatore.
- Preparare almeno 10 L di soluzione di mangime con il 15% di saccarosio in acqua DI. Quando si prepara la soluzione di saccarosio, aggiungere lentamente il saccarosio all'acqua mescolando a temperatura ambiente. Utilizzare sia un agitatore magnetico che una pagaia.
- Aggiungi il mangime nel serbatoio delle sostanze organiche.
2. Funzionamento del reattore a letto imballato
- Per iniziare il flusso di alimentazione del saccarosio, accendere la pompa e regolare il flusso come desiderato utilizzando il regolatore di velocità della pompa e il rotametro. Il regolatore di velocità è per la regolazione grossolana, mentre il rotametro è per la regolazione fine.
- Programmare il setpoint per T505 a 50°C e impostarlo su AUTO. Il sistema è programmato per tagliare i riscaldatori se la temperatura del letto raggiunge i 90°C, o se la caduta di pressione, misurata dal trasmettitore d/p, scende al di sotto di 1 in. sulla pressione della colonna H2O, il che indica che non c'è alimentazione.
- Una temperatura tipica per la reazione è di 60°C. Quando la temperatura del reattore supera per la prima volta i 50°C, spostare il set point alla temperatura finale desiderata. Un profilo di temperatura può essere osservato attraverso la sezione del catalizzatore, che può essere visualizzato esaminando le termocoppie T502 e T503.
- Raccogliere campioni da 25 ml dei prodotti di reazione nello scarico superiore in provette o flaconi campione a 10 minuti di distanza. Non raccogliere campioni fino a quando non sono trascorsi almeno due tempi di residenza del letto (il volume aperto del letto è ~ 1,2 L).
3. Spegnimento del sistema
- Impostare il controllo della temperatura T-505, Bed #1 su zero output su MANUAL.
- Interrompere il flusso al reattore una volta che la temperatura inizia a diminuire.
- Chiudere le valvole di blocco sul letto #1.
4. Utilizzo del polarimetro
Analizzare i campioni di prodotto di reazione e l'alimentazione iniziale con il polarimetro. Per un mangime al 15 % in peso di saccarosio, le conversioni devono essere compreso tra 80 e 120 ml/min. Saccarosio puro, glucosio e fruttosio devono essere utilizzati come standard di calibrazione. Vedere l'appendice per maggiori dettagli sulla polarimetria.
- Accendere la lampada al sodio e lasciarla riscaldare per circa 5-10 minuti. Sarà visibile una luce gialla.
- Controllare la posizione zero del quadrante. A zero, dovrebbe essere osservato un campo scuro uniforme senza frange scure / chiare.
- Aggiungere 25 ml della soluzione di alimentazione iniziale a un tubo pulito. Assicurarsi che il tubo sia completamente riempito. Utilizzare lo stesso tubo sia per le calibrazioni che per le misurazioni perché la lettura dipende dalla lunghezza del percorso.
- Posizionare il tubo nel polarimetro. Il tubo deve essere rivolto verso l'alto per rimuovere l'aria intrappolata dalla linea di vista e la lampadina deve essere vicino all'oculare.
- Chiudere il coperchio. Se la soluzione ruota la luce polarizzata, le frange scure / chiare devono essere osservate attraverso la lente.
- Ruotare il quadrante fino a quando le frange scompaiono e si osserva un campo scuro uniforme.
- Leggere l'angolo di rotazione attraverso la lente d'ingrandimento utilizzando la scala vernier. Le divisioni del quadrante sono di 1 grado ciascuna e ogni divisione vernier è di 0,05 °. Per regolare la messa a fuoco, ruotare il quadrante nero situato sotto l'oculare.
- Ripetere l'operazione per ogni campione. Utilizzare acqua DI per pulire il tubo prima di ogni misurazione.
Risultati
Il polarimetro determina le conversioni frazionarie del saccarosio dopo la reazione in un reattore a letto imballato. Una precedente calibrazione del polarimetro per tre diversi alimentatori di saccarosio è mostrata nella Figura 3.
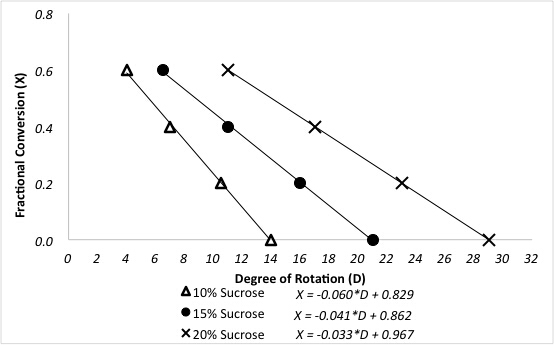
Figura 3. Relazione tra grado di rotazione e conversione frazionaria del saccarosio per diverse concentrazioni di mangime.
I dati del campione sono presentati nella Figura 4 per la reazione a 60 °C a concentrazioni variabili di mangime per saccarosio. Le conversioni frazionarie sono state calcolate direttamente dalla curva di calibrazione del polarimetro usando la seguente equazione, dove D è i gradi di rotazione dal polarimetro:
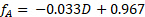 (4)
(4)
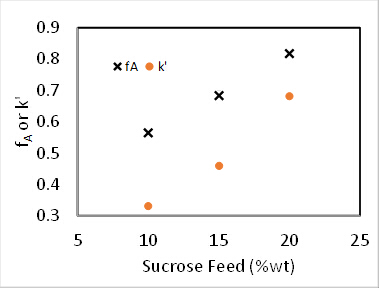
Figura 4. Reazione di inversione del saccarosio a 60°C, velocità di avanzamento di 100 ml/min.
Per entrambe le reazioni di0 ° e 1° ordine, la conversione in un PFR è indipendente dalla concentrazione di mangime. 2 Inoltre, k' dovrebbe essere invariante per la cinetica di 1° ordine. Supponendo che il reattore sia un PFR, la costante di velocità del 2° ordine, k2 (siti mL / mmol • min), è stata determinata tenendo conto della dipendenza del 1° ordine dal catalizzatore, e la pseudo-1 costante di velocità diordine k' (mL / gcat • min) è stata determinata ignorando la dipendenza di 1° ordine del catalizzatore. I risultati dei calcolipseudo-k' sono riportati nella Figura 4. E il valore di k2 è stato trovato dividendo k' per la concentrazione di catalizzatore (mmol acid sites/gcat)data in precedenza.
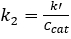 (5)
(5)
Per determinare se la cinetica di reazione era più vicina a 0, 0,5, 1, 1,5 o2 ° ordine in saccarosio, è stata utilizzata la regressione non lineare del bilancio di massa e la somma degli errori al quadrato è stata ridotta al minimo per tutte e tre le esecuzioni. Al fine di utilizzare la regressione non lineare, è stata formulata una funzione oggettiva basata sul bilancio di massa PFR integrato e sul rispettivo ordine di reazione. Ad esempio, la seguente è la funzione oggettiva per un ordine cinetico 1,5 in concentrazione di saccarosio:
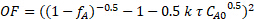 (6)
(6)
Altre funzioni oggettive possono essere formulate dalle soluzioni standard di bilancio di massa PFR, che possono essere trovate in tutti i libri di testo di cinetica. 2 I dati sperimentali in Figura 4 erano adatti ai bilanci di massa PFR integrati per 1, 1,5 e 2 ordini rispetto al saccarosio. La somma degli errori al quadrato per i tre ordini di reazione è stata determinata rispettivamente in 0,39, 0,16 e 1,3. Pertanto, la soluzione migliore è risultata essere n = 1,5 ordine. Questo porta ad un valore k' di 35 (mL/gcat • min).
Inizialmente si pensava che la cinetica fosse di 1° ordine rispetto al saccarosio. 2-3 Usando questa ipotesi, si può determinare il numero di CSTR di volume uguale, N, in serie che sono necessari per modellare questo reattore. Ancora una volta, la somma degli errori al quadrato nel bilancio di massa per tutte e tre le corse è stata ridotta al minimo per determinare sia N che k'. I dati erano adatti al modello tanks-in-series per reazionidi 1° ordine:
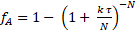 (7)
(7)
Si è scoperto che N = 2,1 "serbatoi" e k' = 0,62 ml/gcat • min. Questa non è una grande misura perché l'ordine di reazione non è esattamente 1. I dati suggeriscono un ordine di saccarosio > 1. Le deviazioni standard relative di fA erano al massimo del 2%, il che è facilmente spiegato dalla variazione di temperatura (fino a 9 ° C). Non c'erano prove di disattivazione del catalizzatore. Le conversioni frazionarie sia per un PFR che per due serbatoi CSTR in serie sono state calcolate usando i k dalla regressione non lineare e tracciate nella Figura 1. Per l'ordine zero, non c'era differenza tra un PFR e CSTR in serie perché il tasso è indipendente dalla concentrazione di saccarosio. Se le curve per 6 o più CSTR fossero state tracciate, avrebbero coinciso strettamente con le curve PFR. Le conversioni frazionarie previste per due serbatoi CSTR in serie sono più lente di un PFR per tutti gli ordini di reazione. I dati sperimentali per il 15% in peso di saccarosio sono in realtà più vicini a una reazione del primo ordine in PFR.
L'errore in k' può essere stimato confrontando le differenze nei valori k' calcolati alla deviazione media della temperatura (4,5 °C) con la temperatura della reazione, 60 °C, utilizzando l'equazione di Arrhenius e facendo la media delle due energie di attivazione della letteratura. La stima k' per 1,5 cinetica di ordine a 64,5 °C è 52 (mL/mol)0,5 mL • gcat-1 • min-1, che è quasi il 50% superiore al valore regresso di 35 (mL/mol)0,5 mL • gcat-1 • min-1. Lievi variazioni di temperatura possono influenzare notevolmente il k'.
Applicazione e Riepilogo
La reazione non si comporta esattamente come previsto perché l'ordine apparente n è > 1. Di tutti i fenomeni che possono causare tali deviazioni nei reattori reali, le deviazioni dal comportamento PFR ideale causato dalla miscelazione assiale sono suggerite dal fatto che il montaggio al modello serbatoi in serie dà solo un piccolo numero di serbatoi - per un PFR perfetto, N dovrebbe essere almeno 6. Tali deviazioni si trovano spesso in letti relativamente corti, specialmente se il flusso è multifase (parte dell'acqua viene vaporizzata nel reattore). Tuttavia, un'altra causa della deviazione è meno evidente ma probabilmente ancora più importante. La reazione è altamente esotermica e, come detto, la temperatura oscillava fino a 9°C (per lo più al di sopra del set point). Più saccarosio nel mangime, più calore verrà generato. Come ci si poteva aspettare, le oscillazioni erano più significative con l'alimentazione del 20% in peso. Ciò suggerisce un'altra ragione per un ordine apparente n > 1: più calore generato a una maggiore concentrazione di alimentazione aumenta maggiormente la temperatura del reattore, il che a sua volta aumenta la velocità di reazione risultando in un ordine apparente derivato >'ordine effettivo. Se la temperatura non è adeguatamente controllata, la temperatura del reattore potrebbe aumentare fino al limite adiabatico. Le deviazioni dal comportamento PFR ideale sia nel flusso che nella temperatura possono influenzare la cinetica apparente derivata dai reattori reali, mettendo un premio su un attento scale-up del reattore per duplicare le condizioni dell'impianto pilota di flusso del fluido e del trasferimento di calore.
I reattori a letto imballato hanno molti usi nell'industria chimica. L'acido solforico, una sostanza chimica utilizzata per produrre centinaia di prodotti diversi, è comunemente fabbricato in parte utilizzando reattori chimici a letto imballato in serie. Oltre 200 milioni di tonnellate vengono prodotte ogni anno. In questa reazione, l'anidride solforosa e l'aria vengono passate attraverso reattori a letto fisso in serie (con scambiatori di calore intermedi per la rimozione del calore) contenenti un catalizzatore di ossido di vanadio supportato ad alte temperature. 4 L'SO2 viene ossidato a SO3, che, quando assorbito in acqua, produce acido solforico.
Un uso più recente per i reattori a letto imballato è nella produzione di biodiesel transesterificando i trigliceridi, o esterificando gli acidi grassi, con metanolo. Mentre il biodiesel viene prodotto in modi diversi, i reattori a letto imballato possono essere vantaggiosi per la produzione continua. Il biodiesel è considerato una fonte di energia rinnovabile perché è prodotto da alghe o alimenti di scarto e perché è biodegradabile e non tossico. Indipendentemente dal catalizzatore utilizzato, deve essere accuratamente eliminato dal prodotto dopo la reazione, perché anche piccole quantità possono rendere il carburante inutilizzabile. 5
APPENDICE A – UTILIZZO DEL POLARIMETRO
La polarimetria misura la misura in cui una sostanza interagisce con la luce polarizzata piana (luce che consiste di onde che vibrano solo su un piano). Può ruotare la luce polarizzata a sinistra, a destra o per niente. Se ruota la luce polarizzata a sinistra o a destra, è "otticamente attiva". Se un composto non ha un centro chirale, non ruoterà la luce polarizzata. Il numero di gradi e la direzione di rotazione sono misurati per dare la rotazione osservata. La rotazione osservata viene corretta per la lunghezza della cella utilizzata e la concentrazione della soluzione, utilizzando la seguente equazione: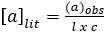 (A1)
(A1)
dove: a = rotazione specifica (gradi) (valore di letteratura), l = lunghezza del percorso (dm) e c = concentrazione (g/mL).
Confrontare la rotazione osservata corretta con i valori della letteratura può aiutare nell'identificazione di un composto sconosciuto. Tuttavia, se i composti sono noti, è più comune preparare standard di calibrazione delle incognite e correlare la rotazione osservata alla concentrazione.
Riferimenti
- J. Sauer, N. Dahmen and E. Henrich. "Chemical Reactor Types." Ullman's Encycylopedia of Industrial Chemistry (2015). Web. 15 Oct. 2016.
- H.S. Fogler, "Elements of Chemical Reaction Engineering," 4th Ed., Prentice-Hall, Upper Saddle River, NJ, 2006, Ch. 2-4; O. Levenspiel, "Chemical Reaction Engineering," 3rd Ed., John Wiley, New York, 1999, Ch. 4-6; C.G. Hill, Jr. and T.W. Root, "Introduction to Chemical Engineering Kinetics and Reactor Design," 2nd Ed., John Wiley, New York, 2014, Ch. 8.
- N. Lifshutz and J. S. Dranoff, Ind. Eng. Chem. Proc. Des. Dev., 7, 266-269 (1968).
- E.R. Gilliland, H. J. Bixler, and J. E. O'Connell, Ind. Eng. Chem. Fundam., 10, 185-191 (1971).
- "Sulfuric Acid." The Essential Chemical Industry. Univ. of York, 2016. http://www.essentialchemicalindustry.org/chemicals/sulfuric-acid.html. Accessed 10/20/16.
- E. Lotero, Y. Liu, D.E. Lopez, K. Suwannakarn, D.A. Bruce and J.G. Goodwin, Jr., Ind. Eng. Chem. Res.,44, 5353-5363 (2005); A. Buasri, N. Chaiyut, V. Loryuenyong, C. Rodklum, T. Chaikwan, and N. Kumphan, Appl. Sci.2, 641-653 (2012); doi:10.3390/app2030641.
Vai a...
Video da questa raccolta:

Now Playing
Reattore in fase liquida: inversione del saccarosio
Chemical Engineering
9.7K Visualizzazioni

Verifica dell'efficienza del trasferimento di calore di uno scambiatore di calore a tubi alettati
Chemical Engineering
17.9K Visualizzazioni

Utilizzo di un essiccatore a vassoio per studiare il trasferimento di calore convettivo e conduttivo
Chemical Engineering
43.9K Visualizzazioni

Viscosità delle soluzioni di glicole propilenico
Chemical Engineering
32.7K Visualizzazioni

Porosimetria della polvere di silicato di alluminio
Chemical Engineering
9.6K Visualizzazioni

Dimostrazione del modello Power Law per estrusione
Chemical Engineering
10.0K Visualizzazioni

Assorbitore di gas
Chemical Engineering
36.6K Visualizzazioni

Equilibrio vapore-liquido
Chemical Engineering
88.7K Visualizzazioni

L'effetto del rapporto di riflusso sull'efficienza della distillazione dei vassoi
Chemical Engineering
77.7K Visualizzazioni

Efficienza di estrazione liquido-liquido
Chemical Engineering
48.4K Visualizzazioni

Cristallizzazione dell'acido salicilico mediante modificazione chimica
Chemical Engineering
24.2K Visualizzazioni

Flusso monofase e bifase in un reattore a letto impaccato
Chemical Engineering
18.9K Visualizzazioni

Cinetica di polimerizzazione per addizione al polidimetilsilossano
Chemical Engineering
16.1K Visualizzazioni

Reattore catalitico: Idrogenazione dell'etilene
Chemical Engineering
30.4K Visualizzazioni

Valutazione del trasferimento di calore di uno Spin-and-Chill
Chemical Engineering
7.4K Visualizzazioni