Reator de fase líquida: Inversão de sacarose
Visão Geral
Fonte: Kerry M. Dooley e Michael G. Benton, Departamento de Engenharia Química, Louisiana State University, Baton Rouge, LA
Tanto os reatores de fluxo em lote quanto os de fluxo contínuo são usados em reações catalíticas. Camas embaladas, que usam catalisadores sólidos e um fluxo contínuo, são a configuração mais comum. Na ausência de um extenso fluxo de reciclagem, tais reatores de cama embalados são tipicamente modelados como "fluxo de plugue". O outro reator contínuo mais comum é um tanque mexido, que se supõe ser perfeitamente misturado. 1 Uma das razões para a prevalência de reatores de cama embalados é que, ao contrário da maioria dos projetos de tanques agitados, uma grande relação de área de parede para o volume do reator promove uma transferência de calor mais rápida. Para quase todos os reatores, o calor deve ser adicionado ou retirado para controlar a temperatura para que a reação desejada ocorra.
A cinética das reações catalíticas são muitas vezes mais complexas do que a simples1ª ordem, 2ªordem, etc. cinética encontrada em livros didáticos. As taxas de reação também podem ser afetadas por taxas de transferência de massa - a reação não pode ocorrer mais rapidamente do que a taxa na qual os reagentes são fornecidos à superfície ou a taxa em que os produtos são removidos - e transferência de calor. Por essas razões, a experimentação é quase sempre necessária para determinar a cinética de reação antes de projetar equipamentos de grande escala. Neste experimento, exploramos como realizar tais experimentos e como interpretá-los encontrando uma expressão de taxa de reação e uma taxa aparente constante.
Este experimento explora o uso de um reator de cama embalado para determinar a cinética da inversão de sacarose. Essa reação é típica daquelas caracterizadas por um catalisador sólido com reagentes e produtos de fase líquida.
sacarose → glicose (dextrose) + frutose(1)
Um reator de cama embalado será operado a diferentes taxas de fluxo para controlar o tempo de espaço, que está relacionado ao tempo de residência e é análogo ao tempo decorrido em um reator de lote. O catalisador, um ácido sólido, será primeiro preparado trocando prótons por quaisquer outros cations presentes. Em seguida, o reator será aquecido à temperatura desejada (operação isotérmica) com o fluxo de reagentes. Quando a temperatura estiver equilibrada, a amostragem do produto começará. As amostras serão analisadas por um polarímetro, que mede a rotação óptica. A rotação óptica da mistura pode estar relacionada à conversão de sacarose, que pode então ser usada em análises cinéticas padrão para determinar a ordem da reação, com relação à sacarose reagente, e à taxa aparente constante. Os efeitos da mecânica dos fluidos - sem mistura axial (fluxo de plugue) versus alguma mistura axial (tanques mexidos em série) - na cinética também serão analisados.
Princípios
Em comparação com reatores de tanques agitados contínuos (CSTRs), os reatores de fluxo de plugue (PFRs) geralmente são mais adequados para reações rápidas e grandes efeitos de calor. 2 No entanto, a queda de pressão e o desenvolvimento de "pontos quentes" podem ser problemáticos. Portanto, os tamanhos de partículas catalisadores não podem ser muito pequenos e procedimentos cuidadosos de inicialização devem ser seguidos.
Um PFR é matematicamente equivalente a um grande número de CSTRs pequenas e igualmente dimensionadas em séries cujo volume total ou peso catalisador corresponde ao do sistema. Quando a mistura ocorre na direção axial, o número de tanques, N, necessários para descrever a operação do reator diminui. O modelo é chamado de "Tanques em Série". Os parâmetros N e τ (espaço-tempo) do modelo podem, por vezes, ser obtidos a partir da média e variância da distribuição do tempo de residência (Curva E) do reator. Para um PFR, a média pode ser calculada exatamente, e a variância é zero. Para um reator real, τ é geralmente estimado, e N é regredido do modelo (Equação 2):
 (2)
(2)
onde "i" é o número do reator, CAo é a concentração de alimentação do reacionário limitante (neste caso, sacarose), ΔfAi é a mudança na conversão fracionada de "A" no i tanque agitado, e rAi é a taxa de reação avaliada nas concentrações de saída do tanque. Essa taxa deve ser positiva. Resolver o equilíbrio de massa para CSTRs de tamanho igual em série também pode ser usado para determinar a ordem de reação para "A" usando dados de um reator real e assumindo que a temperatura pode ser mantida razoavelmente constante e que N é conhecido.
A equação da taxa de avanço para uma reação catalítica é quase sempre1ª ordem na concentração de catalisadores e alguma ordem positiva ≤2 em qualquer concentração reagente. Os produtos às vezes podem inibir o catalisador, fazendo com que a ordem do reagente pareça menos do que realmente é. Mesmo os reagentes podem inibir o catalisador, resultando em ordens para um reagente mais perto de zero. Por essas razões, reações catalíticas são muitas vezes expressas por um modelo de "poder-lei":2
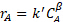 (3)
(3)
onde  está a concentração de limitar o reagente, k' é a taxa aparente constante, e é a
está a concentração de limitar o reagente, k' é a taxa aparente constante, e é a  ordem de reação aparente. Este modelo pressupõe que a concentração do catalisador é constante (é absorvida na verdadeira constante taxa para dar k'). Na vida real, catalisadores frequentemente desativam, ou seja,c cat [em locais de ácido mmol/gcat] diminui devido ao acúmulo de venenos catalisadores. Por esta razão, deve-se responder pela desativação(gato C expresso em função do tempo onstream) ou (preferencialmente) coletar dados durante um período de tempo onde o catalisador é relativamente estável.
ordem de reação aparente. Este modelo pressupõe que a concentração do catalisador é constante (é absorvida na verdadeira constante taxa para dar k'). Na vida real, catalisadores frequentemente desativam, ou seja,c cat [em locais de ácido mmol/gcat] diminui devido ao acúmulo de venenos catalisadores. Por esta razão, deve-se responder pela desativação(gato C expresso em função do tempo onstream) ou (preferencialmente) coletar dados durante um período de tempo onde o catalisador é relativamente estável.
A cinética da inversão de sacarose é geralmente encontrada como primeira ordem na concentração de sacarose e primeira ordem na concentração de locais catalisadores. Lifshutz e Dranoff relatam uma taxa de segunda ordem constante k de ~0,029 mL/(locais de ácido mmol • min) para um catalisador semelhante ao usado aqui a 60 °C com uma energia de ativação de 77 kJ/mol.4 Gilliland et al. relatório ~1,21 mL/(locais de ácido mmol • min) com uma energia de ativação de 84 kJ/mol para um catalisador semelhante nessas condições. 4 As diferenças significativas em k podem surgir de vários fatores: (a) efeitos do calor e transferência de massa na cinética; b Má distribuição de fluxo; c Mau controle de temperatura; e (d) diferentes estados de ativação de catalisadores.
O tempo de espaço (análogo ao tempo de residência) para um reator catalítico é geralmente expresso como  = W/Q, onde W é o peso do catalisador e Q é a taxa de fluxo volumoso da ração. As unidades na constante de taxa são ajustadas para contabilizar as unidades no espaço-tempo (ou seja, para uma reaçãode 1ª ordem as unidades em k' seriam as mesmas de 1/
= W/Q, onde W é o peso do catalisador e Q é a taxa de fluxo volumoso da ração. As unidades na constante de taxa são ajustadas para contabilizar as unidades no espaço-tempo (ou seja, para uma reaçãode 1ª ordem as unidades em k' seriam as mesmas de 1/  ). A Figura 1 ilustra o comportamento das reações de várias ordens cinéticas tanto em um PFR quanto em um modelo tanque-em-série composto por dois tanques. Note que para ordens positivas, o PFR é sempre superior.
). A Figura 1 ilustra o comportamento das reações de várias ordens cinéticas tanto em um PFR quanto em um modelo tanque-em-série composto por dois tanques. Note que para ordens positivas, o PFR é sempre superior.
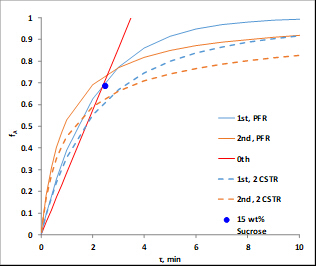
Figura 1. Conversões fracionadas computadas (vs. tempo espacial) de sacarose usando constantes de taxa derivadas dos dados para vários feeds de sacarose a 60°C.
Para determinar a quantidade de açúcar, é utilizado um polarímetro, que mede o grau de rotação da luz polarizada pelo composto de analito. Açúcares são exemplos de compostos com enantiomers que podem ser diferenciados por sua atividade óptica, a capacidade de girar a luz. Um polarímetro é especialmente adequado para a medição de concentrações neste experimento porque a sacarose reagente gira luz para a direita (rotação óptica positiva), enquanto os produtos glicose e frutose giram para a esquerda (rotação óptica negativa).
Procedimento
As propriedades do catalisador são: tamanho = 20 - 40 malha; peso = 223 g; teor de água = 30 wt. %; densidade aparente (a granel) = 1,01 g/mL; concentração do local do ácido = 4,6 locais de ácido mmol/g peso seco; área da superfície = 50 m2/g; macroporosidade (volume macroporo/volume total de gato.) = 0,34; tamanho médio de macroporos = 80 nm. Um diagrama de P&ID da unidade é mostrado na Figura 2. Para este experimento, são utilizados apenas #1 de cama, o tanque orgânico, a bomba e o rotametro. Amostras são coletadas no ralo superior. T505 é o controlador de temperatura.
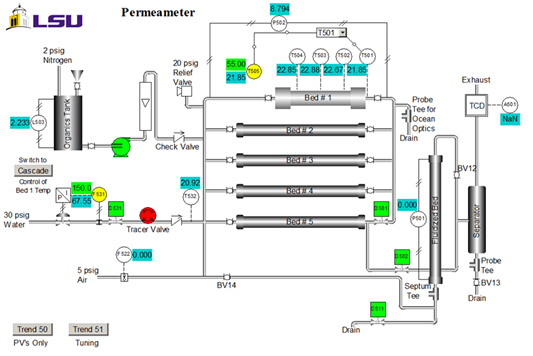
Figura 2. Representação P&ID do aparelho (interface do sistema de controle).
1. Iniciando o reator
- Acesse a interface do sistema de controle distribuído. No item Unidade no menu, selecione Perm. O esquema perm P&ID (Figura 2) aparecerá. Todos os dados podem ser coletados em uma planilha do Excel. Clique em "Trend 50" na interface para obter as principais variáveis do processo em relação ao tempo.
- Abra a entrada e saia das válvulas para a cama do reator catalítico (Cama #1). Certifique-se de que as válvulas de entrada e saída para os outros leitos estão fechadas, e que a válvula de controle (F531) e a válvula de descarga (D531) no abastecimento de água da cidade também estão fechadas.
- Adicione ácido diluído (0,25 M H2SO4) ao tanque de alimentação (2 L).
- Ligue a bomba de alimentação a uma velocidade constante (pelo menos 3 no mostrador) e defina o rotametro para dar a vazão desejada (40 - 70 mL/min). Se o rotador não puder controlar o fluxo nesta faixa, aumente a velocidade da bomba para a próxima configuração mais alta.
- Uma vez alimentado com ácido, adicione 200 mL ou mais de água DI ao tanque de alimentação. Os prótons ácidos trocarão por quaisquer outros íons (Na+, Ca2+) estão ligados aos ânions de ácido sulfônico. Isso porque até a água DI contém impurezas e a água municipal contém ainda mais. Isso é chamado de "regenerar" o catalisador.
- Prepare pelo menos 10 L de solução de alimentação com 15 wt% de sacarose em água DI. Ao preparar a solução de sacarose, adicione a sacarose lentamente à água enquanto mexe à temperatura ambiente. Use um agitador magnético e uma raquete.
- Adicione a ração no tanque de orgânicos.
2. Operação do reator de cama embalado
- Para iniciar o fluxo de alimentação de sacarose, ligue a bomba e ajuste o fluxo conforme desejado usando o controlador de velocidade da bomba e o rotômetro. O controlador de velocidade é para ajuste bruto, enquanto o rotador é para ajuste fino.
- Programe o ponto de configuração para T505 a 50°C e configure-o como AUTO. O sistema é programado para cortar os aquecedores se a temperatura do leito atingir 90°C, ou se a queda de pressão, medida pelo transmissor d/p, cair abaixo de 1 em. na pressão da coluna H2O, o que indica que não há alimentação.
- Uma temperatura típica para a reação é de 60°C. Quando a temperatura do reator excede pela primeira vez 50°C, mova o ponto de partida para esta temperatura final desejada. Um perfil de temperatura pode ser observado em toda a seção catalisador, que pode ser visualizado examinando termopares T502 e T503.
- Colete 25 mL amostras dos produtos de reação no ralo superior em tubos de ensaio ou garrafas de amostra a 10 minutos de distância. Não colete amostras até que pelo menos duas horas de residência na cama (o volume aberto da cama é ~1,2 L) tenham passado.
3. Desligar o sistema
- Ajuste o T-505, Cama #1 controle de temperatura para zero de saída no MANUAL.
- Desligue o fluxo para o reator assim que a temperatura começar a diminuir.
- Feche as válvulas de bloco na #1 de cama.
4. Usando o Polarímetro
Analise amostras de produtos de reação e a alimentação inicial com o polarímetro. Para uma ração de sucrose de 15 wt. % , as conversões devem ser na faixa de 80 a 120 mL/min. Sacarose pura, glicose e frutose devem ser utilizadas como padrões de calibração. Consulte o apêndice para obter mais detalhes sobre polarimetria.
- Ligue a lâmpada de sódio e deixe aquecer por aproximadamente 5 a 10 minutos. Uma luz amarela será visível.
- Verifique a posição zero do mostrador. A zero, deve ser observado um campo escuro uniforme, sem franjas escuras/claras.
- Adicione 25 mL da solução inicial de alimentação a um tubo limpo. Certifique-se de que o tubo está completamente cheio. Use o mesmo tubo para calibrações e medição, pois a leitura é dependente do comprimento do caminho.
- Coloque o tubo no polarímetro. O tubo deve estar voltado para cima para remover qualquer ar preso da linha de visão e a lâmpada deve estar perto da ocular.
- Feche a tampa. Se a solução girar a luz polarizada, as franjas escuras/claras devem ser observadas através da lente.
- Gire o mostrador até que as franjas desapareçam e um campo escuro uniforme seja observado.
- Leia o ângulo de rotação através da lupa usando a escala vernier. As divisões de discagem são de 1 grau cada e cada divisão vernier é 0,05°. Para ajustar o foco, gire o mostrador preto localizado abaixo da ocular.
- Repita para cada amostra. Use água DI para limpar o tubo antes de cada medição.
Resultados
O polarímetro determina as conversões fracionárias de sacarose após reação em um reator de cama embalado. Uma calibração polarímetro anterior para três rações diferentes de sacarose é mostrada na Figura 3.
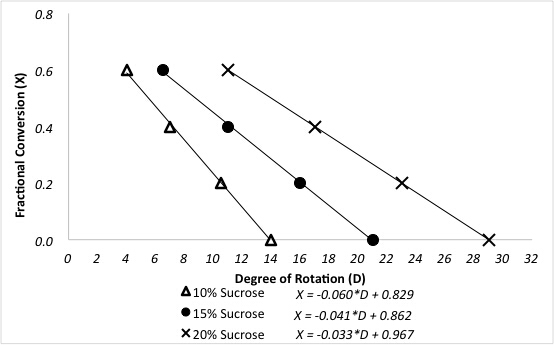
Figura 3. Relação entre grau de rotação e conversão fracionária de sacarose para diferentes concentrações de alimentação.
Os dados amostrais são apresentados na Figura 4 para a reação a 60 °C em diferentes concentrações de alimentação de sacarose. As conversões fracionárias foram calculadas diretamente da curva de calibração do polarímetro usando a seguinte equação, onde D é os graus de rotação do polarímetro:
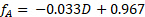 (4)
(4)
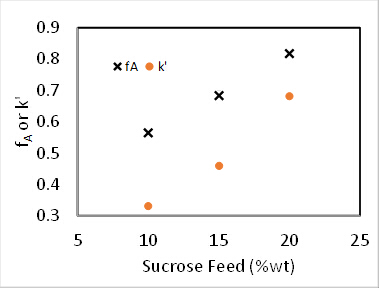
Figura 4. Reação de inversão de sacarose a 60°C, 100 mL/min de alimentação.
Para as reações de 0a 1º ordem, a conversão em um PFR é independente da concentração de alimentação. 2 Além disso, k' deve ser invariante para 1st order cinética. Supondo que o reator seja um PFR, a taxa de2ª ordem constante, k2 (sítios mL/mmol • min), foi determinada pela contabilização da dependência de 1ª ordem do catalisador, e a taxa deordem pseudo-1 constante k' (mL/g cat • min) foi determinada ignorando a dependência de 1ª ordem do catalisador. Os resultados dos cálculospseudo-k' são traçados na Figura 4. E o valor de k2 foi encontrado dividindo k' pela concentração de catalisador (locais ácidos mmol/gcat) dado anteriormente.
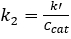 (5)
(5)
Para determinar se a cinética de reação estava mais próxima de 0, 0,5, 1, 1,5 ou2ª ordem em sacarose, foi utilizada a regressão não linear do equilíbrio de massa, e a soma de erros ao quadrado foi minimizada para todas as três corridas. Para a utilização da regressão não linear, foi formulada uma função objetiva com base no equilíbrio de massa PFR integrado e na respectiva ordem de reação. Por exemplo, a seguinte é a função objetiva para uma ordem cinética de 1,5 na concentração de sacarose:
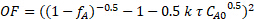 (6)
(6)
Outras funções objetivas podem ser formuladas a partir das soluções padrão de equilíbrio de massa PFR, que podem ser encontradas em todos os livros cinéticos. 2 Os dados experimentais na Figura 4 foram adequados aos saldos de massa pfr integrados para 1, 1,5 e 2 pedidos em relação à sacarose. A soma dos erros quadrados para as três ordens de reação foi determinada em 0,39, 0,16 e 1,3, respectivamente. Portanto, o melhor ajuste foi encontrado n = 1,5 ordem. Isso leva a um valor k' de 35(mL/g gato • min).
Inicialmente se pensava que a cinética era1ª ordem em relação à sacarose. 2-3 Usando esta suposição, pode-se determinar o número de CSTRs de volume igual, N, em séries que são necessárias para modelar este reator. Mais uma vez, a soma de erros quadrados no saldo de massa para todas as três corridas foi minimizada para determinar tanto N quanto k'. Os dados foram adequados ao modelo tanques em série para reações de1ª ordem:
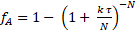 (7)
(7)
Verificou-se que N = 2,1 "tanques" e k' = 0,62 mL/ggato • min. Este não é um grande ajuste porque a ordem de reação não é exatamente 1. Os dados sugerem uma ordem de sacarose > 1. Os desvios padrão relativos de fA foram no máximo 2%, o que é facilmente contabilizado pela variação de temperatura (até 9 °C). Não havia evidência de desativação do catalisador. As conversões fracionadas tanto para um PFR quanto para dois tanques CSTR em série foram computadas usando os k's de regressão não linear e plotadas na Figura 1. Para a ordem zero, não houve diferença entre um PFR e CSTRs em série porque a taxa é independente da concentração de sacarose. Se as curvas para 6 ou maiores CSTRs tivessem sido traçadas, elas teriam coincidido de perto com as curvas PFR. As conversões fracionadas previstas para dois tanques CSTR em série são mais lentas que um PFR para todas as ordens de reação. Os dados experimentais para 15 wt% de sacarose estão realmente mais próximos de uma reação de primeira ordem em PFR.
O erro em k' pode ser estimado comparando as diferenças nos valores calculados k' no desvio médio de temperatura (4,5 °C) à temperatura da reação, 60 °C, usando a equação de Arrhenius e com média das duas energias de ativação da literatura. A cinética estimada para 1,5 pedido a 64,5 °C é de 52 (mL/mol)0,5 mL • gcat-1 • min-1, que é quase 50% maior que o valor regredido de 35 (mL/mol)0,5 mL • gcat-1 • min-1. Pequenas variações de temperatura podem afetar muito o k'
Aplicação e Resumo
A reação não se comporta exatamente como esperado porque a ordem aparente n é > 1. De todos os fenômenos que podem causar tais desvios em reatores reais, desvios do comportamento pfr ideal causado pela mistura axial são sugeridos pelo fato de que a montagem do modelo tanque-em-série dá apenas um pequeno número de tanques - para um PFR perfeito, N deve ser pelo menos 6. Tais desvios são frequentemente encontrados em leitos relativamente curtos, especialmente se o fluxo for multifásico (alguma água é vaporizada no reator). No entanto, outra causa do desvio é menos aparente, mas provavelmente ainda mais importante. A reação é altamente exotérmica, e como mencionado, a temperatura oscilou até 9°C (principalmente acima do ponto de partida). Quanto mais sacarose na ração, mais calor será gerado. Como era de se esperar, as oscilações foram mais significativas com a alimentação de 20% Isso sugere outra razão para uma ordem aparente n > 1: quanto mais calor gerado em uma maior concentração de ração aumenta mais a temperatura do reator, o que por sua vez aumenta a taxa de reação resultando em uma ordem aparente derivada > a ordem real. Se a temperatura for inadequadamente controlada, a temperatura do reator pode aumentar para o limite adiabático. Desvios do comportamento ideal do PFR tanto no fluxo quanto na temperatura podem afetar a cinética aparente derivada de reatores reais, colocando um prêmio em uma escala cuidadosa do reator para duplicar as condições piloto-planta de fluxo de fluido e transferência de calor.
Reatores de cama embalados têm muitos usos na indústria química. O ácido sulfúrico, um produto químico usado para fazer centenas de produtos diferentes, é comumente fabricado em parte usando reatores químicos embalados em série. Mais de 200 milhões de toneladas são produzidas anualmente. Nesta reação, dióxido de enxofre e ar são passados através de reatores de leito fixo em série (com trocadores de calor intermediários para remoção de calor) contendo um catalisador de óxido de vanádio suportado a altas temperaturas. 4 O SO2 é oxidado para SO3, que, quando absorvido em água, produz ácido sulfúrico.
Um uso mais recente para reatores de cama embalados está na produção de biodiesel por triglicérides transesterificadores, ou ácidos graxos esterificantes, com metanol. Enquanto o biodiesel é produzido de diferentes maneiras, reatores de cama embalados podem ser vantajosos para a produção contínua. O biodiesel é considerado uma fonte de energia renovável porque é produzido a partir de algas ou resíduos de alimentos, e por ser biodegradável e não tóxico. Independentemente do catalisador utilizado, ele deve ser completamente purgado do produto após a reação, pois mesmo pequenas quantidades podem tornar o combustível inutilizável. 5
APÊNDICE A – UTILIZANDO O POLARÍMETRO
A polarimetria mede até que ponto uma substância interage com a luz polarizada do plano (luz que consiste em ondas que vibram apenas em um plano). Pode girar a luz polarizada para a esquerda, para a direita, ou não. Se girar a luz polarizada para a esquerda ou para a direita, ela será "opticamente ativa". Se um composto não tiver um centro quiral, ele não irá girar a luz polarizada. O número de graus e a direção de rotação são medidos para dar a rotação observada. A rotação observada é corrigida para o comprimento da célula utilizada e a concentração da solução, utilizando a seguinte equação: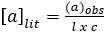 (A1)
(A1)
onde: a = rotação específica (graus) (valor da literatura), l = comprimento do caminho (dm) e c = concentração (g/mL).
Comparar a rotação observada corrigida com os valores da literatura pode auxiliar na identificação de um composto desconhecido. No entanto, se os compostos são conhecidos, é mais comum preparar padrões de calibração das incógnitas e correlacionar a rotação observada à concentração.
Referências
- J. Sauer, N. Dahmen and E. Henrich. "Chemical Reactor Types." Ullman's Encycylopedia of Industrial Chemistry (2015). Web. 15 Oct. 2016.
- H.S. Fogler, "Elements of Chemical Reaction Engineering," 4th Ed., Prentice-Hall, Upper Saddle River, NJ, 2006, Ch. 2-4; O. Levenspiel, "Chemical Reaction Engineering," 3rd Ed., John Wiley, New York, 1999, Ch. 4-6; C.G. Hill, Jr. and T.W. Root, "Introduction to Chemical Engineering Kinetics and Reactor Design," 2nd Ed., John Wiley, New York, 2014, Ch. 8.
- N. Lifshutz and J. S. Dranoff, Ind. Eng. Chem. Proc. Des. Dev., 7, 266-269 (1968).
- E.R. Gilliland, H. J. Bixler, and J. E. O'Connell, Ind. Eng. Chem. Fundam., 10, 185-191 (1971).
- "Sulfuric Acid." The Essential Chemical Industry. Univ. of York, 2016. http://www.essentialchemicalindustry.org/chemicals/sulfuric-acid.html. Accessed 10/20/16.
- E. Lotero, Y. Liu, D.E. Lopez, K. Suwannakarn, D.A. Bruce and J.G. Goodwin, Jr., Ind. Eng. Chem. Res.,44, 5353-5363 (2005); A. Buasri, N. Chaiyut, V. Loryuenyong, C. Rodklum, T. Chaikwan, and N. Kumphan, Appl. Sci.2, 641-653 (2012); doi:10.3390/app2030641.
Pular para...
Vídeos desta coleção:

Now Playing
Reator de fase líquida: Inversão de sacarose
Chemical Engineering
9.7K Visualizações

Teste de eficiência da transferência de calor de um trocador de calor de tubos aletados
Chemical Engineering
17.9K Visualizações

Uso de um secador de bandeja para investigar a transferência de calor por convecção e condução
Chemical Engineering
43.9K Visualizações

Viscosidade de soluções de propilenoglicol
Chemical Engineering
32.7K Visualizações

Porosimetria de um pó de sílica alumina
Chemical Engineering
9.6K Visualizações

Demonstração do modelo de lei de potência por meio de extrusão
Chemical Engineering
10.0K Visualizações

Absorvedor de gás
Chemical Engineering
36.7K Visualizações

Equilíbrio vapor-líquido
Chemical Engineering
88.7K Visualizações

O efeito da taxa de refluxo na eficiência da destilação em bandejas
Chemical Engineering
77.7K Visualizações

Eficiência da Extração Líquido-Líquido
Chemical Engineering
48.4K Visualizações

Cristalização de Ácido Salicílico via Modificação Química
Chemical Engineering
24.2K Visualizações

Fluxo monofásico e bifásico em um reator de leito compactado
Chemical Engineering
18.9K Visualizações

Cinética da Polimerização por Adição ao Polidimetilsiloxano
Chemical Engineering
16.1K Visualizações

Reator Catalítico: Hidrogenação de etileno
Chemical Engineering
30.4K Visualizações

Avaliação a Transferência de Calor de um Equipamento de Resfriamento e Agitação
Chemical Engineering
7.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados