Method Article
Emiepatectomia sinistra laparoscopica combinata con resezione del lobo caudato
In questo articolo
Riepilogo
Il colangiocarcinoma intraepatico del lobo caudato è una sfida per molti chirurghi a causa della sua posizione unica. Qui, presentiamo un protocollo per mostrare i dettagli passo dopo passo dell'emiepatectomia sinistra laparoscopica combinata con la resezione del lobo caudato per colangiocarcinoma.
Abstract
Il colangiocarcinoma intraepatico (ICC) è il tumore maligno comune del fegato. La resezione chirurgica radicale è il cardine del trattamento potenzialmente curativo per l'ICC. La resezione epatica anatomica per ICC nel lobo caudato è una delle resezioni epatiche più difficili. Perché il tumore si trova in profondità e invade facilmente i vasi sanguigni circostanti, come il peduncolo epatico sinistro, il peduncolo epatico destro e la vena epatica media. L'epatectomia anatomica laparoscopica del lobo caudato non solo garantisce un margine di incisione negativo, ma offre anche un approccio più minimamente invasivo per i pazienti. Questa tecnica è pronta a diventare la scelta preferita per la chirurgia radicale del lobo caudato in futuro. In questo protocollo chirurgico, un paziente di sesso maschile di 65 anni con colangiocarcinoma intraepatico (di dimensioni circa 3,2 × 1,9cm2) localizzato nel lobo caudale sinistro è stato sottoposto a emiepatectomia sinistra laparoscopica combinata con resezione del lobo caudato con successo senza alcuna complicanza postoperatoria. L'esame patologico postoperatorio ha evidenziato un colangiocarcinoma con trombo tumorale visibile nel sistema vascolare. Il paziente è stato dimesso il 14° giorno postoperatorio. L'emiepatectomia sinistra laparoscopica combinata con la lobectomia caudata per il trattamento dell'ICC del lobo caudato può essere eseguita in sicurezza e non aumenta significativamente la morbilità o la mortalità della procedura.
Introduzione
Il colangiocarcinoma intraepatico origina dalle cellule epiteliali del dotto biliare intraepatico ed è un colangiocarcinoma che si verifica al di sopra del dotto biliare secondario del fegato. L'incidenza dell'ICC è seconda solo a quella del carcinoma epatocellulare (HCC), rappresentando dal 10% al 15% del carcinoma epatico primario e circa il 20% del carcinoma del dotto biliare1. L'incidenza della ICC è aumentata di anno in anno nel mondo, aumentando del 140% negli ultimi 40 anni2. La resezione chirurgica rimane il cardine del trattamento potenzialmente curativo per l'ICC. Tuttavia, solo il 20-30% dei pazienti ha la possibilità di resezione chirurgica. Dopo la resezione chirurgica, il tasso di sopravvivenza globale a 5 anni dei pazienti con ICC è solo del 20%-35%3. Questo perché anche se viene eseguita la resezione radicale, solo pochi pazienti possono ottenere margini negativi4. È particolarmente importante per i pazienti con ICC precoce ottenere un intervento chirurgico curativo. La chirurgia curativa per i pazienti con ICC è strettamente correlata ai margini chirurgici. Due recenti meta-analisi 5,6 hanno indicato che una larghezza del margine chirurgico di >1 cm è associata a una migliore sopravvivenza globale. Uno studio7 che ha coinvolto 126 pazienti ha dimostrato che un margine ≥1,0 cm era associato a una migliore sopravvivenza globale (OS) e sopravvivenza libera da recidiva (RFS).
Nella chirurgia ICC, la resezione epatica anatomica, che è importante per la prognosi dei pazienti ICC8, non solo può ottenere un margine chirurgico sicuro, ma può anche asportare il peduncolo epatico violato. Uno studio9 ha riportato che la via infiltrante più comune per il colangiocarcinoma del lobo caudato è attraverso il tessuto connettivo fibroso lungo il sistema di Glisson, non il dotto biliare. In uno studio precedente, Si et al.10 hanno esaminato i dati di 702 pazienti con ICC e hanno scoperto che l'incidenza delle complicanze era simile tra resezione anatomica e resezione non anatomica, e la resezione anatomica era associata a una migliore sopravvivenza libera da malattia e sopravvivenza globale a 1, 3 e 5 anni. Un altro studio di corrispondenza della propensione11 sull'ICC ha identificato la resezione non anatomica come un fattore di rischio indipendente per OS (p < 0,05).
Tuttavia, la resezione chirurgica dell'ICC caudato può essere impegnativa per il chirurgo. È molto difficile per i chirurghi esplorare il lobo caudato a causa della sua posizione anatomica unica, come la sua profonda penetrazione nel parenchima epatico e la sua vicinanza ai vasi principali12 (la vena cava inferiore, le vene epatiche medie o destre, la vena porta e il legamento venoso). Questi possono rendere difficile ottenere un ampio campo visivo durante l'intervento chirurgico e ottenere un tagliente invisibile. Negli ultimi anni, con lo studio dettagliato dell'anatomia del fegato, il rapido sviluppo della tecnologia laparoscopica e la continua promozione del concetto di resezione epatica precisa, la gestione chirurgica dell'ICC è passata dalla lobectomia caudata isolata13,14 all'emiepatectomia laparoscopica combinata con la lobectomia caudata15, che è raramente riportato in letteratura. C'è un grande bisogno di video di operazioni di successo per guidare l'uso diffuso di tali operazioni in futuro. Qui, presentiamo un'emiepatectomia sinistra laparoscopica combinata con resezione del lobo caudato per il trattamento di un colangiocarcinoma intraepatico nel lobo caudato.
Un uomo cinese di 65 anni è stato ricoverato in ospedale con una massa epatica rilevata accidentalmente mediante ecografia addominale. L'esame obiettivo non ha mostrato anomalie significative. Gli esami di laboratorio, compresi gli esami del sangue di routine, i test di funzionalità epatica, la coagulazione e gli indicatori tumorali (AFP, CEA, CA199), erano normali. La tomografia computerizzata (TC) potenziata dell'addome superiore ha mostrato un'ombra di potenziamento anormale di 3,2 1,9cm2 alla giunzione S1/4/8 e ha mostrato che la vena epatica media (MHV) e la vena epatica sinistra (LHV) condividevano un tronco comune (Figura 1A). La risonanza magnetica (MRI) potenziata dell'addome superiore ha anche rivelato un nodulo di 2,5 2,0 cm2 nella stessa area, suggerendo però ICC (Figura 1B). Dopo aver completato la valutazione preoperatoria, abbiamo deciso di eseguire un'emiepatectomia sinistra laparoscopica combinata con la resezione del lobo caudato per garantire un margine chirurgico negativo.
Protocollo
Questo protocollo segue le linee guida del comitato etico per la ricerca umana dell'Ospedale del Popolo di Meizhou. È stato ottenuto il consenso informato dai pazienti per rilasciare informazioni e dati relativi a questo trattamento.
1. Preparazione preoperatoria
- Vietare al paziente di mangiare per 6 ore e bere per 2 ore prima dell'operazione.
- Applicare l'antibiotico (1 g di Ceftriaxone sodico) attraverso un'iniezione endovenosa del gomito per prevenire l'infezione preventivamente 30 minuti prima di tagliare la pelle.
- Utilizzare l'intubazione tracheale in anestesia generale. Pungere e cateterizzare l'arteria radiale destra (dimensione del catetere, 20 G) e la vena giugulare interna (dimensione del catetere, 8 Fr) sotto guida ecografica.
- Sterilizzare la pelle con uno scrub a base di iodio allo 0,5% e teli sterili per esporre completamente l'area chirurgica. Disinfettare l'area chirurgica con iodoforo tre volte.
2. Tecnica chirurgica
- Impostazione del funzionamento
- Tagliare la pelle a circa 10 mm longitudinalmente sotto l'ombelico, quindi inserire un ago monouso per pneumoperitoneo attraverso l'incisione. Iniettare CO2 dopo che l'ago del pneumoperitoneo è stato collegato alla macchina per pneumoperitoneo per stabilire il pneumoperitoneo.
- Quindi, inserire un trocar di ferro da 10 mm nell'incisione. Passare il paziente da una posizione supina a una posizione supina con le gambe divaricate, la testa sollevata di 30° e i piedi abbassati dopo aver esaminato nessun danno da puntura.
NOTA: La pressione del pneumoperitoneo è stata impostata a 12 mmHg. - Posizionare due trocar da 12 mm sulla linea medioclavicolare destra e sinistra sopra le 4 dita ombelicali (B e C), due trocar da 5 mm sulla linea ascellare anteriore destra sottocostale e sulla linea medioclavicolare sinistra sottocostale (D ed E), vedere la Figura 2.
- Eseguire l'esplorazione addominale per via laparoscopica. Verificare la presenza di lesioni addominali e sanguinamento da puntura; Verificare la presenza di metastasi extraepatiche significative per valutare la fattibilità della chirurgia radicale.
- Fase di esplorazione
- Liberare la metà sinistra del fegato e dividere i legamenti rotondi e falciformi fino al livello della fossa venosa epatica. Dividere il legamento triangolare sinistro e il legamento coronarico sinistro, estendendosi fino a identificare il bordo laterale della vena epatica sinistra.
- Bloccare il legamento rotondo prossimale del fegato.
- Rivelare il legamento epatoduodenale quando si accede all'omento minore e posizionare regolarmente una fascia di occlusione del flusso sanguigno epatico. Se necessario, utilizzare il metodo Pringle per bloccare in modo intermittente il flusso sanguigno epatico.
- Fase di dissezione
- Sezionare il peduncolo epatico sinistro utilizzando l'approccio extratecale.
- Dopo aver sollevato il lobo laterale sinistro, esporre il lobo caudato aprendolo completamente al piccolo omento. Identificare, imbracare e sezionare il peduncolo epatico sinistro utilizzando una pinza non traumatica e una pinza da dissezione ad angolo retto da 10 mm.
- Pochi minuti dopo, creare una linea di pre-resezione marcata con un elettrocauterizzazione basato sulla linea di ischemia delle metà sinistra e destra del fegato (Figura 3A, B).
- Utilizzare un coltello a ultrasuoni per incidere il tessuto epatico, iniziando dalla parte superiore del fegato dalla parte anteriore a quella posteriore, fino a quando il livello del peduncolo epatico sinistro e destro è completamente esposto lungo la linea segnata (Figura 3C).
- Fissare il tubo strutturato >4 mm di diametro con clip e dissociarlo con un coltello ad ultrasuoni all'estremità distale.
- Utilizzando il tempo per attivare il fegato, sezionare lo spazio tra il lobo caudato e la vena cava inferiore (IVC) attraverso un approccio dorsale. Quando si incontra la vena epatica corta (VHS), bloccarla con un hem-o-lok e poi scollegarla all'estremità distale.
- Dopo aver esposto completamente l'IVC, segnare il piano paracavale destro, che è il margine destro immaginario del lobo caudato (Figura 3D).
- Dopo aver rimosso la linea di sospensione del peduncolo epatico sinistro, scollegare il peduncolo epatico sinistro mediante ricariche lineari del cutler (Figura 4A).
- Lungo l'estremità rotta del peduncolo epatico sinistro, cercare il peduncolo epatico del lobo caudato e sezionarlo, quindi bloccare la sua estremità prossimale con due hem-o-lok e tagliare la sua estremità distale con un coltello a ultrasuoni attraverso l'approccio sul lato sinistro (Figura 4B).
- Tirare il primo portale epatico verso destra per esporre il piano paracavale destro. Lungo il margine destro del lobo caudato, come marcato, tagliare il parenchima epatico sotto la giunzione dei peduncoli epatici sinistro e destro fino a rivelare il tronco comune di MHV e la vena epatica sinistra (LHV) (Figura 4C).
- Quando si incontra la vena caudata, bloccarla con l'hem-o-lok e scollegarla dalla sua estremità distale.
- Successivamente, completare la transezione del tronco comune di MHV e LHV utilizzando ricariche lineari cutler per separare completamente il fegato sinistro e il lobo caudato, facendo attenzione a evitare lesioni da trazione alla vena epatica media e alla vena cava.
- Dopo un'accurata emostasi della ferita, posizionare il campione in un sacchetto e rimuoverlo attraverso un'incisione verticale di 6 cm attorno all'ombelico nell'addome inferiore. Posizionare due tubi di drenaggio rispettivamente sulla sezione epatica e sull'incavo epatorenale.
- Sezionare il peduncolo epatico sinistro utilizzando l'approccio extratecale.
Risultati
Il risultato rilevante di questa operazione è mostrato nella Tabella 1. Il lobo caudato totale e il fegato sinistro del paziente sono stati rimossi in 200 minuti con 50 ml di perdita di sangue e circa 1500 ml di sostituzione di liquidi. La produzione urinaria intraoperatoria è stata di 150 ml. Il tempo di sezionamento del parenchima epatico, compresa la sezionazione del peduncolo epatico e dello spazio tra il lobo caudato del fegato e la vena cava inferiore, è stato di 84 minuti. La manovra di pringle è stata eseguita tre volte (il tempo di occlusione ilare epatica è stato rispettivamente di 10 minuti, 20 minuti e 15 minuti). L'intero periodo di recupero dopo l'intervento chirurgico si è svolto senza intoppi, senza segni di perdite di bile e sanguinamento postoperatorio. Due drenaggi sono stati rimossi il 6° e il 10° giorno dopo l'intervento. Il paziente è stato dimesso il 14° giorno postoperatorio .
L'analisi patologica ha rivelato un colangiocarcinoma (pT1N0M0, stadio I, AJCC 8aedizione)16, con un trombo tumorale visibile nel sistema vascolare. Grado MVI: M2 (gruppo ad alto rischio). Il margine chirurgico del fegato era negativo. L'immunoistochimica ha indicato positività CK7, CK19, EMA, CK8, MSH6, MSH2, PMS2, MLH1, Ki67 (40%). Secondo l'AJCC 8aedizione 16, il paziente è tornato in ospedale 1 mese dopo l'intervento chirurgico per ricevere una chemioterapia regolare a causa del grado MVI.
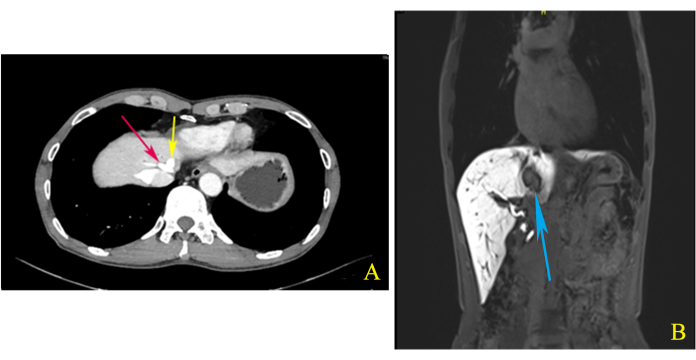
Figura 1: Tomografia computerizzata (TC) e risonanza magnetica per immagini (MRI). (A) La vena epatica media (MHV) e la vena epatica sinistra (LHV) condividevano un tronco comune (frecce rosse e gialle), come mostrato dalla tomografia computerizzata (TC) potenziata dell'addome superiore durante la fase di ritardo. (B) L'imaging coronale della risonanza magnetica (MRI) potenziata dell'addome superiore ha mostrato che il tumore situato nella giunzione S1/4/8 è strettamente correlato all'MHV (freccia blu). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Incisione di estrazione del campione e posizionamento del trocar. (A) Il foro di osservazione. (B) Il trocar della linea medioclavicolare destra era il foro principale per l'operatore. (C) Il trocar della linea medioclavicolare sinistra era il foro di intervento ausiliario per l'assistente. (D) Il trocar della linea ascellare anteriore destra sottocostale era il foro dell'operatore per l'operatore dell'operazione. (E) Il trocar della linea medioclavicolare sinistra sottocostale era il foro principale per l'operatore e (linea rossa) l'incisione verticale per rimuovere il campione. Clicca qui per visualizzare una versione più grande di questa figura.
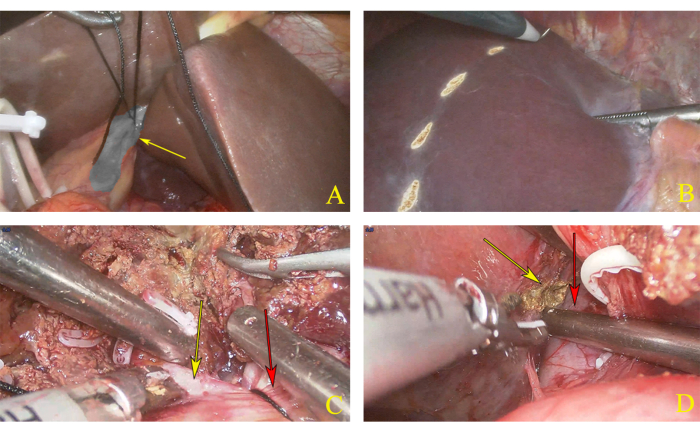
Figura 3: Dissezione dell'emiepatectomia sinistra. (A) Legatura del peduncolo epatico sinistro. La freccia gialla indica il peduncolo epatico sinistro. (B) Linea di pre-resezione contrassegnata secondo la linea ischemica. (C) Il piano di transezione. La freccia gialla indica il peduncolo epatico destro e la freccia rossa indica il peduncolo epatico sinistro. (D) La freccia gialla indica il bordo destro del lobo caudale e la freccia rossa indica la vena cava inferiore (IVC). Clicca qui per visualizzare una versione più grande di questa figura.
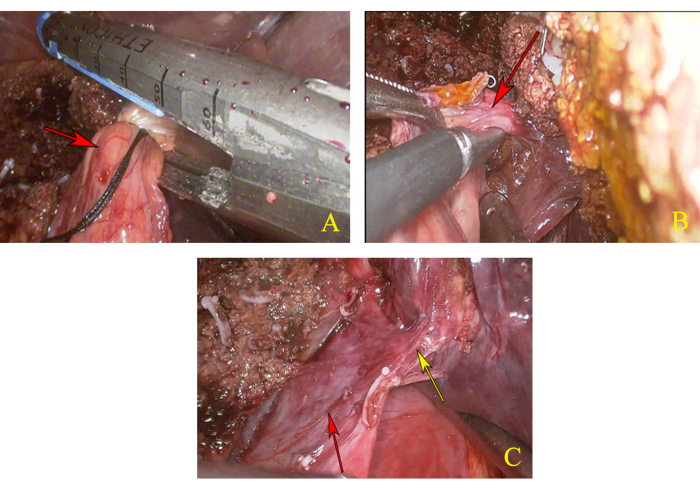
Figura 4: Dissezione del lobo caudale. (A) Scollegare il peduncolo epatico sinistro. La freccia rossa indica il peduncolo epatico sinistro. (B) Anatomia e dissezione del peduncolo epatico del lobo caudato. La freccia rossa indica il peduncolo epatico del lobo caudato. (C) Esposizione completa del tronco comune della vena epatica media (MHV) e della vena epatica sinistra (LHV). La freccia gialla indica il tronco comune di MHV e LHV e la freccia rossa indica IVC. Clicca qui per visualizzare una versione più grande di questa figura.
| Variabile | Risultato | |
| Intraoperatorio | Tempo operativo (min) | 200 |
| Perdita di sangue intraoperatoria (mL) | 50 | |
| Trasfusione di sangue (mL) | 0 | |
| Sostituzione dei liquidi (mL) | 1500 | |
| produzione urinaria (mL) | 150 | |
| il tempo di occlusione ilare epatica (min) | 10, 20, 15 | |
| Postoperatorio | Tempo di scarica (giorni) | 14 |
| Complicanze postoperatorie | Nessuno | |
| Patologico | Diagnosi | Colangiocarcinoma intraepatico |
| Marcatori positivi | CK7, CK19, EMA, CK8, MSH6, MSH2, PMS2, MLH1, Ki67 (40%) | |
| Marcatori negativi | CEA, Hep, Arginasi-1, HER-2 | |
| Grado MVI | M2 | |
Tabella 1: Esiti chirurgici e dettagli postoperatori del paziente.
Discussione
L'ICC del lobo caudato spesso invade i segmenti epatici circostanti o il peduncolo epatico adiacente, il cui principio di trattamento è simile a quello di un colangiocarcinoma ilare17 e, a causa della sua posizione anatomica e delle sue caratteristiche biologiche, l'ICC del lobo caudato è soggetto a danneggiare le strutture circostanti durante l'intervento chirurgico, portando a sanguinamento massiccio e perdita di bile postoperatoria. Quindi, la lobectomia caudatata laparoscopica è una delle resezioni epatiche più difficili, che richiede elevata abilità ed esperienza. Abbiamo riportato un caso riuscito di emiepatectomia sinistra laparoscopica combinata con lobectomia caudata per il trattamento dell'ICC del lobo caudato. Il paziente è stato dimesso senza complicazioni postoperatorie. Abbiamo migliorato la sicurezza e la fattibilità della procedura chirurgica perfezionando alcune tecniche durante l'operazione. Una valutazione preoperatoria completa e una meticolosa pianificazione chirurgica sono fondamentali. Abbiamo impiegato l'occlusione emiepatica continua in combinazione con la manovra di Pringle intermittente, che delinea il piano di resezione attraverso la demarcazione ischemica, ottimizzando così la conservazione della funzione epatica residua e minimizzando la perdita di sangue intraoperatoria. Fondamentalmente, abbiamo integrato più approcci chirurgici per facilitare una migliore esposizione del lobo caudato epatico e delle strutture vascolari critiche circostanti, garantendo una visione anatomica più chiara e migliorando la sicurezza chirurgica complessiva.
A causa di diversi fattori come la resezione impegnativa per la resezione combinata del segmento epatico o anche la resezione semi-epatica, l'infiltrazione vascolare tumorale e la necessità di dissezione linfonodale, l'adozione del trattamento laparoscopico per l'ICC, rispetto al carcinoma epatocellulare, è stata relativamente ritardata. Ciononostante, la resezione laparoscopica per ICC ha mostrato risultati superiori a breve termine e risultati comparabili a lungo termine rispetto all'approccio laparotomico18. Questo perché la laparoscopia può fornire una varietà di approcci chirurgici, consentendo una migliore esposizione e controllo dei vasi vitali. Inoltre, è facile distinguere le metastasi addominali da impianto durante l'esplorazione laparoscopica, il che rende la stadiazione del tumore più accurata. Inoltre, le lesioni epatiche nascoste possono essere identificate anche durante la chirurgia laparoscopica attraverso la colorazione a fluorescenza o l'ecografia intraoperatoria19. Una recente meta-analisi20 ha indicato che la resezione laparoscopica del lobo caudato presentava molteplici vantaggi rispetto alla chirurgia a cielo aperto, in particolare la perdita di sangue intraoperatoria e le degenze ospedaliere. Due studi 21,22 sul trattamento dell'ICC hanno suggerito che la resezione laparoscopica per il lobo caudato è una procedura fattibile e sicura. Tuttavia, sono necessari ulteriori studi per stabilire i reali benefici della laparoscopia perché l'emiepatectomia sinistra laparoscopica combinata con la chirurgia radicale del lobo caudato per il trattamento dell'ICC del lobo caudato è ancora relativamente rara.
Determinare il margine destro del lobo caudato è estremamente impegnativo. L'approccio tradizionale consiste nell'utilizzare il peduncolo di Glisson posteriore destro come piano ventrale destro del lobo caudato e nell'utilizzare l'IVC come punto di riferimento per il sezionamento del parenchima epatico tra le vene epatiche medie e destre al fine di determinare il confine giusto per una semplice resezione del lobo caudato. Tuttavia, è importante notare che le decisioni chirurgiche non dovrebbero basarsi esclusivamente su questo piano concettuale. Kogure et al.23 hanno sottolineato che le vene epatiche sono delineate dal fegato destro e dal processo caudato. Kumon et al.24 hanno suggerito che le vene epatiche corte nella porzione paravavale fungono da confini, ma queste possono essere difficili da operare intraoperatoriamente. Ho et al.25 hanno stabilito un confine tra il processo caudato e il lobo posteriore utilizzando l'occlusione del peduncolo epatico inferiore destro. La maggior parte degli studiosi26 pensa che il piano paraventrale destro sia tipicamente impiegato per definire il margine destro del lobo caudato, che si allinea con l'approccio chirurgico qui descritto.
C'è controversia sul fatto che la dissezione linfonodale sia necessaria durante la chirurgia radicale per i pazienti con colangiocarcinoma. Sebbene i linfonodi metastatici siano associati a un valore prognostico negativo, la linfoadenectomia estesa non viene eseguita di routine nei casi in cui i linfonodi appaiono macroscopicamente non sospetti8. Ratti F et al.27 hanno condotto uno studio che ha dimostrato che non vi è alcuna differenza significativa nell'efficacia della dissezione linfonodale laparoscopica rispetto alla chirurgia a cielo aperto, e anche la differenza nell'efficacia a lungo termine tra i due non è statisticamente significativa. La dissezione linfonodale laparoscopica non porta ad un aumento o addirittura a una minore incidenza di complicanze e non vi è alcuna differenza significativa nel numero di dissezioni linfonodali rispetto alla chirurgia a cielo aperto.
Per i pazienti con ICC del lobo caudato resecabile, la resezione laparoscopica del lobo caudato o anche la resezione combinata di altri segmenti epatici, che è sicura e fattibile, rappresenta una preziosa opportunità di trattamento. Tuttavia, sono necessarie ulteriori ricerche per chiarire l'efficacia a lungo termine dell'intervento chirurgico, determinare il margine appropriato per la resezione del lobo caudato e valutare se è necessaria la dissezione dei linfonodi.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Ringraziamo gli anestesisti e gli infermieri di sala operatoria che hanno assistito all'operazione.
Materiali
| Name | Company | Catalog Number | Comments |
| Bipolar radiofrequency excision hemostatic device | ERBE | 20195-136 | |
| Disposable trocar | Kangji Medical | 101Y.611 | |
| Endoscopic linear cutter reloads | Ethicon, LLC | ECR60W | |
| Laparoscopic system | STORZ | 26003BA | |
| Laparoscopic system | STORZ | TC200 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544240 | |
| Pneumoperitoneum needle | Kangji Medical | 101Y.611 | |
| Ultrasound knife | Johnson | GEN11 | |
| Video system | SONY | LMD-3252SC |
Riferimenti
- Rebecca, L., Angela, N. S., Ahmedin, G., , J. Cancer statistics, 2024. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Paramita, D., et al. Global trends in incidence rates of primary adult liver cancers: A systematic review and meta-analysis. Front Oncol. 10, 171(2020).
- Dimitrios, M., et al. Advances in the treatment of intrahepatic cholangiocarcinoma: An overview of the current and future therapeutic landscape for clinicians. CA Cancer J Clin. 73 (2), 198-222 (2022).
- Nuzzo, G., Giuliante, F., Ardito, F., Giovannini, I. Intrahepatic cholangiocarcinoma. Ann Surg. 249 (3), author reply 542 541-542 (2009).
- Jiang, J. H., Fang, D. Z., Hu, Y. T. Influence of surgical margin width on survival rate after resection of intrahepatic cholangiocarcinoma: A systematic review and meta-analysis. BMJ Open. 13 (5), e067222(2023).
- Dai, Y. S., et al. The influence of resection margin width in patients with intrahepatic cholangiocarcinoma: A meta-analysis. World J Surg Oncol. 21 (1), 16(2023).
- Zhu, H., et al. Prognostic value of resection margin length after surgical resection for intrahepatic cholangiocarcinoma. Am J Surg. 222 (2), 383-389 (2021).
- Lauterio, A., et al. Current surgical management of peri-hilar and intra-hepatic cholangiocarcinoma. Cancers (Basel). 13 (15), 3657(2021).
- Jiang, N., et al. Patterns of caudate lobe invasion of hilar cholangiocarcinoma: A panoramic histologic study of liver. Ann Surg Oncol. 29 (11), 6804-6812 (2022).
- Si, A., et al. Impact of anatomical versus non-anatomical liver resection on short- and long-term outcomes for patients with intrahepatic cholangiocarcinoma. Ann Surg Oncol. 26 (6), 1841-1850 (2019).
- Wang, C., et al. Anatomical resection improved the outcome of intrahepatic cholangiocarcinoma: A propensity score matching analysis of a retrospective cohort. J Oncol. 2022, 4446243(2022).
- Huang, J., Sun, D., Xu, D., Zhang, Y., Hu, M. A comprehensive study and extensive review of the caudate lobe: The last piece of "jigsaw" puzzle. Asian J Surg. 47 (1), 1-7 (2024).
- Parikh, M., Han, H. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Sci Rep. 11 (1), 4328(2021).
- Guo, L., et al. An inferior vena cava-priority approach in laparoscopic isolated hepatic caudate lobectomy. Langenbecks Arch Surg. 409 (1), 106(2024).
- Wang, Z., et al. Laparoscopic right hemi-hepatectomy plus total caudate lobectomy for perihilar cholangiocarcinoma via anterior approach with augmented reality navigation: A feasibility study. Surg Endosc. 37 (10), 8156-8164 (2023).
- Chun, Y. S., Pawlik, T. M., Vauthey, J. N. 8th edition of the AJCC cancer staging manual: Pancreas and hepatobiliary cancers. Ann Surg Oncol. 25 (4), 845-847 (2018).
- Wang, D., et al. The value of total caudate lobe resection for hilar cholangiocarcinoma: A systematic review. Int J Surg. 110 (1), 385-394 (2024).
- Ratti, F., et al. Intrahepatic cholangiocarcinoma as the new field of implementation of laparoscopic liver resection programs. A comparative propensity score-based analysis of open and laparoscopic liver resections. Surg Endosc. 35 (4), 1851-1862 (2021).
- Dorovinis, P., et al. Safety and efficacy of laparoscopic caudate lobectomy: A systematic review. J Clin Med. 10 (21), 4907(2021).
- Ding, Z., et al. Safety and feasibility for laparoscopic versus open caudate lobe resection: A meta-analysis. Langenbecks Arch Surg. 406 (5), 1307-1316 (2021).
- Wan, H. F., et al. Laparoscopic caudate lobectomy for cholangiocarcinoma of caudate lobe invading middle hepatic vein. Ann Surg Oncol. 27 (11), 4181-4185 (2020).
- Hu, Y. F., Hu, H. J., Ma, W. J., Jin, Y. W., Li, F. Y. Laparoscopic versus open liver resection for intrahepatic cholangiocarcinoma: A systematic review of propensity score-matched studies. Updates Surg. 75 (8), 2049-2061 (2023).
- Kogure, K., et al. The caudate processus hepatic vein: A boundary hepatic vein between the caudate lobe and the right liver. Ann Surg. 247 (2), 288-293 (2008).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Ho, K. M., et al. Laparoscopic total caudate lobectomy for hepatocellular carcinoma. J Laparoendosc Adv Surg Tech A. 27 (10), 1074-1078 (2017).
- Shen, X. Y., et al. Can we delineate preoperatively the right and ventral margins of caudate lobe of the liver. Ann Surg Treat Res. 97 (3), 124-129 (2019).
- Ratti, F., et al. Perioperative and long-term outcomes of laparoscopic versus open lymphadenectomy for biliary tumors: A propensity-score-based, case-matched analysis. Ann Surg Oncol. 26 (2), 564-575 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon