Method Article
Hémihépatectomie gauche laparoscopique associée à une résection du lobe caudé
Dans cet article
Résumé
Le cholangiocarcinome intrahépatique du lobe caudé est un défi pour de nombreux chirurgiens en raison de son emplacement unique. Ici, nous présentons un protocole pour montrer les détails étape par étape de l’hémihépatectomie gauche laparoscopique associée à la résection du lobe caudé pour le cholangiocarcinome.
Résumé
Le cholangiocarcinome intrahépatique (CCI) est une tumeur maligne commune du foie. La résection chirurgicale radicale est le pilier du traitement potentiellement curatif de la CCI. La résection hépatique anatomique pour la CCI dans le lobe caudé est l’une des résections hépatiques les plus difficiles. Parce que la tumeur est située profondément et envahit facilement les vaisseaux sanguins environnants, tels que le pédicule hépatique gauche, le pédicule hépatique droit et la veine hépatique moyenne. L’hépatectomie anatomique laparoscopique du lobe caudé assure non seulement une marge d’incision négative, mais offre également une approche moins invasive pour les patients. Cette technique est sur le point de devenir le choix privilégié pour la chirurgie radicale du lobe caudé à l’avenir. Dans ce protocole chirurgical, un patient de 65 ans atteint d’un cholangiocarcinome intrahépatique (d’environ 3,2 × 1,9 cm2) situé dans le lobe caudal gauche a subi une hémihépatectomie gauche laparoscopique associée à une résection du lobe caudé avec succès sans aucune complication postopératoire. L’examen pathologique postopératoire a révélé un cholangiocarcinome avec un thrombus tumoral visible dans le système vasculaire. Le patient est sorti de l’hôpital le 14e jour postopératoire. L’hémihépatectomie gauche laparoscopique associée à la lobectomie caudidée pour le traitement de la CCI du lobe caudé peut être réalisée en toute sécurité et n’augmente pas de manière significative la morbidité ou la mortalité de l’intervention.
Introduction
Le cholangiocarcinome intrahépatique prend naissance dans les cellules épithéliales des canaux biliaires intrahépatiques et est un cholangiocarcinome apparaissant au-dessus du canal biliaire secondaire du foie. L’incidence de la CCI est la deuxième après celle du carcinome hépatocellulaire (CHC), représentant 10 % à 15 % des cancers primitifs du foie et environ 20 % des cancers des canaux biliaires1. L’incidence de la CPI a augmenté d’année en année dans le monde, augmentant de 140 % au cours des 40 dernières années2. La résection chirurgicale reste le pilier du traitement potentiellement curatif de la CCI. Cependant, seuls 20 % à 30 % des patients ont la possibilité d’une résection chirurgicale. Après résection chirurgicale, le taux de survie globale à 5 ans des patients atteints d’ICC n’est que de 20 % à 35 %3. En effet, même si une résection radicale est réalisée, seuls quelques patients peuvent obtenir des marges négatives4. Il est particulièrement important pour les patients atteints d’ICC précoce d’obtenir une chirurgie curative. La chirurgie curative pour les patients atteints de CCI est étroitement liée aux marges chirurgicales. Deux méta-analyses récentes 5,6 ont indiqué qu’une largeur de marge chirurgicale de >1 cm est associée à une meilleure survie globale. Une étude7 portant sur 126 patients a montré qu’une marge ≥1,0 cm était associée à une meilleure survie globale (SG) et à une survie sans récidive (RFS).
Dans la chirurgie ICC, la résection anatomique du foie, qui est importante pour le pronostic des patients ICC8, peut non seulement obtenir une marge chirurgicale sûre, mais peut également exciser le pédicule hépatique violé. Une étude9 a rapporté que la voie d’infiltration la plus courante pour le cholangiocarcinome du lobe caudé est le tissu conjonctif fibreux le long du système Glisson, et non dans le canal biliaire. Dans une étude antérieure, Si et al.10 ont examiné les données de 702 patients atteints d’ICC et ont constaté que l’incidence des complications était similaire entre la résection anatomique et la résection non anatomique, et que la résection anatomique était associée à une meilleure survie sans maladie et à une survie globale à 1, 3 et 5 ans. Une autre étude d’appariement de propension11 sur l’ICC a identifié la résection non anatomique comme un facteur de risque indépendant de SG (p < 0,05).
Cependant, la résection chirurgicale de l’ICC caudé peut être difficile pour le chirurgien. Il est très difficile pour les chirurgiens d’explorer le lobe caudé en raison de son emplacement anatomique unique, comme sa pénétration profonde dans le parenchyme hépatique et sa proximité avec les principaux vaisseaux12 (la veine cave inférieure, les veines hépatiques moyennes ou droites, la veine porte et le ligamentum venosum). Ceux-ci peuvent rendre difficile l’obtention d’un large champ de vision pendant la chirurgie et l’obtention d’un tranchant invisible. Au cours des dernières années, grâce à l’étude détaillée de l’anatomie hépatique, au développement rapide de la technologie laparoscopique et à la promotion continue du concept de résection hépatique précise, la prise en charge chirurgicale de l’ICC est passée d’une lobectomie caudidée isolée13,14 à une hémihépatectomie laparoscopique associée à une lobectomie caudidée15, ce qui est rarement rapporté dans la littérature. Il y a un grand besoin de vidéos d’opérations réussies pour guider l’utilisation généralisée de telles opérations à l’avenir. Ici, nous présentons une hémihépatectomie gauche laparoscopique associée à une résection du lobe caudé pour traiter un cholangiocarcinome intrahépatique dans le lobe caudé.
Un Chinois de 65 ans a été admis à l’hôpital avec une masse hépatique détectée fortuitement par échographie abdominale. L’examen physique n’a révélé aucune anomalie significative. Les examens de laboratoire, y compris les analyses sanguines de routine, les tests de la fonction hépatique, la coagulation et les indicateurs tumoraux (AFP, CEA, CA199), étaient normaux. La tomodensitométrie (TDM) améliorée de la partie supérieure de l’abdomen a montré une ombre de rehaussement anormale de 3,2 à 1,9 cm2 à la jonction S1/4/8 et a montré que la veine hépatique moyenne (VHM) et la veine hépatique gauche (VHL) partageaient un tronc commun (Figure 1A). L’imagerie par résonance magnétique (IRM) améliorée de la partie supérieure de l’abdomen a également révélé la présence d’un nodule de 2,5 à 2,0cm2 dans la même zone, mais suggérant une ICC (Figure 1B). Après avoir terminé l’évaluation préopératoire, nous avons décidé de réaliser une hémihépatectomie gauche laparoscopique associée à une résection du lobe caudé pour assurer une marge chirurgicale négative.
Protocole
Ce protocole suit les directives du comité d’éthique de la recherche humaine de l’hôpital populaire de Meizhou. Le consentement éclairé des patients a été obtenu pour divulguer des informations et des données relatives à ce traitement.
1. Préparation préopératoire
- Interdire au patient de manger pendant 6 h et de boire pendant 2 h avant l’opération.
- Appliquez l’antibiotique (1 g de Ceftriaxone sodique) par injection intraveineuse du coude pour prévenir l’infection de manière préventive 30 minutes avant de couper à travers la peau.
- Utilisez l’intubation trachéale sous anesthésie générale. Perforation et cathétérisation de l’artère radiale droite (taille du cathéter, 20 G) et de la veine jugulaire interne (taille du cathéter, 8 Fr) sous guidage échographique.
- Stérilisez la peau avec un gommage à base d’iode à 0,5 % et des serviettes stériles pour exposer pleinement la zone chirurgicale. Désinfectez la zone chirurgicale avec de l’iodophor trois fois.
2. Technique chirurgicale
- Réglage du fonctionnement
- Coupez la peau à environ 10 mm longitudinalement sous l’ombilic, puis insérez une aiguille jetable pour pneumopéritoine à travers l’incision. Injectez du CO2 après que l’aiguille du pneumopéritoine est connectée à l’appareil de pneumopéritoine pour établir le pneumopéritoine.
- Ensuite, insérez un trocart en fer de 10 mm dans l’incision. Changer le patient d’une position couchée à une position couchée avec les jambes écartées, la tête levée à 30° et les pieds abaissés après avoir examiné aucun dommage par perforation.
REMARQUE : La pression du pneumopéritoine a été réglée à 12 mmHg. - Placez deux trocarts de 12 mm sur la ligne médio-claviculaire droite et gauche au-dessus des 4 doigts ombilicaux (B et C), deux trocarts de 5 mm sur la ligne axillaire antérieure droite sous-costale et la ligne sous-costale médio-claviculaire gauche (D et E), voir Figure 2.
- Effectuer l’exploration abdominale par laparoscopie. Vérifiez s’il n’y a pas de blessure abdominale et de saignement par perforation ; Vérifier la présence de métastases extrahépatiques importantes pour évaluer la faisabilité d’une chirurgie radicale.
- Phase d’exploration
- Libérez la moitié gauche du foie et divisez les ligaments rond et falciforme jusqu’au niveau de la fosse veineuse hépatique. Divisez le ligament triangulaire gauche et le ligament coronaire gauche, en s’étendant jusqu’à ce que le bord latéral de la veine hépatique gauche soit identifié.
- Clamp le ligament rond proximal du foie.
- Révélez le ligament hépatoduodénal en accédant au petit épiploon et positionnez régulièrement une bande d’occlusion du flux sanguin hépatique. Si nécessaire, utilisez la méthode Pringle pour bloquer par intermittence le flux sanguin hépatique.
- Phase de dissection
- Disséquer le pédicule hépatique gauche par voie extrathécale.
- Après avoir soulevé le lobe latéral gauche, exposez le lobe caudé en l’ouvrant complètement vers le petit épiploon. Identifier, élinguer et disséquer le pédicule hépatique gauche à l’aide d’une pince non traumatique et d’une pince de dissection à angle droit de 10 mm.
- Quelques minutes plus tard, créez une ligne de pré-résection marquée avec une électrocautérisation basée sur la ligne d’ischémie des moitiés gauche et droite du foie (Figure 3A, B).
- À l’aide d’un couteau à ultrasons, on incise le tissu hépatique, en commençant par la surface supérieure du foie, de l’avant vers l’arrière, jusqu’à ce que le niveau du pédicule hépatique gauche et droit soit complètement exposé le long de la ligne marquée (figure 3C).
- Fixez le tuyau structuré de >4 mm de diamètre à l’aide de clips et dissociez-le à l’aide d’un couteau à ultrasons à l’extrémité distale.
- En utilisant le temps pour activer le foie, disséquez l’espace entre le lobe caudé et la veine cave inférieure (CVI) par une approche dorsale. Lorsque vous rencontrez la veine hépatique courte (VHS), clampez-la avec un hem-o-lok, puis déconnectez-la à l’extrémité distale.
- Après avoir complètement exposé l’IVC, marquez le plan paracaval droit, qui est le bord droit imaginaire du lobe caudé (Figure 3D).
- Après avoir retiré la ligne de suspension du pédicule hépatique gauche, débranchez le pédicule hépatique gauche à l’aide d’un rechargement linéaire du cutler (figure 4A).
- Le long de l’extrémité brisée du pédicule hépatique gauche, cherchez le pédicule hépatique du lobe caudé et disséquez-le, puis serrez son extrémité proximale avec deux hem-o-loks et coupez son extrémité distale avec un couteau à ultrasons par l’approche du côté gauche (figure 4B).
- Tirez le premier portail hépatique vers la droite pour exposer l’avion paracaval droit. Le long du bord droit du lobe caudé, tel qu’indiqué, coupez le parenchyme hépatique sous la jonction des pédicules hépatiques gauche et droit jusqu’à ce que le tronc commun du MHV et de la veine hépatique gauche (LHV) soit révélé (Figure 4C).
- Lorsque vous rencontrez la veine caudé, clampez-la avec hem-o-lok et déconnectez-la à son extrémité distale.
- Par la suite, complétez la section du tronc commun du MHV et du LHV en utilisant des recharges linéaires de cutler pour séparer complètement le foie gauche et le lobe caudé, en prenant soin d’éviter les lésions de traction à la veine hépatique moyenne et à la veine cave.
- Après une hémostase complète de la plaie, placez l’échantillon dans un sac et retirez-le par une incision verticale de 6 cm autour du nombril dans le bas-ventre. Placez deux tubes de drainage sur la section hépatique et la cavité hépato-rénale, respectivement.
- Disséquer le pédicule hépatique gauche par voie extrathécale.
Résultats
Le tableau 1 présente les résultats pertinents de cette opération. Le lobe caudé total et le foie gauche du patient ont été retirés en 200 minutes avec une perte de sang de 50 ml et environ 1500 ml de remplacement de liquide. Le débit urinaire peropératoire était de 150 mL. Le temps de transectation du parenchyme hépatique, y compris la dissection du pédicule hépatique et l’espace entre le lobe caudé du foie et la veine cave inférieure, était de 84 min. La manœuvre de pringle a été effectuée trois fois (le temps d’occlusion hilaire hépatique était de 10 min, 20 min et 15 min, respectivement). Toute la période de récupération après l’opération s’est déroulée sans problème, sans aucun signe de fuite de bile et de saignement postopératoires. Deux drains ont été retirés le 6e et le 10e jour après l’opération. Le patient est sorti de l’hôpital le 14e jour postopératoire.
L’analyse pathologique a révélé un cholangiocarcinome (pT1N0M0, stade I, AJCC 8e édition)16, avec un thrombus tumoral visible dans le système vasculaire. Grade MVI : M2 (groupe à haut risque). La marge chirurgicale du foie était négative. L’immunohistochimie a indiqué une positivité CK7, CK19, EMA, CK8, MSH6, MSH2, PMS2, MLH1, Ki67 (40 %). Selon la 8 e édition16 de l’AJCC, le patient est retourné à l’hôpital 1 mois après l’opération pour recevoir une chimiothérapie régulière en raison du grade MVI.
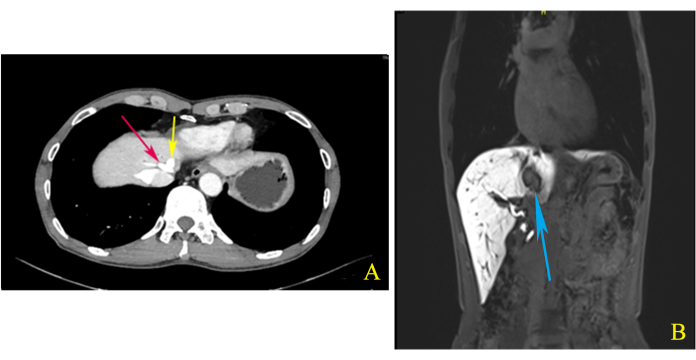
Figure 1 : Tomodensitométrie (TDM) et imagerie par résonance magnétique (IRM) (A) La veine hépatique moyenne (MHV) et la veine hépatique gauche (LHV) partageaient un tronc commun (flèches rouges et jaunes), comme le montre la tomodensitométrie (TDM) améliorée de la partie supérieure de l’abdomen pendant la phase de retard. (B) L’imagerie coronale de l’imagerie par résonance magnétique (IRM) améliorée de la partie supérieure de l’abdomen a montré que la tumeur située dans la jonction S1/4/8 est étroitement liée au MHV (flèche bleue). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Incision d’extraction de l’échantillon et placement du trocart. (A) Le trou d’observation. (B) Le trocart de la ligne médio-claviculaire droite était le principal trou de manœuvre pour l’opérateur. (C) Le trocart de la ligne médio-claviculaire gauche était l’orifice de manœuvre auxiliaire de l’assistant. (D) Le trocart de la ligne axillaire sous-costale antérieure droite était le trou de manœuvre auxiliaire pour l’opérateur. (E) Le trocart de la ligne médio-claviculaire sous-costale gauche était le trou d’opération principal pour l’assistant, et (ligne rouge) l’incision verticale pour retirer l’échantillon. Veuillez cliquer ici pour voir une version agrandie de cette figure.
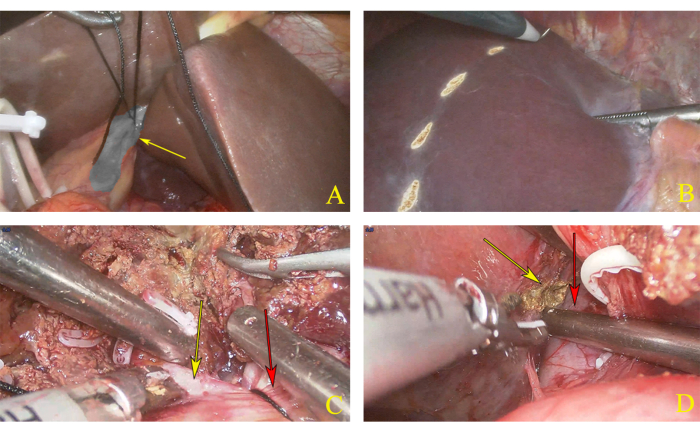
Figure 3 : Dissection de l’hémihépatectomie gauche. (A) Ligature du pédicule hépatique gauche. La flèche jaune indique le pédicule hépatique gauche. (B) Ligne de pré-résection marquée selon la ligne ischémique. (C) Le plan de transsection. La flèche jaune indique le pédicule hépatique droit et la flèche rouge indique le pédicule hépatique gauche. (D) La flèche jaune indique le bord droit du lobe caudal, et la flèche rouge indique la veine cave inférieure (IVC). Veuillez cliquer ici pour voir une version agrandie de cette figure.
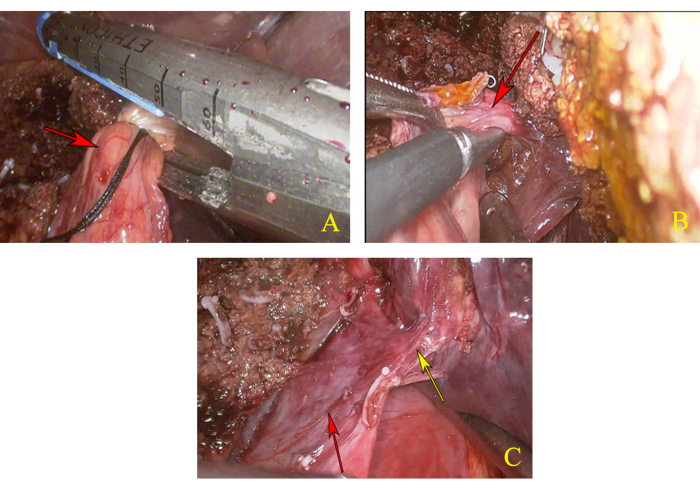
Figure 4 : Dissection du lobe caudal. (A) Débranchez le pédicule hépatique gauche. La flèche rouge indique le pédicule hépatique gauche. (B) Anatomie et dissection du pédicule hépatique du lobe caudé. La flèche rouge indique le pédicule hépatique du lobe caudé. (C) Exposition complète du tronc commun de la veine hépatique moyenne (MHV) et de la veine hépatique gauche (LHV). La flèche jaune indique le tronc commun du MHV et du LHV, et la flèche rouge indique la VCV. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Variable | Résultat | |
| Peropératoire | Temps de fonctionnement (min) | 200 |
| Perte de sang peropératoire (mL) | 50 | |
| Transfusion sanguine (mL) | 0 | |
| Remplacement des liquides (mL) | 1500 | |
| débit urinaire (mL) | 150 | |
| Le temps de l’occlusion hilaire hépatique (min) | 10, 20, 15 | |
| Postopératoire | Temps de décharge (jours) | 14 |
| Complications postopératoires | Aucun | |
| Pathologique | Diagnostic | Cholangiocarcinome intrahépatique |
| Marqueurs positifs | CK7, CK19, EMA, CK8, MSH6, MSH2, PMS2, MLH1, Ki67 (40 %) | |
| Marqueurs négatifs | ACE, Hep, Arginase-1, HER-2 | |
| Grade MVI | M2 | |
Tableau 1 : Résultats chirurgicaux et détails postopératoires du patient.
Discussion
L’ICC du lobe caudé envahit souvent les segments hépatiques environnants ou le pédicule hépatique adjacent, dont le principe de traitement est similaire à celui de certains cholangiocarcinomes hilaires17, et en raison de son emplacement anatomique et de ses caractéristiques biologiques, l’ICC du lobe caudé est sujet à endommager les structures environnantes pendant la chirurgie, entraînant des saignements massifs et des fuites biliaires postopératoires. Ainsi, la lobectomie caudidée laparoscopique est l’une des résections hépatiques les plus difficiles, qui nécessite des compétences et une expérience élevées. Nous avons rapporté un cas réussi d’hémihépatectomie gauche laparoscopique associée à une lobectomie caudidée pour le traitement de la CCI du lobe caudé. Le patient est sorti de l’hôpital sans aucune complication postopératoire. Nous avons amélioré la sécurité et la faisabilité de l’intervention chirurgicale en affinant certaines techniques tout au long de l’opération. Une évaluation préopératoire complète et une planification chirurgicale méticuleuse sont primordiales. Nous avons utilisé l’occlusion hémihépatique continue en conjonction avec la manœuvre de Pringle intermittente, qui délimite le plan de résection par démarcation ischémique, optimisant ainsi la préservation de la fonction hépatique résiduelle et minimisant la perte de sang peropératoire. De manière cruciale, nous avons intégré plusieurs approches chirurgicales pour faciliter une meilleure exposition du lobe caudé hépatique et de ses structures vasculaires critiques environnantes, assurant une vue anatomique plus claire et améliorant la sécurité chirurgicale globale.
En raison de plusieurs facteurs tels que la résection difficile pour la résection combinée du segment hépatique ou même la résection semi-hépatique, l’infiltration vasculaire tumorale et la nécessité d’un curage ganglionnaire, l’adoption du traitement par laparoscopie pour la CCI, par rapport au carcinome hétatocellulaire, a été relativement retardée. Néanmoins, la résection laparoscopique pour l’ICC a montré des résultats à court terme supérieurs et des résultats comparables à long terme par rapport à l’approche laparotomique18. En effet, la laparoscopie peut fournir une variété d’approches chirurgicales, permettant une meilleure exposition et un meilleur contrôle des vaisseaux vitaux. De plus, il est facile de distinguer les métastases d’implantation abdominale lors de l’exploration laparoscopique, ce qui rend la stadification tumorale plus précise. De plus, des lésions hépatiques cachées peuvent également être identifiées lors d’une chirurgie laparoscopique par coloration par fluorescence ou par échographie peropératoire19. Une méta-analyse récentea indiqué que la résection laparoscopique du lobe caudé présentait de multiples avantages par rapport à la chirurgie ouverte, en particulier la perte de sang peropératoire et les séjours à l’hôpital. Deux études 21,22 sur le traitement de la CCI ont suggéré que la résection laparoscopique du lobe caudé est une procédure réalisable et sûre. Cependant, d’autres études sont nécessaires pour établir les avantages réels de la laparoscopie, car la hémihépatectomie gauche laparoscopique associée à la chirurgie radicale du lobe caudé pour le traitement de la CCI du lobe caudé est encore relativement rare.
Déterminer le bord droit du lobe caudé est extrêmement difficile. L’approche traditionnelle consiste à utiliser le pédicule Glisson postérieur droit comme plan ventral droit du lobe caudé et à utiliser la CVI comme point de référence pour traverser le parenchyme hépatique entre les veines hépatiques moyenne et droite afin de déterminer la limite droite pour la résection simple du lobe caudé. Cependant, il est important de noter que les décisions chirurgicales ne doivent pas être basées uniquement sur ce plan conceptuel. Kogure et al.23 ont souligné que les veines hépatiques sont délimitées par le foie droit et le processus caudé. Kumon et coll.24 ont suggéré que les courtes veines hépatiques de la partie paravavale servent de limites, mais qu’il peut être difficile de les opérer en peropératoire. Ho et al.25 ont établi une limite entre l’apophyse caudée et le lobe postérieur en utilisant l’occlusion du pédicule hépatique inférieur droit. La plupart des chercheurspensent que le plan paraventral droit est généralement utilisé pour définir la marge droite du lobe caudé, ce qui s’aligne avec l’approche chirurgicale décrite ici.
Il existe une controverse sur la nécessité d’un curage ganglionnaire lors d’une chirurgie radicale pour les patients atteints de cholangiocarcinome. Bien que les ganglions lymphatiques métastatiques soient associés à une valeur pronostique négative, une lymphadénectomie extensive n’est pas systématiquement pratiquée dans les cas où les ganglions lymphatiques semblent macroscopiquement non suspects8. Ratti F et coll.27 ont mené une étude qui a montré qu’il n’y a pas de différence significative dans l’efficacité du curage ganglionnaire laparoscopique par rapport à la chirurgie ouverte, et que la différence d’efficacité à long terme entre les deux n’est pas non plus statistiquement significative. Le curage ganglionnaire laparoscopique n’entraîne pas une augmentation ou même une diminution de l’incidence des complications, et il n’y a pas de différence significative dans le nombre de curages ganglionnaires par rapport à la chirurgie ouverte.
Pour les patients atteints d’ICC du lobe caudé résécable, la résection laparoscopique du lobe caudé, ou même la résection combinée d’autres segments du foie, qui est sûre et réalisable, représente une opportunité de traitement précieuse. Cependant, d’autres recherches sont nécessaires pour clarifier l’efficacité à long terme de la chirurgie, déterminer la marge appropriée pour la résection du lobe caudé et évaluer si un curage ganglionnaire est nécessaire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions les anesthésistes et les infirmières de la salle d’opération qui ont aidé à l’opération.
matériels
| Name | Company | Catalog Number | Comments |
| Bipolar radiofrequency excision hemostatic device | ERBE | 20195-136 | |
| Disposable trocar | Kangji Medical | 101Y.611 | |
| Endoscopic linear cutter reloads | Ethicon, LLC | ECR60W | |
| Laparoscopic system | STORZ | 26003BA | |
| Laparoscopic system | STORZ | TC200 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544240 | |
| Pneumoperitoneum needle | Kangji Medical | 101Y.611 | |
| Ultrasound knife | Johnson | GEN11 | |
| Video system | SONY | LMD-3252SC |
Références
- Rebecca, L., Angela, N. S., Ahmedin, G., , J. Cancer statistics, 2024. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Paramita, D., et al. Global trends in incidence rates of primary adult liver cancers: A systematic review and meta-analysis. Front Oncol. 10, 171 (2020).
- Dimitrios, M., et al. Advances in the treatment of intrahepatic cholangiocarcinoma: An overview of the current and future therapeutic landscape for clinicians. CA Cancer J Clin. 73 (2), 198-222 (2022).
- Nuzzo, G., Giuliante, F., Ardito, F., Giovannini, I. Intrahepatic cholangiocarcinoma. Ann Surg. 249 (3), 541-542 (2009).
- Jiang, J. H., Fang, D. Z., Hu, Y. T. Influence of surgical margin width on survival rate after resection of intrahepatic cholangiocarcinoma: A systematic review and meta-analysis. BMJ Open. 13 (5), e067222 (2023).
- Dai, Y. S., et al. The influence of resection margin width in patients with intrahepatic cholangiocarcinoma: A meta-analysis. World J Surg Oncol. 21 (1), 16 (2023).
- Zhu, H., et al. Prognostic value of resection margin length after surgical resection for intrahepatic cholangiocarcinoma. Am J Surg. 222 (2), 383-389 (2021).
- Lauterio, A., et al. Current surgical management of peri-hilar and intra-hepatic cholangiocarcinoma. Cancers (Basel). 13 (15), 3657 (2021).
- Jiang, N., et al. Patterns of caudate lobe invasion of hilar cholangiocarcinoma: A panoramic histologic study of liver. Ann Surg Oncol. 29 (11), 6804-6812 (2022).
- Si, A., et al. Impact of anatomical versus non-anatomical liver resection on short- and long-term outcomes for patients with intrahepatic cholangiocarcinoma. Ann Surg Oncol. 26 (6), 1841-1850 (2019).
- Wang, C., et al. Anatomical resection improved the outcome of intrahepatic cholangiocarcinoma: A propensity score matching analysis of a retrospective cohort. J Oncol. 2022, 4446243 (2022).
- Huang, J., Sun, D., Xu, D., Zhang, Y., Hu, M. A comprehensive study and extensive review of the caudate lobe: The last piece of "jigsaw" puzzle. Asian J Surg. 47 (1), 1-7 (2024).
- Parikh, M., Han, H. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Sci Rep. 11 (1), 4328 (2021).
- Guo, L., et al. An inferior vena cava-priority approach in laparoscopic isolated hepatic caudate lobectomy. Langenbecks Arch Surg. 409 (1), 106 (2024).
- Wang, Z., et al. Laparoscopic right hemi-hepatectomy plus total caudate lobectomy for perihilar cholangiocarcinoma via anterior approach with augmented reality navigation: A feasibility study. Surg Endosc. 37 (10), 8156-8164 (2023).
- Chun, Y. S., Pawlik, T. M., Vauthey, J. N. 8th edition of the AJCC cancer staging manual: Pancreas and hepatobiliary cancers. Ann Surg Oncol. 25 (4), 845-847 (2018).
- Wang, D., et al. The value of total caudate lobe resection for hilar cholangiocarcinoma: A systematic review. Int J Surg. 110 (1), 385-394 (2024).
- Ratti, F., et al. Intrahepatic cholangiocarcinoma as the new field of implementation of laparoscopic liver resection programs. A comparative propensity score-based analysis of open and laparoscopic liver resections. Surg Endosc. 35 (4), 1851-1862 (2021).
- Dorovinis, P., et al. Safety and efficacy of laparoscopic caudate lobectomy: A systematic review. J Clin Med. 10 (21), 4907 (2021).
- Ding, Z., et al. Safety and feasibility for laparoscopic versus open caudate lobe resection: A meta-analysis. Langenbecks Arch Surg. 406 (5), 1307-1316 (2021).
- Wan, H. F., et al. Laparoscopic caudate lobectomy for cholangiocarcinoma of caudate lobe invading middle hepatic vein. Ann Surg Oncol. 27 (11), 4181-4185 (2020).
- Hu, Y. F., Hu, H. J., Ma, W. J., Jin, Y. W., Li, F. Y. Laparoscopic versus open liver resection for intrahepatic cholangiocarcinoma: A systematic review of propensity score-matched studies. Updates Surg. 75 (8), 2049-2061 (2023).
- Kogure, K., et al. The caudate processus hepatic vein: A boundary hepatic vein between the caudate lobe and the right liver. Ann Surg. 247 (2), 288-293 (2008).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Ho, K. M., et al. Laparoscopic total caudate lobectomy for hepatocellular carcinoma. J Laparoendosc Adv Surg Tech A. 27 (10), 1074-1078 (2017).
- Shen, X. Y., et al. Can we delineate preoperatively the right and ventral margins of caudate lobe of the liver. Ann Surg Treat Res. 97 (3), 124-129 (2019).
- Ratti, F., et al. Perioperative and long-term outcomes of laparoscopic versus open lymphadenectomy for biliary tumors: A propensity-score-based, case-matched analysis. Ann Surg Oncol. 26 (2), 564-575 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon