Method Article
Hemihepatectomía laparoscópica izquierda combinada con resección del lóbulo caudado
En este artículo
Resumen
El colangiocarcinoma intrahepático del lóbulo caudado es un desafío para muchos cirujanos debido a su ubicación única. Aquí, presentamos un protocolo para mostrar los detalles paso a paso de la hemihepatectomía izquierda laparoscópica combinada con la resección del lóbulo caudado para el colangiocarcinoma.
Resumen
El colangiocarcinoma intrahepático (CCI) es el tumor maligno común del hígado. La resección quirúrgica radical es el pilar del tratamiento potencialmente curativo para la ICC. La resección anatómica del hígado por ICC en el lóbulo caudado es una de las resecciones hepáticas más difíciles. Porque el tumor se localiza profundamente e invade fácilmente los vasos sanguíneos circundantes, como el pedículo hepático izquierdo, el pedículo hepático derecho y la vena hepática media. La hepatectomía anatómica laparoscópica del lóbulo caudado no solo garantiza un margen de incisión negativo, sino que también ofrece un enfoque menos invasivo para los pacientes. Esta técnica está a punto de convertirse en la opción preferida para la cirugía radical del lóbulo caudado en el futuro. En este protocolo quirúrgico, un paciente masculino de 65 años con colangiocarcinoma intrahepático (tamaño aproximado de 3,2 × 1,9cm2) localizado en el lóbulo caudal izquierdo, se sometió a una hemihepatectomía laparoscópica izquierda combinada con resección del lóbulo caudado con éxito y sin complicaciones postoperatorias. El examen anatomopatológico postoperatorio mostró un colangiocarcinoma con trombo tumoral visible en la vasculatura. El paciente fue dado de alta a los 14 días del postoperatorio. La hemihepatectomía izquierda laparoscópica combinada con lobectomía caudada para el tratamiento del lóbulo caudado se puede realizar de manera segura y no aumenta significativamente la morbilidad o mortalidad del procedimiento.
Introducción
El colangiocarcinoma intrahepático se origina a partir de las células epiteliales del conducto biliar intrahepático y es un colangiocarcinoma que se produce por encima del conducto biliar secundario del hígado. La incidencia de ICC solo es superada por la del carcinoma hepatocelular (CHC), que representa entre el 10% y el 15% de los cánceres primarios de hígado y alrededor del 20% de los cánceres de vías biliares1. La incidencia de la CPI ha ido aumentando año tras año en el mundo, aumentando en un 140% en los últimos 40 años2. La resección quirúrgica sigue siendo el pilar del tratamiento potencialmente curativo para la ICC. Sin embargo, solo entre el 20% y el 30% de los pacientes tienen la posibilidad de una resección quirúrgica. Después de la resección quirúrgica, la tasa de supervivencia general a 5 años de los pacientes con ICC es solo del 20 % al 35 %3. Esto se debe a que, incluso si se realiza una resección radical, solo unos pocos pacientes pueden obtener márgenes negativos4. Es particularmente importante que los pacientes con ICC temprano obtengan una cirugía curativa. La cirugía curativa de los pacientes con ICC está estrechamente relacionada con los márgenes quirúrgicos. Dos metaanálisis recientes 5,6 indicaron que un ancho del margen quirúrgico de >1 cm se asocia con una mejor supervivencia global. En un estudio7 con 126 pacientes, se observó que un margen ≥1,0 cm se relacionó con una mejor supervivencia general (SG) y supervivencia sin recidiva (SSR).
En la cirugía ICC, la resección anatómica del hígado, que es importante para el pronóstico de los pacientes con ICC8, no solo puede obtener un margen quirúrgico seguro, sino que también puede extirpar el pedículo hepático violado. En un estudio9 se informó que la vía de infiltración más común para el colangiocarcinoma del lóbulo caudado es a través del tejido conectivo fibroso a lo largo del sistema de Glisson, no del conducto biliar. En un estudio previo, Si et al.10 revisaron los datos de 702 pacientes con ICC y encontraron que la incidencia de complicaciones fue similar entre la resección anatómica y la no anatómica, y la resección anatómica se asoció con una mejor supervivencia libre de enfermedad y supervivencia global a 1, 3 y 5 años. En otro estudio de emparejamiento de propensión11 sobre el CCI, se identificó la resección no anatómica como un factor de riesgo independiente para la SG (p < 0,05).
Sin embargo, la resección quirúrgica del ICC caudado puede ser un desafío para el cirujano. Es muy difícil para los cirujanos explorar el lóbulo caudado debido a su ubicación anatómica única, como su penetración profunda en el parénquima hepático y su proximidad a los vasos principales12 (la vena cava inferior, las venas hepáticas media o derecha, la vena porta y el ligamento venoso). Estos pueden dificultar la obtención de un campo de visión amplio durante la cirugía y obtener un borde de corte invisible. En los últimos años, con el estudio detallado de la anatomía hepática, el rápido desarrollo de la tecnología laparoscópica y la promoción continua del concepto de resección hepática precisa, el manejo quirúrgico de la ICC ha evolucionado desde la lobectomía caudada aislada13,14 hasta la hemihepatectomía laparoscópica combinada con lobectomía caudada15, que rara vez se reporta en la literatura. Existe una gran necesidad de videos de operaciones exitosas para guiar el uso generalizado de tales operaciones en el futuro. Presentamos una hemihepatectomía izquierda laparoscópica combinada con resección del lóbulo caudado para tratar un colangiocarcinoma intrahepático en el lóbulo caudado.
Un hombre chino de 65 años ingresó en el hospital con una masa hepática detectada incidentalmente mediante ecografía abdominal. La exploración física no mostró alteraciones significativas. Los exámenes de laboratorio, incluidos los análisis de sangre de rutina, las pruebas de función hepática, la coagulación y los indicadores tumorales (AFP, CEA, CA199), fueron normales. La tomografía computarizada (TC) realzada del abdomen superior mostró una sombra de realce anormal de 3,2 a 1,9cm2 en la unión S1/4/8 y mostró que la vena hepática media (MHV) y la vena hepática izquierda (LHV) compartían un tronco común (Figura 1A). La resonancia magnética (RM) mejorada del abdomen superior también reveló un nódulo de 2,5 a 2,0cm2 en la misma área, pero sugestivo de ICC (Figura 1B). Una vez finalizada la evaluación preoperatoria, decidimos realizar una hemihepatectomía izquierda laparoscópica combinada con resección del lóbulo caudado para asegurar un margen quirúrgico negativo.
Protocolo
Este protocolo sigue las pautas del comité de ética de investigación en humanos del Hospital Popular de Meizhou. Se obtuvo el consentimiento informado de los pacientes para divulgar información y datos relacionados con este tratamiento.
1. Preparación preoperatoria
- Prohibir al paciente comer durante 6 h y beber durante 2 h antes de la operación.
- Aplique el antibiótico (1 g de ceftriaxona sódica) a través de una inyección intravenosa en el codo para prevenir la infección de forma preventiva 30 minutos antes de cortar la piel.
- Utilice la intubación traqueal bajo anestesia general. Punción y cateterismo de la arteria radial derecha (tamaño del catéter, 20 G) y de la vena yugular interna (tamaño del catéter, 8 Fr) bajo guía ecográfica.
- Esterilice la piel con un exfoliante a base de yodo al 0,5% y toallitas estériles para exponer completamente el área quirúrgica. Desinfecte el área quirúrgica con yodoforo tres veces.
2. Técnica quirúrgica
- Ajuste de la operación
- Corte la piel unos 10 mm longitudinalmente por debajo del ombligo, luego inserte una aguja de neumoperitoneo desechable a través de la incisión. Inyecte CO2 después de que la aguja del neumoperitoneo se conecte a la máquina de neumoperitoneo para establecer el neumoperitoneo.
- A continuación, inserte un trócar de hierro de 10 mm en la incisión. Cambie al paciente de una posición supina a una posición supina con las piernas separadas, la cabeza levantada 30° y los pies bajados después de examinar que no hay daño por punción.
NOTA: La presión del neumoperitoneo se ajustó a 12 mmHg. - Coloque dos trócares de 12 mm a la derecha y a la línea medioclavicular izquierda por encima de los 4 dedos umbilicales (B y C), dos trócares de 5 mm a la línea axilar anterior derecha subcostal y a la línea medioclavicular izquierda subcostal (D y E), ver Figura 2.
- Realizar exploración abdominal por vía laparoscópica. Comprobar si hay lesiones abdominales y sangrado por punción; Comprobar la presencia de metástasis extrahepáticas significativas para evaluar la viabilidad de la cirugía radical.
- Fase de exploración
- Libere la mitad izquierda del hígado y divida los ligamentos redondos y falciformes hasta el nivel de la fosa de la vena hepática. Divida el ligamento triangular izquierdo y el ligamento coronario izquierdo, extendiéndose hasta identificar el borde lateral de la vena hepática izquierda.
- Pinzar el ligamento redondo proximal del hígado.
- Revelar el ligamento hepatoduodenal al acceder al epiplón menor y colocar rutinariamente una banda de oclusión de flujo sanguíneo hepático. Si es necesario, utilice el método Pringle para bloquear intermitentemente el flujo sanguíneo hepático.
- Fase de disección
- Diseccionar el pedículo hepático izquierdo mediante el abordaje extratecal.
- Después de levantar el lóbulo lateral izquierdo, exponga el lóbulo caudado abriéndolo completamente al epiplón menor. Identificar, eslingar y diseccionar el pedículo hepático izquierdo con una pinza no traumática y una pinza de disección en ángulo recto de 10 mm.
- Unos minutos más tarde, crear una línea de pre-resección marcada con una electrocauterización basada en la línea de isquemia de las mitades izquierda y derecha del hígado (Figura 3A, B).
- Utilice un bisturí ultrasónico para incidir el tejido hepático, comenzando en la superficie superior del hígado desde la parte delantera hasta la posterior, hasta que el nivel del pedículo hepático izquierdo y derecho quede completamente expuesto a lo largo de la línea marcada (Figura 3C).
- Fije la tubería estructurada >4 mm de diámetro con clips y disocie con un cuchillo ultrasónico en el extremo distal.
- Utilizando el tiempo para activar el hígado, diseccione el espacio entre el lóbulo caudado y la vena cava inferior (IVC) a través de un abordaje dorsal. Cuando se encuentre con la vena hepática corta (VHS), sujétela con un dobladillo y luego desconéctela en el extremo distal.
- Después de exponer completamente la VCI, marque el plano paracavo derecho, que es el margen derecho imaginario del lóbulo caudado (Figura 3D).
- Después de retirar la línea de suspensión del pedículo hepático izquierdo, desconecte el pedículo hepático izquierdo mediante recargas lineales del cutler (Figura 4A).
- A lo largo del extremo roto del pedículo hepático izquierdo, busque el pedículo hepático del lóbulo caudado y diseccione, luego sujete su extremo proximal con dos hem-o-loks y corte su extremo distal con un bisturí ultrasónico a través del abordaje del lado izquierdo (Figura 4B).
- Tire del primer portal hepático hacia la derecha para exponer el plano paracavo derecho. A lo largo del margen derecho del lóbulo caudado, como se ha marcado, se cortó el parénquima hepático por debajo de la unión de los pedículos hepáticos izquierdo y derecho hasta que se reveló el tronco común del MHV y la vena hepática izquierda (LHV) (Figura 4C).
- Cuando se encuentre con la vena caudada, sujétela con hem-o-lok y desconéctela en su extremo distal.
- Posteriormente, completar la transección del tronco común de MHV y LHV mediante el uso de recargas lineales de cuchillero para separar completamente el hígado izquierdo y el lóbulo caudado, teniendo cuidado de evitar lesiones por tracción en la vena hepática media y la vena cava.
- Después de la hemostasia completa de la herida, coloque la muestra en una bolsa y retírela a través de una incisión vertical de 6 cm alrededor del ombligo en la parte inferior del abdomen. Colocar dos tubos de drenaje en la sección hepática y en el receso hepatorrenal, respectivamente.
- Diseccionar el pedículo hepático izquierdo mediante el abordaje extratecal.
Resultados
El resultado relevante de esta operación se muestra en la Tabla 1. El lóbulo caudado total y el hígado izquierdo del paciente se extirparon en 200 min con 50 mL de pérdida de sangre y alrededor de 1500 mL de reposición de líquidos. El gasto urinario intraoperatorio fue de 150 mL. El tiempo de seccionamiento del parénquima hepático, incluyendo la disección del pedículo hepático y el espacio entre el lóbulo caudado del hígado y la vena cava inferior, fue de 84 min. La maniobra de Pringle se realizó tres veces (el tiempo de oclusión hiliar hepática fue de 10 min, 20 min y 15 min, respectivamente). Todo el período de recuperación después de la cirugía transcurrió sin problemas, sin signos de fuga de bilis y sangrado postoperatorio. Se retiraron dos drenajes al6º y10º día después de la cirugía. El paciente fue dado de alta a los 14 díasdel postoperatorio .
El análisis anatomopatológico reveló un colangiocarcinoma (pT1N0M0, estadio I, AJCC8ª edición)16, con un trombo tumoral visible en la vasculatura. Grado MVI: M2 (grupo de alto riesgo). El margen quirúrgico del hígado fue negativo. La inmunohistoquímica indicó positividad para CK7, CK19, EMA, CK8, MSH6, MSH2, PMS2, MLH1, Ki67 (40%). De acuerdo con la8ª edición del AJCC16, el paciente regresó al hospital 1 mes después de la cirugía para recibir quimioterapia regular debido al grado MVI.
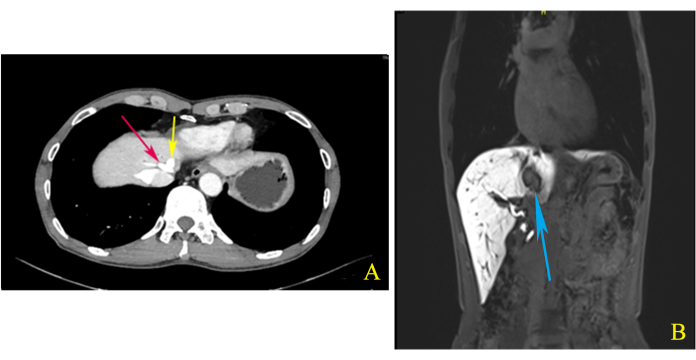
Figura 1: Tomografía computarizada (TC) y resonancia magnética (RMN). (A) La vena hepática media (MHV) y la vena hepática izquierda (LHV) compartían un tronco común (flechas rojas y amarillas), como se muestra en la tomografía computarizada (TC) mejorada del abdomen superior durante la fase de retardo. (B) Las imágenes de la vista coronal de la resonancia magnética (RM) mejorada del abdomen superior mostraron que el tumor ubicado en la unión S1/4/8 está estrechamente relacionado con el MHV (flecha azul). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Incisión en la extracción de la muestra y colocación del trócar. (A) El orificio de observación. (B) El trócar de la línea medioclavicular derecha era el orificio de operación principal para el operador. (C) El trocar de la línea medioclavicular izquierda era el orificio de operación auxiliar para el asistente. (D) El trocar de la línea axilar anterior derecha subcostal era el orificio de operación auxiliar para el operador. (E) El trocar de la línea medioclavicular izquierda subcostal fue el orificio principal de la operación para el asistente, y (línea roja) la incisión vertical para extraer el espécimen. Haga clic aquí para ver una versión más grande de esta figura.
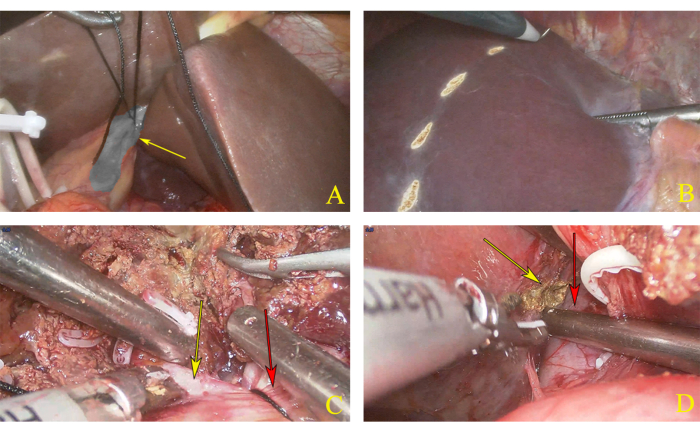
Figura 3: Disección de la hemihepatectomía izquierda. (A) Ligadura del pedículo hepático izquierdo. La flecha amarilla indica el pedículo hepático izquierdo. (B) Línea de pre-resección marcada de acuerdo con la línea isquémica. (C) El plano de transección. La flecha amarilla indica el pedículo hepático derecho y la flecha roja indica el pedículo hepático izquierdo. (D) La flecha amarilla indica el borde derecho del lóbulo caudal, y la flecha roja indica la vena cava inferior (VCI). Haga clic aquí para ver una versión más grande de esta figura.
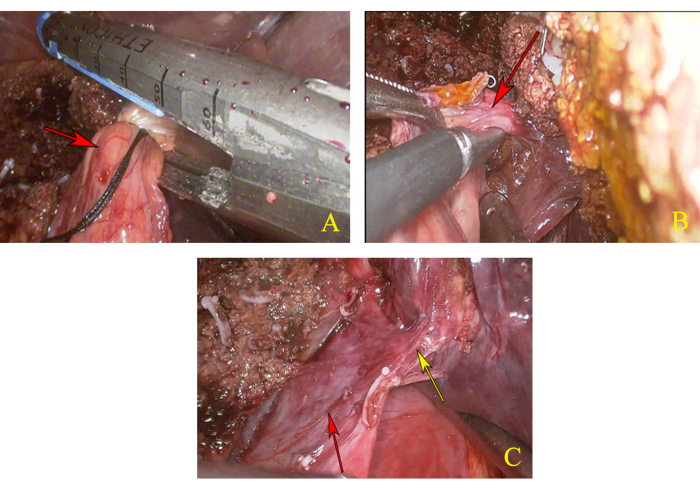
Figura 4: Disección del lóbulo caudal. (A) Desconecte el pedículo hepático izquierdo. La flecha roja indica el pedículo hepático izquierdo. (B) Anatomía y disección del pedículo hepático del lóbulo caudado. La flecha roja indica el pedículo hepático del lóbulo caudado. (C) Exposición completa del tronco común de la vena hepática media (MHV) y la vena hepática izquierda (LHV). La flecha amarilla indica el tronco común de MHV y LHV, y la flecha roja indica IVC. Haga clic aquí para ver una versión más grande de esta figura.
| Variable | Resultado | |
| Intraoperatorio | Tiempo de funcionamiento (min) | 200 |
| Pérdida de sangre intraoperatoria (mL) | 50 | |
| Transfusión de sangre (mL) | 0 | |
| Reemplazo de líquidos (mL) | 1500 | |
| gasto urinario (mL) | 150 | |
| El tiempo de la oclusión hiliar hepática (min) | 10, 20, 15 | |
| Postoperatorio | Tiempo de alta (días) | 14 |
| Complicaciones postoperatorias | Ninguno | |
| Patológico | Diagnóstico | Colangiocarcinoma intrahepático |
| Marcadores positivos | CK7, CK19, EMA, CK8, MSH6, MSH2, PMS2, MLH1, Ki67 (40%) | |
| Marcadores negativos | CEA, Hep, Arginasa-1, HER-2 | |
| Grado MVI | M2 | |
Tabla 1: Evolución quirúrgica y detalles postoperatorios del paciente.
Discusión
El lóbulo caudado ICC a menudo invade los segmentos hepáticos circundantes o el pedículo hepático adyacente, cuyo principio de tratamiento es similar a algunos colangiocarcinoma hiliar17, y debido a su ubicación anatómica y características biológicas, el lóbulo caudado ICC es propenso a dañar las estructuras circundantes durante la cirugía, lo que lleva a una hemorragia masiva y fuga de bilis postoperatoria. Por lo tanto, la lobectomía caudada laparoscópica es una de las resecciones hepáticas más difíciles, que requiere mucha habilidad y experiencia. Presentamos un caso exitoso de hemihepatectomía izquierda laparoscópica combinada con lobectomía caudada para el tratamiento del lóbulo caudado ICC. El paciente fue dado de alta sin complicaciones postoperatorias. Mejoramos la seguridad y la viabilidad del procedimiento quirúrgico mediante el perfeccionamiento de ciertas técnicas a lo largo de la operación. Una evaluación preoperatoria completa y una planificación quirúrgica meticulosa son primordiales. Empleamos la oclusión hemihepática continua junto con la maniobra de Pringle intermitente, que delinea el plano de resección a través de la demarcación isquémica, optimizando así la preservación de la función hepática residual y minimizando la pérdida de sangre intraoperatoria. De manera crucial, integramos múltiples enfoques quirúrgicos para facilitar una mejor exposición del lóbulo caudado hepático y sus estructuras vasculares críticas circundantes, lo que garantiza una visión anatómica más clara y mejora la seguridad quirúrgica general.
Debido a varios factores, como la resección difícil para la resección combinada de segmentos hepáticos o incluso la resección semihepática, la infiltración vascular tumoral y la necesidad de disección de ganglios linfáticos, la adopción del tratamiento laparoscópico para la ICC, en comparación con el carcinoma hepatocelular, se ha retrasado relativamente. No obstante, la resección laparoscópica para la CCI ha mostrado resultados superiores a corto plazo y resultados comparables a largo plazo cuando se contrasta con el abordaje laparotómico18. Esto se debe a que la laparoscopia puede proporcionar una variedad de enfoques quirúrgicos, lo que permite una mejor exposición y control de los vasos vitales. Además, es fácil distinguir la metástasis de implantación abdominal durante la exploración laparoscópica, lo que hace que la estadificación del tumor sea más precisa. Además, las lesiones hepáticas ocultas también pueden ser identificadas durante la cirugía laparoscópica mediante tinción fluorescente o ultrasonido intraoperatorio19. Un metaanálisis reciente20 indicó que la resección laparoscópica del lóbulo caudado tenía múltiples ventajas sobre la cirugía abierta, especialmente la pérdida de sangre intraoperatoria, y las estancias hospitalarias. Dos estudios 21,22 sobre el tratamiento de la CCI sugirieron que la resección laparoscópica del lóbulo caudado es un procedimiento factible y seguro. Sin embargo, se necesitan más estudios para establecer los beneficios reales de la laparoscopia porque la hemihepatectomía laparoscópica izquierda combinada con la cirugía radical del lóbulo caudado para el tratamiento del lóbulo caudado sigue siendo relativamente rara.
Determinar el margen derecho del lóbulo caudado es extremadamente difícil. El abordaje tradicional consiste en utilizar el pedículo de Glisson posterior derecho como plano ventral derecho del lóbulo caudado y utilizar la VCI como punto de referencia para seccionar el parénquima hepático entre las venas hepáticas media y derecha con el fin de determinar el límite derecho para la resección simple del lóbulo caudado. Sin embargo, es importante tener en cuenta que las decisiones quirúrgicas no deben basarse únicamente en este plano conceptual. Kogure et al.23 enfatizaron que las venas hepáticas están delineadas por el hígado derecho y el proceso caudado. Kumon et al.24 sugirieron que las venas hepáticas cortas en la porción paravaval sirven como límites, pero pueden ser difíciles de operar intraoperatoriamente. Ho et al.25 establecieron un límite entre la apófisis caudada y el lóbulo posterior mediante oclusión del pedículo hepático inferior derecho. La mayoría de los estudiosos26 piensan que el plano paraventral derecho se emplea típicamente para definir el margen derecho del lóbulo caudado, lo que se alinea con el enfoque quirúrgico descrito aquí.
Existe controversia sobre si la disección de los ganglios linfáticos es necesaria durante la cirugía radical para los pacientes con colangiocarcinoma. A pesar de que los ganglios linfáticos metastásicos se asocian con un valor pronóstico negativo, la linfadenectomía extensa no se realiza de forma rutinaria en los casos en que los ganglios linfáticos parecen macroscópicamente no sospechosos8. Ratti F et al.27 realizaron un estudio que demostró que no existe diferencia significativa en la efectividad de la disección laparoscópica de ganglios linfáticos en comparación con la cirugía abierta, y la diferencia en la eficacia a largo plazo entre ambas tampoco es estadísticamente significativa. La disección laparoscópica de los ganglios linfáticos no conduce a una mayor o incluso menor incidencia de complicaciones, y no hay diferencias significativas en el número de disecciones de ganglios linfáticos en comparación con la cirugía abierta.
Para los pacientes con CCI del lóbulo caudado resecable, la resección laparoscópica del lóbulo caudado, o incluso la resección combinada de otros segmentos hepáticos, que es segura y factible, representa una valiosa oportunidad de tratamiento. Sin embargo, se necesita más investigación para aclarar la eficacia a largo plazo de la cirugía, determinar el margen apropiado para la resección del lóbulo caudado y evaluar si es necesaria la disección de los ganglios linfáticos.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos a los anestesiólogos y enfermeras de quirófano que ayudaron con la operación.
Materiales
| Name | Company | Catalog Number | Comments |
| Bipolar radiofrequency excision hemostatic device | ERBE | 20195-136 | |
| Disposable trocar | Kangji Medical | 101Y.611 | |
| Endoscopic linear cutter reloads | Ethicon, LLC | ECR60W | |
| Laparoscopic system | STORZ | 26003BA | |
| Laparoscopic system | STORZ | TC200 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544240 | |
| Pneumoperitoneum needle | Kangji Medical | 101Y.611 | |
| Ultrasound knife | Johnson | GEN11 | |
| Video system | SONY | LMD-3252SC |
Referencias
- Rebecca, L., Angela, N. S., Ahmedin, G., , J. Cancer statistics, 2024. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Paramita, D., et al. Global trends in incidence rates of primary adult liver cancers: A systematic review and meta-analysis. Front Oncol. 10, 171 (2020).
- Dimitrios, M., et al. Advances in the treatment of intrahepatic cholangiocarcinoma: An overview of the current and future therapeutic landscape for clinicians. CA Cancer J Clin. 73 (2), 198-222 (2022).
- Nuzzo, G., Giuliante, F., Ardito, F., Giovannini, I. Intrahepatic cholangiocarcinoma. Ann Surg. 249 (3), 541-542 (2009).
- Jiang, J. H., Fang, D. Z., Hu, Y. T. Influence of surgical margin width on survival rate after resection of intrahepatic cholangiocarcinoma: A systematic review and meta-analysis. BMJ Open. 13 (5), e067222 (2023).
- Dai, Y. S., et al. The influence of resection margin width in patients with intrahepatic cholangiocarcinoma: A meta-analysis. World J Surg Oncol. 21 (1), 16 (2023).
- Zhu, H., et al. Prognostic value of resection margin length after surgical resection for intrahepatic cholangiocarcinoma. Am J Surg. 222 (2), 383-389 (2021).
- Lauterio, A., et al. Current surgical management of peri-hilar and intra-hepatic cholangiocarcinoma. Cancers (Basel). 13 (15), 3657 (2021).
- Jiang, N., et al. Patterns of caudate lobe invasion of hilar cholangiocarcinoma: A panoramic histologic study of liver. Ann Surg Oncol. 29 (11), 6804-6812 (2022).
- Si, A., et al. Impact of anatomical versus non-anatomical liver resection on short- and long-term outcomes for patients with intrahepatic cholangiocarcinoma. Ann Surg Oncol. 26 (6), 1841-1850 (2019).
- Wang, C., et al. Anatomical resection improved the outcome of intrahepatic cholangiocarcinoma: A propensity score matching analysis of a retrospective cohort. J Oncol. 2022, 4446243 (2022).
- Huang, J., Sun, D., Xu, D., Zhang, Y., Hu, M. A comprehensive study and extensive review of the caudate lobe: The last piece of "jigsaw" puzzle. Asian J Surg. 47 (1), 1-7 (2024).
- Parikh, M., Han, H. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Sci Rep. 11 (1), 4328 (2021).
- Guo, L., et al. An inferior vena cava-priority approach in laparoscopic isolated hepatic caudate lobectomy. Langenbecks Arch Surg. 409 (1), 106 (2024).
- Wang, Z., et al. Laparoscopic right hemi-hepatectomy plus total caudate lobectomy for perihilar cholangiocarcinoma via anterior approach with augmented reality navigation: A feasibility study. Surg Endosc. 37 (10), 8156-8164 (2023).
- Chun, Y. S., Pawlik, T. M., Vauthey, J. N. 8th edition of the AJCC cancer staging manual: Pancreas and hepatobiliary cancers. Ann Surg Oncol. 25 (4), 845-847 (2018).
- Wang, D., et al. The value of total caudate lobe resection for hilar cholangiocarcinoma: A systematic review. Int J Surg. 110 (1), 385-394 (2024).
- Ratti, F., et al. Intrahepatic cholangiocarcinoma as the new field of implementation of laparoscopic liver resection programs. A comparative propensity score-based analysis of open and laparoscopic liver resections. Surg Endosc. 35 (4), 1851-1862 (2021).
- Dorovinis, P., et al. Safety and efficacy of laparoscopic caudate lobectomy: A systematic review. J Clin Med. 10 (21), 4907 (2021).
- Ding, Z., et al. Safety and feasibility for laparoscopic versus open caudate lobe resection: A meta-analysis. Langenbecks Arch Surg. 406 (5), 1307-1316 (2021).
- Wan, H. F., et al. Laparoscopic caudate lobectomy for cholangiocarcinoma of caudate lobe invading middle hepatic vein. Ann Surg Oncol. 27 (11), 4181-4185 (2020).
- Hu, Y. F., Hu, H. J., Ma, W. J., Jin, Y. W., Li, F. Y. Laparoscopic versus open liver resection for intrahepatic cholangiocarcinoma: A systematic review of propensity score-matched studies. Updates Surg. 75 (8), 2049-2061 (2023).
- Kogure, K., et al. The caudate processus hepatic vein: A boundary hepatic vein between the caudate lobe and the right liver. Ann Surg. 247 (2), 288-293 (2008).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Ho, K. M., et al. Laparoscopic total caudate lobectomy for hepatocellular carcinoma. J Laparoendosc Adv Surg Tech A. 27 (10), 1074-1078 (2017).
- Shen, X. Y., et al. Can we delineate preoperatively the right and ventral margins of caudate lobe of the liver. Ann Surg Treat Res. 97 (3), 124-129 (2019).
- Ratti, F., et al. Perioperative and long-term outcomes of laparoscopic versus open lymphadenectomy for biliary tumors: A propensity-score-based, case-matched analysis. Ann Surg Oncol. 26 (2), 564-575 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados