Method Article
Laparoskopische linke Hemihepatektomie kombiniert mit Resektion des Kauzatlappens
In diesem Artikel
Zusammenfassung
Das intrahepatische Cholangiokarzinom des Schwanzlappens ist aufgrund seiner einzigartigen Lage eine Herausforderung für viele Chirurgen. Hier stellen wir ein Protokoll vor, das die laparoskopische linke Hemihepatektomie in Kombination mit einer Saudarmappenresektion beim Cholangiokarzinom Schritt für Schritt zeigt.
Zusammenfassung
Das intrahepatische Cholangiokarzinom (ICC) ist der häufigste bösartige Tumor der Leber. Die radikale chirurgische Resektion ist die Hauptstütze der potenziell kurativen Behandlung von ICC. Die anatomische Leberresektion bei ICC im Schwanzlappen ist eine der schwierigsten Leberresektionen. Weil der Tumor tief sitzt und leicht in die umliegenden Blutgefäße eindringt, wie z. B. den linken Leberstiel, den rechten Leberstiel und die mittlere Lebervene. Die laparoskopische anatomische Hepatektomie des Schwanzlappens sorgt nicht nur für einen negativen Inzisionsrand, sondern bietet auch einen minimalinvasiveren Zugang für den Patienten. Diese Technik ist im Begriff, in Zukunft die bevorzugte Wahl für radikale Operationen des Schwanzlappens zu werden. In diesem chirurgischen Protokoll wurde ein 65-jähriger Patient mit intrahepatischem Cholangiokarzinom (Größe ca. 3,2 × 1,9 cm2) im linken Schwanzlappen erfolgreich und ohne postoperative Komplikationen einer laparoskopischen linken Hemihepatektomie in Kombination mit einer Schwanzlappenresektion unterzogen. Die postoperative pathologische Untersuchung zeigte ein Cholangiokarzinom mit einem im Gefäßsystem sichtbaren Tumorthrombus. Der Patient wurde am 14. postoperativen Tag entlassen. Die laparoskopische linke Hemihepatektomie in Kombination mit einer Caudat-Lobektomie zur Behandlung der ICC des Caudatlappens kann sicher durchgeführt werden und trägt nicht wesentlich zur Morbidität oder Mortalität des Eingriffs bei.
Einleitung
Das intrahepatische Cholangiokarzinom geht von intrahepatischen Gallengangsepithelzellen aus und ist ein Cholangiokarzinom, das oberhalb des sekundären Gallengangs der Leber auftritt. Die Inzidenz des ICC ist nach dem hepatozellulären Karzinom (HCC) die zweithäufigste und macht 10 % bis 15 % des primären Leberkrebses und etwa 20 % des Gallengangskrebsesaus 1. Die Inzidenz von ICC hat weltweit von Jahr zu Jahr zugenommen und ist in den letzten 40 Jahren um 140 %gestiegen 2. Die chirurgische Resektion ist nach wie vor die Hauptstütze der potenziell kurativen Behandlung von ICC. Allerdings haben nur 20 bis 30 % der Patienten die Möglichkeit einer chirurgischen Resektion. Nach chirurgischer Resektion liegt die 5-Jahres-Gesamtüberlebensrate von ICC-Patienten bei nur 20 % bis 35 %3. Denn selbst bei einer radikalen Resektion können nur wenige Patienten negative Ränder erzielen4. Für frühe ICC-Patienten ist es besonders wichtig, eine kurative Operation zu erhalten. Die kurative Chirurgie bei ICC-Patienten steht in engem Zusammenhang mit den Operationsrändern. Zwei aktuelle Metaanalysen 5,6 zeigten, dass eine chirurgische Randbreite von >1 cm mit einem besseren Gesamtüberleben assoziiert ist. Eine Studie7 mit 126 Patienten zeigte, dass ein Rand von ≥1,0 cm mit einem besseren Gesamtüberleben (OS) und einem rezidivfreien Überleben (RFS) verbunden war.
In der ICC-Chirurgie kann mit der anatomischen Leberresektion, die für die Prognose von ICC-Patienten wichtig ist8, nicht nur ein sicherer chirurgischer Rand erzielt werden, sondern auch der verletzte Leberstiel exzidiert werden. Eine Studie9 berichtete, dass der häufigste Infiltrationsweg für das Cholangiokarzinom des Schwanzlappens durch fibröses Bindegewebe entlang des Glisson-Systems und nicht über den Gallengang führt. In einer früheren Studie überprüften Si et al.10 die Daten von 702 ICC-Patienten und stellten fest, dass die Häufigkeit von Komplikationen zwischen anatomischer Resektion und nicht-anatomischer Resektion ähnlich war und die anatomische Resektion mit einem besseren krankheitsfreien Überleben und Gesamtüberleben nach 1, 3 und 5 Jahren verbunden war. Eine weitere Propensity-Matching-Studie11 über ICC identifizierte die nichtanatomische Resektion als unabhängigen Risikofaktor für das OS (p < 0,05).
Die chirurgische Resektion des Caudatus ICC kann jedoch für den Chirurgen eine Herausforderung darstellen. Für Chirurgen ist es sehr schwierig, den Schwanzlappen zu untersuchen, da er eine einzigartige anatomische Lage aufweist, wie z. B. sein tiefes Eindringen in das Leberparenchym und seine Nähe zu den wichtigsten Gefäßen12 (der Vena cava inferior, der Vena breticum media oder right, der Pfortadern und dem Ligamentum venosum). Diese können es schwierig machen, während der Operation ein breites Sichtfeld zu erhalten und eine unsichtbare Schnittkante zu erhalten. In den letzten Jahren hat sich das chirurgische Management des ICC mit der detaillierten Untersuchung der Leberanatomie, der rasanten Entwicklung der laparoskopischen Technologie und der kontinuierlichen Förderung des Konzepts der präzisen Leberresektion von der isolierten Caudat-Lobektomie13,14 zur laparoskopischen Hemihepatektomie in Kombination mit der Caudat-Lobektomie15 entwickelt, über die in der Literatur nur selten berichtet wird. Es besteht ein großer Bedarf an Videos von erfolgreichen Operationen, um die breite Nutzung solcher Operationen in der Zukunft zu steuern. In dieser Arbeit wird eine laparoskopische linke Hemihepatektomie in Kombination mit einer Resektion des Caudatlappens zur Behandlung eines intrahepatischen Cholangiokarzinoms im Schwanzlappen vorgestellt.
Ein 65-jähriger Chinese wurde mit einer zufällig festgestellten Lebermasse im Bauchultraschall ins Krankenhaus eingeliefert. Die körperliche Untersuchung zeigte keine signifikanten Auffälligkeiten. Laboruntersuchungen, einschließlich routinemäßiger Blutuntersuchungen, Leberfunktionstests, Gerinnungs- und Tumorindikatoren (AFP, CEA, CA199), waren normal. Die erweiterte Computertomographie (CT) des Oberbauchs zeigte einen abnormalen Verstärkungsschatten von 3,2 bis 1,9 cm2 am Übergang S1/4/8 und zeigte, dass die mittlere Lebervene (MHV) und die linke Lebervene (LHV) einen gemeinsamen Rumpf hatten (Abbildung 1A). Eine verbesserte Magnetresonanztomographie (MRT) des Oberbauchs zeigte ebenfalls einen 2,5 bis 2,0 cm2 großen Knoten im gleichen Bereich, der jedoch auf eine ICC hindeutet (Abbildung 1B). Nach Abschluss der präoperativen Abklärung entschieden wir uns für eine laparoskopische linke Hemihepatektomie in Kombination mit einer Resektion des Schwanzlappens, um einen negativen chirurgischen Rand zu gewährleisten.
Protokoll
Dieses Protokoll folgt den Richtlinien der Ethikkommission für Humanforschung des Volkskrankenhauses Meizhou. Es wurde eine Einverständniserklärung der Patienten eingeholt, um Informationen und Daten im Zusammenhang mit dieser Behandlung freizugeben.
1. Präoperative Vorbereitung
- Verbieten Sie dem Patienten, vor der Operation 6 Stunden lang zu essen und zu trinken.
- Tragen Sie das Antibiotikum (1 g Ceftriaxon-Natrium) durch eine intravenöse Injektion aus dem Ellbogen auf, um eine Infektion zu verhindern, 30 Minuten vor dem Durchschneiden der Haut.
- Verwenden Sie eine tracheale Intubation unter Vollnarkose. Punktion und Katheterisierung der rechten Arteria radialis (Kathetergröße, 20 G) und der Vena jugularis interna (Kathetergröße, 8 Fr) unter Ultraschallkontrolle.
- Sterilisieren Sie die Haut mit einem Peeling auf 0,5 % Jodbasis und sterilen Handtüchern, um den Operationsbereich vollständig freizulegen. Desinfizieren Sie den Operationsbereich dreimal mit einem Jodophor.
2. Operationstechnik
- Einstellung der Bedienung
- Schneiden Sie die Haut etwa 10 mm in Längsrichtung unterhalb des Nabels ein und führen Sie dann eine Einwegnadel des Pneumoperitoneums durch den Schnitt ein. Injizieren Sie CO2 , nachdem die Pneumoperitoneumnadel mit dem Pneumoperitoneumgerät verbunden wurde, um das Pneumoperitoneum zu etablieren.
- Führen Sie dann einen 10 mm Eisentrokar in den Einschnitt ein. Wechseln Sie den Patienten von einer Rückenlage in eine Rückenlage mit gespreizten Beinen, um 30° angehobenem Kopf und gesenkten Füßen, nachdem keine Einstichschäden untersucht wurden.
HINWEIS: Der Pneumoperitoneumdruck wurde auf 12 mmHg eingestellt. - Platzieren Sie zwei 12-mm-Trokare an der rechten und linken Mittelklavikularlinie über den Nabelfingern (B und C), zwei 5-mm-Trokare an der rechten vorderen Achsellinie subkostal und die linke mittlere Clavicularlinie subkostal (D und E), siehe Abbildung 2.
- Führen Sie die Bauchexploration laparoskopisch durch. Auf Bauchverletzungen und Einstichblutungen prüfen; Überprüfen Sie, ob signifikante extrahepatische Metastasen vorhanden sind, um die Durchführbarkeit einer radikalen Operation zu bewerten.
- Erkundungsphase
- Befreien Sie die linke Leberhälfte und teilen Sie die runden und falziformen Bänder wieder auf Höhe der Schädelgrube der Lebervene. Teilen Sie das linke Dreiecksband und das linke Koronarband und erstrecken Sie sich, bis der laterale Rand der linken Lebervene identifiziert ist.
- Klemmen Sie das proximale runde Band der Leber ein.
- Legen Sie das hepatoduodenale Band beim Zugang zum Omentum minor frei und positionieren Sie routinemäßig ein Leberblutfluss-Okklusionsband. Verwenden Sie bei Bedarf die Pringle-Methode, um den Leberblutfluss intermittierend zu blockieren.
- Phase der Präparierung
- Präparieren Sie den linken Leberstiel mit dem extrathekalen Zugang.
- Nach dem Anheben des linken Seitenlappens legen Sie den Schwanzlappen frei, indem Sie ihn vollständig zum kleinen Omentum öffnen. Identifizieren, schlingen und präparieren Sie den linken Leberstiel mit einem nichttraumatischen Greifer und einer 10 mm rechtwinkligen Präparierzange.
- Einige Minuten später legen Sie mit einem Elektrokauter eine markierte Vorresektionslinie an, die auf der Ischämielinie der linken und rechten Leberhälfte basiert (Abbildung 3A, B).
- Verwenden Sie ein Ultraschallmesser, um das Lebergewebe zu schneiden, beginnend auf der oberen Leberoberfläche von vorne nach hinten, bis die Höhe des linken und rechten Leberstiels entlang der markierten Linie vollständig freigelegt ist (Abbildung 3C).
- Fixieren Sie das Rohr mit einem Durchmesser von >4 mm mit Klammern und dissoziieren Sie es mit einem Ultraschallmesser am distalen Ende.
- Nutzen Sie die Zeit, um die Leber zu aktivieren, und präparieren Sie den Raum zwischen dem Schwanzlappen und der Vena cava inferior (IVC) durch einen dorsalen Zugang. Wenn Sie auf die kurze Lebervene (VHS) stoßen, klemmen Sie sie mit einem Hem-o-Lok ein und trennen Sie sie dann am distalen Ende.
- Nachdem Sie IVC vollständig freigelegt haben, markieren Sie die rechte paracavale Ebene, die den imaginären rechten Rand des Schwanzlappens darstellt (Abbildung 3D).
- Nachdem Sie die Aufhängungsleitung des linken Leberstiels entfernt haben, trennen Sie den linken Leberstiel durch lineares Nachladen des Messers (Abbildung 4A).
- Suchen Sie entlang des gebrochenen Endes des linken Leberstiels nach dem Leberstiel des Schwanzlappens und präparieren Sie ihn, klemmen Sie dann sein proximales Ende mit zwei Hem-o-Loks ein und schneiden Sie sein distales Ende mit einem Ultraschallmesser durch den linken Zugang (Abbildung 4B).
- Ziehe das erste Leberportal nach rechts, um die rechte parakavale Ebene freizulegen. Entlang des rechten Randes des Schwanzlappens, wie markiert, das Leberparenchym unterhalb der Verbindung des linken und rechten Leberstiels abschneiden, bis der gemeinsame Rumpf von MHV und linker Lebervene (LHV) freigelegt wurde (Abbildung 4C).
- Wenn Sie auf die Vena caudatus treffen, klemmen Sie sie mit hem-o-lok ein und trennen Sie sie an ihrem distalen Ende.
- Schließen Sie anschließend die Durchtrennung des gemeinsamen Rumpfes von MHV und LHV ab, indem Sie lineare Cutler-Nachladungen verwenden, um die linke Leber und den Schwanzlappen vollständig zu trennen, wobei darauf zu achten ist, dass eine Traktionsverletzung der mittleren Lebervene und der Hohlvene vermieden wird.
- Nach gründlicher Blutstillung der Wunde legen Sie die Probe in einen Beutel und entfernen Sie sie durch einen 6 cm langen vertikalen Schnitt um den Nabel im Unterbauch. Legen Sie zwei Drainageschläuche auf den Leberabschnitt bzw. den hepatorenalen Recessus.
- Präparieren Sie den linken Leberstiel mit dem extrathekalen Zugang.
Ergebnisse
Das relevante Ergebnis dieser Operation ist in Tabelle 1 dargestellt. Der gesamte Schwanzlappen und die linke Leber des Patienten wurden in 200 Minuten mit einem Blutverlust von 50 ml und einem Flüssigkeitsersatz von etwa 1500 ml entfernt. Die intraoperative Urinausscheidung betrug 150 ml. Die Zeit für die Durchtrennung des Leberparenchyms, einschließlich der Präparation des Leberstiels und des Raums zwischen dem Schwanzlappen der Leber und der unteren Hohlvene, betrug 84 Minuten. Das Pringle-Manöver wurde dreimal durchgeführt (die Zeit des hepatischen hilaren Verschlusses betrug 10 min, 20 min bzw. 15 min). Die gesamte Erholungsphase nach der Operation verlief reibungslos, ohne Anzeichen von postoperativem Gallenaustritt und Blutungen. Am 6. und 10. Tag nach der Operation wurden zwei Drainagen entfernt. Der Patient wurde am 14. postoperativen Tag entlassen.
Die pathologische Analyse ergab ein Cholangiokarzinom (pT1N0M0, Stadium I, AJCC 8. Auflage)16 mit einem im Gefäßsystem sichtbaren Tumorthrombus. MVI-Klasse: M2 (Hochrisikogruppe). Der chirurgische Rand der Leber war negativ. Die Immunhistochemie zeigte Positivität CK7, CK19, EMA, CK8, MSH6, MSH2, PMS2, MLH1, Ki67 (40%). Laut der AJCC 8. Auflage16 kehrte die Patientin 1 Monat nach der Operation ins Krankenhaus zurück, um aufgrund des MVI-Grades eine regelmäßige Chemotherapie zu erhalten.
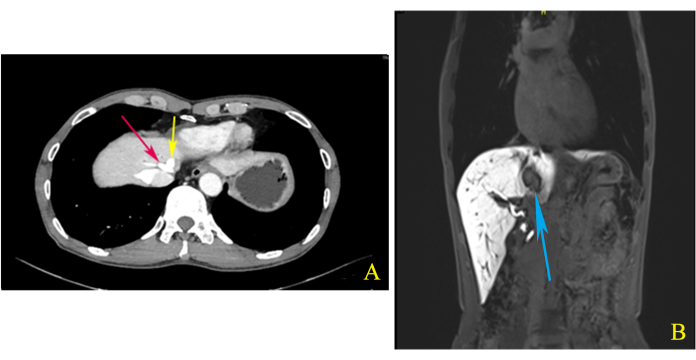
Abbildung 1: Computertomographie (CT) und Magnetresonanztomographie (MRT). (A) Die mittlere Lebervene (MHV) und die linke Lebervene (LHV) teilten sich einen gemeinsamen Rumpf (rote und gelbe Pfeile), wie die erweiterte Computertomographie (CT) des Oberbauchs während der Verzögerungsphase zeigt. (B) Die koronale Bildgebung der erweiterten Magnetresonanztomographie (MRT) des Oberbauchs zeigte, dass der Tumor im S1/4/8-Übergang eng mit dem MHV verwandt ist (blauer Pfeil). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Schnitt aus der Probenentnahme und Platzierung des Trokars. (A) Das Beobachtungsloch. (B) Der Trokar der rechten Mittelklavikularlinie war das Hauptoperationsloch für den Operateur. (C) Der Trokar der linken Mittelklavikularlinie war das Hilfsoperationsloch für die Assistentin. (D) Der Trokar der subkostalen rechten anterioren Achsellinie war das Hilfsoperationsloch für den Operateur. (E) Der Trokar der linken Mittelklavikularlinie subkostal war das Hauptoperationsloch für den Assistenten und (rote Linie) der vertikale Schnitt zur Entnahme der Probe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
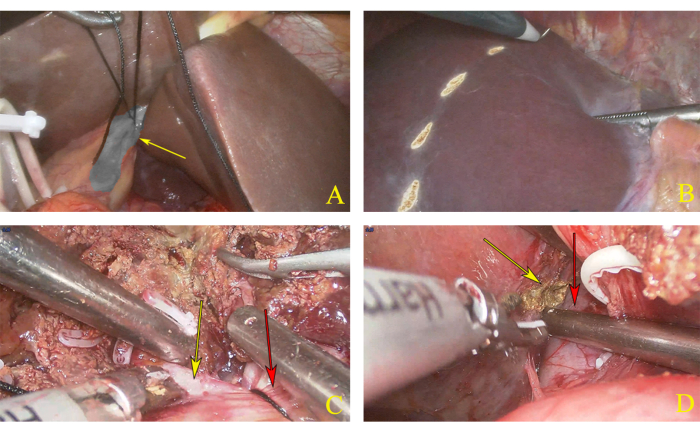
Abbildung 3: Dissektion der linken Hemihepatektomie. (A) Ligatur des linken Leberstiels. Der gelbe Pfeil zeigt den linken Leberstiel. (B) Vorresektionslinie, die entsprechend der ischämischen Linie markiert ist. (C) Die Durchtrennebene. Der gelbe Pfeil zeigt den rechten Leberstiel und der rote Pfeil den linken Leberstiel. (D) Der gelbe Pfeil zeigt den rechten Rand des Schwanzlappens und der rote Pfeil die untere Hohlvene (IVC). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
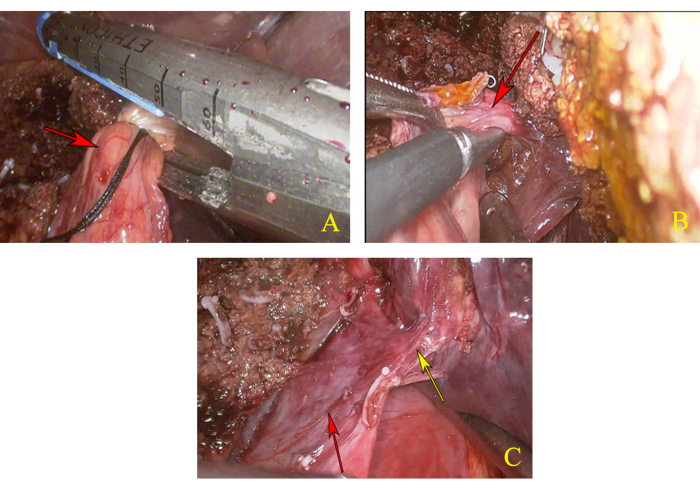
Abbildung 4: Dissektion des Schwanzlappens. (A) Trennen Sie den linken Leberstiel. Der rote Pfeil zeigt den linken Leberstiel an. (B) Anatomie und Dissektion des Leberstiels des Schwanzlappens. Der rote Pfeil zeigt den Leberstiel des Schwanzlappens. (C) Vollständige Freilegung des Truncus communis der mittleren Lebervene (MHV) und der linken Lebervene (LHV). Der gelbe Pfeil zeigt den gemeinsamen Stamm von MHV und LHV an, und der rote Pfeil zeigt IVC an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Variable | Ergebnis | |
| Intraoperativ | Betriebszeit (min) | 200 |
| Intraoperativer Blutverlust (ml) | 50 | |
| Bluttransfusion (ml) | 0 | |
| Flüssigkeitsersatz (mL) | 1500 | |
| Harnausscheidung (ml) | 150 | |
| Der Zeitpunkt des hepatischen hilaren Verschlusses (min) | 10, 20, 15 | |
| Postoperativ | Entladezeit (Tage) | 14 |
| Postoperative Komplikationen | Nichts | |
| Pathologisch | Diagnose | Intrahepatisches Cholangiokarzinom |
| Positive Marker | CK7, CK19, EMA, CK8, MSH6, MSH2, PMS2, MLH1, Ki67(40%) | |
| Negative Marker | CEA, Hep, Arginase-1, HER-2 | |
| MVI-Klasse | M2 | |
Tabelle 1: Chirurgische Ergebnisse und postoperative Details des Patienten.
Diskussion
Der Schwanzlappen ICC dringt häufig in die umgebenden Lebersegmente oder den angrenzenden Leberstiel ein, welches Behandlungsprinzip dem eines hilären Cholangiokarzinomsähnelt 17, und aufgrund seiner anatomischen Lage und biologischen Eigenschaften ist der Schwanzlappen ICC anfällig für Schäden an den umgebenden Strukturen während der Operation, was zu massiven Blutungen und postoperativem Gallenaustritt führt. Die laparoskopische Lobektomie des Pumas ist also eine der schwierigsten Leberresektionen, die viel Geschicklichkeit und Erfahrung erfordert. Wir berichteten über einen erfolgreichen Fall einer laparoskopischen linken Hemihepatektomie in Kombination mit einer Caudat-Lobektomie zur Behandlung der Caudatallappen-ICC. Der Patient wurde ohne postoperative Komplikationen entlassen. Wir haben die Sicherheit und Machbarkeit des chirurgischen Eingriffs erhöht, indem wir bestimmte Techniken während der Operation verfeinert haben. Eine umfassende präoperative Abklärung und eine sorgfältige Operationsplanung sind von größter Bedeutung. Wir verwendeten einen kontinuierlichen hemihepischen Verschluss in Verbindung mit einem intermittierenden Pringle-Manöver, das die Resektionsebene durch ischämische Demarkation abgrenzt, wodurch der Erhalt der Restleberfunktion optimiert und der intraoperative Blutverlust minimiert wird. Entscheidend ist, dass wir mehrere chirurgische Ansätze integriert haben, um eine bessere Freilegung des hepatischen Schwanzlappens und seiner umgebenden kritischen Gefäßstrukturen zu ermöglichen, eine klarere anatomische Sicht zu gewährleisten und die allgemeine chirurgische Sicherheit zu erhöhen.
Aufgrund mehrerer Faktoren wie der schwierigen Resektion bei der kombinierten Lebersegmentresektion oder sogar der Halbleberresektion, der Gefäßinfiltration des Tumors und der Notwendigkeit einer Lymphknotendissektion hat sich die Einführung der laparoskopischen Behandlung des ICC im Vergleich zum hepatozellulären Karzinom relativ verzögert. Nichtsdestotrotz hat die laparoskopische Resektion bei ICC im Gegensatz zum laparotomischen Ansatz überlegene kurzfristige Ergebnisse und vergleichbare Langzeitergebnisse gezeigt18. Dies liegt daran, dass die Laparoskopie eine Vielzahl von chirurgischen Ansätzen bieten kann, die eine bessere Freilegung und Kontrolle lebenswichtiger Gefäße ermöglichen. Darüber hinaus ist es einfach, die Metastasierung der abdominalen Implantation während der laparoskopischen Exploration zu unterscheiden, was das Tumorstaging genauer macht. Darüber hinaus können versteckte Leberläsionen auch während der laparoskopischen Operation durch Fluoreszenzfärbung oder intraoperativen Ultraschall identifiziert werden19. Eine kürzlich durchgeführte Metaanalyse20 zeigte, dass die laparoskopische Resektion des Schwanzlappens mehrere Vorteile gegenüber der offenen Operation hatte, insbesondere bei intraoperativem Blutverlust und Krankenhausaufenthalten. Zwei Studien 21,22 über die Behandlung von ICC deuten darauf hin, dass die laparoskopische Resektion des Schwanzlappens ein praktikables und sicheres Verfahren ist. Es sind jedoch weitere Studien erforderlich, um den tatsächlichen Nutzen der Laparoskopie zu ermitteln, da die laparoskopische linke Hemihepatektomie in Kombination mit einer radikalen Operation des Caudatlappens zur Behandlung der ICC des Caudatlappens noch relativ selten ist.
Die Bestimmung des rechten Randes des Schwanzlappens ist eine große Herausforderung. Der traditionelle Ansatz besteht darin, den rechten hinteren Glisson-Stiel als rechte ventrale Ebene des Schwanzlappens zu verwenden und die IVC als Referenzpunkt für die Durchtrennung des Leberparenchyms zwischen der mittleren und der rechten Lebervene zu verwenden, um die rechte Grenze für eine einfache Resektion des Schwanzlappens zu bestimmen. Es ist jedoch wichtig zu beachten, dass chirurgische Entscheidungen nicht ausschließlich auf dieser konzeptionellen Ebene beruhen sollten. Kogure et al.23 betonten, dass Lebervenen durch den rechten Leber- und Schwanzfortsatz abgegrenzt werden. Kumon et al.24 schlugen vor, dass die kurzen Lebervenen im paravavalen Teil als Grenzen dienen, die jedoch intraoperativ schwierig zu operieren sein können. Ho et al.25 etablierten eine Grenze zwischen dem Processus caudatus und dem hinteren Lappen durch Okklusion des rechten unteren Leberstiels. Die meisten Wissenschaftler26 sind der Meinung, dass die rechte paraventrale Ebene typischerweise verwendet wird, um den rechten Rand des Schwanzlappens zu definieren, was mit dem hier beschriebenen chirurgischen Ansatz übereinstimmt.
Es gibt Kontroversen darüber, ob eine Lymphknotendissektion während einer radikalen Operation bei Patienten mit Cholangiokarzinom notwendig ist. Obwohl metastasierte Lymphknoten mit einem negativen prognostischen Wert assoziiert sind, wird in Fällen, in denen die Lymphknoten makroskopisch nicht verdächtig erscheinen, keine extensive Lymphadenektomie routinemäßig durchgeführt8. Ratti F et al.27 führten eine Studie durch, die zeigte, dass es keinen signifikanten Unterschied in der Wirksamkeit der laparoskopischen Lymphknotendissektion im Vergleich zur offenen Operation gibt, und der Unterschied in der Langzeitwirksamkeit zwischen den beiden ist auch statistisch nicht signifikant. Die laparoskopische Lymphknotendissektion führt nicht zu einer erhöhten oder gar geringeren Inzidenz von Komplikationen, und es gibt keinen signifikanten Unterschied in der Anzahl der Lymphknotendissektionen im Vergleich zur offenen Operation.
Für Patienten mit resezierbarer ICC des Schwanzlappens stellt die laparoskopische Resektion des Schwanzlappens oder sogar die kombinierte Resektion anderer Lebersegmente, die sicher und durchführbar ist, eine wertvolle Behandlungsmöglichkeit dar. Es sind jedoch weitere Untersuchungen erforderlich, um die langfristige Wirksamkeit der Operation zu klären, den geeigneten Spielraum für die Resektion des Schwanzlappens zu bestimmen und zu beurteilen, ob eine Lymphknotendissektion erforderlich ist.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir danken den Anästhesisten und OP-Schwestern, die bei der Operation assistiert haben.
Materialien
| Name | Company | Catalog Number | Comments |
| Bipolar radiofrequency excision hemostatic device | ERBE | 20195-136 | |
| Disposable trocar | Kangji Medical | 101Y.611 | |
| Endoscopic linear cutter reloads | Ethicon, LLC | ECR60W | |
| Laparoscopic system | STORZ | 26003BA | |
| Laparoscopic system | STORZ | TC200 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544240 | |
| Pneumoperitoneum needle | Kangji Medical | 101Y.611 | |
| Ultrasound knife | Johnson | GEN11 | |
| Video system | SONY | LMD-3252SC |
Referenzen
- Rebecca, L., Angela, N. S., Ahmedin, G., , J. Cancer statistics, 2024. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Paramita, D., et al. Global trends in incidence rates of primary adult liver cancers: A systematic review and meta-analysis. Front Oncol. 10, 171 (2020).
- Dimitrios, M., et al. Advances in the treatment of intrahepatic cholangiocarcinoma: An overview of the current and future therapeutic landscape for clinicians. CA Cancer J Clin. 73 (2), 198-222 (2022).
- Nuzzo, G., Giuliante, F., Ardito, F., Giovannini, I. Intrahepatic cholangiocarcinoma. Ann Surg. 249 (3), 541-542 (2009).
- Jiang, J. H., Fang, D. Z., Hu, Y. T. Influence of surgical margin width on survival rate after resection of intrahepatic cholangiocarcinoma: A systematic review and meta-analysis. BMJ Open. 13 (5), e067222 (2023).
- Dai, Y. S., et al. The influence of resection margin width in patients with intrahepatic cholangiocarcinoma: A meta-analysis. World J Surg Oncol. 21 (1), 16 (2023).
- Zhu, H., et al. Prognostic value of resection margin length after surgical resection for intrahepatic cholangiocarcinoma. Am J Surg. 222 (2), 383-389 (2021).
- Lauterio, A., et al. Current surgical management of peri-hilar and intra-hepatic cholangiocarcinoma. Cancers (Basel). 13 (15), 3657 (2021).
- Jiang, N., et al. Patterns of caudate lobe invasion of hilar cholangiocarcinoma: A panoramic histologic study of liver. Ann Surg Oncol. 29 (11), 6804-6812 (2022).
- Si, A., et al. Impact of anatomical versus non-anatomical liver resection on short- and long-term outcomes for patients with intrahepatic cholangiocarcinoma. Ann Surg Oncol. 26 (6), 1841-1850 (2019).
- Wang, C., et al. Anatomical resection improved the outcome of intrahepatic cholangiocarcinoma: A propensity score matching analysis of a retrospective cohort. J Oncol. 2022, 4446243 (2022).
- Huang, J., Sun, D., Xu, D., Zhang, Y., Hu, M. A comprehensive study and extensive review of the caudate lobe: The last piece of "jigsaw" puzzle. Asian J Surg. 47 (1), 1-7 (2024).
- Parikh, M., Han, H. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Sci Rep. 11 (1), 4328 (2021).
- Guo, L., et al. An inferior vena cava-priority approach in laparoscopic isolated hepatic caudate lobectomy. Langenbecks Arch Surg. 409 (1), 106 (2024).
- Wang, Z., et al. Laparoscopic right hemi-hepatectomy plus total caudate lobectomy for perihilar cholangiocarcinoma via anterior approach with augmented reality navigation: A feasibility study. Surg Endosc. 37 (10), 8156-8164 (2023).
- Chun, Y. S., Pawlik, T. M., Vauthey, J. N. 8th edition of the AJCC cancer staging manual: Pancreas and hepatobiliary cancers. Ann Surg Oncol. 25 (4), 845-847 (2018).
- Wang, D., et al. The value of total caudate lobe resection for hilar cholangiocarcinoma: A systematic review. Int J Surg. 110 (1), 385-394 (2024).
- Ratti, F., et al. Intrahepatic cholangiocarcinoma as the new field of implementation of laparoscopic liver resection programs. A comparative propensity score-based analysis of open and laparoscopic liver resections. Surg Endosc. 35 (4), 1851-1862 (2021).
- Dorovinis, P., et al. Safety and efficacy of laparoscopic caudate lobectomy: A systematic review. J Clin Med. 10 (21), 4907 (2021).
- Ding, Z., et al. Safety and feasibility for laparoscopic versus open caudate lobe resection: A meta-analysis. Langenbecks Arch Surg. 406 (5), 1307-1316 (2021).
- Wan, H. F., et al. Laparoscopic caudate lobectomy for cholangiocarcinoma of caudate lobe invading middle hepatic vein. Ann Surg Oncol. 27 (11), 4181-4185 (2020).
- Hu, Y. F., Hu, H. J., Ma, W. J., Jin, Y. W., Li, F. Y. Laparoscopic versus open liver resection for intrahepatic cholangiocarcinoma: A systematic review of propensity score-matched studies. Updates Surg. 75 (8), 2049-2061 (2023).
- Kogure, K., et al. The caudate processus hepatic vein: A boundary hepatic vein between the caudate lobe and the right liver. Ann Surg. 247 (2), 288-293 (2008).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Ho, K. M., et al. Laparoscopic total caudate lobectomy for hepatocellular carcinoma. J Laparoendosc Adv Surg Tech A. 27 (10), 1074-1078 (2017).
- Shen, X. Y., et al. Can we delineate preoperatively the right and ventral margins of caudate lobe of the liver. Ann Surg Treat Res. 97 (3), 124-129 (2019).
- Ratti, F., et al. Perioperative and long-term outcomes of laparoscopic versus open lymphadenectomy for biliary tumors: A propensity-score-based, case-matched analysis. Ann Surg Oncol. 26 (2), 564-575 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten