Method Article
Modellazione computazionale di neuroni retinici per la ricerca di protesi visive - Approcci fondamentali
In questo articolo
Riepilogo
Riassumiamo un flusso di lavoro per modellare computazionalmente i comportamenti di un neurone retinico in risposta alla stimolazione elettrica. Il modello computazionale è versatile e include fasi di automazione utili per simulare una serie di scenari fisiologici e anticipare i risultati di futuri studi in vivo / in vitro .
Abstract
La modellazione computazionale è diventata un metodo sempre più importante nell'ingegneria neurale grazie alla sua capacità di prevedere i comportamenti dei sistemi in vivo e in vitro . Ciò ha il vantaggio chiave di ridurre al minimo il numero di animali richiesti in un determinato studio fornendo una previsione spesso molto precisa dei risultati fisiologici. Nel campo della protesi visiva, la modellazione computazionale ha una serie di applicazioni pratiche, tra cui informare la progettazione di un array di elettrodi impiantabili e la previsione delle percezioni visive che possono essere suscitate attraverso la consegna di impulsi elettrici da detto array. Alcuni modelli descritti in letteratura combinano una morfologia tridimensionale (3D) per calcolare il campo elettrico e un modello a cavo del neurone o della rete neurale di interesse. Per aumentare l'accessibilità di questo metodo in due fasi ai ricercatori che potrebbero avere una limitata esperienza precedente nella modellazione computazionale, forniamo un video degli approcci fondamentali da adottare per costruire un modello computazionale e utilizzarlo nella previsione dei risultati fisiologici e psicofisici dei protocolli di stimolazione implementati tramite una protesi visiva. La guida comprende i passaggi per costruire un modello 3D in un software di modellazione ad elementi finiti (FEM), la costruzione di un modello di cellule gangliari retiniche in un software computazionale neuronale multicompartimentale, seguito dalla fusione dei due. Un software di modellazione ad elementi finiti per risolvere numericamente equazioni fisiche verrebbe utilizzato per risolvere la distribuzione del campo elettrico nelle stimolazioni elettriche dei tessuti. Quindi, è stato utilizzato un software specializzato per simulare le attività elettriche di una cellula neurale o di una rete. Per seguire questo tutorial, sarebbe necessaria familiarità con il principio di funzionamento di una neuroprotesi, così come i concetti neurofisiologici (ad esempio, il meccanismo del potenziale d'azione e la comprensione del modello di Hodgkin-Huxley).
Introduzione
Le neuroprotesi visive sono un gruppo di dispositivi che forniscono stimolazioni (elettriche, luminose, ecc.) alle cellule neurali nel percorso visivo per creare fosfeni o sensazione di vedere la luce. È una strategia di trattamento che è stata in uso clinico per quasi un decennio per le persone con cecità permanente causata da malattie degenerative della retina. In genere, un sistema completo includerebbe una telecamera esterna che cattura le informazioni visive intorno all'utente, un alimentatore e un'unità di calcolo per elaborare e tradurre l'immagine in una serie di impulsi elettrici e un array di elettrodi impiantati che interfaccia il tessuto neurale e fornisce gli impulsi elettrici alle cellule neurali. Il principio di funzionamento consente di posizionare una neuroprotesi visiva in diversi siti lungo il percorso visivo dalla retina alla corteccia visiva, purché sia a valle del tessuto danneggiato. La maggior parte della ricerca attuale in neuroprotesi visive si concentra sull'aumento dell'efficacia della stimolazione e sul miglioramento dell'acuità spaziale per fornire una visione più naturale.
Negli sforzi per migliorare l'efficacia della stimolazione, la modellazione computazionale è stata un metodo economico e tempestivo per convalidare un progetto di protesi e simularne il risultato visivo. La modellazione computazionale in questo campo ha guadagnato popolarità dal 1999 quando Greenberg1 ha modellato la risposta di una cellula gangliare retinica agli stimoli elettrici extracellulari. Da allora, la modellazione computazionale è stata utilizzata per ottimizzare i parametri dell'impulso elettrico2,3 o il design geometrico dell'elettrodo 4,5. Nonostante la variazione della complessità e delle domande di ricerca, questi modelli funzionano determinando la distribuzione della tensione elettrica nel mezzo (ad esempio, il tessuto neurale) e stimando la risposta elettrica che i neuroni nelle vicinanze produrranno a causa della tensione elettrica.
La distribuzione della tensione elettrica in un conduttore può essere trovata risolvendo le equazioni di Poisson6 in tutte le posizioni:
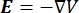
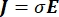
dove E è il campo elettrico, V il potenziale elettrico, J la densità di corrente e σ è la conduttività elettrica. L'equazione  indica un operatore gradiente. Nel caso di corrente stazionaria, al modello sono imposte le seguenti condizioni al contorno:
indica un operatore gradiente. Nel caso di corrente stazionaria, al modello sono imposte le seguenti condizioni al contorno:


dove n è la normale alla superficie, Ω rappresenta il limite e I0 rappresenta la corrente specifica. Insieme, creano isolamento elettrico ai confini esterni e creano una sorgente di corrente per un limite selezionato. Se assumiamo una sorgente puntiforme monopolare in un mezzo omogeneo con una conduttività isotropa, il potenziale elettrico extracellulare in una posizione arbitraria può essere calcolato da7:

dove I e è la corrente e è la distanza tra l'elettrodo e il punto di misura. Quando il mezzo è disomogeneo o anisotropo, o l'array di elettrodi ha più elettrodi, una suite computazionale per risolvere numericamente le equazioni può essere conveniente. Un software di modellazione agli elementi finiti6 suddivide il conduttore di volume in piccole sezioni note come "elementi". Gli elementi sono interconnessi tra loro in modo tale che gli effetti del cambiamento in un elemento influenzano il cambiamento in altri, e risolve le equazioni fisiche che servono a descrivere questi elementi. Con la crescente velocità di calcolo dei computer moderni, questo processo può essere completato in pochi secondi. Una volta calcolato il potenziale elettrico, si può quindi stimare la risposta elettrica del neurone.
Un neurone invia e riceve informazioni sotto forma di segnali elettrici. Tali segnali si presentano in due forme: potenziali graduati e potenziali d'azione. I potenziali graduati sono cambiamenti temporanei del potenziale di membrana in cui la tensione attraverso la membrana diventa più positiva (depolarizzazione) o negativa (iperpolarizzazione). I potenziali graduati hanno tipicamente effetti localizzati. Nelle cellule che li producono, i potenziali d'azione sono risposte "tutto o niente" che possono percorrere lunghe distanze lungo la lunghezza di un assone. Sia i potenziali graduati che quelli d'azione sono sensibili all'ambiente elettrico e chimico. Un picco di potenziale d'azione può essere prodotto da vari tipi di cellule neuronali, comprese le cellule gangliari retiniche, quando viene attraversato un potenziale transmembrana di soglia. Il potenziale d'azione e la propagazione innescano quindi la trasmissione sinaptica dei segnali ai neuroni a valle. Un neurone può essere modellato come un cavo diviso in segmenti cilindrici, dove ogni segmento ha capacità e resistenza a causa della membrana lipidica a doppio strato8. Un programma computazionale neuronale9 può stimare l'attività elettrica di una cellula elettricamente eccitabile discretizzando la cellula in più compartimenti e risolvendo il modello matematico10:
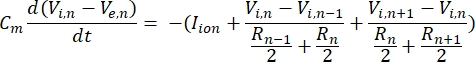
In questa equazione, Cmè la capacità della membrana, V e,n è il potenziale extracellulare al nodo n, V i,n il potenziale intracellulare al nodo n, R n la resistenza intracellulare (longitudinale) al nodo n e loione I è la corrente ionica che attraversa i canali ionici al nodo n. I valori di V dal modello FEM sono implementati come Ve,n per tutti i nodi del neurone quando la stimolazione è attiva.
Le correnti transmembrana dai canali ionici possono essere modellate usando le formulazioni di Hodgkin-Huxley11:
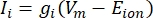
dove g i è la conduttanza specifica del canale, V m il potenziale transmembrana (V i,n - Ve,n) e lo ione E il potenziale di inversione del canale ionico. Per i canali voltaggio-dipendenti, come il canale Na, vengono introdotti parametri adimensionali, m e h, che descrivono la probabilità di apertura o chiusura dei canali:
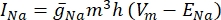
dove  è la massima conduttanza di membrana per il particolare canale ionico, e i valori dei parametri m e h sono definiti da equazioni differenziali:
è la massima conduttanza di membrana per il particolare canale ionico, e i valori dei parametri m e h sono definiti da equazioni differenziali:

dove α x e βx sono funzioni dipendenti dalla tensione che definiscono le costanti di velocità del canale ionico. Generalmente assumono la forma:

I valori dei parametri in queste equazioni, inclusa la conduttanza massima, così come le costanti A, B, C e D, sono stati tipicamente trovati da misurazioni empiriche.
Con questi elementi costitutivi, è possibile creare modelli di diversa complessità seguendo i passaggi descritti. Un software FEM è utile quando l'equazione di Poisson non può essere risolta analiticamente, come nel caso di conduttanza disomogenea o anisotropa nel conduttore di volume o quando la geometria dell'array di elettrodi è complessa. Dopo che i valori di potenziale extracellulare sono stati risolti, il modello del cavo neuronale può essere risolto numericamente nel software computazionale del neurone. La combinazione dei due software consente il calcolo di una cellula o rete di neuroni complessi in un campo elettrico non uniforme.
Un semplice modello in due fasi di una cellula gangliare retinica sotto una stimolazione sopracoroideale sarà costruito utilizzando i programmi di cui sopra. In questo studio, la cellula gangliare retinica sarà sottoposta a una gamma di grandezze di impulsi di corrente elettrica. Anche la posizione della cellula rispetto allo stimolo viene variata per mostrare la relazione distanza-soglia. Inoltre, lo studio include una convalida del risultato computazionale rispetto a uno studio in vivo della soglia di attivazione corticale utilizzando diverse dimensioni dell'elettrodo di stimolazione12, nonché uno studio in vitro che mostra la relazione tra la distanza elettrodo-neurone e la soglia di attivazione13.
Protocollo
1. Impostazione del modello agli elementi finiti per il calcolo del potenziale elettrico
- Determinare le fasi di simulazione e la complessità del modello
NOTA: Lo scopo del primo passo è chiarire lo scopo della modellazione, che determinerà gli elementi necessari del modello e della procedura di simulazione. Un punto importante da considerare è il comportamento delle cellule neurali che deve essere mostrato dal modello e quale protocollo di test sarebbe necessario per dimostrare tale comportamento. Questo studio mostra una relazione distanza-soglia per un neurone che viene stimolato extracellulare, così come la curva dimensione-soglia dell'elettrodo. Per fare ciò, è necessario un modello di cellula neurale compartimentata in diverse sezioni (per incorporare la variazione dei parametri morfologici e biofisici nel neurone) sensibile alla tensione extracellulare e la simulazione di una gamma di dimensioni e posizioni degli elettrodi.- Definire la domanda di ricerca e le variabili sperimentali.
- Definire una domanda di ricerca e un protocollo di test per guidare la costruzione del modello. È meglio iniziare con una domanda chiara e costruire un modello il più semplice possibile per rispondere.
- Determinare gli elementi necessari da includere nel modello completo
NOTA: In questo approccio di modellazione, la cellula è vista come immersa in un mezzo elettricamente conduttivo, cioè il tessuto biologico. La stimolazione elettrica avviene attraverso questo "conduttore di volume", cioè il mezzo, con conseguente distribuzione del potenziale elettrico.- Sulla base delle domande di ricerca e delle variabili da risolvere, decidere se sono necessari entrambi gli elementi (FEM e modello di cavo neuronale). Se, ad esempio, la modellazione ha bisogno di un singolo elettrodo che può essere semplificato come sorgente puntiforme e che il mezzo è omogeneo, un FEM potrebbe non essere necessario e un calcolo analitico del campo elettrico extracellulare può essere fatto per sostituirlo.
- Definire la domanda di ricerca e le variabili sperimentali.
- Scarica e installa il software
NOTA: lo studio ha utilizzato le versioni delle applicazioni software (COMSOL, NEURON, e Python Anaconda) e l'hardware specificato nella tabella dei materiali. Potrebbero esserci piccole differenze nei passaggi o nei risultati se vengono utilizzate versioni diverse del software/hardware.- Scarica il software adatto al sistema operativo del computer e acquista una licenza, se necessario. Assicurarsi che tutti i moduli di simulazione richiesti siano scaricati e installare tutto il software.
- Raccogliere i dati sull'anatomia del tessuto e della cellula da modellare
NOTA: Per questo metodo, i parametri anatomici e biofisici sono stati presi da risultati empirici. È comune per i modelli computazionali mescolare parametri misurati in specie diverse a causa dell'indisponibilità di dati. Per una simulazione della stimolazione sopracoroidale, gli strati di tessuto tra gli elettrodi stimolanti e di riferimento devono essere inclusi nel modello.- Raccogliere l'anatomia del tessuto da studi istologici.
- In questo modello, includere la coroide, il tessuto retinico e i domini vitreali, dove ogni dominio è modellato come un prisma rettangolare per una facile costruzione del modello. Raccogliere lo spessore medio del tessuto retinico dai dati istologici pubblicati14 per essere successivamente utilizzato come altezza di ciascun prisma.
- Raccogliere i dati morfologici a singola cellula dalla colorazione cellulare o dal database pubblico dei neuroni.
- Scarica la morfologia dettagliata dei neuroni da un database come NeuroMorpho.org, che fornisce una funzione di metadati di ricerca per trovare il neurone pertinente in base a specie, regione del cervello, tipo di cellula, ecc. Per questo studio, trova il modello OFF RGC di Guo (D23WM13_27_1-OffRGC_msa)15 inserendo Rabbit > New Zealand White nel campo Specie e Retina nel campo Brain Region . Clicca sul modello e scarica il file .swc.
- Raccogliere l'anatomia del tessuto da studi istologici.
- Raccogliere i dati biofisici della cellula modellata
NOTA: I parametri biofisici includono i valori di conducibilità elettrica per ogni strato tissutale e i parametri elettrici della membrana neurale e dei canali ionici.- A causa della disponibilità di dati, utilizzare i valori di conducibilità elettrica che sono stati presi dal coniglio16 per il modello tissutale, mentre la dinamica dei canali ionici era basata sul modello di Sheasby e Fohlmeister della salamandra tigre retina17.
- Costruire la geometria del modello agli elementi finiti del tessuto e dell'elettrodo nel software FEM
NOTA: La geometria del tessuto e dell'array di elettrodi influenzano entrambi la distribuzione del potenziale elettrico, che a sua volta influenza il comportamento delle cellule neurali. Quindi, costruire una geometria realistica del mezzo in cui risiedono le celle, così come l'elettrodo, è importante. Il software FEM utilizzato in questo tutorial ha una GUI che consente una facile costruzione della geometria del modello.- Impostazione del modello FEM nella GUI del software:
- Eseguire il software FEM e fare clic su Model Wizard > 3D. Nella casella di riepilogo Seleziona fisica , espandere i campi elettrici > AC/DC e corrente > correnti elettriche (ec), quindi fare clic su Aggiungi. Fare clic su Studio e aggiungere uno studio stazionario sotto l'opzione Studi generali , quindi fare clic su Fine (Figura supplementare 1).
- Impostazione dell'unità e dei parametri geometrici dell'elettrodo.
- Nell'albero di Model Builder, fare clic su Parametri 1. Nella tabella digitare 'elec_rad' nel campo Nome e '50' nel campo Espressione per creare un elettrodo con un raggio di 50 unità. Quindi, fare clic su Geometria e modificare l'unità di lunghezza in μm, poiché il soma di una tipica cellula gangliare retinica ha un diametro di circa 10 μm (Figura supplementare 2).
- Creare gli strati di tessuto utilizzando i domini a blocchi
NOTA: per costruire la geometria del modello, sono stati utilizzati tre blocchi per rappresentare diverse strutture nell'occhio. Il blocco 1 rappresentava la coroide, il blocco 2 il tessuto retinico e il blocco 3 il vitreo.- Fare clic con il pulsante destro del mouse su Geometry 1 > Block per creare un dominio di blocco. Ripetere questo passaggio altre due volte per creare tre blocchi in totale. Per tutti i blocchi, impostate Profondità e Larghezza su 5.000 μm e modificate l'opzione Base (in Posizione) su Centro. Assegnate i seguenti valori di altezza (in Dimensioni e forma) e z (in Posizione) per ogni blocco:
Blocco 1: Altezza = 112 μm, z = 0 μm
Blocco 2: Altezza = 151 μm, z = 131,5 μm
Blocco 3: Altezza = 5.000 μm, z = 2.707 μm
- Fare clic con il pulsante destro del mouse su Geometry 1 > Block per creare un dominio di blocco. Ripetere questo passaggio altre due volte per creare tre blocchi in totale. Per tutti i blocchi, impostate Profondità e Larghezza su 5.000 μm e modificate l'opzione Base (in Posizione) su Centro. Assegnate i seguenti valori di altezza (in Dimensioni e forma) e z (in Posizione) per ogni blocco:
- Creazione di un piano di lavoro per aggiungere un elettrodo al modello
- Fate clic con il pulsante destro del mouse sulla geometria 1 nell'albero del modello e scegliete Piano di lavoro (Work Plan). Fate clic su Piano di lavoro 1 e impostate Tipo piano (Plane Type) in Faccia parallelo (Face Parallel), fate clic sul pulsante Attiva selezione (Activate Selection ) sotto il Tipo piano (Plane Type) e scegliete la superficie inferiore del Blocco 1 (blk 1 > 1).
- Disegno di un elettrodo a disco sul piano di lavoro
- Fate clic su Geometria piano (Plane Geometry) in Piano di lavoro 1 (Work Plane 1) e fate clic su Sketch (Sketch ) nella barra degli strumenti principale. Selezionare Cerchio, fare clic in un punto qualsiasi all'interno del rettangolo nella scheda Grafica e trascinare per creare un elettrodo a disco. Modificare il raggio in 'elec_rad' μm, xw e yw a 0 μm, quindi fare clic su Costruisci tutto.
- Assegnazione delle proprietà dei materiali a ciascun dominio
NOTA: seguendo i passaggi per costruire la geometria, il modello verrebbe separato in diversi "domini", che sono singole parti 3D che costituiscono la geometria completa. A ciascun dominio dovrebbe essere assegnato un valore di conducibilità elettrica per calcolare la distribuzione del campo elettrico nell'intero modello.- Nell'albero del modello, fate clic con il pulsante destro del mouse su Materiale > Materiale vuoto, quindi selezionate Materiale 1 (Material 1) e impostate la selezione su Manuale.
- Fare clic sui domini nell'area grafica in modo che venga scelto solo il dominio 1. Scegliere Proprietà materiale > Proprietà di base > Conduttività elettrica, fare clic sul pulsante Aggiungi al materiale e modificare il valore di conducibilità elettrica sul valore di 0,043 S / m15.
- Ripetere i passaggi per i domini 2 e 3, con i valori di conducibilità elettrica rispettivamente di 0,7 16 e 1,5516 S/m (figura supplementare 3).
- Meshing di un modello 3D: Per eseguire il mesh del modello, vai all'albero del modello e fai clic con il pulsante destro del mouse su Mesh 1 > Free Tetrahedral. Fare clic su Tetraedrico libero 1 e scegliere Costruisci tutto.
NOTA: Il processo di mesh suddivide l'intera geometria in "elementi" più piccoli (un elemento è un segmento virtuale della geometria del modello in cui le equazioni fisiche vengono risolte numericamente). La mesh con elementi più piccoli aumenta teoricamente l'accuratezza dell'approssimazione, ma è computazionalmente esaustiva. Una pratica comune consiste nell'avviare il modello con mesh sparse e registrare il risultato della simulazione, quindi ripetere continuamente la simulazione con elementi di mesh più piccoli ogni volta e confrontare i risultati. Il processo di perfezionamento può interrompersi quando non vi è alcuna differenza significativa nei risultati del calcolo dalle fasi successive di perfezionamento.- Valutazione della qualità della mesh: fare clic con il pulsante destro del mouse su Mesh 1 e scegliere Statistiche per visualizzare l'istogramma della qualità dell'elemento. Segui i passaggi di raffinazione della mesh riportati di seguito per migliorare la qualità degli elementi.
NOTA: l'utilizzo della mesh predefinita può produrre molti elementi di bassa qualità, che a loro volta rendono imprecisi i calcoli. Nella maggior parte dei casi, è necessario un certo grado di perfezionamento della mesh. - Affinare la maglia attorno al perimetro dell'elettrodo
NOTA: Le aree in cui potrebbero esserci bruschi cambiamenti nel campo elettrico richiedono in genere una maglia più raffinata. Qui, è stata aggiunta una mesh più densa attorno al perimetro dell'elettrodo utilizzando la funzione di distribuzione dei bordi.- In primo luogo, eliminare la maglia Tetraedrico 1 libera esistente. Quindi, fare clic con il pulsante destro del mouse su Mesh 1 > Distribuzione, fare clic su Distribuzione 1, modificare il livello di entità geometrica in Spigolo e scegliere Bordi 19-22 (il perimetro dell'elettrodo del disco).
- Impostare Tipo di distribuzione su Numero fisso di elementi e modificare il campo Numero di elementi su elec_rad*3/10 per rendere gli elementi ragionevolmente piccoli.
- Affinare la rete attraverso la coroide e il tessuto retinico
- Nell'albero del modello, fate clic con il pulsante destro del mouse su Mesh 1 > sweep. Fare clic su Spazzato 1. Scegli Domini 1 e 2. Quindi, fare clic con il pulsante destro del mouse su Mesh 1 > Tetraedrico libero, impostare il livello di entità geometrica su Rimanente e fare clic su Costruisci tutto. (Facoltativo: controllare nuovamente l'istogramma della qualità dell'elemento per assicurarsi che gli elementi di bassa qualità siano stati ridotti in proporzione).
- Valutazione della qualità della mesh: fare clic con il pulsante destro del mouse su Mesh 1 e scegliere Statistiche per visualizzare l'istogramma della qualità dell'elemento. Segui i passaggi di raffinazione della mesh riportati di seguito per migliorare la qualità degli elementi.
- Impostazione del modello FEM nella GUI del software:
- Applicare la fisica al modello agli elementi finiti
NOTA: La "fisica" nel software FEM sono insiemi di equazioni matematiche e condizioni al contorno che devono essere assegnate al modello. È il calcolo della soluzione all'insieme simultaneo di equazioni che viene eseguito durante l'esecuzione del modello. La scelta della fisica da applicare alla geometria dipende dal fenomeno fisico che viene simulato. Ad esempio, la fisica della corrente elettrica, come usata in questo modello, osserva la distribuzione del campo elettrico e trascura il fenomeno magnetico (induttivo). Un'altra fisica potrebbe essere applicata alla geometria se altri problemi fisici (ad esempio, distribuzione della temperatura, stress meccanico, ecc.) devono essere risolti.- Selezione della fisica e applicazione delle condizioni al contorno
NOTA: se deve essere applicato un impulso di tensione costante, la condizione al contorno del potenziale flottante deve essere sostituita con una condizione al contorno del potenziale elettrico.- Espandete Correnti elettriche 1 nell'albero del modello e verificate se sono elencati Conservazione corrente 1, Isolamento elettrico 1 e Valori iniziali 1 . Quindi, fare clic con il pulsante destro del mouse su Correnti elettriche 1 > massa (questo assegna 0 V a un piano distante, simulando un elettrodo di riferimento distante) e applicarlo alla superficie più lontana dall'elettrodo (superficie 10).
- Quindi, fare clic con il pulsante destro del mouse su Correnti elettriche 1 > potenziale fluttuante (questo simula una sorgente di corrente con corrente costante), assegnato all'elettrodo del disco (superficie 14) e modificare il valore I 0 in 1 [μA] per applicare una corrente unitaria.
- Esecuzione della simulazione con una sweep parametrica.
NOTA: questo passaggio eseguirà la simulazione ed è stata aggiunta una scansione parametrica, in cui sono state eseguite più simulazioni con il valore di un parametro modificato in ogni simulazione. Qui, il parametro del raggio dell'elettrodo è stato spazzato e la distribuzione del potenziale elettrico per ogni simulazione è stata memorizzata nel file del modello. Dopo l'esecuzione della simulazione, il ramo Risultati nell'albero del modello è stato popolato con un grafico multislice del potenziale elettrico (ec).- Nell'albero del modello, fate clic con il pulsante destro del mouse su Studio 1 > sweep parametrica (Parametric Sweep). Fare clic su Sweep parametrica e, nella tabella Impostazioni di studio , fare clic su Aggiungi, quindi scegliere elec_rad per il nome del parametro.
- Digitare '50, 150, 350, 500' per l'elenco dei valori dei parametri e 'μm' per l'unità di parametro e fare clic su Calcola per eseguire lo studio (Figura supplementare 4).
- Selezione della fisica e applicazione delle condizioni al contorno

Figura 1: Creazione della geometria tisssue. Una geometria a blocchi è stata inserita nel modello FEM per rappresentare il tessuto. Fare clic qui per visualizzare una versione ingrandita di questa figura.
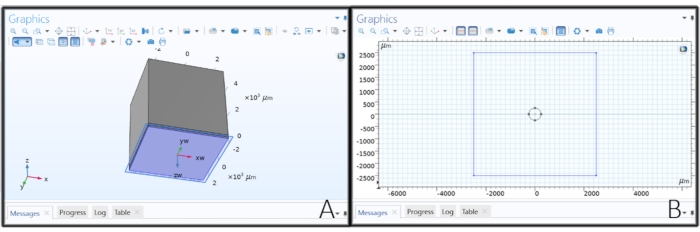
Figura 2: Creazione della geometria dell'elettrodo . (A) Creazione di un piano di lavoro per disegnare l'elettrodo a disco. (B) Sketch di un cerchio su un piano di lavoro per creare un elettrodo a disco. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: L'istogramma della qualità dell'elemento del modello FEM. L'istogramma mostrava la qualità degli elementi in tutto il modello. I perfezionamenti della mesh sono necessari se una parte significativa degli elementi si trova nella regione di bassa qualità. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura 4: Assegnazione di un valore di corrente all'elettrodo. Una corrente unitaria applicata alla geometria dell'elettrodo nel software FEM. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Importazione della geometria della cellula neurale nella GUI della suite computazionale neuronale
- Creare la geometria del modello di cella
- Importazione della morfologia mediante la funzionalità Cell Builder.
- Esegui 'nrngui' dalla cartella di installazione della suite computazionale neuronale, fai clic su Strumenti > Varie > Importa 3D, quindi seleziona la casella Scegli un file .
- Individua il file .swc scaricato e fai clic su Leggi. Una volta importata la geometria, fare clic su Esporta > Cell Builder (Figura supplementare 5).
- Creazione di un file .hoc della morfologia cellulare importata
- Vai alla scheda Sottoinsiemi e osserva i sottoinsiemi che sono stati predefiniti nel modello (ad esempio, soma, assone, basale, ecc.). Selezionare la casella Creazione continua , passare a Gestione > esportazione ed esportare la morfologia come 'rgc.hoc'.
- Visualizzazione della morfologia della cellula
- Fate clic su Strumento > Vista modello > 1 Celle reali > Soma radice [0] sulla barra degli strumenti, fate clic con il pulsante destro del mouse sulla finestra visualizzata e fate clic su Tipo asse > Asse vista. Con l'ispezione visiva, il diametro del campo dendritico di questo modello è di circa 250 μm. Chiudere le finestre NEURON per ora.
- Importazione della morfologia mediante la funzionalità Cell Builder.

Figura 5: Esportazione delle informazioni del modello neuronale come file .hoc. La geometria del neurone è stata esportata in un file .hoc per consentire ulteriori modifiche. Fare clic qui per visualizzare una versione ingrandita di questa figura.
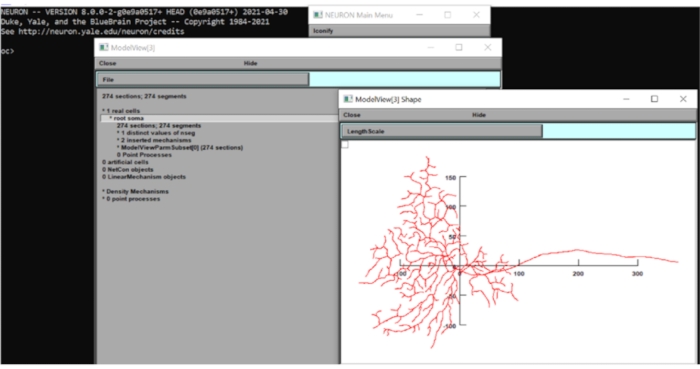
Figura 6: Misurazione della dimensione del neurone. La morfologia del neurone (vista dall'alto) è stata visualizzata nella GUI della suite computazionale dei neuroni con gli assi x-y sovrapposti. La scala era in μm. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Programmazione della simulazione di calcolo NEURON
- Regolazione della morfologia della cellula mediante programmazione in linguaggio .hoc
NOTA: La morfologia della cella può essere regolata tramite la funzione Cell Builder della GUI. Tuttavia, viene illustrato come ciò potrebbe essere fatto modificando il file .hoc per accelerare il processo. Il file .hoc definisce la topologia (connessioni fisiche tra ciascuna parte dei neuroni), la morfologia (la lunghezza, il diametro e la posizione di ciascuna sezione neuronale) e le proprietà biofisiche (parametri del canale ionico) della cellula modellata. La documentazione completa per la programmazione .hoc è disponibile in: https://neuron.yale.edu/neuron/static/new_doc/index.html#,- Aprire il file .hoc risultante con un editor di testo (ad esempio, Blocco note). Aggiungere un segmento iniziale dell'assone di 40 μm di lunghezza e uno stretto segmento assonale di 90 μm di lunghezza vicino al soma come descritto in Sheasby e Fohlmeister17, nonché modificare la lunghezza dei dendriti in modo che la dimensione del campo dendritico diventi 180 μm per corrispondere alla cella G1 in Rockhill, et al.18.
- Creazione di nuove sezioni di cella e definizione delle connessioni topologiche per ogni sezione.
- Per creare nuove sezioni di cella per il segmento iniziale dell'assone (AIS) e il segmento assonale stretto (NS), aggiungere queste righe all'inizio del file rgc.hoc:
creare AIS, NS // Dichiarare compartimenti cellulari chiamati AIS e NS
Quindi, sostituire la riga 'collega assone(0), soma[1](1)' con:
connect ais(0), soma[1](1) // Collegamento del primo segmento di AIS alla fine di soma[1]
connect ns(0), ais(1) // Collegamento del primo segmento di NS alla fine di AIS
collegare l'assone(0), ns(1) // Collegare il primo segmento dell'assone alla fine di NS
- Per creare nuove sezioni di cella per il segmento iniziale dell'assone (AIS) e il segmento assonale stretto (NS), aggiungere queste righe all'inizio del file rgc.hoc:
- Definizione delle posizioni, dei diametri e della lunghezza 3D delle sezioni di cella
- Definisci le posizioni e i diametri 3D dei compartimenti AIS e NS scrivendo queste righe all'interno delle parentesi 'proc shape3d_31()':
ais { pt3dadd(-2.25, -1.55, 0, 1) // I primi tre numeri sono la coordinata xyz e il diametro è 1 μm
pt3dadd(37,75, -1,55, 0, 1)} // Il primo punto è a x = -2,25 μm e l'ultimo punto è a x = 37,75 μm
ns { pt3dadd(37.75, -1.55, 0, 0.3) // Le coordinate 3D e il diametro per i segmenti NS
pt3dadd(127,75, -1,55, 0, 0,3)} - Alla fine del file, spostare la coordinata 3D dell'assone in modo che il suo punto iniziale raggiunga il punto finale di NS digitando:
axon {for i=0,n3d()-1 {pt3dchange(i, x3d(i)+130, y3d(i),z3d(i)-5, diam3d(i))}} //Shift the x-coordinate - Alla fine del file, accorciare i compartimenti dendritici del 18% digitando:
forsec basale {L=L*0.82} // Ridimensionamento della lunghezza per ridurre la dimensione del campo dendritico
define_shape() // Compilazione delle informazioni 3D mancanti
- Definisci le posizioni e i diametri 3D dei compartimenti AIS e NS scrivendo queste righe all'interno delle parentesi 'proc shape3d_31()':
- Creazione di nuove sezioni di cella e definizione delle connessioni topologiche per ogni sezione.
- Aprire il file .hoc risultante con un editor di testo (ad esempio, Blocco note). Aggiungere un segmento iniziale dell'assone di 40 μm di lunghezza e uno stretto segmento assonale di 90 μm di lunghezza vicino al soma come descritto in Sheasby e Fohlmeister17, nonché modificare la lunghezza dei dendriti in modo che la dimensione del campo dendritico diventi 180 μm per corrispondere alla cella G1 in Rockhill, et al.18.
- Definizione del numero di segmenti per ogni sezione
NOTA: Ogni sezione del neurone può essere discretizzata spazialmente, proprio come il processo di meshing nel modello FEM. La discretizzazione spaziale divide virtualmente il neurone in segmenti più piccoli in cui devono essere fatti i calcoli. Per il numero di segmenti 'nseg', assicurati che i numeri dispari siano usati per assicurarti che ci sia un nodo interno nel punto medio di una sezione di cella e prova a triplicare il numero nseg fino a quando il calcolo produce un risultato coerente9. Un numero maggiore di segmenti produrrà un'approssimazione numerica più accurata, ma aumenterà anche il carico computazionale.- Per esemplificare il processo di discretizzazione, aggiungere le seguenti righe nel file rgc.hoc per dividere le sezioni neuronali nei sottoinsiemi somatici e assonali in diversi segmenti:
Forsec somatic {nseg=31}
Forsec axonal {nseg=301}
Anche altre sezioni del modello devono essere discretizzate digitando queste righe ma cambiando il nome del sottoinsieme (dopo 'forsec') e il numero di segmenti (dopo 'nseg') come desiderato.
- Per esemplificare il processo di discretizzazione, aggiungere le seguenti righe nel file rgc.hoc per dividere le sezioni neuronali nei sottoinsiemi somatici e assonali in diversi segmenti:
- Inserire meccanismi di canale ionico personalizzati
- Scrittura di meccanismi di canale ionico personalizzati come file .mod: Per applicare i meccanismi dei canali ionici, creare file .mod e inserire i file nella sezione biofisica parte del file .hoc seguendo i passaggi 3.3.1-3.3.3. Il file .mod contiene le variabili e le equazioni differenziali da risolvere per ogni canale ionico.
NOTA: Le definizioni e le implementazioni corrette dei meccanismi dei canali ionici sono fondamentali nelle simulazioni accurate dei neuroni. Quando scrivi file .mod, controlla se le unità sono corrette (l'utilità 'modlunit' fornita che può essere eseguita per verificare la coerenza delle unità) e che le equazioni siano scritte correttamente. Per verificare che i meccanismi dei canali ionici siano corretti, la corrente per ciascun canale ionico durante la stimolazione intracellulare o extracellulare può essere tracciata e confrontata con i risultati empirici.- Canali ionici voltaggio-dipendenti
NOTA: un file .mod per creare un canale ionico voltaggio-dipendente include in genere un blocco DERIVATIVE che ha l'equazione differenziale da risolvere, un blocco BREAKPOINT che ha i comandi per risolvere le equazioni differenziali utilizzando un metodo di approssimazione numerica scelto e blocchi PROCEDURE che indicano al programma di calcolare i parametri di gating (ad esempio, mt, ht e d in questo esempio). Questo codice calcolerà i valori della corrente ionica che passa attraverso il canale per ogni passo temporale.- Per esemplificare il processo, creare un canale Ca dipendente dalla tensione con equazioni differenziali del primo ordine da risolvere per le variabili di gating.
- Aprite un nuovo file nell'editor di testo e digitate le righe in Materiale supplementare - Definizione di un canale Cat dipendente dalla tensione. Salvare il file come Cat.mod nella stessa cartella del file .hoc. Questo processo deve essere ripetuto per gli altri canali ionici contenuti nel neurone modello.
- Canali ionici dipendenti dalla tensione e dalla concentrazione
- La cinetica di alcuni canali ionici, come i canali del potassio attivati dal calcio nelle cellule gangliari retiniche, dipende dalla concentrazione intracellulare di calcio oltre alla tensione transmembrana19. Per modellare questo tipo di meccanismo, create un file denominato KCa.mod e digitate le linee come mostrato in Canali ionici supplementari dipendenti dalla tensione e dalla concentrazione del materiale. In questo file .mod, è stata calcolata la variabile 'cai', che è definita come la concentrazione interna dello ione Ca, e quindi questa variabile viene utilizzata nell'equazione per calcolare la corrente iKCa.
- Canali ionici voltaggio-dipendenti
- Compilazione di file .mod
- Compilare tutti i file .mod eseguendo l'utilità mknrndll della suite computazionale neuron dalla cartella di installazione. Individuare la cartella in cui sono contenuti i file .mod e fare clic su Compila per creare file O e C. Dopo questo, i meccanismi possono essere inseriti in questo modello cellulare.
- Applicazione dei file .mod nel file principale del modello NEURON.
NOTA: Oltre ad inserire i canali ionici, la conduttanza Na massima è stata definita solo per il sottoinsieme "somatico". Potremmo regolare individualmente la conduttanza massima della membrana per diversi segmenti neuronali, se necessario.- Per brevità, combinare tutti i meccanismi del canale ionico in un singolo file .mod (Supplementary Material-Complete .mod file). Inserire il file .mod combinato contenente tutti i canali ionici e un canale di perdita passivo a tutti i segmenti del sottoinsieme 'somatico' digitando le righe seguenti nella procedura 'biophys' del file rgc.hoc:
forsec somatic {insert rgcSpike
Inserire PAS // canale di perdita passivo
gnabar_rgcSpike = 80e-3
g_pas = 0,008E-3 // conduttanza della membrana di perdita}
- Per brevità, combinare tutti i meccanismi del canale ionico in un singolo file .mod (Supplementary Material-Complete .mod file). Inserire il file .mod combinato contenente tutti i canali ionici e un canale di perdita passivo a tutti i segmenti del sottoinsieme 'somatico' digitando le righe seguenti nella procedura 'biophys' del file rgc.hoc:
- Impostazione della resistività assoplasmatica
- Le cellule hanno resistività assoplasmatica che può essere modificata per compartimento. Per questo modello, tutti i segmenti hanno la stessa resistività di 110 Ω·cm. Modificare la resistività assoplasmatica nel file rgc.hoc:
forall {Ra = 110}
- Le cellule hanno resistività assoplasmatica che può essere modificata per compartimento. Per questo modello, tutti i segmenti hanno la stessa resistività di 110 Ω·cm. Modificare la resistività assoplasmatica nel file rgc.hoc:
- Scrittura di meccanismi di canale ionico personalizzati come file .mod: Per applicare i meccanismi dei canali ionici, creare file .mod e inserire i file nella sezione biofisica parte del file .hoc seguendo i passaggi 3.3.1-3.3.3. Il file .mod contiene le variabili e le equazioni differenziali da risolvere per ogni canale ionico.
- Inserire meccanismi extracellulari e definire la forma d'onda dell'impulso
- Inserimento di un meccanismo extracellulare nel modello cellulare
- Affinché il modello di cella risponda alla tensione extracellulare, inserire un meccanismo extracellulare in tutti i segmenti digitando la riga nella parte inferiore del file rgc.hoc:
forall {inserire extracellulare}
- Affinché il modello di cella risponda alla tensione extracellulare, inserire un meccanismo extracellulare in tutti i segmenti digitando la riga nella parte inferiore del file rgc.hoc:
- Creazione di un impulso bifasico
NOTA: in questa dimostrazione viene creato un impulso bifasico a corrente costante regolabile dall'utente in termini di larghezza dell'impulso, intervallo interfase e numero di ripetizioni creando una procedura in un file .hoc. Per un programma più strutturato, utilizzare il file rgc.hoc come file per creare il modello cellulare, mentre il processo di stimolazione viene applicato in un file .hoc separato, che caricherà il modello cellulare a cui viene applicata la stimolazione.- Creare un nuovo file di testo chiamato stimulation.hoc e avviare il codice caricando il file del modello cellulare; quindi, fare un impulso bifasico definendo una procedura come mostrato in Materiale supplementare - Creazione di un impulso bifasico nella simulazione del neurone.
NOTA: questo passaggio crea un impulso bifasico catodico a corrente costante in cui i parametri di stimolo devono essere dichiarati dall'utente durante l'esecuzione della simulazione. Attualmente, la grandezza degli impulsi anodici e catodici è ±1 μA, ma questa grandezza deve cambiare a seconda della corrente di stimolazione erogata dall'elettrodo a disco.
- Creare un nuovo file di testo chiamato stimulation.hoc e avviare il codice caricando il file del modello cellulare; quindi, fare un impulso bifasico definendo una procedura come mostrato in Materiale supplementare - Creazione di un impulso bifasico nella simulazione del neurone.
- Inserimento di un meccanismo extracellulare nel modello cellulare
4. Esecuzione e automazione di simulazioni multiple
- Combinazione dei modelli
- Estrazione delle coordinate per i nodi nel modello di cellula neuronale
NOTA: Lo scopo della combinazione delle simulazioni è quello di acquisire i valori di potenziale extracellulare corrispondenti a ciascun nodo del modello cellulare. Le coordinate dei due modelli devono tuttavia essere allineate. In questo esempio, il segmento centrale del soma (soma (0.5)) è stato allineato per giacere sul piano mediano orizzontale del tessuto retinico (corrispondente allo strato di cellule gangliari retiniche), con il nodo centrale del soma situato proprio sopra il centro dell'elettrodo del disco.- Aprite il modello FEM e notate la coordinata di un punto di riferimento (ad esempio, il piano mediano orizzontale del tessuto retinico, sopra il centro dell'elettrodo a disco), nel qual caso è [0, 0, 131,5] μm.
- Nella suite computazionale dei neuroni, creare un file chiamato calculateCoord.hoc per estrarre le coordinate del centroide di ciascun segmento e spostare ogni sezione in modo che il segmento centrale del soma abbia le stesse coordinate del punto di riferimento nel modello FEM (Supplementary Material-Calculation the coordinate of each node).
- Salvataggio dei punti di coordinate in un file di testo
- Eseguire il file calculateCoord.hoc (facendo doppio clic su Esplora file o aprendo la GUI della suite computazionale dei neuroni; quindi, fare clic su File > caricare hoc nella barra degli strumenti). Salvare le coordinate per i valori di tensione extracellulare da valutare in un file di testo denominato 'coordinates.dat'.
- Esecuzione delle simulazioni e salvataggio dei dati di tensione in un file di testo
NOTA: In questo passaggio, abbiamo estratto i valori extracellulari calcolati dal modello FEM, ma salveremo solo i dati dalle coordinate pertinenti che coincidono con il centro di ciascun segmento di cella. Seguire il punto 4.1.6.2 quando è necessario un gran numero di potenziali per l'esportazione.- Aprire il file del modello tissutale nel software FEM; vai all'intestazione Risultati nell'albero del modello e fai clic su Esporta dati > > Dati 1. Assicurarsi che il set di dati sia impostato su Studio 1/Soluzioni parametriche 1, quindi digitare 'V' nella colonna Espressione e 'mV' nella colonna Unità.
- In Output modificare il nome file in extracellular.dat e scegliere Punti da valutare in: Da file. Caricare le coordinate.dat per il campo File di coordinate , quindi fare clic su Esporta.
- Applicazione dell'impulso bifasico al modello cellulare
NOTA: In questa fase, sono disponibili i valori di tensione extracellulare per ciascun segmento di cella in un punto temporale (dove la corrente è di 1 μA). Poiché lo studio intende sottoporre la cellula a un impulso bifasico, fai in modo che il valore di tensione extracellulare sperimentato dalla cellula cambi nel tempo usando il metodo "vector.play".- Aggiungere le linee mostrate nel Materiale-Applicazione supplementare dell'impulso bifasico nel stimulation.hoc.
- Esecuzione della simulazione combinata
NOTA: per eseguire le simulazioni è necessario definire un intervallo di tempo 'dt' per le approssimazioni numeriche. Simile a nseg, un dt più breve può aumentare l'accuratezza computazionale ma aumenta anche il costo computazionale.- Aggiungere le linee mostrate nella simulazione del neurone Materiale supplementare alla fine del file stimulation.hoc. Quindi, fare doppio clic sul file stimulation.hoc per caricare lo script ed eseguire automaticamente la simulazione. Il potenziale transmembrana del segmento di interesse può essere visualizzato nella GUI della suite computazionale neuronale (passo 4.2.1) o salvato in un file di testo per essere letto in altri programmi (passo 4.1.6.1.2). Seguire i punti 4.1.6.1 e 4.1.6.2 se è necessario esportare calcoli ripetuti e un gran numero di potenziali di membrana.
- Extra: Automatizzare le simulazioni
NOTA: per trovare un'ampiezza di soglia, eseguire il ciclo della simulazione più volte con un'ampiezza di corrente diversa ogni volta. Potrebbe essere necessaria un'altra automazione per trovare la soglia per i neuroni situati in posizioni diverse rispetto all'elettrodo stimolante. Una fase di automazione può essere eseguita nella suite computazionale dei neuroni utilizzando una procedura, così come nel software FEM utilizzando uno script chiamato "metodo".- Automazione della simulazione dei neuroni per trovare un'ampiezza di soglia
NOTA: Un batch di simulazioni neuronali può essere eseguito automaticamente. I seguenti passaggi sono implementati nel programma di simulazione dei neuroni per trovare le ampiezze di soglia dei neuroni sotto diversi parametri di stimolazione.- Creare una procedura per ripetere la simulazione nel programma di simulazione dei neuroni: nel file stimulation.hoc, creare un vettore che contenga un intervallo di ampiezza corrente da testare. Quindi, creare una procedura per applicare l'ampiezza corrente e registrare qualsiasi presenza di un picco (una variazione positiva da una tensione transmembrana negativa a una positiva) e l'ampiezza di soglia viene definita come l'ampiezza di corrente più bassa che causa un picco. Per fare ciò, definire una procedura chiamata findTh() (Supplementary Material-Looping over a range of current ampwides) alla fine del file stimulation.hoc
- Salvataggio della risposta alla soglia in un file di testo: aggiungere le seguenti righe alla procedura findTh() in stimulation.hoc per memorizzare i valori di tensione transmembrana calcolati per tutti i compartimenti neuronali da ogni passaggio temporale in un file di testo:
sprint(saveFileName, "Response_%d.dat", th) // Memorizza il valore di soglia
saveFile.wopen(saveFileName)
for i=0,(responseVector.size()-1){
saveFile.printf("%g, ", responseVector.x[i])
if(i==responseVector.size()-1) {saveFile.printf("%g\n", responseVector.x[i])
saveFile.close(saveFileName)
}}
- Automazione nel software FEM per trovare i valori di tensione per i neuroni in diverse posizioni
NOTA: Un'altra automazione che può essere eseguita è l'acquisizione automatica dei valori di tensione extracellulare per i neuroni in posizioni diverse. Il menu Application Builder nel software FEM fornisce un mezzo per definire un "metodo" o uno script per automatizzare i passaggi necessari al software per eseguire i calcoli. Per dimostrare, la posizione della cella nella direzione x viene spostata di 5 volte in un passo di 100 μm (Figura supplementare 6).- Scrittura di un codice per automazioni di simulazioni FEM.
- Vai a Application Builder, fai clic con il pulsante destro del mouse su Metodi nella struttura di Application Builder, scegli Nuovo metodo e fai clic su OK. Vai su File > Preferenze > Metodi, seleziona la casella Visualizza tutti i codici e fai clic su OK.
- Scrivere uno script .hoc che carichi il file di coordinate, sposti i valori in modo che corrispondano alla posizione desiderata e salvare un file di testo contenente i valori di tensione per la nuova posizione della cella digitando i codici mostrati in Materiale supplementare - Definizione di un metodo per automatizzare le simulazioni FEM.
- Esecuzione dei passaggi automatici nel software FEM: passare al Model Builder, allo sviluppatore > al metodo Run > al metodo 1. Ciò produrrà file .dat con i valori di tensione appropriati, denominati extracellular_1.dat, extracellular_2.dat, ecc.
- Scrittura di un codice per automazioni di simulazioni FEM.
- Looping delle simulazioni in un linguaggio di programmazione generico
NOTA: per eseguire il ciclo delle simulazioni, il file di testo appropriato deve essere caricato ogni volta nella simulazione della suite computazionale neuronale e un linguaggio di programmazione20 in grado di caricare e manipolare facilmente i file di testo è conveniente per eseguire questo passaggio. Per questo passaggio è possibile utilizzare qualsiasi ambiente di sviluppo integrato (IDE)21 .- Apri l'IDE scelto, fai clic su Nuovo file per creare un nuovo script. In questo esempio viene utilizzato un file .py. Digitare le righe mostrate in Materiale supplementare - Esecuzione delle simulazioni in un linguaggio di programmazione generico.
- Infine, fare clic su Esegui o premere F5 per eseguire lo script, che aprirà anche la GUI (Figura 7 supplementare).
- Automazione della simulazione dei neuroni per trovare un'ampiezza di soglia
- Estrazione delle coordinate per i nodi nel modello di cellula neuronale
- Visualizzazione dei dati di simulazione
NOTA: seguendo tutti i passaggi precedenti, i risultati della simulazione devono essere memorizzati in file di testo, contenenti il valore di soglia e il potenziale transmembrana alla soglia. Tuttavia, l'utente ha la possibilità di visualizzare il risultato della simulazione mentre la simulazione è in esecuzione utilizzando la GUI di NEURON.- Rappresentare graficamente la risposta del modello neuronale alla stimolazione extracellulare nella GUI della suite computazionale del neurone. Per fare ciò, esegui stimulation.hoc, fai clic su Grafico > asse di tensione dalla barra degli strumenti e, nella finestra del grafico, fai clic con il pulsante destro del mouse in un punto qualsiasi e scegli Traccia cosa.
- Digita 'axon.v(1)' nel campo Da variabile a grafico , il che significa che traccerà il potenziale transmembrana dell'ultimo segmento dell'assone per passo temporale.
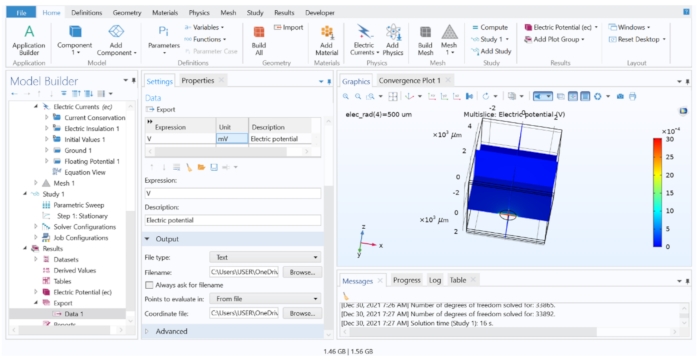
Figura 7: Visualizzazione ed esportazione dei risultati del calcolo FEM in un file di testo. La finestra grafica che mostra un grafico multislice del potenziale elettrico in V. Le opzioni dell'impostazione Esportazione dati consentivano di esportare la variabile calcolata in un file di testo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
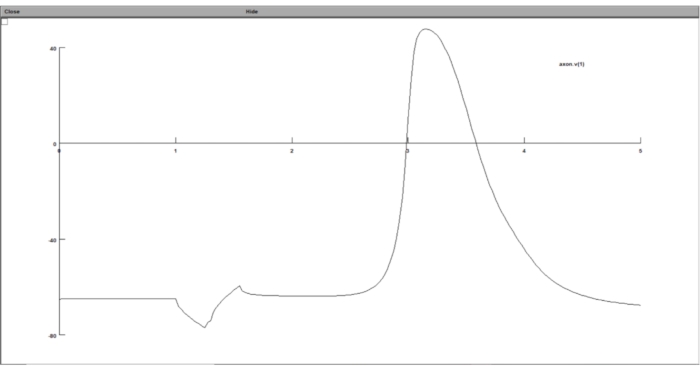
Figura 8: Visualizzazione del grafico del potenziale transmembrana utilizzando un grafico di tensione. Il potenziale transmembrana neuronale è stato visualizzato nella GUI della suite computazionale neuronale. L'asse x è il tempo in ms, mentre l'asse y è il potenziale transmembrana del segmento neuronale scelto in mV. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Abbiamo condotto due protocolli di simulazione per dimostrare l'uso del modello. Il primo protocollo prevedeva la variazione della dimensione dell'elettrodo mantenendo la posizione del neurone e i parametri dell'impulso elettrico uguali. Il secondo protocollo prevedeva lo spostamento del neurone nella direzione x in passi di 100 μm, mentre la dimensione dell'elettrodo rimaneva costante. Per entrambi i protocolli, l'impulso utilizzato era un singolo impulso bifasico catodico di 0,25 ms di larghezza con un gap interfasico di 0,05 ms. Per il primo protocollo, il raggio dell'elettrodo è stato variato per essere 50, 150, 350 e 500 μm, mentre per il secondo protocollo, il raggio dell'elettrodo è stato mantenuto costante a 50 μm.
Il modello qui descritto ha mostrato che l'aumento della dimensione dell'elettrodo sopracoroidale a 0,25 ms di larghezza dell'impulso ha aumentato la soglia di attivazione del neurone modello (Figura 9A). Questo risultato riflette i risultati in vivo di Liang et al.12, che hanno dimostrato che la soglia di attivazione corticale aumenta con l'aumentare delle dimensioni dell'elettrodo a questa larghezza di impulso.
Le grandezze delle soglie di attivazione del modello differiscono dai risultati empirici a causa di diversi fattori. In primo luogo, questo modello coinvolge solo un singolo RGC di un tipo specifico, che potrebbe non essere presente nel gruppo di cellule attivate nello studio in vivo . Successivamente, questo modello non includeva una rete retinica, che può facilitare l'attivazione delle RGC attraverso input eccitatori dalle cellule bipolari. Un'altra possibile ragione per la discrepanza è la distanza elettrodo-retina. È possibile che la distanza elettrodo-retina nello studio in vivo fosse inferiore rispetto a questo modello a causa della variabilità anatomica o della chirurgia. Di conseguenza, abbiamo sovrastimato la distanza elettrodo-retina e quindi la soglia di attivazione. È anche importante notare che, sebbene ciò non sia stato dimostrato nei nostri risultati, la modellazione di una singola soglia cellulare spesso sottostima la soglia corticale in vivo . Ciò è dovuto alle limitazioni tecniche nelle misurazioni corticali (principalmente relative al rapporto segnale-rumore) che l'attività corticale viene tipicamente rilevata solo dopo che sono state attivate più cellule gangliari retiniche. Di conseguenza, è prevedibile una discrepanza nell'entità delle soglie di attivazione retinica e corticale. Nonostante queste differenze, questo modello ha mostrato con successo la tendenza all'aumento della soglia di attivazione a causa dell'aumento delle dimensioni dell'elettrodo. Ciò è risultato dall'assenza di un'area di alto campo elettrico rispetto all'ambiente circostante quando la dimensione dell'elettrodo è aumentata, il che non ha favorito l'attivazione neurale22.
Successivamente, abbiamo osservato le caratteristiche del potenziale d'azione per convalidare il modello qui descritto. La latenza, o il tempo tra l'inizio dello stimolo e il picco del picco del potenziale d'azione, variava da 1 a 2,2 ms (Figura 9B). Ciò corrispondeva al picco di breve latenza dovuto all'attivazione retinica non mediata dalla rete23. La larghezza del picco di questo modello era di 1 ms, e questo è nello stesso intervallo delle larghezze delle punte degli RGC di coniglio misurati in vitro24.
Nel secondo protocollo di stimolazione, è stata variata solo la posizione del neurone nell'asse x (lungo la lunghezza dell'assone) rispetto all'elettrodo. A distanza 0, il centroide della sezione soma era immediatamente sopra il centro dell'elettrodo del disco. La distanza negativa significa che l'elettrodo del disco è stato posizionato più vicino al lato assonale, mentre la distanza positiva significa che l'elettrodo del disco è stato posizionato più vicino al lato dendritico. Il modello ha mostrato che la soglia più bassa è stata raggiunta quando il segmento stretto dell'assone era immediatamente sopra l'elettrodo del disco, e aumentava man mano che la distanza x diventava più grande (Figura 9C). Spostare ulteriormente l'elettrodo verso l'assone distale ha prodotto una soglia più bassa rispetto allo spostamento dell'elettrodo verso i dendriti a causa della presenza del segmento iniziale dell'assone e del segmento stretto in cui i canali del sodio sono più prevalenti. Questo risultato concordava con la scoperta in vitro di Jensen et al.13, in cui gli RGC di coniglio sono stati stimolati con un microelettrodo ultrafine e la soglia di attivazione era la più alta quando l'elettrodo veniva spostato più vicino ai dendriti.

Figura 9: I risultati del metodo di modellazione . (A) Le soglie di attivazione per una cellula gangliare retinica situata sopra l'elettrodo del disco. Il raggio dell'elettrodo è stato variato (50, 150, 350 e 500 μm) e la soglia è aumentata con l'aumentare delle dimensioni dell'elettrodo. (B) La forma del potenziale d'azione del modello neuronale a 0,25 ms di larghezza di impulso. I potenziali d'azione alla soglia per diverse dimensioni dell'elettrodo hanno la stessa larghezza di picco di 1 ms, ma la latenza aumenta con l'aumentare delle dimensioni dell'elettrodo. Il tempo di insorgenza dello stimolo è stato di 1 ms e la fase catodica ha causato una depolarizzazione sulla membrana, ma non abbastanza da causare un potenziale d'azione. (C) Il neurone è stato spostato lungo l'asse x e le soglie di attivazione hanno mostrato che la soglia più bassa è stata raggiunta dal neurone il cui soma era situato proprio sopra il centro dell'elettrodo. Il raggio dell'elettrodo era di 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Inizializzazione del modello agli elementi finiti. I tipi di studio e fisica determinano l'elenco delle equazioni risolte nel modello. Questi sono stati impostati durante la creazione iniziale del file di modello FEM, ma possono anche essere modificati / aggiunti dopo che il modello è stato creato. Clicca qui per scaricare questo file.
Figura supplementare 2: Modifica dell'unità di lunghezza. L'unità di lunghezza e l'unità angolare determinano le unità utilizzate nel processo di definizione della geometria. Clicca qui per scaricare questo file.
Figura supplementare 3: Inserimento di una proprietà materiale. Le proprietà del materiale sono state definite per ciascun dominio in un modello 3D. Le proprietà del materiale disponibili sono state elencate nella finestra Proprietà materiale nella finestra Impostazioni materiali. Per il calcolo del potenziale elettrico, è stata definita solo la proprietà di conducibilità elettrica. Clicca qui per scaricare questo file.
Figura supplementare 4: Creazione di uno studio parametrico per eseguire un ciclo su un elenco di valori di parametro. Uno studio parametrico ha permesso al software FEM di ripetere automaticamente i calcoli e modificare il valore del raggio dell'elettrodo per ogni ripetizione. I risultati del calcolo sono stati memorizzati per ogni ripetizione. Clicca qui per scaricare questo file.
Figura 5 supplementare: Importazione della morfologia del neurone dal file SWC. La suite computazionale neuronale era in grado di leggere file SWC acquisiti dal tracciamento neuronale. Il file importato contiene informazioni sulla morfologia e la topologia di ciascun segmento neuronale. Clicca qui per scaricare questo file.
Figura supplementare 6: Automazione delle operazioni FEM mediante la definizione di un metodo. Un metodo è stato definito scrivendo uno script per automatizzare i processi nel software FEM che non può essere fatto definendo uno studio parametrico. Clicca qui per scaricare questo file.
Figura supplementare 7: Integrazione dei modelli e automazione delle simulazioni utilizzando un linguaggio di programmazione generico. Il linguaggio di programmazione generico è stato utilizzato per eseguire il loop delle simulazioni dei neuroni, mentre si modifica il file di tensione extracellulare utilizzato come ingresso e il file di tensione di risposta neurale come output per ogni fase del ciclo. Clicca qui per scaricare questo file.
Materiale supplementare: Linee di comando per (1) Definizione di un canale Cat dipendente dalla tensione. (2) Canali ionici dipendenti dalla tensione e dalla concentrazione. (3) Completare il file .mod. (4) Creazione di un impulso bifasico nella simulazione neuronale. (5) Calcolo delle coordinate di ciascun nodo. (6) Applicazione dell'impulso bifasico. (7) Esecuzione della simulazione neuronale. (8) Looping su un intervallo di ampiezze di corrente. (9) Definizione di un metodo per automatizzare le simulazioni FEM. (10) Esecuzione delle simulazioni in un linguaggio di programmazione generico. Clicca qui per scaricare questo file.
Discussione
In questo articolo, abbiamo dimostrato un flusso di lavoro di modellazione che combina la modellazione degli elementi finiti e dei neuroni biofisici. Il modello è altamente flessibile, in quanto può essere modificato nella sua complessità per adattarsi a scopi diversi e fornisce un modo per convalidare i risultati rispetto ai risultati empirici. Abbiamo anche dimostrato come abbiamo parametrizzato il modello per consentire l'automazione.
Il metodo di modellazione in due fasi combina i vantaggi dell'utilizzo della FEM e della suite computazionale dei neuroni per risolvere l'equazione del cavo del neurone in presenza di una stimolazione extracellulare. Un FEM è utile per calcolare con precisione il campo extracellulare attraverso il conduttore di volume, che spesso è poco pratico da risolvere analiticamente nel caso di geometria complessa o disomogeneità di conduttività. Anche il costo computazionale di questo modello è relativamente basso, poiché si assume una condizione statica.
Sebbene il metodo di modellazione descritto sia vantaggioso in termini di facilità d'uso e flessibilità, esistono limitazioni a questo flusso di lavoro di modellazione. In primo luogo, questo metodo non consentiva la presenza di una membrana neurale nel calcolo del campo elettrico. Joucla et al.25 hanno confrontato il metodo in due fasi con l'intero metodo FEM, in cui la geometria neurale e le proprietà della membrana sono state incluse nel modello FEM. Hanno dimostrato che includere il neurone nel calcolo del campo elettrico cambierebbe il calcolo del potenziale transmembrana quando una struttura cellulare più grande, come un corpo cellulare, è stata inclusa nella geometria. In particolare, la semplificazione della geometria neuronale nel metodo a due fasi significa che il potenziale transmembrana di qualsiasi punto in un compartimento è rappresentato dal potenziale transmembrana al nodo o al punto centrale del compartimento. Al contrario, il modello di intero FEM proposto da Joucla includeva una rappresentazione esplicita della geometria 3D del neurone, che ha permesso la valutazione individuale del potenziale transmembrana su qualsiasi punto all'interno del compartimento. Pertanto, il modello FEM completo potrebbe essere più adatto se sono necessarie la forma e la posizione esatte del potenziale transmembrana. Tuttavia, questo metodo è computazionalmente più costoso rispetto al metodo in due fasi.
La seconda limitazione del metodo di modellazione riguarda la disponibilità di dati morfologici e cinetici ionici. Il modello utilizzato qui era basato sui dati della salamandra tigre, che è stata utilizzata per modellare RGC di altre specie, ma potrebbero esserci state differenze nei tipi di canali ionici presenti che non sono stati chiariti. Quindi, potrebbe essere necessario in alcuni casi eseguire lavori in vitro per regolare i parametri del canale ionico.
In terzo luogo, il costo del software FEM potrebbe essere un vincolo. In questo caso, un programma FEM open source26 che ha un risolutore di equazioni di Poisson incorporato potrebbe essere un'alternativa. Oltre al software FEM utilizzato, il software utilizzato in questo flusso di lavoro è gratuito. Mentre il software FEM utilizzato offre una GUI intuitiva e una modellazione della corrente elettrica pronta all'uso, è possibile eseguire i calcoli del valore extracellulare in un software di programmazione generico. Tuttavia, ciò richiederebbe la definizione manuale delle equazioni fisiche e dei metodi numerici per risolvere le equazioni27. Inoltre, questo metodo potrebbe essere noioso quando si deve utilizzare una complessa geometria di tessuto o array di elettrodi.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questa ricerca è finanziata dal National Health and Medical Research Council Project Grant (Grant Number 1109056).
Materiali
| Name | Company | Catalog Number | Comments |
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
Riferimenti
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user's guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neuroscience. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder's Documentation - Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon