Method Article
Ecografia doppler transcranici funzionale per il monitoraggio del flusso sanguigno cerebrale
In questo articolo
Riepilogo
L'ecografia Doppler transcraniale funzionale integra altre modalità di imaging funzionale, con la sua misurazione ad alta risoluzione temporale dei cambiamenti indotti dallo stimolo nel flusso sanguigno cerebrale all'interno delle arterie cerebrali basali. Questo documento sui metodi fornisce istruzioni dettagliate per l'utilizzo di ultrasuoni Doppler transcranici funzionali per eseguire un esperimento di imaging funzionale.
Abstract
L'ecografia Doppler transcraniale funzionale (fTCD) è l'uso dell'ecografia Doppler transcranico (TCD) per studiare l'attivazione neurale che si verifica durante stimoli come il movimento fisico, l'attivazione di sensori tattili nella pelle e la visualizzazione di immagini. L'attivazione neurale è dedotta da un aumento della velocità del flusso sanguigno cerebrale (CBFV) che fornisce la regione del cervello coinvolta nell'elaborazione dell'input sensoriale. Ad esempio, la visualizzazione di luce intensa provoca un aumento dell'attività neurale nel lobo occipitale della corteccia cerebrale, portando ad un aumento del flusso sanguigno nell'arteria cerebrale posteriore, che fornisce il lobo occipitale. In fTCD, i cambiamenti in CBFV sono utilizzati per stimare i cambiamenti nel flusso sanguigno cerebrale (CBF).
Con la sua misurazione ad alta risoluzione temporale delle velocità del flusso sanguigno nelle principali arterie cerebrali, fTCD integra altre tecniche di imaging funzionale consolidate. L'obiettivo di questo documento sui metodi è fornire istruzioni dettagliate per l'utilizzo di fTCD per eseguire un esperimento di imaging funzionale. In primo luogo, verranno descritti i passaggi di base per identificare l'arteria cerebrale media (MCA) e ottimizzare il segnale. Successivamente, verrà descritto il posizionamento di un dispositivo di fissazione per tenere la sonda TCD in posizione durante l'esperimento. Infine, verrà dimostrato l'esperimento di mantenimento del respiro, che è un esempio specifico di un esperimento di imaging funzionale che utilizza fTCD.
Introduzione
Nella ricerca neuroscientifica, è spesso auspicabile monitorare l'attività cerebrale in tempo reale in modo non invasivo in una varietà di ambienti. Tuttavia, le modalità di neuroimaging funzionale convenzionali hanno limitazioni che impediscono la capacità di catturare cambiamenti di attività localizzati e / o rapidi. La vera risoluzione temporale (non nervosa, non retrospettiva) della risonanza magnetica funzionale (fMRI) è attualmente dell'ordine di pochi secondi1, che potrebbe non catturare cambiamenti emodinamici transitori legati all'attivazione neurale transitoria. In un altro esempio, sebbene la spettroscopia funzionale nel vicino infrarosso (fNIRS) abbia un'alta risoluzione temporale (millisecondi) e una ragionevole risoluzione spaziale, può solo sondare i cambiamenti emodinamici all'interno della corteccia cerebrale e non può fornire informazioni sui cambiamenti che si verificano nelle arterie più grandi che alimentano il cervello.
Al contrario, fTCD – classificato come una modalità di neuroimaging – "imaging" si riferisce alle dimensioni del tempo e dello spazio, piuttosto che a due direzioni spaziali ortogonali che sono più familiari in una "immagine". fTCD fornisce informazioni complementari ad altre modalità di neuroimaging misurando cambiamenti emodinamici ad alta risoluzione temporale (tipicamente 10 ms) in posizioni precise all'interno dei vasi della circolazione cerebrale basale. Come con altre modalità di neuroimaging, fTCD può essere utilizzato per una varietà di esperimenti come lo studio della lateralizzazione dell'attivazione cerebrale durante i compiti legati al linguaggio2,3,4, lo studio dell'attivazione neurale in risposta a vari stimoli somatosensoriali5e l'esplorazione dell'attivazione neurale in vari stimoli cognitivi come compiti visivi6, compiti mentali7e persino produzione di strumenti8.
Sebbene fTCD offra diversi vantaggi per l'uso nell'imaging funzionale, tra cui basso costo delle apparecchiature, portabilità e maggiore sicurezza (rispetto al test Wada3 o alle scansioni di tomografia a emissione di positroni [PET]), il funzionamento di una macchina TCD richiede competenze ottenute con la pratica. Alcune di queste abilità, che devono essere apprese da un operatore TCD, includono la capacità di identificare varie arterie cerebrali e le capacità motorie necessarie per manipolare con precisione la sonda ad ultrasuoni durante la ricerca dell'arteria pertinente. L'obiettivo di questo documento sui metodi è quello di presentare una tecnica per l'utilizzo di fTCD per eseguire un esperimento di imaging funzionale. In primo luogo, verranno elencati i passaggi di base per identificare e ottimizzare il segnale dall'MCA, che perfonde l'80% dell'emisfero cerebrale9. Successivamente, verrà descritto il posizionamento di un dispositivo di fissazione per tenere la sonda TCD in posizione durante l'esperimento. Infine, verrà descritto l'esperimento di mantenimento del respiro, che è un esempio di un esperimento di imaging funzionale che utilizza fTCD, e verranno mostrati risultati rappresentativi.
Protocollo
Tutte le ricerche su soggetti umani sono state eseguite in conformità con l'Institutional Review Board dell'Università del Nebraska-Lincoln e il consenso informato è stato ottenuto da tutti i soggetti.
1. Localizzazione del segnale MCA tramite TCD a mano libera
NOTA: "Freehand" TCD si riferisce al funzionamento di TCD con un trasduttore portatile per trovare un segnale CBFV prima di iniziare un esperimento fTCD.
- Impostazione dei parametri TCD
- Mantenere la potenza a un valore ragionevolmente elevato (ad esempio, 400 mW) durante la ricerca iniziale dell'MCA. Una volta individuato il segnale MCA, ridurre il più possibile la potenza mantenendo comunque un segnale "buono" (vedere il passaggio 2.2.7).
NOTA: L'utilizzo di una potenza ragionevolmente elevata durante la ricerca iniziale non viola il principio "As Low As Reasonably Achievable" (ALARA) di esposizione alla radiazione acustica perché una maggiore potenza consentirà di scoprire il segnale MCA più rapidamente10. - Impostare il volume del campione su 8-12 mm durante la ricerca iniziale del segnale MCA. Se il segnale è difficile da trovare, aumentare la dimensione del gate per aumentare l'intensità del segnale, ma si noti che questo può incorporare il segnale da una o più arterie vicine nel segnale dall'MCA.
- Impostare il guadagno a un livello medio, con l'obiettivo di "mantenere il rumore di fondo al minimo, ma presente"10.
- Impostare il cutoff del filtro passa-alto (normalmente chiamato "soglia") su 50-150 Hz.
- Se il soggetto è un adulto, impostare la profondità su 50 mm, che è la profondità media del punto medio del segmento M1 dell'MCA10 (Figura 1).
NOTA: questa impostazione verrà discussa in modo più dettagliato nei passaggi successivi. Le impostazioni di profondità per i bambini sono riportate nella Tabella 1.
- Mantenere la potenza a un valore ragionevolmente elevato (ad esempio, 400 mW) durante la ricerca iniziale dell'MCA. Una volta individuato il segnale MCA, ridurre il più possibile la potenza mantenendo comunque un segnale "buono" (vedere il passaggio 2.2.7).

Figura 1: Rappresentazione del cerchio di Willis e delle principali arterie del sistema circolatorio cerebrale. La biforcazione dell'ICA in ACA e MCA è contrassegnata da un cerchio nero. Viene mostrato il segmento M1 dell'MCA. Questa cifra è stata modificata da24. Abbreviazioni: ACA = arteria cerebrale anteriore; Bif. = biforcazione; ICA = arteria carotide interna; MCA = arteria cerebrale media. Fare clic qui per visualizzare una versione più grande di questa figura.
- Individuazione della finestra temporale
NOTA: La finestra temporale, detta anche finestra acustica transtemporale, è una parte del cranio dove l'osso è più sottile11,permettendo così la trasmissione dell'energia ultrasonica a bassa frequenza attraverso il cranio(Figura 2).- Per neonati e bambini piccoli, individuare la finestra temporale proprio di fronte all'orecchio (lo "spazio intertragale") e sopra il bordo rostrale dell'arco zigomatico, che può essere facilmente sentito sotto la pelle.
- Per adolescenti e giovani adulti, individuare la finestra temporale tramite una qualsiasi delle sottofiniste.
NOTA: la sottofinestro posteriore di solito fornisce il segnale migliore (Figura 2). - Per gli adulti di età pari o superiore a 30 anni, individuare la finestra temporale proprio di fronte all'orecchio.
NOTA: La finestra acustica diminuisce di dimensioni man mano che le persone invecchiano a causa della crescente porosità dell'osso del cranio, causando ad alcune persone anziane di avere una finestra temporale molto limitata12. In tali individui, l'insonazione bilaterale dell'MCA è talvolta impossibile.

Figura 2: La finestra transtemporale (contrassegnata dall'ellisse tratteggiata), l'arco zigomatico (freccia) e le sottofinistre11. (A) Sottofinetola frontale. (B) Sottofinetola anteriore. (C) Sottofinetola centrale. (D) Sottofinetola posteriore. Fare clic qui per visualizzare una versione più grande di questa figura.
- Applicazione del trasduttore
- Applicare abbastanza gel ad ultrasuoni per coprire la superficie del trasduttore.
NOTA: Quando viene posizionato sulla testa, il gel deve coprire uno spazio sufficiente per mantenere una tenuta tra il cuoio capelluto e la superficie della sonda Doppler, evitando così l'interruzione del segnale dall'accoppiamento dell'aria sotto la superficie della sonda. - Avvisare il soggetto che il gel potrebbe sentire freddo (se a temperatura ambiente).
- Posizionare il trasduttore sulla finestra temporale, che si trovava al punto 1.2.
- Applicare abbastanza gel ad ultrasuoni per coprire la superficie del trasduttore.
- Ricerca dell'MCA
- Dopo aver posizionato il trasduttore sul cuoio capelluto, cercare il segnale MCA, che generalmente si troverà leggermente anteriore (in avanti) e rostrale (verso la testa) dalla posizione del posizionamento iniziale del cuoio capelluto del trasduttore10.
- Se il segnale spettrale TCD non è immediatamente evidente, regolare l'angolo del trasduttore mantenendolo nella stessa posizione rispetto al cuoio capelluto. Inclinare lentamente la sonda da rostrale a caudale (verso i piedi) e posteriore a anteriore.
NOTA: la Figura 3 mostra due spettri presi dalla stessa posizione, ma ad angoli diversi. - Se un segnale è ancora assente dopo aver eseguito il passaggio 1.4.2, controllare il display a colori in modalità M per il flusso nell'MCA a diverse profondità (indicate dalla colorazione rossa). Incrementare o decrementare la profondità del segnale in passi di 5 mm e cercare come descritto al punto 1.4.2. Se il flusso è visibile in modalità M ma non nello spettro Doppler, aumentare o diminuire la profondità fino a quando il segnale di flusso è visibile nello spettro Doppler.
- Se non si ottiene ancora un segnale soddisfacente, spostare il trasduttore in una posizione vicina sul cuoio capelluto, che è leggermente più anteriore, e ripetere i passaggi 1.4.1-1.4.3.
- Quando si ottiene un segnale MCA ottimale, annotare la profondità e la velocità massima.
- Utilizzando una penna per il trucco lavabile, posizionare un segno sul cuoio capelluto (parte traccia del bordo del trasduttore) dove è stato trovato il segnale ottimale.

Figura 3: Esempi di spettri Doppler e immagini in modalità M dal punto medio del segmento M1 dell'MCA. (A) Spettro preso subito dopo aver applicato il trasduttore alla finestra temporale, proprio di fronte all'orecchio. (B) Spettro Doppler campione nella stessa posizione e profondità di (A). L'unico cambiamento è che il trasduttore è stato inclinato verso l'alto (superiormente) leggermente. In entrambi (A) e (B), profondità = 50 mm, guadagno = 50, volume del campione = 12 mm, potenza = 420 mW/cm2e filtro = 100 Hz. Fare clic qui per visualizzare una versione più grande di questa figura.
- Ricerca della biforcazione
NOTA: Trovare la biforcazione dell'arteria carotide interna (ICA) è importante per aiutare a confermare che l'MCA è l'arteria monitorata. Questa fase deve essere eseguita su entrambi i lati se verrà eseguito il monitoraggio bilaterale, poiché la biforcazione potrebbe non essere alla stessa profondità su entrambi i lati.- Aumentare la profondità fino a quando non si nota il segnale dalla biforcazione dell'ICA nell'MCA e nell'ACA (Figura 4), in genere ad una profondità di 51-65 mm10.
- Cercare il segnale spettrale di biforcazione ottimale utilizzando la procedura descritta al punto 1.4.2. Cerca sempre il segnale spettrale più alto possibile10.
- Quando si ottiene un segnale di biforcazione ottimale, notare la profondità della biforcazione.
- Per il monitoraggio bilaterale, ripetere i tratti 1.1–1.4 e 1.5.1–1.5.3 sull'altro lato della testa.
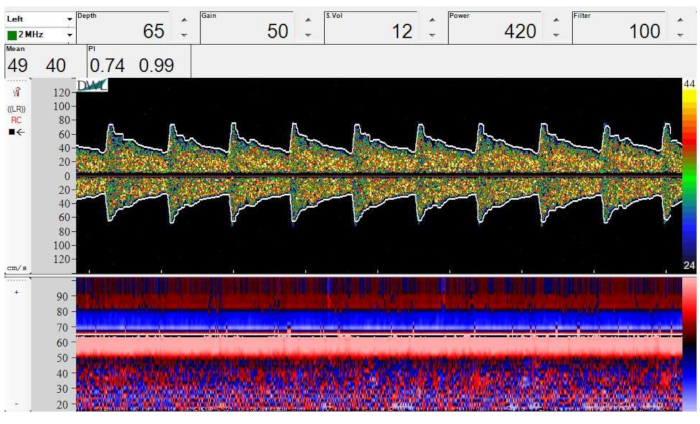
Figura 4: Immagine spettrale Doppler (in alto) e in modalità M (in basso) della biforcazione dell'ICA nell'MCA e nell'ACA. Profondità = 65 mm, guadagno = 50, volume del campione = 12 mm, potenza = 420 mW/cm2e filtro = 100 Hz. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Riposizionamento dell'MCA dopo aver posizionato un dispositivo di fissaggio
NOTA: per gli esperimenti fTCD, è necessario monitorare CBFV per 10-90 minuti o più. Pertanto, un dispositivo di fissaggio (Figura 5) è fondamentale per fornire stabilità.
- Posizionamento del dispositivo di fissaggio
- Mediante ispezione visiva, regolare il dispositivo di fissaggio (Figura 5) in base alle dimensioni approssimative della testa del soggetto.
- Avvisare il soggetto prima di posizionare l'auricolare sulla sua testa. Posizionare l'auricolare sulla testa del soggetto.
NOTA: se il soggetto ha i capelli lunghi o folti, potrebbe essere necessario legare i capelli del soggetto, a seconda del dispositivo di fissazione utilizzato. - Regolare la vestibilità del dispositivo di fissaggio e chiedere al soggetto se il dispositivo è troppo stretto.
NOTA: il dispositivo deve essere abbastanza stretto da non muoversi quando urtato leggermente, ma abbastanza sciolto da non scomodare il soggetto.
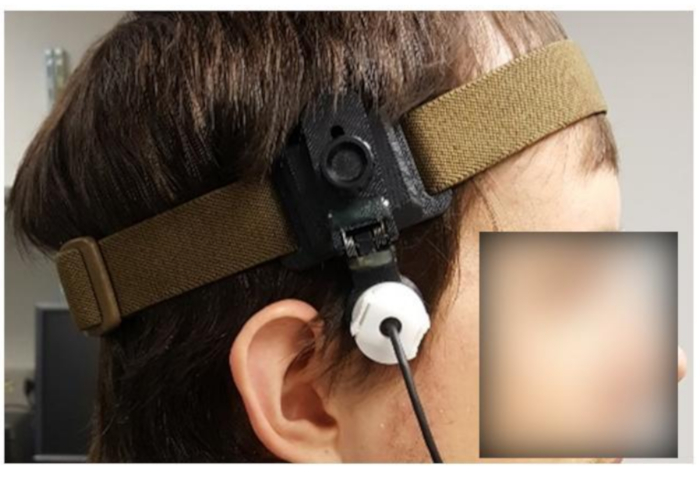
Figura 5: Soggetto che indossa un dispositivo di fissaggio personalizzato. Fare clic qui per visualizzare una versione più grande di questa figura.
- Individuazione del segnale MCA
- Allentare il meccanismo del dispositivo di fissazione tenendo il trasduttore in posizione (ad esempio, allentare il meccanismo, mostrato in Figura 5, ruotando una manopola in senso antiorario) in modo che il trasduttore possa muoversi liberamente.
- Avvisare il soggetto prima di applicare il gel ai trasduttori (che dovrebbero essere già in posizione dal paragrafo 2.1) e che il gel potrebbe essere freddo (se è stato conservato a temperatura ambiente).
- Applicare abbastanza gel ad ultrasuoni sul trasduttore per coprire la faccia del trasduttore.
- Regolare il dispositivo di fissaggio in modo che il trasduttore si trovi sopra la parte superiore del segno fatto al punto 1.4.6.
- Cercare il segnale spettrale MCA ottimale utilizzando la procedura descritta nei passaggi 1.4.1–1.4.3. Cerca sempre il segnale spettrale più alto possibile10.
NOTA: rispetto al TCD a mano libera, la profondità ottimale alla quale si trova l'MCA utilizzando il dispositivo di fissaggio può differire leggermente (al massimo 1-2 mm) dalla profondità del dispositivo a mano libera. Questo perché il dispositivo di fissaggio può tenere il trasduttore leggermente più lontano dal cuoio capelluto pur mantenendo una guarnizione in gel di accoppiamento. - Quando viene trovato il segnale spettrale MCA ottimale, stringere il meccanismo del dispositivo di fissazione per bloccare il trasduttore in posizione. Nota la profondità e tutte le altre impostazioni.
- Diminuire il più possibile la potenza (vedere il passaggio 1.1.1) pur mantenendo un inviluppo spettrale che traccia con precisione la velocità massima.
- Per il monitoraggio bilaterale,ripetere i passaggi da 2.2.1 a 2.2.7 dall'altra parte.
3. Esecuzione di una manovra di tenuta del respiro
NOTA: questa sezione è fornita come esempio di un esperimento funzionale che può essere eseguito utilizzando la configurazione sperimentale descritta nella sezione 1 e nella sezione 2.
- Eseguire tutti i passaggi descritti nella sezione 1 e nella sezione 2.
- Iniziare la registrazione sul software TCD.
- Respirare normalmente per 3 minuti per ottenere una buona registrazione di base e consentire al CBFV di stabilizzarsi da eventuali esperimenti o stimoli precedenti.
- Conto alla rovescia lentamente da tre. Sul conteggio di uno, chiedi al soggetto di iniziare a trattenere il respiro seguendo una normale ispirazione13.
NOTA: Il soggetto non deve inalare profondamente, in quanto ciò diminuirebbe l'anidride carbonica nei polmoni e diminuirebbe la probabilità di osservare l'aumento di CBFV a causa della reattività cerebrovascolare. Il soggetto dovrebbe anche evitare di eseguire una manovra di Valsalva, in cui la pressione intratoracica è sostanzialmente aumentata contro un'ispirazione trattenuta14. - Posiziona un marcatore nella registrazione TCD per indicare l'inizio della presa del respiro.
- Fai trattenere il respiro al soggetto per 30 anni o fino a quando non si sente più a suo agio nel trattenere il respiro.
- Quando il soggetto inspira, posiziona un marcatore nella registrazione TCD per indicare la fine del respiro.
- Continuare a monitorare CBFV utilizzando TCD e registrare per almeno 30 s dopo la fine del respiro per garantire che CBFV ritorni ai valori basali.
Risultati
La Figura 3 mostra gli spettri Doppler di esempio e le modalità M di colore dal punto medio del segmento M1 dell'MCA. Figura 3A,B sono stati presi nella stessa posizione sul cuoio capelluto, ma ad angoli diversi. Si noti come un piccolissimo cambiamento di angolo, senza modificare la posizione di contatto sul cuoio capelluto,possa migliorare notevolmente la potenza del segnale Doppler, come mostrato dalla colorazione gialla ad alta intensità dello spettrogramma in Figura 3B. Si noti inoltre che la modalità M nella Figura 3B mostra due arterie (blu e rosso, corrispondenti rispettivamente all'ACA e all'MCA).
La Figura 4 mostra uno spettro Doppler campione e la modalità M dalla biforcazione dell'ICA nell'ACA e nell'MCA. Si notino le regioni ombreggiate in rosso e blu sovrapposte nell'immagine in modalità M che denotano rispettivamente MCA e ACA. Si noti anche la simmetria della forma d'onda spettrale Doppler quando si confronta il flusso verso il trasduttore (positivo) con il flusso lontano dal trasduttore (negativo).
La Figura 6 mostra spettri campione e immagini in modalità M da diversi punti temporali nella manovra di tenuta del respiro. La Figura 6A mostra lo spettro TCD basale e la modalità M all'inizio del trattenimento del respiro. Si noti la velocità media di 56 cm/s. La Figura 6B mostra lo spettro TCD e la modalità M alla fine della presa del respiro. Si noti che la velocità media è ora aumentata a 70 cm / s. La Figura 6C mostra lo spettro TCD e la modalità M dopo la fine della presa di respiro. Si noti il sottosegremento della velocità al di sotto dei valori basali, con la media che scende a 47 cm / s. Si noti che l'ACA è visibile come flusso lontano dal trasduttore negli spettri Doppler.
La Figura 7 mostra l'intero esperimento di mantenimento del respiro. Si noti che l'inviluppo rimane elevato per circa 15 s dopo le estremità di trattenimento del respiro, scende a valori inferiori a quelli all'inizio del respiro per ~ 20 s e quindi infine si riprende ai valori basali. Si noti che l'ACA è visibile come flusso lontano dal trasduttore nello spettro Doppler.
La Figura 6 e la Figura 7 mostrano una buona intensità del segnale nella porzione MCA dello spettro TCD (l'MCA è rappresentato dalle velocità positive); si noti come la linea bianca che rappresenta l'inviluppo segue lo spettro TCD in modo molto accurato quando lo spettro è luminoso. Gli spettri della Figura 6 e della Figura 7 potrebbero essere migliorati diminuendo la profondità di monitoraggio di 5-10 mm in modo che la porzione ACA dello spettro TCD non sia visibile (l'ACA è rappresentata da velocità negative) e modificando la scala dell'asse verticale nello spettro TCD per andare da circa -100 cm/s a 100 cm/s, che consentirebbe il campionamento della massima velocità dello spettro TCD in direzione verticale.
La Figura 8 mostra esempi di spettri TCD bilaterali e modalità M adatte per fTCD bilaterale. La Figura 8A e la Figura 8B dimostrano spettri bilaterali e modalità M accettabili, ma non ottimali. Si noti come il guadagno sia più alto nella Figura 8A (MCA sinistro) che nella Figura 8B (MCA destro) per compensare il segnale più debole e come la qualità dell'inviluppo nella Figura 8A sia leggermente inferiore rispetto alla Figura 8B. Si noti inoltre come la velocità massima alla sistole nella Figura 8A sia leggermente inferiore rispetto alla Figura 8B. Al contrario, si noti come i due spettri nella Figura 8C e nella Figura 8D siano molto simili in termini di impostazioni, tra cui profondità, guadagno, potenza e volume del campione, e come le forme d'onda spettrali su entrambi i lati abbiano velocità e forme massime simili. Per risolvere questo problema, si raccomanda che lo spettro dall'MCA sinistro sia costantemente posizionato nella finestra di sinistra e lo spettro dall'MCA destro nella finestra di destra, specialmente per gli esperimenti che comportano la lateralizzazione del flusso sanguigno.

Figura 6: Esempi di spettri Doppler e immagini in modalità M dall'MCA durante le diverse fasi della manovra di mantenimento del respiro. (A) Spettro e modalità M all'inizio della tenuta del respiro. La linea gialla verticale al centro denota l'inizio del respiro. (B) Spettro e modalità M alla fine del trattenimento del respiro. La linea gialla verticale al centro denota la fine del respiro quando il soggetto inspira. (C) Spettro e modalità M dopo la fine della presa del respiro, che mostra la diminuzione della velocità del flusso che persiste per circa 30 s dopo la presa del respiro. In tutti gli spettri, profondità = 56 mm, guadagno = 50, volume del campione = 8 mm, potenza = 420 mW/cm2e filtro = 100 Hz. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Spettro e modalità M dall'MCA durante la presa del respiro. Profondità = 56 mm, guadagno = 50, volume del campione = 8 mm, potenza = 420 mW/cm2e filtro = 100 Hz. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Esempi di spettri bilaterali e immagini in modalità M dall'MCA. (A) Spettro e modalità M accettabili, ma non ottimali, dell'MCA sinistro, con profondità = 62 mm, guadagno = 69, volume del campione = 12 mm, potenza = 420 mW/cm2e filtro = 100 Hz. (B) Buon spettro e modalità M dell'MCA destro, con profondità = 62 mm, guadagno = 56, volume del campione = 12 mm, potenza = 420 mW/cm2e filtro = 100 Hz. (C) Buon spettro e modalità M dell'MCA sinistro. (D) Buon spettro e modalità M dell'MCA giusto. Per entrambi (C) e (D), profondità = 62 mm, guadagno = 56, volume del campione = 12, potenza = 420 mW/cm2e filtro = 100 Hz. Fare clic qui per visualizzare una versione più grande di questa figura.
| Età | Profondità dell'arteria cerebrale media (mm) |
| 0-3 mesia | 25 |
| 3-12 mesia | 30 |
| 1-3 annia | 35–45 |
| 3-6 annia | 40–45 |
| 6–10 annia | 45–50 |
| 10–18 annia | 45–50 |
| >18 annib | 50 |
Tabella 1: Profondità MCA a varie età. Fonti: a = Bode25, b = Alexandrov et al.10
Discussione
I passaggi critici nel protocollo includono 1) trovare l'MCA, 2) posizionare l'archetto e 3) eseguire la manovra di mantenimento del respiro.
Possono essere necessarie modifiche a seconda dei soggetti dello studio. Ad esempio, i soggetti con malattia di Alzheimer possono avere difficoltà a seguire le istruzioni, rendendo necessario l'uso di un capnografo per garantire la conformità con le istruzioni di mantenimento del respiro15. I bambini piccoli possono avere difficoltà a seguire le istruzioni e possono essere timidi dello sperimentatore; quindi, potrebbe essere necessario semplificare i protocolli sperimentali per tale popolazione (vedi Lohmann et al.2). Alcune impostazioni sulla macchina TCD potrebbero anche dover essere modificate a seconda della popolazione di interesse. Ad esempio, quando si insonano i bambini, che hanno ossa craniche sottili, ridurre il più possibile la potenza, soprattutto se il monitoraggio TCD avverrà per un periodo della durata di diverse ore16.
La risoluzione dei problemi spesso si concentra sulla difficoltà di trovare un segnale spettrale TCD buono e stabile. Ad esempio, per le persone di età superiore ai 50 anni, la finestra acustica temporale diventa sempre più piccola man mano che l'età aumenta a causa dell'aumentata porosità dell'osso del cranio e tende a localizzarsi nella regione appena davanti all'orecchio (lo "spazio intertragale")12. In una tale popolazione, trovare un buon segnale spettrale MCA su entrambi i lati della testa può a volte essere impossibile, e lievi cambiamenti nell'angolo o nella posizione del trasduttore possono causare la perdita del segnale. Poiché un segnale di buona qualità è essenziale per gli esperimenti che dipendono dalla forma d'onda dell'inviluppo per l'analisi, è necessario fare ogni sforzo per aumentare l'intensità e la qualità del segnale spettrale MCA. Ad esempio, il guadagno può essere regolato per ottimizzare il segnale e il volume del campione può essere aumentato per ottenere un segnale più forte. Come ultima risorsa, il potere può essere aumentato. Infine, è importante notare che in circa il 10% dei pazienti, la finestra acustica temporale può essere assente11,17. La finestra acustica temporale può essere facilmente trovata nei neonati e nei bambini piccoli ed è più difficile da trovare negli adulti di età superiore ai 50 anni.
I limiti della fTCD includono l'acquisizione di informazioni CBFV in una posizione spaziale17 piuttosto che in un ampio campo visivo, anche se con una risoluzione temporale molto elevata. Pertanto, fTCD è un complemento alla fMRI, che fornisce informazioni emodinamiche cerebrali (e quindi attività neurale) con un ampio campo visivo a bassa risoluzione temporale18,19. Infatti, fTCD ha una risoluzione temporale paragonabile a quella di fNIRS20, con l'importante differenza che fTCD misura i cambiamenti emodinamici a livello delle principali arterie cerebrali, mentre fNIRS misura i cambiamenti nella corteccia. Pertanto, fTCD può inserire dettagli significativi sui cambiamenti emodinamici cerebrali in risposta all'attivazione neurale, che nessun'altra modalità di neuroimaging è attualmente in grado di misurare.
Le potenziali applicazioni del TCD includono il monitoraggio per la formazione di embolo cerebrale durante la cardiochirurgia16 e il monitoraggio per rilevare l'esito del trattamento con attivatore del plasminogeno tissutale per l'ictus21. Le potenziali applicazioni della fTCD includono qualsiasi domanda di ricerca che coinvolga la risposta neurale a stimoli interni o esterni, come lo studio dell'elaborazione lateralizzata del linguaggio nel cervello umano2,3,4,la stimolazione somatosensoriale "tattile"5o la lateralizzazione dell'elaborazione visiva6. Inoltre, fTCD può essere utilizzato per studiare le risposte fisiologiche (con o senza cambiamenti dell'attività neurale) a stimoli come l'esercizio22 e il respirotrattenuto 13,15,23. Infine, il basso costo, la portabilità e la semplicità della fTCD rendono pratica l'imaging di un gran numero di soggetti, un vantaggio rispetto alla fMRI e ad altre modalità di neuroimaging come la PET, ad esempio, durante lo screening per la malattia di Alzheimer preclinica15.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo progetto si basa su una ricerca che è stata parzialmente sostenuta dalla Nebraska Agricultural Experiment Station con finanziamenti dall'Hatch Act (Numero di adesione 0223605) attraverso l'USDA National Institute of Food and Agriculture.
Materiali
| Name | Company | Catalog Number | Comments |
| Aquasonic | Parker Laboratories, Inc., Fairfield, NJ, USA | 01-50 | Ultrasound Gel |
| Doppler Box X | DWL Compumedics Gmbh, Singen, Germany | Model "BoxX" | Transcranial Doppler with 2-MHz monitoring probes |
| Kimwipes | Kimberly-Clark Professional | 34256 | Delicate Task Wipers |
| Transeptic | Parker Laboratories, Inc., Fairfield, NJ, USA | 09-25 | Cleaning Spray |
Riferimenti
- Buxton, R. B. The physics of functional magnetic resonance imaging (fMRI). Reports on Progress in Physics. 76 (9), 096601(2013).
- Lohmann, H., Dräger, B., Müller-Ehrenberg, S., Deppe, M., Knecht, S. Language lateralization in young children assessed by functional transcranial Doppler sonography. NeuroImage. 24 (3), 780-790 (2005).
- Knecht, S., et al. Noninvasive determination of language lateralization by functional transcranial Doppler sonography: a comparison with the Wada test. Stroke. 29 (1), 82-86 (1998).
- Knecht, S., et al. Successive activation of both cerebral hemispheres during cued word generation. Neuroreport. 7 (3), 820-824 (1996).
- Hage, B., Way, E., Barlow, S. M., Bashford, G. R. Real-time cerebral hemodynamic response to tactile somatosensory stimulation. Journal of Neuroimaging. 28 (6), 615-620 (2018).
- Hage, B., et al. Functional transcranial Doppler ultrasound for measurement of hemispheric lateralization during visual memory and visual search cognitive tasks. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 63 (12), 2001-2007 (2016).
- Meyer, G. F., Spray, A., Fairlie, J. E., Uomini, N. T. Inferring common cognitive mechanisms from brain blood-flow lateralization data: a new methodology for fTCD analysis. Frontiers in Psychology. 5, 552(2014).
- Uomini, N. T., Meyer, G. F. Shared brain lateralization patterns in language and Acheulean stone tool production: a functional transcranial Doppler ultrasound study. PLoS ONE. 8 (8), 72693(2013).
- Edvinsson, L., MacKenzie, E. T., McCulloch, J. Cerebral Blood Flow and Metabolism. , Raven Press, Ltd. New York, NY. (1993).
- Alexandrov, A. V., et al. Practice standards for transcranial Doppler ultrasound: part I--test performance. Journal of Neuroimaging. 17 (1), 11-18 (2007).
- Fujioka, K. A., Douville, C. M. Anatomy and freehand examination techniques. Transcranial Doppler. Newell, D. W., Aaslid, R. , Raven Press, Ltd. New York, NY. (1992).
- Alexandrov, A. V. Transcranial Doppler physics and techniques, lecture notes. American Society of Neuroimaging Conference. , deliverd 5 March (2020).
- Alwatban, M., Truemper, E. J., Al-rethaia, A., Murman, D. L., Bashford, G. R. The breath-hold acceleration index: a new method to evaluate cerebrovascular reactivity using transcranial Doppler. Journal of Neuroimaging. 28 (4), 429-435 (2018).
- Tiecks, F. P., et al. Effects of the Valsalva maneuver on cerebral circulation in healthy adults: a transcranial Doppler study. Stroke. 26 (8), 1386-1392 (1995).
- Alwatban, M., Murman, D. L., Bashford, G. Cerebrovascular reactivity impairment in preclinical Alzheimer's disease. Journal of Neuroimaging. 29 (4), 493-498 (2019).
- Twedt, M. H., et al. Most high-intensity transient signals are not associated with specific surgical maneuvers. World Journal for Pediatric and Congenital Heart Surgery. 11 (4), 401-408 (2020).
- Moehring, M. A., Spencer, M. P. Power M-mode Doppler (PMD) for observing cerebral blood flow and tracking emboli. Ultrasound in Medicine & Biology. 28 (1), 49-57 (2002).
- Poldrack, R. A. The future of fMRI in cognitive neuroscience. NeuroImage. 62 (2), 1216-1220 (2012).
- Oh, H., Custead, R., Wang, Y., Barlow, S. Neural encoding of saltatory pneumotactile velocity in human glabrous hand. PLoS ONE. 12 (8), 0183532(2017).
- Rosner, A. O., Barlow, S. M. Hemodynamic changes in cortical sensorimotor systems following hand and orofacial motor tasks and pulsed pneumotactile stimulation. Somatosensory & Motor Research. 33 (3-4), 145-155 (2016).
- Alexandrov, A. V., et al. High rate of complete recanalization and dramatic clinical recovery during tPA infusion when continuously monitored with 2-MHz transcranial doppler monitoring. Stroke. 31 (3), 610-614 (2000).
- Watt, B. P., Burnfield, J. M., Truemper, E. J., Buster, T. W., Bashford, G. R. Monitoring cerebral hemodynamics with transcranial Doppler ultrasound during cognitive and exercise testing in adults following unilateral stroke. 2012 IEEE Engineering in Medicine and Biology Society Annual Conference Proceedings. , San Diego, CA. 2310-2313 (2012).
- Markus, H. S., Harrison, M. J. Estimation of cerebrovascular reactivity using transcranial Doppler, including the use of breath-holding as the vasodilatory stimulus. Stroke. 23 (5), 668-673 (1992).
- File:Circle of Willis en.svg. . Wikimedia Commons, the free media repository. , Available from: https://commons.wikimedia.org/w/index.php?title=File:Circle_of_Willis_en.svg (2020).
- Bode, H. Pediatric Applications of Transcranial Doppler Sonography. , Springer-Verlag. Wien. (1988).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon