Method Article
Ultrasonido Doppler Transcraneal Funcional para el Monitoreo del Flujo Sanguíneo Cerebral
En este artículo
Resumen
La ecografía Doppler transcraneal funcional complementa otras modalidades de imágenes funcionales, con su medición de alta resolución temporal de los cambios inducidos por estímulos en el flujo sanguíneo cerebral dentro de las arterias cerebrales basales. Este documento de Métodos proporciona instrucciones paso a paso para usar el ultrasonido Doppler transcraneal funcional para realizar un experimento de imágenes funcionales.
Resumen
El ultrasonido Doppler transcraneal funcional (fTCD) es el uso del ultrasonido Doppler transcraneal (TCD) para estudiar la activación neuronal que ocurre durante estímulos como el movimiento físico, la activación de sensores táctiles en la piel y la visualización de imágenes. La activación neuronal se infiere de un aumento en la velocidad del flujo sanguíneo cerebral (CBFV) que suministra la región del cerebro involucrada en el procesamiento de la entrada sensorial. Por ejemplo, ver luz brillante causa un aumento de la actividad neuronal en el lóbulo occipital de la corteza cerebral, lo que lleva a un aumento del flujo sanguíneo en la arteria cerebral posterior, que suministra el lóbulo occipital. En fTCD, los cambios en CBFV se utilizan para estimar los cambios en el flujo sanguíneo cerebral (CBF).
Con su medición de alta resolución temporal de las velocidades del flujo sanguíneo en las principales arterias cerebrales, fTCD complementa otras técnicas de imagen funcionales establecidas. El objetivo de este documento de Métodos es dar instrucciones paso a paso para usar fTCD para realizar un experimento de imágenes funcionales. En primer lugar, se describirán los pasos básicos para identificar la arteria cerebral media (AME) y optimizar la señal. A continuación, se describirá la colocación de un dispositivo de fijación para mantener la sonda TCD en su lugar durante el experimento. Finalmente, se demostrará el experimento de contención de la respiración, que es un ejemplo específico de un experimento de imágenes funcionales utilizando fTCD.
Introducción
En la investigación en neurociencia, a menudo es deseable monitorear la actividad cerebral en tiempo real de manera no invasiva en una variedad de entornos. Sin embargo, las modalidades convencionales de neuroimagen funcional tienen limitaciones que impiden la capacidad de capturar cambios de actividad localizados y / o rápidos. La verdadera resolución temporal (no nerviosa, no retrospectiva) de la resonancia magnética funcional (fMRI) es actualmente del orden de unos pocos segundos1, que puede no capturar cambios hemodinámicos transitorios relacionados con la activación neuronal transitoria. En otro ejemplo, aunque la espectroscopia funcional de infrarrojo cercano (fNIRS) tiene una alta resolución temporal (milisegundos) y una resolución espacial razonable, solo puede sondear los cambios hemodinámicos dentro de la corteza cerebral y no puede proporcionar información sobre los cambios que tienen lugar en las arterias más grandes que irrigan el cerebro.
En contraste, fTCD, clasificada como una modalidad de neuroimagen, "imagen" se refiere a las dimensiones del tiempo y el espacio, en lugar de dos direcciones espaciales ortogonales que son más familiares en una "imagen". fTCD proporciona información complementaria a otras modalidades de neuroimagen mediante la medición de cambios hemodinámicos de alta resolución temporal (típicamente 10 ms) en ubicaciones precisas dentro de los vasos de la circulación cerebral basal. Al igual que con otras modalidades de neuroimagen, fTCD se puede utilizar para una variedad de experimentos, como el estudio de la lateralización de la activación cerebral durante las tareas relacionadas con el lenguaje2,3,4,el estudio de la activación neuronal en respuesta a diversos estímulos somatosensoriales5y la exploración de la activación neuronal en diversos estímulos cognitivos, como las tareas visuales6,las tareasmentales 7e incluso la producción de herramientas8.
Aunque fTCD ofrece varias ventajas para su uso en imágenes funcionales, incluido el bajo costo del equipo, la portabilidad y la seguridad mejorada (en comparación con la pruebaWada 3 o las tomografías por emisión de positrones [PET]), la operación de una máquina TCD requiere habilidades obtenidas por la práctica. Algunas de estas habilidades, que deben ser aprendidas por un operador de TCD, incluyen la capacidad de identificar varias arterias cerebrales y las habilidades motoras necesarias para manipular con precisión la sonda de ultrasonido durante la búsqueda de la arteria relevante. El objetivo de este artículo de Métodos es presentar una técnica para usar fTCD para realizar un experimento de imagen funcional. En primer lugar, se enumerarán los pasos básicos para identificar y optimizar la señal del MCA, que perfunde el 80% del hemisferio cerebral9. A continuación, se describirá la colocación de un dispositivo de fijación para mantener la sonda TCD en su lugar durante el experimento. Finalmente, se describirá el experimento de retención de la respiración, que es un ejemplo de un experimento de imágenes funcionales utilizando fTCD, y se mostrarán resultados representativos.
Protocolo
Toda la investigación en sujetos humanos se realizó de acuerdo con la Junta de Revisión Institucional de la Universidad de Nebraska-Lincoln, y se obtuvo el consentimiento informado de todos los sujetos.
1. Localización de la señal MCA mediante TCD a mano alzada
NOTA: TCD "a mano alzada" se refiere a la operación de TCD con un transductor de mano para encontrar una señal CBFV antes de comenzar un experimento fTCD.
- Configuración de parámetros TCD
- Mantenga la potencia en un valor razonablemente alto (por ejemplo, 400 mW) durante la búsqueda inicial del MCA. Una vez que se encuentre la señal MCA, reduzca la potencia tanto como sea posible mientras mantiene una señal "buena" (consulte el paso 2.2.7).
NOTA: El uso de una potencia razonablemente alta durante la búsqueda inicial no viola el principio de exposición a la radiación acústica "Tan bajo como sea razonablemente alcanzable" (ALARA) porque una mayor potencia permitirá que la señal MCA se descubra más rápidamente10. - Establezca el volumen de muestra en 8–12 mm durante la búsqueda inicial de la señal MCA. Si la señal es difícil de encontrar, aumente el tamaño de la puerta para aumentar la intensidad de la señal, pero tenga en cuenta que esto puede incorporar la señal de una o más arterias cercanas a la señal del MCA.
- Establezca la ganancia en un nivel medio, con el objetivo de "mantener el ruido de fondo al mínimo, pero presente"10.
- Establezca el límite del filtro de paso alto (normalmente denominado "umbral") en 50–150 Hz.
- Si el sujeto es un adulto, establezca la profundidad en 50 mm, que es la profundidad media del punto medio del segmento M1 del MCA10 (Figura 1).
NOTA: Esta configuración se discutirá con más detalle en los pasos siguientes. La configuración de profundidad para los niños se indica en la Tabla 1.
- Mantenga la potencia en un valor razonablemente alto (por ejemplo, 400 mW) durante la búsqueda inicial del MCA. Una vez que se encuentre la señal MCA, reduzca la potencia tanto como sea posible mientras mantiene una señal "buena" (consulte el paso 2.2.7).

Figura 1: Representación del círculo de Willis y las arterias principales del sistema circulatorio cerebral. La bifurcación del ICA en el ACA y el MCA está marcada con un círculo negro. Se muestra el segmento M1 del MCA. Esta cifra ha sido modificada de24. Abreviaturas: ACA = arteria cerebral anterior; Bif. = bifurcación; ICA = arteria carótida interna; MCA = arteria cerebral media. Haga clic aquí para ver una versión más grande de esta figura.
- Localización de la ventana temporal
NOTA: La ventana temporal, también llamada ventana acústica transtemporal, es una parte del cráneo donde el hueso es más delgado11,lo que permite la transmisión de energía de ultrasonido de baja frecuencia a través del cráneo(Figura 2).- Para bebés y niños pequeños, ubique la ventana temporal justo en frente de la oreja (el "espacio intertragal") y por encima del borde rostral del arco cigomático, que se puede sentir fácilmente debajo de la piel.
- Para adolescentes y adultos jóvenes, ubique la ventana temporal a través de cualquiera de las subventanas.
NOTA: La subventana posterior generalmente proporciona la mejor señal(Figura 2). - Para los adultos de 30 años o más, ubique la ventana temporal justo en frente de la oreja.
NOTA: La ventana acústica disminuye de tamaño a medida que las personas envejecen debido al aumento de la porosidad del hueso del cráneo, lo que hace que algunas personas mayores tengan una ventana temporal muy limitada12. En tales individuos, la insonación bilateral del MCA a veces es imposible.

Figura 2: La ventana transtemporal (marcada por la elipse discontinua), el arco cigomático (flecha) y las subventanas11. (A) Subventana frontal. (B) Subventana anterior. (C) Subventana media. (D) Subventana posterior. Haga clic aquí para ver una versión más grande de esta figura.
- Aplicación del transductor
- Aplique suficiente gel de ultrasonido para cubrir la superficie del transductor.
NOTA: Cuando se coloca en la cabeza, el gel debe cubrir suficiente espacio para mantener un sello entre el cuero cabelludo y la superficie de la sonda Doppler, evitando así la interrupción de la señal del acoplamiento de aire debajo de la superficie de la sonda. - Alerte al sujeto de que el gel puede sentirse frío (si está a temperatura ambiente).
- Coloque el transductor en la ventana temporal, que se encontraba en la sección 1.2.
- Aplique suficiente gel de ultrasonido para cubrir la superficie del transductor.
- Buscando el MCA
- Después de colocar el transductor en el cuero cabelludo, busque la señal MCA, que generalmente se ubicará ligeramente anterior (hacia adelante) y rostral (hacia la cabeza) desde la ubicación de la colocación inicial del transductor del cuero cabelludo10.
- Si la señal espectral TCD no es inmediatamente obvia, ajuste el ángulo del transductor mientras lo mantiene en la misma ubicación en relación con el cuero cabelludo. Incline lentamente la sonda de rostral a caudal (hacia los pies) y de posterior a anterior.
NOTA: La Figura 3 muestra dos espectros tomados de la misma posición, pero en ángulos diferentes. - Si una señal sigue ausente después de realizar el paso 1.4.2, compruebe el flujo en la pantalla de modo M a color en el MCA a diferentes profundidades (indicado por la coloración roja). Incremente o disminuye la profundidad de la señal en pasos de 5 mm y busque como se describe en el paso 1.4.2. Si el flujo es visible en el modo M pero no en el espectro Doppler, aumente o disminuya la profundidad hasta que la señal de flujo sea visible en el espectro Doppler.
- Si aún no se obtiene una señal satisfactoria, mueva el transductor a una posición cercana en el cuero cabelludo, que es ligeramente más anterior, y repita los pasos 1.4.1–1.4.3.
- Cuando se obtiene una señal MCA óptima, anote la profundidad y la velocidad máxima.
- Usando una pluma de maquillaje lavable, coloque una marca en el cuero cabelludo (parte traza del borde del transductor) donde se encontró la señal óptima.

Figura 3:Muestra de espectros Doppler e imágenes en modo M desde el punto medio del segmento M1 del MCA. (A) Espectro tomado justo después de aplicar el transductor a la ventana temporal, justo en frente de la oreja. (B) Muestreo del espectro Doppler en la misma ubicación y profundidad que (A). El único cambio es que el transductor se ha inclinado ligeramente hacia arriba (superiormente). Tanto en (A) como en (B), profundidad = 50 mm, ganancia = 50, volumen de muestra = 12 mm, potencia = 420 mW/cm2y filtro = 100 Hz. Haga clic aquí para ver una versión más grande de esta figura.
- Buscando la bifurcación
NOTA: Encontrar la bifurcación de la arteria carótida interna (ICA) es importante para ayudar a confirmar que el MCA es la arteria que se está monitoreando. Este paso debe realizarse en ambos lados si se realiza un monitoreo bilateral, ya que la bifurcación puede no estar a la misma profundidad en ambos lados.- Aumentar la profundidad hasta que se adice la señal de la bifurcación del ICA en el MCA y ACA(Figura 4),típicamente a una profundidad de 51–65 mm10.
- Búsqueda de la señal espectral de bifurcación óptima mediante el procedimiento descrito en el paso 1.4.2. Esfuércese siempre por obtener la señal espectral de mayor velocidad posible10.
- Cuando se obtiene una señal de bifurcación óptima, observe la profundidad de la bifurcación.
- Para la monitorización bilateral, repita las secciones 1.1–1.4 y los pasos 1.5.1–1.5.3 en el otro lado de la cabeza.
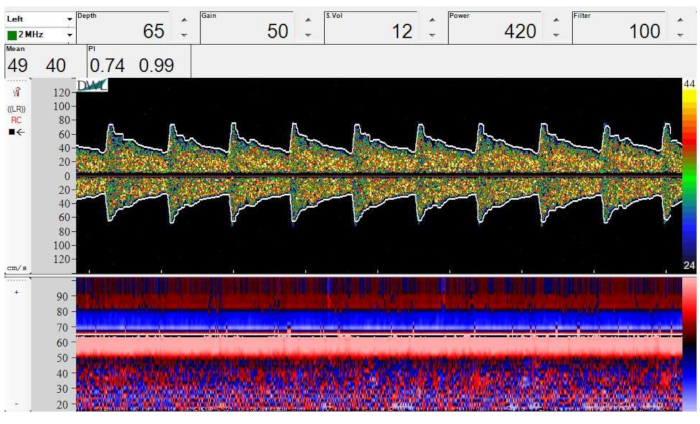
Figura 4: Imagen Doppler espectral (arriba) y modo M (abajo) de bifurcación del ICA en el MCA y ACA. Profundidad = 65 mm, ganancia = 50, volumen de muestra = 12 mm, potencia = 420 mW/cm2y filtro = 100 Hz. Haga clic aquí para ver una versión más grande de esta figura.
2. Reubicación del MCA después de colocar un dispositivo de fijación
NOTA: Para los experimentos fTCD, es necesario monitorear CBFV durante 10-90 minutos o más. Por lo tanto, un dispositivo de fijación(Figura 5)es crucial para proporcionar estabilidad.
- Colocación del dispositivo de fijación
- Mediante inspección visual, ajuste el dispositivo de fijación(Figura 5)al tamaño aproximado de la cabeza del sujeto.
- Alerte al sujeto antes de colocarse el auricular en la cabeza. Coloque el auricular en la cabeza del sujeto.
NOTA: Si el sujeto tiene el cabello largo o grueso, puede ser necesario atar el cabello del sujeto hacia atrás, dependiendo del dispositivo de fijación que se esté utilizando. - Ajuste el ajuste del dispositivo de fijación y pregúntele al sujeto si el dispositivo está demasiado apretado.
NOTA: El dispositivo debe estar lo suficientemente apretado como para que no se mueva cuando se golpea ligeramente, pero lo suficientemente suelto como para que el sujeto no se sienta incómodo.
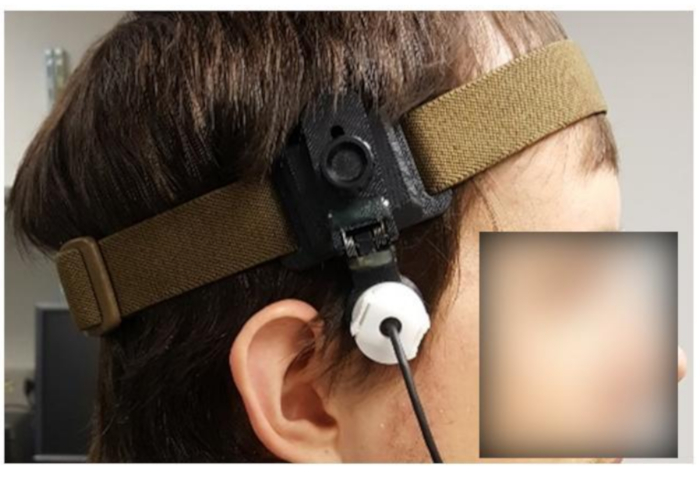
Figura 5: Sujeto que lleva un dispositivo de fijación personalizado. Haga clic aquí para ver una versión más grande de esta figura.
- Localización de la señal MCA
- Afloje el mecanismo del dispositivo de fijación que mantiene el transductor en su lugar (por ejemplo, afloje el mecanismo, que se muestra en la Figura 5,girando una perilla en sentido contrario a las agujas del reloj) para que el transductor pueda moverse libremente.
- Avise al sujeto antes de aplicar gel a los transductores (que ya deben estar en su lugar de la sección 2.1), y que el gel puede estar frío (si se ha almacenado a temperatura ambiente).
- Aplique suficiente gel de ultrasonido al transductor para cubrir la cara del transductor.
- Ajuste el dispositivo de fijación para que el transductor se ubuzca sobre la parte superior de la marca realizada en el paso 1.4.6.
- Busque la señal espectral MCA óptima utilizando el procedimiento descrito en los pasos 1.4.1–1.4.3. Esfuércese siempre por obtener la señal espectral de mayor velocidad posible10.
NOTA: En comparación con la TCD a mano alzada, la profundidad óptima a la que se encuentra el MCA utilizando el dispositivo de fijación puede diferir ligeramente (como máximo 1-2 mm) de la profundidad del dispositivo a mano alzada. Esto se debe a que el dispositivo de fijación puede mantener el transductor un poco más lejos del cuero cabelludo mientras mantiene un sello de gel de acoplamiento. - Cuando se encuentre la señal espectral MCA óptima, apriete el mecanismo del dispositivo de fijación para bloquear el transductor en su lugar. Tenga en cuenta la profundidad y todas las demás configuraciones.
- Disminuya la potencia (consulte el paso 1.1.1) tanto como sea posible mientras mantiene una envoltura espectral que traza la velocidad máxima con precisión.
- Para el monitoreo bilateral,repita los pasos 2.2.1–2.2.7 en el otro lado.
3. Realizar una maniobra de retención de la respiración
NOTA: Esta sección se proporciona como ejemplo de un experimento funcional que se puede realizar utilizando la configuración experimental descrita en las secciones 1 y 2.
- Realice todos los pasos descritos en las secciones 1 y 2.
- Comience a grabar en el software TCD.
- Respire normalmente durante 3 minutos para lograr un buen registro de referencia y permita que CBFV se estabilice a partir de cualquier experimento o estímulo anterior.
- Cuenta a poco desde tres. En la cuenta de uno, pídale al sujeto que comience a contener la respiración siguiendo una inspiración normal13.
NOTA: El sujeto no debe inhalar profundamente, ya que esto disminuiría el dióxido de carbono en los pulmones y disminuiría la probabilidad de observar el aumento de CBFV debido a la reactividad cerebrovascular. El sujeto también debe evitar realizar una maniobra de Valsalva, en la que la presión intratorácica se incrementa sustancialmente contra una inspiración sostenida14. - Coloque un marcador en la grabación de TCD para indicar el inicio de la contención de la respiración.
- Haga que el sujeto contenga la respiración durante 30 s, o hasta que ya no se sienta cómodo conteniendo la respiración.
- Cuando el sujeto inhala, coloque un marcador en la grabación de TCD para indicar el final de la contención de la respiración.
- Continúe monitoreando CBFV usando TCD y registrando durante al menos 30 s después del final de la contención de la respiración para asegurarse de que CBFV regrese a los valores de referencia.
Resultados
La Figura 3 muestra espectros Doppler de muestra y modos M de color desde el punto medio del segmento M1 del MCA. Figura 3A,B se tomaron en la misma posición en el cuero cabelludo, pero en diferentes ángulos. Observe cómo un cambio muy pequeño en el ángulo, sin cambiar la posición de contacto en el cuero cabelludo,puede mejorar en gran medida la intensidad de la señal Doppler, como lo demuestra la coloración amarilla de mayor intensidad del espectrograma en la Figura 3B. Tenga en cuenta también que el modo M en la Figura 3B muestra dos arterias (azul y rojo, correspondientes a la ACA y MCA, respectivamente).
La Figura 4 muestra una muestra del espectro Doppler y el modo M de la bifurcación del ICA en el ACA y el MCA. Observe las regiones sombreadas en rojo y azul superpuestas en la imagen de modo M que denota el MCA y el ACA, respectivamente. También tenga en cuenta la simetría de la forma de onda espectral Doppler al comparar el flujo hacia el transductor (positivo) con el flujo alejado del transductor (negativo).
La Figura 6 muestra espectros de muestra e imágenes en modo M de diferentes puntos de tiempo en la maniobra de retención de la respiración. La Figura 6A muestra el espectro TCD de referencia y el modo M al comienzo de la contención de la respiración. Nótese la velocidad media de 56 cm/s. La Figura 6B muestra el espectro TCD y el modo M al final de la contención de la respiración. Tenga en cuenta que la velocidad media ahora ha aumentado a 70 cm / s. La Figura 6C muestra el espectro TCD y el modo M después del final de la retención de la respiración. Nótese el subgiro en la velocidad por debajo de los valores basales, con la media cayendo a 47 cm/s. Tenga en cuenta que el ACA es visible como un flujo alejado del transductor en los espectros Doppler.
La Figura 7 muestra todo el experimento de contención de la respiración. Tenga en cuenta que la envoltura permanece elevada durante aproximadamente 15 s después de que termina la contención de la respiración, cae a valores más bajos que los del comienzo de la contención de la respiración durante ~ 20 s, y luego finalmente se recupera a los valores de referencia. Tenga en cuenta que el ACA es visible como flujo lejos del transductor en el espectro Doppler.
La Figura 6 y la Figura 7 muestran una buena intensidad de señal en la porción MCA del espectro TCD (el MCA está representado por las velocidades positivas); observe cómo la línea blanca que representa la envolvente sigue el espectro TCD con mucha precisión cuando el espectro es brillante. Los espectros de la Figura 6 y la Figura 7 podrían mejorarse disminuyendo la profundidad de monitoreo en 5-10 mm para que la porción ACA del espectro TCD no sea visible (el ACA está representado por velocidades negativas) y cambiando la escala del eje vertical en el espectro TCD para que funcione de aproximadamente -100 cm / s a 100 cm / s, lo que permitiría el muestreo a máxima velocidad del espectro TCD en la dirección vertical.
La Figura 8 muestra ejemplos de espectros bilaterales de TCD y modos M adecuados para fTCD bilateral. La Figura 8A y la Figura 8B demuestran espectros bilaterales aceptables, pero no óptimos, y modos M. Observe cómo la ganancia es mayor en la Figura 8A (MCA izquierda) que en la Figura 8B (MCA derecha) para compensar la señal más débil, y cómo la calidad de la envolvente en la Figura 8A es ligeramente más pobre que en la Figura 8B. Observe también cómo la velocidad máxima en la sístole en la Figura 8A es ligeramente menor que en la Figura 8B. Por el contrario, observe cómo los dos espectros en la Figura 8C y la Figura 8D son muy similares en términos de configuración, incluida la profundidad, la ganancia, la potencia y el volumen de la muestra, y cómo las formas de onda espectrales en ambos lados tienen velocidades y formas máximas similares. Para abordar esto, se recomienda que el espectro del MCA izquierdo se coloque consistentemente en la ventana izquierda y el espectro del MCA derecho en la ventana derecha, especialmente para experimentos que involucran la lateralización del flujo sanguíneo.

Figura 6: Muestra de espectros Doppler e imágenes en modo M del MCA durante las diferentes etapas de la maniobra de retención de la respiración. (A) Espectro y modo M al comienzo de la contención de la respiración. La línea amarilla vertical en el centro denota el comienzo de la contención de la respiración. (B) Espectro y modo M al final de la contención de la respiración. La línea amarilla vertical en el centro denota el final de la contención de la respiración cuando el sujeto inhala. (C) Espectro y modo M después del final de la contención de la respiración, mostrando la disminución de la velocidad del flujo que persiste durante aproximadamente 30 s después de la contención de la respiración. En todos los espectros, profundidad = 56 mm, ganancia = 50, volumen de muestra = 8 mm, potencia = 420 mW/cm2y filtro = 100 Hz. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7:Espectro y modo M del MCA durante la contención de la respiración. Profundidad = 56 mm, ganancia = 50, volumen de muestra = 8 mm, potencia = 420 mW/cm2y filtro = 100 Hz. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Ejemplos de espectros bilaterales e imágenes en modo M del MCA. (A) Espectro aceptable, pero no óptimo, y modo M del MCA izquierdo, con profundidad = 62 mm, ganancia = 69, volumen de muestra = 12 mm, potencia = 420 mW/ cm2, y filtro = 100 Hz. (B) Buen espectro y modo M del MCA derecho, con profundidad = 62 mm, ganancia = 56, volumen de muestra = 12 mm, potencia = 420 mW/cm2, y filtro = 100 Hz. (C) Buen espectro y modo M del MCA izquierdo. (D) Buen espectro y modo M del MCA derecho. Tanto para (C) como (D), profundidad = 62 mm, ganancia = 56, volumen de muestra = 12, potencia = 420 mW/cm2y filtro = 100 Hz. Haga clic aquí para ver una versión más grande de esta figura.
| Edad | Profundidad de la arteria cerebral media (mm) |
| 0–3 mesesa | 25 |
| 3–12 mesesa | 30 |
| 1–3 añosa | 35–45 |
| 3–6 añosa | 40–45 |
| 6–10 añosa | 45–50 |
| 10-18 añosa | 45–50 |
| >18 añosb | 50 |
Tabla 1: Profundidades de MCA a varias edades. Fuentes: a = Bode25, b = Alexandrov et al.10
Discusión
Los pasos críticos en el protocolo incluyen 1) encontrar el MCA, 2) colocar la diadema y 3) realizar la maniobra de contención de la respiración.
Las modificaciones pueden ser necesarias dependiendo de los sujetos en el estudio. Por ejemplo, los sujetos con enfermedad de Alzheimer pueden tener dificultades para seguir las instrucciones, lo que requiere el uso de un capnógrafo para garantizar el cumplimiento de las instrucciones de contención de la respiración15. Los niños pequeños pueden tener dificultades para seguir las instrucciones y pueden ser tímidos con el experimentador; por lo tanto, es posible que sea necesario simplificar los protocolos experimentales para dicha población (véase Lohmann et al.2). Es posible que también sea necesario cambiar ciertas configuraciones en la máquina TCD dependiendo de la población de interés. Por ejemplo, cuando los bebés insonantes, que tienen huesos craneales delgados, reducen la potencia tanto como sea posible, especialmente si el monitoreo de TCD se llevará a cabo durante un período que durará varias horas16.
La solución de problemas a menudo se centra en las dificultades para encontrar una señal espectral TCD buena y estable. Por ejemplo, para las personas mayores de 50 años, la ventana acústica temporal se hace cada vez más pequeña a medida que aumenta la edad debido al aumento de la porosidad del hueso del cráneo y tiende a localizarse en la región justo delante del oído (el "espacio intertragal")12. En tal población, encontrar una buena señal espectral MCA en ambos lados de la cabeza a veces puede ser imposible, y cambios muy leves en el ángulo o la posición del transductor pueden hacer que la señal se pierda. Debido a que una señal de buena calidad es esencial para los experimentos que dependen de la forma de onda de la envolvente para el análisis, se debe hacer todo lo posible para aumentar la intensidad y la calidad de la señal espectral MCA. Por ejemplo, la ganancia se puede ajustar para optimizar la señal, y el volumen de la muestra se puede aumentar para obtener una señal más fuerte. Como último recurso, el poder puede aumentar. Finalmente, es importante señalar que en aproximadamente el 10% de los pacientes, la ventana acústica temporal puede estar ausente11,17. La ventana acústica temporal se puede encontrar fácilmente en bebés y niños pequeños y es más difícil de encontrar en adultos mayores de 50 años.
Las limitaciones de fTCD incluyen la adquisición de información CBFV en una ubicación espacial17 en lugar de un amplio campo de visión, aunque con una resolución temporal muy alta. Así, la fTCD es un complemento de la fMRI, que proporciona información hemodinámica cerebral (y por tanto actividad neuronal) con un amplio campo de visión a una baja resolución temporal18,19. De hecho, fTCD tiene una resolución temporal comparable a la de fNIRS20,con la importante diferencia de que fTCD mide los cambios hemodinámicos a nivel de las principales arterias cerebrales, mientras que fNIRS mide los cambios en la corteza. Por lo tanto, fTCD puede completar detalles significativos sobre los cambios hemodinámicos cerebrales en respuesta a la activación neuronal, que ninguna otra modalidad de neuroimagen es actualmente capaz de medir.
Las aplicaciones potenciales de la TCD incluyen el monitoreo de la formación de émbolo cerebral durante la cirugía cardíaca16 y el monitoreo para detectar el resultado del tratamiento con activadores tisulares del plasminógeno para el accidente cerebrovascular21. Las aplicaciones potenciales de fTCD incluyen cualquier pregunta de investigación que involucre la respuesta neuronal a estímulos internos o externos, como el estudio del procesamiento lateralizado del lenguaje en el cerebro humano2,3,4,la estimulación somatosensorial del "tacto"5o la lateralización del procesamiento visual6. Además, la fTCD se puede utilizar para estudiar las respuestas fisiológicas (con o sin cambios en la actividad neuronal) a estímulos como el ejercicio22 y la contención de la respiración13,15,23. Finalmente, el bajo costo, la portabilidad y la simplicidad de fTCD hacen que las imágenes de un gran número de sujetos sean prácticas, una ventaja sobre fMRI y otras modalidades de neuroimagen como PET, por ejemplo, cuando se detec la enfermedad de Alzheimer preclínica15.
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Este proyecto se basa en una investigación que fue parcialmente apoyada por la Estación Experimental Agrícola de Nebraska con fondos de la Ley Hatch (Número de Acceso 0223605) a través del Instituto Nacional de Alimentos y Agricultura del USDA.
Materiales
| Name | Company | Catalog Number | Comments |
| Aquasonic | Parker Laboratories, Inc., Fairfield, NJ, USA | 01-50 | Ultrasound Gel |
| Doppler Box X | DWL Compumedics Gmbh, Singen, Germany | Model "BoxX" | Transcranial Doppler with 2-MHz monitoring probes |
| Kimwipes | Kimberly-Clark Professional | 34256 | Delicate Task Wipers |
| Transeptic | Parker Laboratories, Inc., Fairfield, NJ, USA | 09-25 | Cleaning Spray |
Referencias
- Buxton, R. B. The physics of functional magnetic resonance imaging (fMRI). Reports on Progress in Physics. 76 (9), 096601(2013).
- Lohmann, H., Dräger, B., Müller-Ehrenberg, S., Deppe, M., Knecht, S. Language lateralization in young children assessed by functional transcranial Doppler sonography. NeuroImage. 24 (3), 780-790 (2005).
- Knecht, S., et al. Noninvasive determination of language lateralization by functional transcranial Doppler sonography: a comparison with the Wada test. Stroke. 29 (1), 82-86 (1998).
- Knecht, S., et al. Successive activation of both cerebral hemispheres during cued word generation. Neuroreport. 7 (3), 820-824 (1996).
- Hage, B., Way, E., Barlow, S. M., Bashford, G. R. Real-time cerebral hemodynamic response to tactile somatosensory stimulation. Journal of Neuroimaging. 28 (6), 615-620 (2018).
- Hage, B., et al. Functional transcranial Doppler ultrasound for measurement of hemispheric lateralization during visual memory and visual search cognitive tasks. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 63 (12), 2001-2007 (2016).
- Meyer, G. F., Spray, A., Fairlie, J. E., Uomini, N. T. Inferring common cognitive mechanisms from brain blood-flow lateralization data: a new methodology for fTCD analysis. Frontiers in Psychology. 5, 552(2014).
- Uomini, N. T., Meyer, G. F. Shared brain lateralization patterns in language and Acheulean stone tool production: a functional transcranial Doppler ultrasound study. PLoS ONE. 8 (8), 72693(2013).
- Edvinsson, L., MacKenzie, E. T., McCulloch, J. Cerebral Blood Flow and Metabolism. , Raven Press, Ltd. New York, NY. (1993).
- Alexandrov, A. V., et al. Practice standards for transcranial Doppler ultrasound: part I--test performance. Journal of Neuroimaging. 17 (1), 11-18 (2007).
- Fujioka, K. A., Douville, C. M. Anatomy and freehand examination techniques. Transcranial Doppler. Newell, D. W., Aaslid, R. , Raven Press, Ltd. New York, NY. (1992).
- Alexandrov, A. V. Transcranial Doppler physics and techniques, lecture notes. American Society of Neuroimaging Conference. , deliverd 5 March (2020).
- Alwatban, M., Truemper, E. J., Al-rethaia, A., Murman, D. L., Bashford, G. R. The breath-hold acceleration index: a new method to evaluate cerebrovascular reactivity using transcranial Doppler. Journal of Neuroimaging. 28 (4), 429-435 (2018).
- Tiecks, F. P., et al. Effects of the Valsalva maneuver on cerebral circulation in healthy adults: a transcranial Doppler study. Stroke. 26 (8), 1386-1392 (1995).
- Alwatban, M., Murman, D. L., Bashford, G. Cerebrovascular reactivity impairment in preclinical Alzheimer's disease. Journal of Neuroimaging. 29 (4), 493-498 (2019).
- Twedt, M. H., et al. Most high-intensity transient signals are not associated with specific surgical maneuvers. World Journal for Pediatric and Congenital Heart Surgery. 11 (4), 401-408 (2020).
- Moehring, M. A., Spencer, M. P. Power M-mode Doppler (PMD) for observing cerebral blood flow and tracking emboli. Ultrasound in Medicine & Biology. 28 (1), 49-57 (2002).
- Poldrack, R. A. The future of fMRI in cognitive neuroscience. NeuroImage. 62 (2), 1216-1220 (2012).
- Oh, H., Custead, R., Wang, Y., Barlow, S. Neural encoding of saltatory pneumotactile velocity in human glabrous hand. PLoS ONE. 12 (8), 0183532(2017).
- Rosner, A. O., Barlow, S. M. Hemodynamic changes in cortical sensorimotor systems following hand and orofacial motor tasks and pulsed pneumotactile stimulation. Somatosensory & Motor Research. 33 (3-4), 145-155 (2016).
- Alexandrov, A. V., et al. High rate of complete recanalization and dramatic clinical recovery during tPA infusion when continuously monitored with 2-MHz transcranial doppler monitoring. Stroke. 31 (3), 610-614 (2000).
- Watt, B. P., Burnfield, J. M., Truemper, E. J., Buster, T. W., Bashford, G. R. Monitoring cerebral hemodynamics with transcranial Doppler ultrasound during cognitive and exercise testing in adults following unilateral stroke. 2012 IEEE Engineering in Medicine and Biology Society Annual Conference Proceedings. , San Diego, CA. 2310-2313 (2012).
- Markus, H. S., Harrison, M. J. Estimation of cerebrovascular reactivity using transcranial Doppler, including the use of breath-holding as the vasodilatory stimulus. Stroke. 23 (5), 668-673 (1992).
- File:Circle of Willis en.svg. . Wikimedia Commons, the free media repository. , Available from: https://commons.wikimedia.org/w/index.php?title=File:Circle_of_Willis_en.svg (2020).
- Bode, H. Pediatric Applications of Transcranial Doppler Sonography. , Springer-Verlag. Wien. (1988).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados