Method Article
Échographie Doppler transcrânienne fonctionnelle pour la surveillance du flux sanguin cérébral
Dans cet article
Résumé
L’échographie Doppler transcrânienne fonctionnelle complète d’autres modalités d’imagerie fonctionnelle, avec sa mesure à haute résolution temporelle des changements induits par le stimulus dans le flux sanguin cérébral dans les artères cérébrales basales. Cet article sur les méthodes donne des instructions étape par étape pour l’utilisation de l’échographie Doppler transcrânienne fonctionnelle pour effectuer une expérience d’imagerie fonctionnelle.
Résumé
L’échographie Doppler transcrânienne fonctionnelle (dtst partie) est l’utilisation de l’échographie Doppler transcrânienne (TCD) pour étudier l’activation neuronale se produisant lors de stimuli tels que le mouvement physique, l’activation de capteurs tactiles dans la peau et la visualisation d’images. L’activation neuronale est déduite d’une augmentation de la vitesse du flux sanguin cérébral (CBFV) alimentant la région du cerveau impliquée dans le traitement de l’entrée sensorielle. Par exemple, la visualisation de la lumière vive provoque une augmentation de l’activité neuronale dans le lobe occipital du cortex cérébral, entraînant une augmentation du flux sanguin dans l’artère cérébrale postérieure, qui alimente le lobe occipital. Dans la dts fTCD, les changements dans le CBFV sont utilisés pour estimer les changements dans le flux sanguin cérébral (CBF).
Avec sa mesure à haute résolution temporelle des vitesses du flux sanguin dans les principales artères cérébrales, la dts fTCD complète d’autres techniques d’imagerie fonctionnelle établies. L’objectif de cet article sur les méthodes est de donner des instructions étape par étape pour l’utilisation de la dts fTCD pour effectuer une expérience d’imagerie fonctionnelle. Tout d’abord, les étapes de base pour identifier l’artère cérébrale moyenne (MCA) et optimiser le signal seront décrites. Ensuite, le placement d’un dispositif de fixation pour maintenir la sonde TCD en place pendant l’expérience sera décrit. Enfin, l’expérience de maintien de la respiration, qui est un exemple spécifique d’expérience d’imagerie fonctionnelle utilisant la dts fTCD, sera démontrée.
Introduction
Dans la recherche en neurosciences, il est souvent souhaitable de surveiller l’activité cérébrale en temps réel de manière non invasive dans divers environnements. Cependant, les modalités conventionnelles de neuroimagerie fonctionnelle ont des limites qui entravent la capacité de capturer des changements d’activité localisés et / ou rapides. La résolution temporelle réelle (non agitée, non rétrospective) de l’imagerie par résonance magnétique fonctionnelle (IRMf) est actuellement de l’ordre de quelques secondes1, qui peut ne pas capturer les changements hémodynamiques transitoires liés à l’activation neuronale transitoire. Dans un autre exemple, bien que la spectroscopie fonctionnelle dans le proche infrarouge (fNIRS) ait une résolution temporelle élevée (millisecondes) et une résolution spatiale raisonnable, elle ne peut sonder que les changements hémodynamiques dans le cortex cérébral et ne peut pas fournir d’informations sur les changements qui se produisent dans les grandes artères alimentant le cerveau.
En revanche, la dts fTC – classée comme une modalité de neuroimagerie – « imagerie » fait référence aux dimensions du temps et de l’espace, plutôt qu’à deux directions spatiales orthogonales qui sont plus familières dans une « image ». La dts fTCD fournit des informations complémentaires à d’autres modalités de neuroimagerie en mesurant les changements hémodynamiques à haute résolution temporelle (généralement 10 ms) à des endroits précis dans les vaisseaux de la circulation cérébrale basale. Comme avec d’autres modalités de neuroimagerie, la dts fTCD peut être utilisée pour une variété d’expériences telles que l’étude de la latéralisation de l’activation cérébrale pendant les tâches liées au langage2,3,4, l’étude de l’activation neuronale en réponse à divers stimuli somatosensoriels5, et l’exploration de l’activation neuronale dans divers stimuli cognitifs tels que les tâches visuelles6, les tâchesmentales 7, et même la production d’outils8.
Bien que la dts fTCD offre plusieurs avantages pour une utilisation en imagerie fonctionnelle, notamment le faible coût de l’équipement, la portabilité et une sécurité accrue (par rapport au test Wada3 ou à la tomographie par émission de positons [TEP]), le fonctionnement d’un appareil TCD nécessite des compétences acquises par la pratique. Certaines de ces compétences, qui doivent être apprises par un opérateur TCD, comprennent la capacité d’identifier diverses artères cérébrales et les habiletés motrices nécessaires pour manipuler avec précision la sonde à ultrasons lors de la recherche de l’artère concernée. L’objectif de cet article sur les méthodes est de présenter une technique d’utilisation de la dts fTC pour effectuer une expérience d’imagerie fonctionnelle. Tout d’abord, les étapes de base pour identifier et optimiser le signal du MCA, qui perfuse 80% de l’hémisphère cérébral9, seront répertoriées. Ensuite, le placement d’un dispositif de fixation pour maintenir la sonde TCD en place pendant l’expérience sera décrit. Enfin, l’expérience de maintien de la respiration, qui est un exemple d’expérience d’imagerie fonctionnelle utilisant la dts fTCD, sera décrite et des résultats représentatifs seront présentés.
Protocole
Toutes les recherches sur des sujets humains ont été effectuées conformément au Comité d’examen institutionnel de l’Université du Nebraska-Lincoln, et le consentement éclairé a été obtenu de tous les sujets.
1. Localisation du signal MCA par TCD à main levée
REMARQUE: TcD « à main levée » fait référence au fonctionnement du TCD avec un transducteur portable pour trouver un signal CBFV avant de commencer une expérience fTCD.
- Définition des paramètres TCD
- Maintenez la puissance à une valeur raisonnablement élevée (p. ex., 400 mW) pendant la recherche initiale du MCA. Une fois le signal MCA localisé, réduisez la puissance autant que possible tout en maintenant un « bon » signal (voir étape 2.2.7).
REMARQUE: L’utilisation d’une puissance raisonnablement élevée lors de la recherche initiale ne viole pas le principe ALARA (As Low As Reasonably Achievable) de l’exposition au rayonnement acoustique, car une puissance plus élevée permettra de découvrir le signal MCA plus rapidement10. - Réglez le volume de l’échantillon sur 8–12 mm lors de la recherche initiale du signal MCA. Si le signal est difficile à trouver, augmentez la taille de la porte pour augmenter l’intensité du signal, mais notez que cela peut incorporer le signal d’une ou plusieurs artères voisines dans le signal du MCA.
- Réglez le gain à un niveau moyen, dans le but de « garder le bruit de fond au minimum, mais présent »10.
- Réglez la coupure du filtre passe-haut (normalement appelée « seuil ») sur 50 à 150 Hz.
- Si le sujet est un adulte, réglez la profondeur sur 50 mm, qui est la profondeur moyenne du point médian du segment M1 du MCA10 (Figure 1).
REMARQUE : Ce paramètre sera abordé plus en détail dans les étapes suivantes. Les paramètres de profondeur pour les enfants sont donnés dans le tableau 1.
- Maintenez la puissance à une valeur raisonnablement élevée (p. ex., 400 mW) pendant la recherche initiale du MCA. Une fois le signal MCA localisé, réduisez la puissance autant que possible tout en maintenant un « bon » signal (voir étape 2.2.7).

Figure 1: Représentation du cercle de Willis et des principales artères du système circulatoire cérébral. La bifurcation de l’ICA en ACA et MCA est marquée d’un cercle noir. Le segment M1 du MCA est montré. Ce chiffre a été modifié à partir de24. Abréviations : ACA = artère cérébrale antérieure; Bif. = bifurcation; ICA = artère carotide interne; MCA = artère cérébrale moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Localisation de la fenêtre temporelle
REMARQUE: La fenêtre temporale, également appelée fenêtre acoustique transtemporale, est une partie du crâne où l’os est le plus mince11, permettant ainsi la transmission de l’énergie ultrasonore basse fréquence à travers le crâne (Figure 2).- Pour les nourrissons et les jeunes enfants, localisez la fenêtre temporale juste devant l’oreille (l'«espace intertragal ») et au-dessus du bord rostral de l’arc zygomatique, qui peut être facilement ressenti sous la peau.
- Pour les adolescents et les jeunes adultes, localisez la fenêtre temporelle via l’une des sous-fenêtres.
REMARQUE: La sous-fenêtre postérieure fournit généralement le meilleur signal (Figure 2). - Pour les adultes âgés de 30 ans ou plus, localisez la fenêtre temporale juste devant l’oreille.
REMARQUE: La fenêtre acoustique diminue en taille à mesure que les gens vieillissent en raison de l’augmentation de la porosité de l’os du crâne, ce qui fait que certaines personnes âgées ont une fenêtre temporelle très limitée12. Chez de telles personnes, l’insonation bilatérale du MCA est parfois impossible.

Figure 2: La fenêtre transtemporelle (marquée par l’ellipse pointillée), l’arc zygomatique (flèche) et les sous-fenêtres11. (A) Sous-fenêtre frontale. (B) Sous-fenêtre antérieure. (C) Sous-fenêtre centrale. (D) Sous-fenêtre postérieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Application du transducteur
- Appliquez suffisamment de gel à ultrasons pour couvrir la surface du transducteur.
REMARQUE: Lorsqu’il est placé sur la tête, le gel doit couvrir suffisamment d’espace pour maintenir une étanchéité entre le cuir chevelu et la surface de la sonde Doppler, empêchant ainsi l’interruption du signal du couplage d’air sous la surface de la sonde. - Avertissez le sujet que le gel peut être froid (s’il est à température ambiante).
- Placez le transducteur sur la fenêtre temporelle, qui se trouvait à la section 1.2.
- Appliquez suffisamment de gel à ultrasons pour couvrir la surface du transducteur.
- Recherche du MCA
- Après avoir placé le transducteur sur le cuir chevelu, recherchez le signal MCA, qui sera généralement situé légèrement antérieur (vers l’avant) et rostral (vers la tête) à partir de l’emplacement du placement initial du cuir chevelu du transducteur10.
- Si le signal spectral TCD n’est pas immédiatement évident, ajustez l’angle du transducteur tout en le gardant au même endroit par rapport au cuir chevelu. Inclinez lentement la sonde du rostral au caudal (vers les pieds) et postérieur à antérieur.
REMARQUE : La figure 3 montre deux spectres pris à partir de la même position, mais sous des angles différents. - Si un signal est toujours absent après avoir effectué l’étape 1.4.2, vérifiez l’affichage couleur en mode M pour le flux dans le MCA à différentes profondeurs (indiqué par une coloration rouge). Incrémentez ou décrémentez la profondeur du signal par pas de 5 mm et recherchez comme décrit à l’étape 1.4.2. Si l’écoulement est visible en mode M mais pas dans le spectre Doppler, augmentez ou diminuez la profondeur jusqu’à ce que le signal d’écoulement soit visible dans le spectre Doppler.
- Si un signal satisfaisant n’est toujours pas obtenu, déplacez le transducteur à une position proche sur le cuir chevelu, qui est légèrement plus antérieure, et répétez les étapes 1.4.1 à 1.4.3.
- Lorsqu’un signal MCA optimal est obtenu, notez la profondeur et la vitesse maximale.
- À l’aide d’un stylo de maquillage lavable, placez une marque sur le cuir chevelu (partie trace du bord du transducteur) où le signal optimal a été trouvé.

Figure 3: Échantillon de spectres Doppler et d’images en mode M à partir du point médian du segment M1 du MCA. (A) Spectre pris juste après l’application du transducteur sur la fenêtre temporelle, juste devant l’oreille. (B) Échantillonner le spectre Doppler au même endroit et à la même profondeur que (A). Le seul changement est que le transducteur a été légèrement incliné vers le haut (de manière supérieure). Dans les deux (A) et (B), profondeur = 50 mm, gain = 50, volume de l’échantillon = 12 mm, puissance = 420 mW/cm2et filtre = 100 Hz. Veuillez cliquer ici pour afficher une version plus grande de cette figure.
- À la recherche de la bifurcation
REMARQUE: Trouver la bifurcation de l’artère carotide interne (ICA) est important pour aider à confirmer que le MCA est l’artère surveillée. Cette étape doit être effectuée des deux côtés si une surveillance bilatérale est effectuée, car la bifurcation peut ne pas être à la même profondeur des deux côtés.- Augmenter la profondeur jusqu’à ce que le signal de la bifurcation de l’ICA dans le MCA et l’ACA soit noté(Figure 4),généralement à une profondeur de 51–65 mm10.
- Rechercher le signal spectral de bifurcation optimal à l’aide de la procédure décrite à l’étape 1.4.2. Efforcez-vous toujours d’obtenir le signal spectral le plus rapide possible10.
- Lorsqu’un signal de bifurcation optimal est obtenu, notez la profondeur de la bifurcation.
- Pour la surveillance bilatérale, répétez les sections 1.1 à 1.4 et les étapes 1.5.1 à 1.5.3 de l’autre côté de la tête.
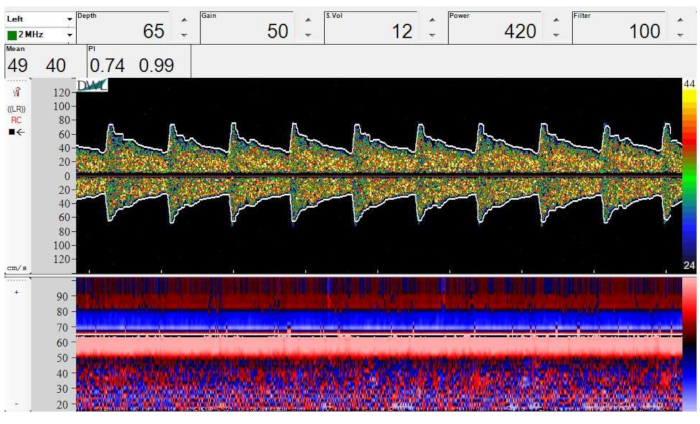
Figure 4: Image spectrale Doppler (en haut) et en mode M (en bas) de la bifurcation de l’ICA dans le MCA et l’ACA. Profondeur = 65 mm, gain = 50, volume de l’échantillon = 12 mm, puissance = 420 mW/cm2et filtre = 100 Hz. Veuillez cliquer ici pour voir une version plus grande de cette figure.
2. Déplacement du MCA après avoir placé un dispositif de fixation
REMARQUE: Pour les expériences fTCD, il est nécessaire de surveiller le CBFV pendant 10 à 90 minutes ou plus. Par conséquent, un dispositif de fixation(Figure 5)est crucial pour assurer la stabilité.
- Placer le dispositif de fixation
- Par inspection visuelle, ajustez le dispositif de fixation(Figure 5)à la taille approximative de la tête du sujet.
- Alertez le sujet avant de placer le casque sur sa tête. Placez le casque sur la tête du sujet.
REMARQUE: Si le sujet a les cheveux longs ou épais, il peut être nécessaire d’attacher les cheveux du sujet en arrière, en fonction du dispositif de fixation utilisé. - Ajustez l’ajustement du dispositif de fixation et demandez au sujet si l’appareil est trop serré.
REMARQUE: L’appareil doit être suffisamment serré pour ne pas bouger lorsqu’il est légèrement heurté, mais suffisamment lâche pour que le sujet ne soit pas inconfortable.
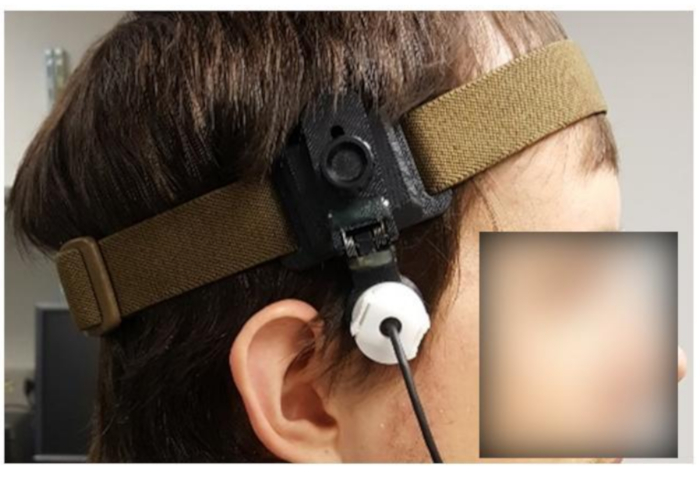
Figure 5: Sujet portant un dispositif de fixation personnalisé. Veuillez cliquer ici pour afficher une version agrandie de cette figure.
- Localisation du signal MCA
- Desserrez le mécanisme du dispositif de fixation qui maintient le transducteur en place (par exemple, desserrez le mécanisme, illustré à la figure 5, en tournant un bouton dans le sens inverse des aiguilles d’une montre) afin que le transducteur puisse se déplacer librement.
- Avertissez le sujet avant d’appliquer le gel sur les transducteurs (qui doivent déjà être en place à partir de la rubrique 2.1), et que le gel peut être froid (s’il a été conservé à température ambiante).
- Appliquez suffisamment de gel à ultrasons sur le transducteur pour couvrir la face du transducteur.
- Réglez le dispositif de fixation de manière à ce que le transducteur soit situé au-dessus de la marque faite à l’étape 1.4.6.
- Recherchez le signal spectral MCA optimal à l’aide de la procédure décrite aux étapes 1.4.1 à 1.4.3. Efforcez-vous toujours d’obtenir le signal spectral le plus rapide possible10.
REMARQUE: Par rapport au TCD à main levée, la profondeur optimale à laquelle le MCA est situé à l’aide du dispositif de fixation peut différer légèrement (au plus 1 à 2 mm) de la profondeur du dispositif à main levée. En effet, le dispositif de fixation peut maintenir le transducteur légèrement plus loin du cuir chevelu tout en maintenant un joint de gel de couplage. - Lorsque le signal spectral MCA optimal est trouvé, serrez le mécanisme du dispositif de fixation pour verrouiller le transducteur en place. Notez la profondeur et tous les autres paramètres.
- Diminuez la puissance (voir étape 1.1.1) autant que possible tout en maintenant une enveloppe spectrale qui trace la vitesse maximale avec précision.
- Pour la surveillance bilatérale,répétez les étapes 2.2.1 à 2.2.7 de l’autre côté.
3. Effectuer une manœuvre de maintien de la respiration
REMARQUE : Cette section est donnée à titre d’exemple d’expérience fonctionnelle qui peut être effectuée à l’aide de la configuration expérimentale décrite dans les sections 1 et 2.
- Effectuez toutes les étapes décrites dans les sections 1 et 2.
- Commencez l’enregistrement sur le logiciel TCD.
- Respirez normalement pendant 3 minutes pour obtenir un bon enregistrement de base et permettre au CBFV de se stabiliser à partir de toute expérience ou stimulation précédente.
- Compte à rebours lentement à partir de trois. Sur le compte d’un, demandez au sujet de commencer à retenir son souffle en suivant une inspiration normale13.
REMARQUE: Le sujet ne doit pas inhaler profondément, car cela diminuerait le dioxyde de carbone dans les poumons et diminuerait la probabilité d’observer l’augmentation du CBFV due à la réactivité cérébrovasculaire. Le sujet doit également éviter d’effectuer une manœuvre de Valsalva, dans laquelle la pression intrathoracique est considérablement augmentée contre une inspiration retenue14. - Placez un marqueur dans l’enregistrement TCD pour signifier le début de la rétention de la respiration.
- Demandez au sujet de retenir son souffle pendant 30 s, ou jusqu’à ce qu’il ne soit plus à l’aise de retenir son souffle.
- Lorsque le sujet inspire, placez un marqueur dans l’enregistrement TCD pour signifier la fin de la rétention de la respiration.
- Continuer à surveiller le CBFV à l’aide de la TCD et à enregistrer pendant au moins 30 s après la fin de la rétention de l’haleine pour s’assurer que le CBFV revient aux valeurs de référence.
Résultats
La figure 3 montre des échantillons de spectres Doppler et de modes M de couleur à partir du point médian du segment M1 du MCA. Figure 3A,B ont été prises à la même position sur le cuir chevelu, mais sous des angles différents. Notez comment un très petit changement d’angle, sans changer la position de contact sur le cuir chevelu,peut grandement améliorer la force du signal Doppler, comme le montre la coloration jaune de plus haute intensité du spectrogramme dans la figure 3B. Notez également que le mode M de la figure 3B montre deux artères (bleues et rouges, correspondant respectivement à l’ACA et au MCA).
La figure 4 montre un échantillon du spectre Doppler et du mode M de la bifurcation de l’ICA dans l’ACA et le MCA. Notez les régions rouges et bleues qui se chevauchent dans l’image en mode M indiquant le MCA et l’ACA, respectivement. Notez également la symétrie de la forme d’onde spectrale Doppler lorsque vous comparez le flux vers le transducteur (positif) avec l’écoulement loin du transducteur (négatif).
La figure 6 montre des spectres d’échantillon et des images en mode M de différents points temporels de la manœuvre de maintien de la respiration. La figure 6A montre le spectre TCD de base et le mode M au début de la rétention de l’haleine. Notez la vitesse moyenne de 56 cm/s. La figure 6B montre le spectre TCD et le mode M à la fin de la rétention de la respiration. Notez que la vitesse moyenne est maintenant passée à 70 cm/s. La figure 6C montre le spectre TCD et le mode M après la fin de la respiration. Notez la sous-vitesse en dessous des valeurs de référence, la moyenne tombant à 47 cm/s. Notez que l’ACA est visible sous forme d’écoulement loin du transducteur dans les spectres Doppler.
La figure 7 montre l’ensemble de l’expérience de maintien de la respiration. Notez que l’enveloppe reste élevée pendant environ 15 s après la fin de la rétention de la respiration, tombe à des valeurs inférieures à celles du début de la rétention de la respiration pendant environ 20 s, puis revient finalement aux valeurs de référence. Notez que l’ACA est visible sous forme de flux éloigné du transducteur dans le spectre Doppler.
La figure 6 et la figure 7 montrent une bonne intensité du signal dans la partie MCA du spectre TCD (le MCA est représenté par les vitesses positives); notez comment la ligne blanche qui représente l’enveloppe suit très précisément le spectre TCD lorsque le spectre est lumineux. Les spectres des figures 6 et 7 pourraient être améliorés en diminuant la profondeur de surveillance de 5 à 10 mm afin que la partie ACA du spectre TCD ne soit pas visible (l’ACA est représentée par des vitesses négatives) et en modifiant l’échelle de l’axe vertical dans le spectre TCD pour passer d’environ -100 cm/s à 100 cm/s, ce qui permettrait un échantillonnage à vitesse maximale du spectre TCD dans la direction verticale.
La figure 8 montre des exemples de spectres TCD bilatéraux et de modes M adaptés à la dtsation fTC bilatérale. La figure 8A et la figure 8B montrent des spectres bilatéraux et des modes M acceptables, mais pas optimaux. Notez comment le gain est plus élevé dans la figure 8A (MCA gauche) que dans la figure 8B (MCA droit) pour compenser le signal plus faible, et comment la qualité de l’enveloppe dans la figure 8A est légèrement inférieure à celle de la figure 8B. Notez également que la vitesse maximale à la systole de la figure 8A est légèrement inférieure à celle de la figure 8B. En revanche, notez comment les deux spectres de la figure 8C et de la figure 8D sont très similaires en termes de paramètres, y compris la profondeur, le gain, la puissance et le volume de l’échantillon, et comment les formes d’onde spectrales des deux côtés ont des vitesses et des formes maximales similaires. Pour y remédier, il est recommandé que le spectre du MCA gauche soit systématiquement placé dans la fenêtre gauche et le spectre du MCA droit dans la fenêtre droite, en particulier pour les expériences impliquant une latéralisation du flux sanguin.

Figure 6: Échantillon de spectres Doppler et d’images en mode M du MCA au cours des différentes étapes de la manœuvre de maintien de la respiration. (A) Spectre et mode M au début de la respiration. La ligne jaune verticale au centre indique le début de la rétention du souffle. (B) Spectre et mode M à la fin de la respiration. La ligne jaune verticale au centre indique la fin de la respiration lorsque le sujet inspire. (C) Spectre et mode M après la fin de la rétention de la respiration, montrant la diminution de la vitesse d’écoulement qui persiste pendant environ 30 s après la rétention de la respiration. Dans tous les spectres, profondeur = 56 mm, gain = 50, volume de l’échantillon = 8 mm, puissance = 420 mW/cm2et filtre = 100 Hz. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 7: Spectre et mode M du MCA tout au long de la respiration. Profondeur = 56 mm, gain = 50, volume de l’échantillon = 8 mm, puissance = 420 mW/cm2et filtre = 100 Hz. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 8: Exemples de spectres bilatéraux et d’images en mode M du MCA. (A) Spectre acceptable, mais non optimal, et mode M du MCA gauche, avec profondeur = 62 mm, gain = 69, volume de l’échantillon = 12 mm, puissance = 420 mW/cm2, et filtre = 100 Hz. (B) Bon spectre et mode M du MCA droit, avec profondeur = 62 mm, gain = 56, volume de l’échantillon = 12 mm, puissance = 420 mW/cm2, et filtre = 100 Hz. (C) Bon spectre et mode M du MCA gauche. (D) Bon spectre et mode M du bon MCA. Pour les deux (C) et (D), profondeur = 62 mm, gain = 56, volume de l’échantillon = 12, puissance = 420 mW/cm2et filtre = 100 Hz. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Âge | Profondeur de l’artère cérébrale moyenne (mm) |
| 0–3 moispar mois | 25 |
| 3 à 12 moispar mois | 30 |
| 1 à 3 anspar an | 35–45 |
| 3 à 6 anspar an | 40–45 |
| 6 à 10 ansa | 45–50 |
| 10 à 18 ansa | 45–50 |
| >18 ansb | 50 |
Tableau 1 : Profondeurs du MCA à différents âges. Sources : a = Bode25, b = Alexandrov et al.10
Discussion
Les étapes critiques du protocole comprennent 1) la recherche du MCA, 2) le placement du bandeau et 3) l’exécution de la manœuvre de maintien de la respiration.
Des modifications peuvent être nécessaires en fonction des sujets de l’étude. Par exemple, les sujets atteints de la maladie d’Alzheimer peuvent avoir de la difficulté à suivre les instructions, ce qui nécessite l’utilisation d’un capnographe pour assurer le respect des instructions de maintien de l’haleine15. Les jeunes enfants peuvent avoir de la difficulté à suivre les instructions et peuvent être timides à l’éventreur; par conséquent, les protocoles expérimentaux peuvent devoir être simplifiés pour une telle population (voir Lohmann et al.2). Certains paramètres de la machine TCD peuvent également devoir être modifiés en fonction de la population d’intérêt. Par exemple, lors de l’insonation des nourrissons, qui ont des os crâniens minces, réduisez la puissance autant que possible, surtout si la surveillance tcD aura lieu sur une période de plusieurs heures16.
Le dépannage est souvent centré sur les difficultés à trouver un bon signal spectral TCD stable. Par exemple, pour les personnes âgées de plus de 50 ans, la fenêtre acoustique temporale devient de plus en plus petite à mesure que l’âge augmente en raison de l’augmentation de la porosité de l’os du crâne et tend à se localiser dans la région juste devant l’oreille (l'« espace intertragal»)12. Dans une telle population, trouver un bon signal spectral MCA des deux côtés de la tête peut parfois être impossible, et de très légers changements dans l’angle ou la position du transducteur peuvent entraîner la perte du signal. Parce qu’un signal de bonne qualité est essentiel pour les expériences qui dépendent de la forme d’onde de l’enveloppe pour l’analyse, tous les efforts doivent être faits pour augmenter l’intensité et la qualité du signal spectral MCA. Par exemple, le gain peut être ajusté pour optimiser le signal, et le volume de l’échantillon peut être augmenté pour obtenir un signal plus fort. En dernier recours, la puissance peut être augmentée. Enfin, il est important de noter que chez environ 10% des patients, la fenêtre acoustique temporale peut être absente11,17. La fenêtre acoustique temporale peut être facilement trouvée chez les nourrissons et les jeunes enfants et est plus difficile à trouver chez les adultes de plus de 50 ans.
Les limites de la dts fTC comprennent l’acquisition d’informations CBFV à un emplacement spatial17 plutôt qu’à un large champ de vision, bien qu’avec une résolution temporelle très élevée. Ainsi, la fTCD est un complément à l’IRMf, qui donne des informations hémodynamiques cérébrales (et donc une activité neuronale) avec un large champ de vision à une faible résolution temporelle18,19. En effet, la fTCD a une résolution temporelle comparable à celle de fNIRS20,à la différence importante que la fTCD mesure les changements hémodynamiques au niveau des principales artères cérébrales, alors que la fNIRS mesure les changements dans le cortex. Par conséquent, la dts fTCD peut remplir des détails importants sur les changements hémodynamiques cérébraux en réponse à l’activation neuronale, qu’aucune autre modalité de neuroimagerie n’est actuellement capable de mesurer.
Les applications potentielles de la TCD comprennent la surveillance de la formation d’embolies cérébrales pendant la chirurgie cardiaque16 et la surveillance pour détecter le résultat du traitement par activateur tissulaire du plasminogène pour l’AVC21. Les applications potentielles de la fTCD comprennent toute question de recherche impliquant la réponse neuronale à des stimuli internes ou externes, telles que l’étude du traitement latéralisé du langage dans le cerveau humain2,3,4, la stimulation somatosensorielle du « toucher »5, ou la latéralisation du traitement visuel6. En outre, la dts fTCD peut être utilisée pour étudier les réponses physiologiques (avec ou sans changements d’activité neuronale) à des stimuli tels que l’exercice22 et la rétention de la respiration13,15,23. Enfin, le faible coût, la portabilité et la simplicité de la dtsf rendent l’imagerie d’un grand nombre de sujets pratique, un avantage par rapport à l’IRMf et à d’autres modalités de neuroimagerie telles que la TEP, par exemple lors du dépistage de la maladie d’Alzheimer préclinique15.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce projet est basé sur des recherches qui ont été partiellement soutenues par la Nebraska Agricultural Experiment Station avec un financement de la Loi Hatch (numéro d’acquisition 0223605) par l’intermédiaire de l’Institut national de l’alimentation et de l’agriculture de l’USDA.
matériels
| Name | Company | Catalog Number | Comments |
| Aquasonic | Parker Laboratories, Inc., Fairfield, NJ, USA | 01-50 | Ultrasound Gel |
| Doppler Box X | DWL Compumedics Gmbh, Singen, Germany | Model "BoxX" | Transcranial Doppler with 2-MHz monitoring probes |
| Kimwipes | Kimberly-Clark Professional | 34256 | Delicate Task Wipers |
| Transeptic | Parker Laboratories, Inc., Fairfield, NJ, USA | 09-25 | Cleaning Spray |
Références
- Buxton, R. B. The physics of functional magnetic resonance imaging (fMRI). Reports on Progress in Physics. 76 (9), 096601(2013).
- Lohmann, H., Dräger, B., Müller-Ehrenberg, S., Deppe, M., Knecht, S. Language lateralization in young children assessed by functional transcranial Doppler sonography. NeuroImage. 24 (3), 780-790 (2005).
- Knecht, S., et al. Noninvasive determination of language lateralization by functional transcranial Doppler sonography: a comparison with the Wada test. Stroke. 29 (1), 82-86 (1998).
- Knecht, S., et al. Successive activation of both cerebral hemispheres during cued word generation. Neuroreport. 7 (3), 820-824 (1996).
- Hage, B., Way, E., Barlow, S. M., Bashford, G. R. Real-time cerebral hemodynamic response to tactile somatosensory stimulation. Journal of Neuroimaging. 28 (6), 615-620 (2018).
- Hage, B., et al. Functional transcranial Doppler ultrasound for measurement of hemispheric lateralization during visual memory and visual search cognitive tasks. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 63 (12), 2001-2007 (2016).
- Meyer, G. F., Spray, A., Fairlie, J. E., Uomini, N. T. Inferring common cognitive mechanisms from brain blood-flow lateralization data: a new methodology for fTCD analysis. Frontiers in Psychology. 5, 552(2014).
- Uomini, N. T., Meyer, G. F. Shared brain lateralization patterns in language and Acheulean stone tool production: a functional transcranial Doppler ultrasound study. PLoS ONE. 8 (8), 72693(2013).
- Edvinsson, L., MacKenzie, E. T., McCulloch, J. Cerebral Blood Flow and Metabolism. , Raven Press, Ltd. New York, NY. (1993).
- Alexandrov, A. V., et al. Practice standards for transcranial Doppler ultrasound: part I--test performance. Journal of Neuroimaging. 17 (1), 11-18 (2007).
- Fujioka, K. A., Douville, C. M. Anatomy and freehand examination techniques. Transcranial Doppler. Newell, D. W., Aaslid, R. , Raven Press, Ltd. New York, NY. (1992).
- Alexandrov, A. V. Transcranial Doppler physics and techniques, lecture notes. American Society of Neuroimaging Conference. , deliverd 5 March (2020).
- Alwatban, M., Truemper, E. J., Al-rethaia, A., Murman, D. L., Bashford, G. R. The breath-hold acceleration index: a new method to evaluate cerebrovascular reactivity using transcranial Doppler. Journal of Neuroimaging. 28 (4), 429-435 (2018).
- Tiecks, F. P., et al. Effects of the Valsalva maneuver on cerebral circulation in healthy adults: a transcranial Doppler study. Stroke. 26 (8), 1386-1392 (1995).
- Alwatban, M., Murman, D. L., Bashford, G. Cerebrovascular reactivity impairment in preclinical Alzheimer's disease. Journal of Neuroimaging. 29 (4), 493-498 (2019).
- Twedt, M. H., et al. Most high-intensity transient signals are not associated with specific surgical maneuvers. World Journal for Pediatric and Congenital Heart Surgery. 11 (4), 401-408 (2020).
- Moehring, M. A., Spencer, M. P. Power M-mode Doppler (PMD) for observing cerebral blood flow and tracking emboli. Ultrasound in Medicine & Biology. 28 (1), 49-57 (2002).
- Poldrack, R. A. The future of fMRI in cognitive neuroscience. NeuroImage. 62 (2), 1216-1220 (2012).
- Oh, H., Custead, R., Wang, Y., Barlow, S. Neural encoding of saltatory pneumotactile velocity in human glabrous hand. PLoS ONE. 12 (8), 0183532(2017).
- Rosner, A. O., Barlow, S. M. Hemodynamic changes in cortical sensorimotor systems following hand and orofacial motor tasks and pulsed pneumotactile stimulation. Somatosensory & Motor Research. 33 (3-4), 145-155 (2016).
- Alexandrov, A. V., et al. High rate of complete recanalization and dramatic clinical recovery during tPA infusion when continuously monitored with 2-MHz transcranial doppler monitoring. Stroke. 31 (3), 610-614 (2000).
- Watt, B. P., Burnfield, J. M., Truemper, E. J., Buster, T. W., Bashford, G. R. Monitoring cerebral hemodynamics with transcranial Doppler ultrasound during cognitive and exercise testing in adults following unilateral stroke. 2012 IEEE Engineering in Medicine and Biology Society Annual Conference Proceedings. , San Diego, CA. 2310-2313 (2012).
- Markus, H. S., Harrison, M. J. Estimation of cerebrovascular reactivity using transcranial Doppler, including the use of breath-holding as the vasodilatory stimulus. Stroke. 23 (5), 668-673 (1992).
- File:Circle of Willis en.svg. . Wikimedia Commons, the free media repository. , Available from: https://commons.wikimedia.org/w/index.php?title=File:Circle_of_Willis_en.svg (2020).
- Bode, H. Pediatric Applications of Transcranial Doppler Sonography. , Springer-Verlag. Wien. (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon