Method Article
Esempio di metodo di preparazione del microscopio elettronico di scansione e trasmissione per le appendici di Woodboring Beetle
In questo articolo
Riepilogo
Per osservare l'ultrastruttura della sensilla degli insetti, nello studio è stata presentata la microscopia elettronica di scansione e trasmissione (rispettivamente SEM e TEM). Tween 20 è stato aggiunto nel fissativo per evitare la deformazione del campione nella microscopia seM.
Abstract
Questo rapporto ha descritto i metodi di preparazione dei campioni che la scansione e le osservazioni al microscopio elettronico a trasmissione, dimostrati preparando le appendici del coleottero legnoso, Chlorophorus caragana Xie & Wang (2012), per entrambi i tipi di microscopia elettronica. Il protocollo di preparazione del campione di microscopia elettronica a scansione (SEM) si è basato sulla fissazione chimica del campione, sulla disidratazione in una serie di bagni di etanolo, sull'essiccazione e sul rivestimento sputter. Aggiungendo Tween 20 (Polyoxyethylene sorbitan laurate) al fissativo e alla soluzione di lavaggio, la superficie del corpo dell'insetto dello scarabeo legnoso è stata lavata in modo più pulito in SEM. La preparazione del campione di microscopia elettronica a trasmissione (TEM) di questo studio ha comportato una serie di passaggi, tra cui fissazione, disidratazione dell'etanolo, incorporamento in resina, posizionamento mediante microscopia a fluorescenza, sezionamento e colorazione. Fissativo con Tween 20 ha permesso di penetrare la parete del corpo degli insetti di coleottero legnoso più facilmente di quanto lo sarebbe stato senza Tween 20, e successivamente tessuti e organi fissi migliori nel corpo, ha quindi prodotto osservazioni chiare al microscopio elettronico delle ultrastrutture della sensilla degli insetti. Il passo successivo di questa preparazione è stato determinare le posizioni della sensilla degli insetti nel campione incorporato nel blocco di resina utilizzando la microscopia a fluorescenza per aumentare la precisione del posizionamento della sensilla bersaglio. Questo ha migliorato la precisione di taglio.
Introduzione
La microscopia elettronica a scansione è uno strumento importante in molti studi di morfologia, che SEM mostra le strutture superficiali1,2. L'appeal della microscopia elettronica a trasmissione è che può essere utilizzata per studiare un'ampia gamma di strutture biologiche su scala nanometrica, dall'architettura delle cellule e l'ultrastruttura degli organelli, alla struttura dei complessi macromolecolari e delle proteine. TEM mostra le strutture interne3,4,5.
Coleoptera è il più grande gruppo di insetti, tra cui circa 182 famiglie e 350.000 specie. La maggior parte degli insetti coleopteraran, in particolare il coleottero che si nutre di piante, molte delle quali sono importanti parassiti di foreste e alberi da frutto, causando danni devastanti agli alberi6. Attualmente, la prevenzione e il controllo della popolazione di parassiti basati sulla teoria dell'ecologia chimica hanno ricevuto una crescente attenzione7. Metodi di controllo dei feromone efficienti, a basso tossico e privo di inquinamento sono diventati un modo efficaceper 8. Studiare la morfologia della sensilla e l'ultrastruttura degli insetti è una parte importante della ricerca sull'ecologia chimica degli insetti. La microscopia elettronica a scansione e trasmissione (rispettivamente SEM e TEM) viene utilizzata con grande effetto per studiarne la morfologia e l'anatomia interna. Tuttavia, durante la preparazione di campioni di insetti per la microscopia elettronica (EM), l'obiettività e l'autenticità del sito di osservazione possono essere influenzate9. In generale, la preparazione del campione SEM degli insetti richiede pulizia, fissazione dei tessuti, disidratazione, metatesi, essiccazione e rivestimento sputter10. A causa dell'ambiente complesso in cui vivono coleotteri in legno, la superficie del corpo ha spesso vari inquinanti e le loro appendici hanno spesso molti sensi o setole lunghe e fini. In particolare, alcuni boscaioli non sono disponibili dall'allevamento di laboratorio, che ha raccolto direttamente sul campo, per poi mettere in liquido di fissaggio per garantire freschezza e successivamente lavati in laboratorio. Se il campione viene prima fissato e poi lavato, ovviamente è molto più difficile rimuovere i detriti perché la glutaraldeide lo fissa fortemente al campione. Tween 20 è un surfactant11,12,13,14, che svolge un ruolo importante nel processo di lavaggio, tra cui la riduzione della tensione superficiale dell'acqua e il miglioramento della umidità dell'acqua sulla superficie del bucato. In questo studio, Tween 20 è stato aggiunto alla soluzione di fissaggio e alla soluzione di pulizia PBS per ridurre la tensione superficiale del liquido e impedire che lo sporco si depositi sulla superficie del corpo del coleottero che lavora, il che ha reso la superficie del corpo più pulita in SEM.
Utilizzando TEM, la sensilla su diversi organi di insetti può essere tagliata per rivelare le strutture chiare al loro interno, fornendo così una base per l'analisi delle funzioni di sensilla. Quando l'insetto soggetto, come il coleottero che lavora nel legno, è grande e la sua parete del corpo ha un notevole grado di sclerotizzazione, quindi il fissativo potrebbe non saturare completamente i tessuti dell'organo all'interno del corpo dell'insetto. Il Tween 20 può migliorare la dispersione e la capacità di sospensione dello sporco. In questo studio, Tween 20 è stato aggiunto al fissativo per migliorare la penetrazione del fluido fissativo nella parete del corpo dell'insetto dello scarabeo legnoso, evitando la deformazione e il collasso dell'epidermi11,12,13. Inoltre, utilizzando la tecnologia generale di affettatura, è difficile individuare con precisione diversi tipi di sensilla, in particolare per qualche piccola sensilla15. Basato sulla preparazione tradizionale del campione TEM, questo studio ha combinato la microscopia a fluorescenza e il SEM per determinare la posizione della sensilla degli insetti nel blocco incorporato, migliorando così la precisione di affettare.
Protocollo
INFORMATIVA: Consultare le schede tecniche di sicurezza dei materiali dei reagenti prima di utilizzarle. Molte delle sostanze chimiche utilizzate durante la preparazione del campione sono tossiche, mutageni, cancerogene e/o reprotossiche. Usa dispositivi di protezione personali (guanti, camice da laboratorio, pantaloni a figura intera e scarpe chiuse) e lavora sotto un cofano a fumi mentre maneggia il campione.
1. Preparazione e imaging dei campioni SEM
- Correzione e pulizia dei campioni
- Lavorando in una zona in cui si verifica C. caragana, attirare gli adulti in trappole da campo esche con attrattivi vegetali, come l'isoforone16. Conservare i corpi puliti di C. caragana adulto in 0,1 mol L-1 salina con buffer fosfato (PBS, pH 7,2), 2,5% (wt/vol) glutaraldedeide hyde (Anhydrous EM Grad) e 0.06% (vol/vol) Tween 20. Fissare il campione a 4 gradi centigradi durante il fine settimana.
- Rimuovere i corpi dal liquido di conservazione e risciacquare nel buffer di fosfato. Utilizzando uno stereoscopio, rimuovere le appendici e pulirle ultrasonicamente (40 kHz) in una soluzione di 0,1 l-1 salina con buffer fosfato (pH 7.2) con 0,06% (vol/vol) Tween 20 (PBST). Dopo la pulizia per 100 s, trasferire il campione al microscopio per verificare se era pulito. In circostanze normali, pulire per 400s per garantire che il campione era abbastanza pulito da osservare e non danneggiato.
- Esempio di disidratazione, montaggio e essiccazione
- Disidratare i campioni utilizzando 20 min trattamenti successivi nel 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100%, e 100% (tutti vol/vol) etanolo. Sotto uno stereoscopio, utilizzare il nastro adesivo a doppia lato in carbonio per fissare separatamente 3 superfici di osservazione (ventrale e laterale dorsale) su mozziconi. Si noti che tutte le superfici di visualizzazione devono essere mantenute pulite e prive di contaminazione. Mettere lo stadio di campionamento in una piastra di Petri contenente un desiccant di gel di silice per 48 h.
- Sputter-coat e inserimento del campione
- Utilizzando lo strumento di sputtering a ioni Hitachi Koki (E-1010), ruotare MAIN VALVE in posizione OPEN, rimuovere il coperchio della camera del campione e mettere il campione nella camera. Accendere l'interruttore POWER e la luce READY era accesa. Impostare Tempo di sputtering come 45 secondi, e lo spessore del rivestimento come 70.875 . Una volta che l'indice di composizione a vuoto della pompa meccanica è sceso sotto 7, premere DISCHARGE e iniziare a spruzzare il platino. Al termine dell'esperimento, spegnere l'alimentatore e estrarre il campione dalla camera. Spessore della pellicola spray: d : KIVt ("d" è lo spessore della pellicola nell'unità di " . " K" è una costante, a seconda del metallo sputtered e gas. Ad esempio, K di aria è 0,07; "I" è l'unità mA del flusso di plasma; "V" è la tensione applicata nell'unità di "KV". "t" è il tempo in secondi.
- Inserire lo stub contenente il campione sullo stage di SEM. Assicurarsi che lo stage campione con lo stub campione avesse un'altezza sufficiente per consentire una buona immagine. Aprire il software SEM e selezionare la tensione operativa desiderata, a partire da 20 kV.
2. Preparazione e imaging dei campioni TEM
- Ottenere e correggere l'esempio come nei passaggi 1.1.1 e 1.1.2.Obtain and fix the sample as in steps 1.1.1 and 1.2.
- Pulizia, fissazione secondaria e disidratazione
- Rimuovere l'adulto C. caragana dal liquido di conservazione. Utilizzando uno stereoscopio, rimuovere le appendici, lavare i campioni in PBST per 3 h, quindi post-fissarli in 1% (wt/vol) tetrossido di osmio in PBS per 1h a 25 . Disidratare i campioni utilizzando 20 min trattamenti successivi nel 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100% e 100% (tutti vol/vol) etanolo a temperatura ambiente.
- Incorporamento e polimerizzazione della resina
- Incorporare i campioni in resina in uno stampo di incorporamento piatto. Il campione era nella parte inferiore della piastra ed è stato posizionato il più vicino possibile al bordo della scanalatura incassata. Collocare l'etichetta nello spazio vuoto, quindi incubare la piastra contenente il campione a 60 gradi centigradi per 72 h. Rimuovere la capsula dall'incubatrice e verificare che la resina sia stata polimerizzata.
- Esempio di sezionamento e colorazione
- Una volta assicurato che il campione sia stato solidificato, posizionare ogni blocco di resina al microscopio a fluorescenza e fotografarli sotto la luce blu. Spostare la sorgente luminosa fluorescente del microscopio in modo che irradiasse il campione dall'alto. Consentire di osservare chiaramente la sensilla nel blocco di resina. Fotografato e misurare le distanze per indirizzare la sensilla (Figura 1).
- Fare riferimento all'immagine SEM dei palpi (Figura 2A) e tagliare approssimativamente il blocco di resina con una lama di rasoio per chiudere il recettore bersaglio (Figura 2B).
- Successivamente, utilizzando la microscopia a fluorescenza blu-luce, fotografare il blocco di resina tagliato grossolanamente, regolando la sorgente luminosa dall'alto in modo che la sensilla sia stata osservata chiaramente. La luce verde eccitata dalla luce blu ha creato un'osservazione favorevole. Durante l'imaging, il micrometro obiettivo (DIV 0.01mm) è stato aggiunto allo stadio del microscopio a fluorescenza, e quindi la distanza del bersaglio è stata misurata dal software ImageJ (U.S. National Institute of Health) (Figura 2C). Il righello dell'immagine è stato creato da Adobe Photoshop CS5 (Adobe Systems, Inc., San Jose, CA, USA). Quindi, per il taglio ultramicrotoma, impostare la distanza di taglio, utilizzando spessori di fetta 50-60 nm, fino a raggiungere la posizione di destinazione. Utilizzare la microscopia a fluorescenza per individuare il recettore bersaglio.
- Montare le sezioni su griglie in rame a 100 maglie rivestite da Formvar, con acetato di uranilo e citrato di piombo.
- In primo luogo, aggiungere 3,75 g di acetato di uranilo a 50 mL di 50 % di metanolo. Griglie di macchia con una siringa filtrata (0,45 m) di una soluzione satura di acetato di uranilo a temperatura ambiente per 10 min. Risciacquare 2x nel 50 % di metanolo; 2x acqua degassata filtrata.
- In secondo luogo, aggiungere il citrato di piombo da 0,02 g a 10 mL di acqua distillata degassata nel tubo centrifuga. Aggiungere 0,1 mL di 10 N di idrossido di sodio, sigillare e agitare per sciogliere. Griglie macchia con una soluzione di citrato di piombo per 8 min. Centrifugi prima dell'uso. La colorazione deve essere fatta in un ambiente privo di anidride carbonica per prevenire la formazione di precipitati di carbonato di piombo. Posizionare gocce di macchia su quadrati di piatti di petri di plastica. Risciacquare in acqua degassata filtrata e asciugare17. Osservarli tramite TEM operante a 80 kV.
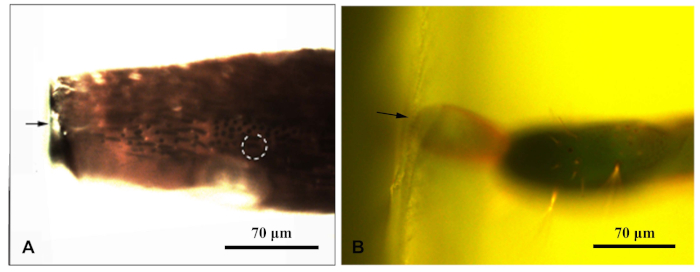
Figura 1: Un microscopio fluorescente ha fotografato un blocco di resina che racchiude l'appendice del Chlorophorus caragana. (A)Blocco di resina dell'antenna; (B) Blocco di resina alla fine dell'ovipositore. La freccia indicava il bordo del blocco di resina; cerchio tratteggiato indica la sensilla di destinazione. Fare clic qui per visualizzare una versione più grande di questa figura.
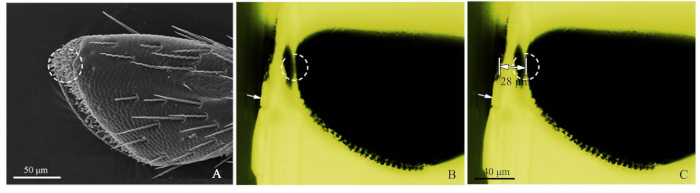
Figura 2: Procedure del metodo preciso di localizzazione sensilla. (A) Il quarto sottosegmento di un palp mascellare di Chlorophorus caragana, il cerchio punteggiato ha mostrato la sensilla presa di mira da SEM. (B) Il quarto sottosegmento di un palp mascellare di C. caragana visto dalla microscopia a fluorescenza. Freccia bianca ha mostrato il bordo tagliato approssimativamente del blocco di resina e il cerchio punteggiato ha mostrato la posizione precisa. (C) La distanza marcata dal bordo del blocco di resina alla posizione massimale di destinazione palp (28 m in questo esempio). Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Utilizzando la soluzione di pulizia e fissativa con Tween 20, è stata osservata un'immagine SEM più pulita di quella senza Tween 20 (Figura 3). Tween 20 soluzione di fissaggio penetrato la soluzione di fissaggio glutaraldeide nel tessuto. La struttura dei microtubuli è stata chiaramente osservata. L'immagine TEM della struttura interna del campione è stata sfocata senza Tween 20 (Figura 4).

Figura 3: La sensilla che si trova sull'antenna di Chlorophorus caragana sotto SEM. Confronto dell'immagine SEM con Tween 20 (A) e senza Tween 20 (B), che ha mostrato che l'immagine A è più pulita dell'immagine B in generale. Fare clic qui per visualizzare una versione più grande di questa figura.
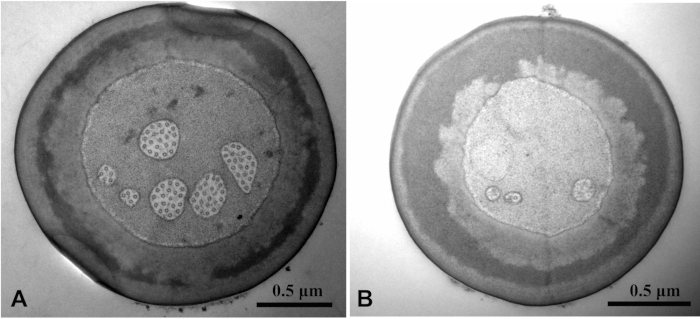
Figura 4: Clorophorus caragana visto dalla microscopia elettronica di trasmissione di sensilla twig basiconica sui palpi labiali. Confronto tra immagine TEM con Tween 20 (A) e senza Tween 20 (B). La struttura dei microtubuli dell'immagine A è chiara, mentre quella dell'immagine B è sfocata. Fare clic qui per visualizzare una versione più grande di questa figura.
Abbiamo usato SEM per studiare i tipi e le ultrastrutture della sensilla sui palpi di C. caragana, trovando 4 tipi di sensilla, tra cui 10 sottotipi: 1 setole di Bàhm (BB.), 3 sensilla chaetica (Ch.1-Ch.3), 1 sensilla digitiforme (Dig.), e 5 sensilla twig basiconica (S.tb.1-S.tb 5) (Tabella 1). L'identificazione e l'ultrastruttura di Sensilla si basavano sulla loro morfologia e dimensione18,19,20,21,22,23. I nostri metodi di preparazione dei campioni hanno reso chiare le immagini delle superfici e delle ultrastrutture interne della sensilla degli insetti.
| Numero | digitare | Lunghezza a | Diametro alla base | Parete | mancia | Socket | Pori cuticolari | Distribuzione |
| 1 | Bb. | 5,18 x 1,25 | 1,70 x 0,47 | Liscia | Affilato | Ampia | No | mascellare palp, palp labiale |
| 2 | Ch.1 (in inglese) | 38,59 x 8,20 | 3.15 - 0,84 | Scanalato | Affilato | Ampia | No | mascellare palp, palp labiale |
| 3 | Ch.2 | 81,54 x 18,07 | 3,75 x 0,88 | Scanalato | Affilato | Ampia | No | mascellare palp, palp labiale |
| 4 | Ch.3 | 282,06 - 22,60 | 6.10 - 0,70 | Scanalato | Affilato | Ampia | No | palp labiale |
| 5 | Scavare. | 24,77 x 2,98 | 1,24 x 0,32 | Liscia | Smussato | Ampia | No | maxillary palp |
| 6 | S.tb.1 | 6.51 - 1,01 | 2,31 - 0,25 | Scanalato | Con sporche | Sollevato e stretto | Poro di punta | mascellare palp, palp labiale |
| 7 | S.tb.2 | 5,91 x 0,90 | 2,24 x 0,30 | Liscia | Smussato | Sollevato e stretto | Poro di punta | mascellare palp, palp labiale |
| 8 | S.tb.3 | 6,84 x 0,98 | 1,96 - 0,35 | Liscia | Con sporche | Sollevato e stretto | Poro di punta | mascellare palp, palp labiale |
| 9 | S.tb.4 | 2.21 - 0,59 | 2,86 - 0,46 | Scanalato | Con sporche | Sollevato | Poro di punta | mascellare palp, palp labiale |
| 10 | S.tb.5 | 1.16 - 0,29 | 1,05 x 0,19 | Liscia | Smussato | Sollevato e largo | Poro di punta | mascellare palp, palp labiale |
Tabella 1: Tipi di sensilla sui palpi di C. caragana.
Per esaminare l'ultrastruttura all'interno della sensilla sui palpi C. caragana, abbiamo usato TEM. Un esempio di questi studi è stato il continuo punto di vista trasversale del piolo del S.tb.1 su palpi mascellari. Le viste hanno mostrato che la guaina dendritica circondava i segmenti dendritici esterni ed estendeva fino al poro di punta (Figura 5A-D). All'interno della cavità linfatica del recettore interno esistevano sette segmenti dendritici esterni non ramificati, che era circondata da una cavità esterna (Figura 5D). Il corpo tubolare è stato separato da una seta dendritica da altri segmenti dendritici esterni ad ogni base di presa sensibile (Figura 5E). Nella regione ciliaria, abbiamo notato 8 dendriti di diversi diametri, indicando la presenza di 8 neuroni bipolari. Infine, il segmento ciliario conteneva 9 doppietti di microtubuli periferici (Figura 5F).

Figura 5: Viste TEM di sensilla tipo 1 ramoscello basiconica (S.tb.1) su un palp maxillary Chlorophorus caragana 30. (A) S.tb.1 con linee tratteggiate che segnano regioni vicine alle sezioni trasversali prese per i fichi. B-E. (B) Sezione trasversale delle sporche a forma di dito che mostrano cuticula sparse. (C) Sezione trasversale della regione basale delle spore a forma di dito che mostrano cavità linfatiche del recettore interno senza segmenti dendritici esterni. (D) Sezione trasversale della regione centrale del piolo che mostra la foia dendritica che divide la cavità sensibile linfo-linfa in cavità sia interne che esterne con 7 segmenti dendritici esterni nella cavità interna. (E) Regione basale del piolo che mostra il corpo tubolare circondato da una guaina dendritica e separato dai segmenti dendritici esterni. Una cellula tormogen forma l'esterno della seta dendritica. (F) Sezione della regione ciliaria che mostra 8 dendriti di diametri diversi. Abbreviazioni: bb, corpo basale; cs, segmento ciliario; CW, parete cuticolare; DS, difasima dendritica; iRL, cavità linfa recettore interno; M, microtubulo; Mi, microvilli; oD, segmento dendritico esterno; oRL, cavità linfa del recettore esterno; S.tb.1, tipo 1 sensilla ramoscello basiconica; TB, corpo tubolare; TH, cellula di colore cologeno; TO, cellula tormogen; TR, cellula tricogena. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
In questo articolo, abbiamo presentato uno schema di preparazione dei campioni per la microscopia elettronica di scansione e trasmissione per coleottero che falegname. Utilizzando l'appendice degli insetti come soggetto di studio rappresentativo, abbiamo dimostrato diversi miglioramenti rispetto ai metodi tradizionali di preparazione dei campioni.
L'olio liquido staccato dalla superficie solida viene emulsionato in piccole goccioline, che possono essere ben disperse e sospese nel mezzo di lavaggio per ridurre il ridepositamento sulla superficie dell'oggetto. Le prestazioni di lavaggio dei surfactant includono tutte le caratteristiche di base come la umidità, la permeabilità, la proprietà emulsionante, la dispersione, la solubilità11,12,13,14. Gli effetti di diversi detergenti sulla preparazione di campioni microscopici elettronici del Nematode d'Oro hanno mostrato che Tween 20 ha avuto il miglior effetto di pulizia, seguito da bicarbonato di sodio, e acqua distillata24. In questo studio, abbiamo scoperto che Tween 20 può essere utilizzato per ridurre la tensione superficiale del liquido e impedire che lo sporco si depositi sulla superficie del corpo dell'insetto, in particolare per il coleottero che lavora in legno raccolto direttamente sul campo. La superficie del corpo degli insetti è stata lavata in modo più pulito in SEM. Fixative con Tween 20 penetrato la parete del corpo dell'insetto più facilmente, e successivamente meglio tessuti fissati e organi nel corpo in TEM. Il vantaggio del surfactant nella preparazione del campione di microscopia elettronica è stato ampiamente studiato24,25, 26,27,28,29,30,31.
Inoltre, abbiamo adottato un metodo di essiccazione dell'aria modificato per la preparazione del campione SEM, in cui il campione disidratato è stato collocato in una piastra di Petri contenente un disiccante di gel di silice che evapora gradualmente l'agente disidratante. Il più grande vantaggio di questo metodo è che è semplice, facilmente mantenuto, e mantiene l'aria microambiente asciutta e nessuna attrezzatura speciale necessaria. Il metodo di essiccazione naturale è un metodo semplice, pratico ed efficace per la conservazione di semi, noci e conservazione a lungo termine di esemplari di insetti. Anche se il volume del campione si riduce durante il processo di essiccazione naturale, la morfologia di base del campione viene mantenuta32 . In generale, gli insetti Coleoptera hanno un contenuto di acqua relativamente basso, e la loro superficie è circondata da pareti di chitina dura. L'aria secca è in grado di soddisfare i requisiti. Tuttavia, questo metodo di essiccazione non è adatto per l'essiccazione di tessuti con un grande contenuto di acqua, come pidocchio, acari e larve, perché la tensione superficiale deformerà il campione durante il processo di essiccazione.
Per osservare e calcolare il tipo e il numero di sensilla distribuiti sulla superficie dell'appendice, deve essere considerato dorsale, ventrale e laterale dell'appendice. Alcuni sensilla erano pochi, piccoli e talvolta coperti, scansionare e osservare con attenzione da tutte le angolazioni per trovare quei sensilla che sporgono completamente l'epidermide o derivanti dalla depressione. Poiché molti sensilla erano relativamente lunghi e simili ai capelli, l'effetto punta può essere significativo. Quindi, la tensione di accelerazione del microscopio elettronico non deve essere troppo alta, 5-20kV era migliore e abbiamo usato 20kV.
Nell'incorporamento del campione TEM, il campione era meglio vicino al bordo degli stampi di incorporamento piatto scanalare per risparmiare tempo durante la sgrossatura del blocco di resina. Il metodo TEM tradizionale per tagliare continuamente la resina è esteso, ed è di solito tagliato ciecamente con un microscopio ottico17,33. Per migliorare questo, abbiamo prima esplorato una tecnica di localizzazione della sensilla degli insetti nei blocchi incorporati in resina usando la microscopia a fluorescenza per visualizzare e misurare la distanza di destinazione dal taglio. Rispetto al metodo di taglio TEM tradizionale, questa tecnologia consente di risparmiare tempo di preparazione del campione e di localizzare in modo più accurato il sensore di destinazione. In assenza di software di misura, un righello scalato può essere posizionato nel campo visivo per misurare approssimativamente la distanza di destinazione. La combinazione di un ultramicrotoma con un microscopio a fluescenza fornisce chiare osservazioni del processo di taglio, producendo tagli accurati di sensilla bersaglio e altri soggetti appropriati.
Divulgazioni
Non abbiamo alcun conflitto di interessi da rivelare.
Riconoscimenti
Apprezziamo la generosa assistenza del Beijing Vocational College of Agriculture, dell'Institute for the Application of Atomic Energy (Accademia cinese delle scienze agricole), del Centro di bioricerca dell'Università forestale di Pechino e del professor Shan-gan dell'Istituto di zoologia dell'Accademia Cinese delle Scienze. Questa ricerca è stata sostenuta dal National Key R&D Program of China (2017YFD0600103), dalla National Natural Science Foundation of China (Grant n. 31570643, 81774015), dalla ricerca scientifica forestale nel Welfare pubblico della Cina (201504304), dalla Mongolia Interna della Mongolia Piano di avvio della ricerca sui talenti dell'Università delle Università agricola (203206038) e progetto di ricerca sull'istruzione superiore della Regione Autonoma della Mongolia Interna (NJ-18047), Regione Autonoma Interna linxue "Doppia classe" (170001).
Materiali
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
Riferimenti
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215 (2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. . Introduction to Conventional Transmission Electron Microscopy. , 1 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon