Method Article
Método de preparación de muestras de microscopio electrónico de escaneo y transmisión para los apéndices del escarabajo carpintero
En este artículo
Resumen
Con el fin de observar la ultraestructura de los insectos sensilla, se presentó en el estudio el protocolo de preparación de muestras de escaneo y transmisión electrónica (SEM y TEM, respectivamente). Se añadió Tween 20 en el fijador para evitar la deformación de la muestra en SEM. La microscopía de fluorescencia fue útil para mejorar la precisión del corte en TEM.
Resumen
Este informe describió métodos de preparación de muestras que escanear y transmisión observaciones del microscopio electrónico, demostrado mediante la preparación de apéndices del escarabajo carpintero de madera, Chlorophorus caragana Xie & Wang (2012), para ambos tipos de microscopía electrónica. El protocolo de preparación de muestras de microscopía electrónica de barrido (SEM) se basó en la fijación química de la muestra, la deshidratación en una serie de baños de etanol, el secado y el recubrimiento de esputo. Al añadir Tween 20 (Laurato de sorbitano de polioxietileno) al fijador y a la solución de lavado, la superficie del cuerpo de insectos del escarabajo carpintero se lavó más limpiamente en SEM. La preparación de muestras de microscopía electrónica de transmisión (TEM) de este estudio implicó una serie de pasos que incluyen fijación, deshidratación de etanol, incrustación en resina, posicionamiento mediante microscopía de fluorescencia, seccionamiento y tinción. Fixative con Tween 20 habilitado penetrar la pared del cuerpo del insecto de escarabajo de madera más fácilmente de lo que habría sido sin Tween 20, y posteriormente mejores tejidos fijos y órganos en el cuerpo, lo que produjo claras observaciones del microscopio electrónico de transmisión de insectos sensilla ultraestructuras. El siguiente paso de esta preparación fue determinar las posiciones de la sensilla de insectos en la muestra incrustada en el bloque de resina mediante el uso de microscopía de fluorescencia para aumentar la precisión del posicionamiento de la sensilla objetivo. Esta precisión de corte mejorada.
Introducción
La microscopía electrónica de barrido es una herramienta importante en muchos estudios morfológicos, que SEM muestra las estructuras superficiales1,2. El atractivo de la microscopía electrónica de transmisión es que se puede utilizar para estudiar una amplia gama de estructuras biológicas a escala nanométrica, desde la arquitectura de las células y la ultraestructura de los orgánulos, hasta la estructura de complejos macromoleculares y proteínas. TEM muestra las estructuras internas3,4,5.
Coleoptera es el grupo más grande de insectos, incluyendo alrededor de 182 familias y 350.000 especies. La mayoría de los insectos coleopterantes, en particular los escarabajos carpinteros, se alimentan de plantas, muchas de las cuales son plagas importantes de bosques y árboles frutales, causando daños devastadores a los árboles6. En la actualidad, la población de prevención y control de plagas basada en la teoría de la ecología química ha recibido una atención cada vez mayor7. Los métodos de control de feromonas eficientes, bajos en tóxicos y libres de contaminación se han convertido en un camino eficaz8. El estudio de la morfología de la sensilla y la ultraestructura de los insectos es una parte importante de la investigación de la ecología química de los insectos. La microscopía electrónica de escaneo y transmisión (SEM y TEM, respectivamente) se utilizan con gran efecto para estudiar su morfología y anatomía interna. Sin embargo, durante la preparación de muestras de insectos para microscopía electrónica (EM), la objetividad y autenticidad del sitio de observación puede verse afectada9. En general, la preparación de muestras SEM de insectos requiere limpieza, fijación de tejidos, deshidratación, metatesis, secado y recubrimiento de esputo10. Debido al complejo entorno en el que vive el escarabajo carpintero, la superficie del cuerpo a menudo tiene varios contaminantes y sus apéndices a menudo tienen muchas sensillas finas largas o cerdas. En particular, algunos woodborers no están disponibles en la cría de laboratorio, que se recoge directamente en el campo, y luego se colocan en el fluido de fijación para garantizar la frescura y posteriormente lavado en el laboratorio. Si la muestra se fija primero y luego se lava, obviamente es mucho más difícil eliminar los desechos porque el glutaraldehído lo fija fuertemente a la muestra. Tween 20 es un tensioactivo11,12,13,14, que desempeña un papel importante en el proceso de lavado, incluyendo la reducción de la tensión superficial del agua y la mejora de la humectabilidad del agua en la superficie de la ropa. En este estudio, Tween 20 se añadió a la solución de fijación y la solución de limpieza PBS para reducir la tensión superficial del líquido, y evitar que la suciedad se deposite en la superficie del cuerpo del escarabajo de madera, lo que hizo que la superficie del cuerpo fuera más limpia en SEM.
Usando TEM, sensilla en diferentes órganos de insectos se puede cortar para revelar las estructuras claras dentro de ellos, proporcionando así una base para analizar las funciones de sensilla. Cuando el insecto sujeto, como el escarabajo carpintero, es grande, y su pared corporal tiene un grado sustancial de esclerotización, por lo que el fijador puede no saturar completamente los tejidos de órganos dentro del cuerpo del insecto. Tween 20 puede mejorar la dispersión y la capacidad de suspensión de la suciedad. En este estudio, Tween 20 se añadió al fijador para mejorar la penetración de fluido fijador en la pared del cuerpo del insecto del escarabajo carpintero, evitando la deformación y el colapso del epidermi11,12,13. Además, utilizando la tecnología de corte general, es difícil localizar con precisión diferentes tipos de sensilla, en particular para algunas sensillaspequeñas 15. Basado en la preparación tradicional de muestras TEM, este estudio combinó la microscopía de fluorescencia y SEM para determinar la posición de la sensilla de insectos en el bloque incrustado, mejorando así la precisión del corte.
Protocolo
ADVERTENCIA: Consulte las fichas de datos de seguridad de los materiales de los reactivos antes de utilizarlas. Varios de los productos químicos utilizados durante la preparación de la muestra son tóxicos, mutagénicos, cancerígenos y/o reprotóxicos. Use equipo de protección personal (guantes, abrigo de laboratorio, pantalones de cuerpo entero y zapatos de punta cerrada) y trabaje bajo una campana de humo mientras manipula la muestra.
1. Preparación de muestras SEM e imágenes
- Fijación y limpieza de muestras
- Trabajando en un área donde se produce C. caragana, atraiga a los adultos a las trampas de campo cebadas con atractores de plantas, como la isoforona16. Conservar cuerpos limpios de C. caragana adulto en 0,1 mol L-1 salina tamponada con fosfato (PBS, pH 7,2), 2,5% (wt/vol) glutaraldehyde (Anhidro EM Grad), y 0,06% (vol/vol) Tween 20. Fijar la muestra a 4 oC durante el fin de semana.
- Retire los cuerpos del líquido de conservación y enjuague en tampón de fosfato. Usando un estereomicroscopio, retire los apéndices y límpielos por ultrasonidos (40 kHz) en una solución salina de 0,1 mol L-1 con fosfato (pH 7,2) con 0,06% (vol/vol) Tween 20 (PBST). Después de la limpieza durante 100 s, transfiera la muestra al microscopio para comprobar si estaba limpia. En circunstancias normales, limpie durante 400 s para asegurarse de que la muestra estaba lo suficientemente limpia como para observarla y no dañada.
- Deshidratación, montaje y secado de muestras
- Deshidratar las muestras utilizando tratamientos sucesivos de 20 min en etanol 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100% y 100% (todo vol/vol). Bajo un estereomicroscopio, utilice cinta adhesiva de doble cara de carbono para fijar por separado 3 superficies de observación (ventral dorsal y lateral) en talones. Tenga en cuenta que todas las superficies de visualización deben mantenerse limpias y libres de contaminación. Coloque la etapa de la muestra en una placa de petri que contenga un desecante de gel de sílice durante 48 h.
- Sputter-coat y Sample Insertion
- Usando el instrumento de sputtering ion Hitachi Koki (E-1010), gire MAIN VALVE a la posición ABIERTA, retire la cubierta de la cámara de muestra y coloque la muestra en la cámara. Encienda el interruptor POWER y la luz READY estaba encendida. Establezca el tiempo de sputtering en 45 segundos y el espesor del recubrimiento en 70,875 o. Una vez que el índice de la esfera de vacío de la bomba mecánica cayó por debajo de 7, presione DISCHARGE y comience a rociar platino. Al final del experimento, apague la fuente de alimentación y saque la muestra de la cámara. Espesor de la película de pulverización: d á KIVt ("d" es el espesor de la película en la unidad de " " " " K" es una constante, dependiendo del metal y el gas sputtered. Por ejemplo, K de aire es 0.07; "I" es la unidad mA del flujo de plasma; "V" es la tensión aplicada en la unidad de "KV". "t" es tiempo en segundos.
- Inserte el talón que contiene la muestra en la etapa de SEM. Asegúrese de que la etapa de la muestra con el talón de la muestra tenía suficiente altura para permitir una buena imagen. Abra el software SEM y seleccione la tensión de funcionamiento deseada, comenzando en 20 kV.
2. Preparación e imágenes de muestras TEM
- Obtenga y corrija la muestra como en los pasos 1.1.1 y 1.1.2.
- Limpieza, Fijación Secundaria y Deshidratación
- Retire el adulto C. caragana del líquido de conservación. Usando un estereomicroscopio, retire los apéndices, lave las muestras en PBST durante 3 h, y luego pos-fix en 1% (wt/vol) tetróxido de osmio en PBS durante 1h a 25 oC. Deshidratar las muestras utilizando tratamientos sucesivos de 20 min en etanol 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100% y 100% (todo vol/vol) a temperatura ambiente.
- Incorporación y polimerización de resina
- Incruste las muestras en resina en moldes de incrustación plana. La muestra estaba en la parte inferior de la placa y se colocó lo más cerca posible del borde de la ranura empotrada. Colocar la etiqueta en blanco y luego incubar la placa que contiene la muestra a 60oC durante 72 h. Retire la cápsula de la incubadora y verifique que la resina se haya polimerizado.
- Sección y tinción de muestras
- Una vez que se asegure de que la muestra se haya solidificado, coloque cada bloque de resina bajo un microscopio de fluorescencia y fotografíelos bajo luz azul. Mueva la fuente de luz fluorescente del microscopio para que irradiara la muestra desde arriba. Permita observar claramente la sensilla en el bloque de resina. Fotografiado y medir distancias para apuntar a la sensilla(Figura 1).
- Consulte la imagen SEM de los palpes(Figura 2A)y corte aproximadamente el bloque de resina con una cuchilla de afeitar para cerrar el receptor de destino(Figura 2B).
- A continuación, utilizando la microscopía de fluorescencia de luz azul, fotografíe el bloque de resina cortado de forma aproximada, ajustando la fuente de luz desde arriba para que la sensilla se observara claramente. La luz verde excitada por la luz azul creó una observación favorable. Cuando se toma imágenes, el micrómetro objetivo (DIV 0,01 mm) se añadió a la etapa del microscopio de fluorescencia, y luego la distancia del objetivo se midió mediante el software ImageJ (Instituto Nacional de Salud de los Estados Unidos)(Figura 2C). La regla de imagen fue hecha por Adobe Photoshop CS5 (Adobe Systems, Inc., San Jose, CA, EE. UU.). A continuación, para el corte de ultramicrotome, establezca la distancia de corte, utilizando espesores de rodaja de 50-60 nm, hasta que se alcance la posición objetivo. Utilice la microscopía de fluorescencia para identificar el receptor objetivo.
- Monte las secciones en rejillas de cobre de 100 mallas recubiertas de Formvar, de doble tela con acetato de ursilix y citrato de plomo.
- En primer lugar, añadir 3,75 g de acetato de ursionlo a 50 ml de metanol al 50 %. Rejillas de manchas con una jeringa filtrada (0,45 m) de una solución saturada de acetato de ursiol a temperatura ambiente durante 10 minutos. Cubra las secciones durante la tinción para bloquear los precipitados inducidos por la luz. Enjuague 2x en 50 % de metanol; 2x agua desgasifada filtrada.
- En segundo lugar, añadir un citrato de plomo de 0,02 g a 10 ml de agua destilada desgasificada en el tubo centrífugo. Añadir 0,1 ml de hidróxido sódico de 10 N, sellar y agitar para disolver. Rejillas de mancha con una solución de citrato de plomo para 8 min. Centrífuga antes de su uso. La tinción debe realizarse en un ambiente libre de dióxido de carbono para evitar la formación de precipitados de carbonato de plomo. Coloque gotas de mancha en cuadrados de platos de plástico petri. Enjuagar en agua filtrada desgasificada y secar17. Observe a través de TEM operando a 80 kV.
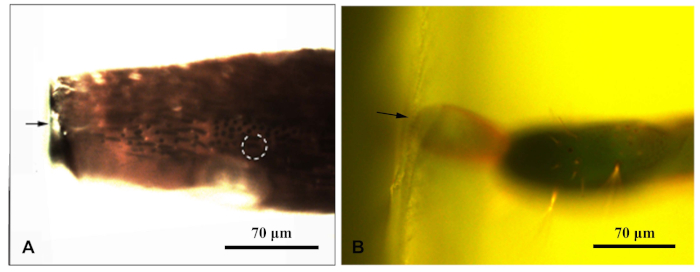
Figura 1: Un microscopio fluorescente fotografió un bloque de resina que encierra el apéndice del Chlorophorus caragana. (A) Bloque de resina de antena; (B) Bloque de resina al final del ovipositor. La flecha indicaba el borde del bloque de resina; círculo punteado indica el objetivo sensilla. Haga clic aquí para ver una versión más grande de esta figura.
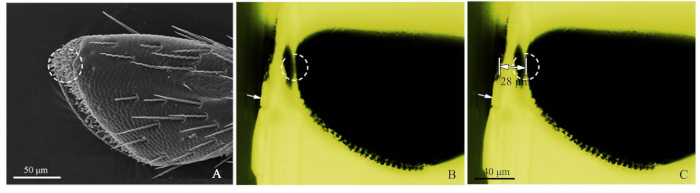
Figura 2: Procedimientos del método preciso de localización de sensilla. (A) El 4o subsegmento de un palp maxilar de Chlorophorus caragana, el círculo punteado mostró la sensilla dirigida por SEM. (B) El 4o subsegmento de un palp maxilar de C. caragana visto por microscopía de fluorescencia. La flecha blanca mostró el borde cortado aproximadamente del bloque de resina y el círculo de puntos mostró la ubicación exacta. (C) La distancia marcada desde el borde del bloque de resina hasta la ubicación objetivo del palp maxilar (28 m en esta muestra). Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Utilizando la solución de limpieza y fijación con Tween 20, se observó una imagen SEM más limpia que la sin Tween 20(Figura 3). La solución de fijación De- 20 penetró la solución de fijación de glutaraldehído en el tejido. Se vio claramente la estructura del microtúbulo. La imagen TEM de la estructura interna de la muestra se desdibujó sin Tween 20(Figura 4).

Figura 3: La sensilla que se ubica en la antena de Chlorophorus caragana bajo SEM. Comparación de la imagen SEM con El Tween 20 (A) y sin La tween 20 (B), que mostró que la imagen A es más limpia que la imagen B en general. Haga clic aquí para ver una versión más grande de esta figura.
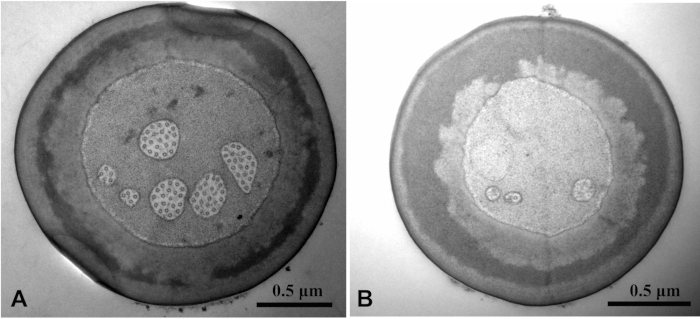
Figura 4: Chlorophorus caragana visto por microscopía electrónica de transmisión de sensilla twig basiconica en los palpes labiales. Comparación de la imagen TEM con El Tween 20 (A) y sin La tween 20 (B). La estructura microtúbula de la imagen A es clara, mientras que la de la imagen B está borrosa. Haga clic aquí para ver una versión más grande de esta figura.
Utilizamos SEM para estudiar los tipos y ultraestructuras de sensilla en los palpes de C. caragana, encontrando 4 tipos de sensilla incluyendo 10 subtipos: 1 cerdas de B-hm (BB.), 3 sensilla chaetica (Ch.1-Ch.3), 1 sensilla digitiform (Dig.), y 5 sensilla twig basiconica (S.tb.1-S.tb.5). La identificación y ultraestructura de Sensilla se basaba en su morfología y tamaño18,19,20,21,22,23. Nuestros métodos de preparación de muestras representaron imágenes claras de las superficies y ultraestructuras internas de la sensilla de insectos.
| Número | Tipo | Longitud (m) a | Diámetro en la base (m)a | Pared | Propina | Zócalo | Poros cuticulares | Distribución |
| 1 | Bb. | 5,18 x 1,25 | 1,70 a 0,47 | Suave | Agudo | extenso | No | palp maxilar, palp labial |
| 2 | Ch.1 | 38,59 a 8,20 | 3,15 a 0,84 | Acanalado | Agudo | extenso | No | palp maxilar, palp labial |
| 3 | Ch.2 | 81,54 a 18,07 | 3,75 á 0,88 | Acanalado | Agudo | extenso | No | palp maxilar, palp labial |
| 4 | Ch.3 | 282,06 a 22,60 | 6,10 a 0,70 | Acanalado | Agudo | extenso | No | labial palp |
| 5 | Cavar. | 24,77 x 2,98 | 1,24 á 0,32 | Suave | desafilado | extenso | No | palp maxilar |
| 6 | S.tb.1 | 6,51 a 1,01 | 2,31 a 0,25 | Acanalado | Con protuberancias | Elevado y apretado | Poro de punta | palp maxilar, palp labial |
| 7 | S.tb.2 | 5,91 a 0,90 | 2,24 á 0,30 | Suave | desafilado | Elevado y apretado | Poro de punta | palp maxilar, palp labial |
| 8 | S.tb.3 | 6,84 a 0,98 | 1,96 á 0,35 | Suave | Con protuberancias | Elevado y apretado | Poro de punta | palp maxilar, palp labial |
| 9 | S.tb.4 | 2,21 a 0,59 | 2,86 a 0,46 | Acanalado | Con protuberancias | Elevado | Poro de punta | palp maxilar, palp labial |
| 10 | S.tb.5 | 1,16 a 0,29 | 1,05 a 0,19 | Suave | desafilado | Elevado y ancho | Poro de punta | palp maxilar, palp labial |
Tabla 1: Tipos de sensilla en los palpes de C. caragana.
Para examinar la ultraestructura dentro de la sensilla en C. caragana palps, utilizamos TEM. Un ejemplo de estos estudios fueron las continuas visiones transversales de la clavija del S.tb.1 sobre los palpes maxilares. Los puntos de vista mostraron que la vaina dendrítica rodeaba los segmentos dendríticos externos y se extendía hasta el poro de la punta(Figura 5A-D). Existen siete segmentos dendríticos externos no ramificados dentro de la cavidad linfática del receptor interno, que estaba rodeada por una cavidad externa(Figura 5D). El cuerpo tubular estaba separado por una vaina dendrítica de otros segmentos dendríticos externos en cada base de zócalo sensillar(Figura 5E). En la región ciliar, observamos 8 dendritas de diferentes diámetros, lo que indica la presencia de 8 neuronas bipolares. Por último, el segmento ciliar contenía 9 dosis periféricas de microtúbulos(Figura 5F).

Figura 5: Vistas TEM de sensilla tipo 1 ramita basiconica (S.tb.1) en un chlorophorus caragana maxilar palp30. (A) S.tb.1 con líneas punteadas que marcan regiones cercanas a las secciones transversales tomadas para las Figs. B-E. (B) Sección transversal de protuberancias en forma de dedo que muestran cutículas dispersas. (C) Sección transversal de la región basal de protuberancias en forma de dedo que muestran cavidades linfáticas del receptor interno sin segmentos dendríticos externos. (D) Sección transversal de la región media de la clavija que muestra la vaina dendrítica que divide la cavidad sensillum-linfática en cavidades internas y externas con 7 segmentos dendríticos externos en la cavidad interna. (E) Región basal de la clavija que muestra el cuerpo tubular rodeado por una vaina dendrítica y separado de los segmentos dendríticos externos. Una célula tormogen forma el exterior de la vaina dendrítica. (F) Sección transversal de la región ciliar que muestra 8 dendritas de diferentes diámetros. Abreviaturas: bb, cuerpo basal; cs, segmento ciliar; CW, pared cuticular; DS, vaina dendrítica; iRL, cavidad linfática del receptor interno; M, microtúbulo; Mi, microvilli; oD, segmento dendrítico externo; oRL, cavidad linfática del receptor externo; S.tb.1, tipo 1 sensilla twig basiconica; TB, cuerpo tubular; TH, célula de elcogen; TO, célula tormogen; TR, célula de trichogen. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este artículo, presentamos un esquema de preparación de muestras para escanear y transmisión de microscopía electrónica para el escarabajo carpintero. Utilizando el apéndice de insectos como sujeto de estudio representativo, demostramos varias mejoras con respecto a los métodos tradicionales de preparación de muestras.
El aceite líquido separado de la superficie sólida se emulsiona en pequeñas gotas, que pueden ser bien dispersadas y suspendidas en el medio de lavado para reducir el redepositado en la superficie del objeto. El rendimiento de lavado del tensioactivo incluye todas las características básicas como humectabilidad, permeabilidad, emulsión de propiedades, dispersión, solubilización11,12,13,14. Los efectos de los diferentes detergentes en la preparación de muestras microscópicas electrónicas de Golden Nematodo mostraron que Tween 20 tenía el mejor efecto de limpieza, seguido del bicarbonato de sodio, y el agua destilada24. En este estudio, encontramos que Tween 20 se puede utilizar para reducir la tensión superficial del líquido, y evitar que la suciedad se deposite en la superficie corporal del insecto, en particular para el escarabajo carpintero recogido directamente en el campo. La superficie del cuerpo del insecto fue lavada más limpiamente en SEM. Fixative con Tween 20 penetró la pared del cuerpo del insecto más fácilmente, y posteriormente mejor los tejidos fijos y órganos en el cuerpo en TEM. La ventaja de la surfactante en la preparación de muestras de microscopía electrónica ha sido ampliamente estudiada24,25,26,27,28,29,30,31.
Además, adoptamos un método de secado por aire modificado para la preparación de muestras SEM, en el que la muestra deshidratada se colocó en una placa petri que contiene un desecante de gel de sílice que evapora gradualmente el agente deshidratante. La mayor ventaja de este método es que es simple, fácil de mantener, y mantiene el microambiente seco y no se requiere equipo especial. El método de secado natural es un método simple, práctico y eficaz para la preservación de semillas, nueces y a largo plazo de especímenes de insectos. Aunque el volumen de la muestra se reduce durante el proceso de secado natural, la morfología básica de la muestra se conserva32. En general, los insectos Coleoptera tienen un contenido de agua relativamente bajo, y su superficie está rodeada de paredes duras de quitina. Air-dry es capaz de cumplir con los requisitos. Sin embargo, este método de secado no es adecuado para el secado de tejidos con un gran contenido de agua, como piojos, ácaros y larvas, ya que la tensión superficial deformará la muestra durante el proceso de secado.
Para observar y calcular el tipo y el número de sensilla distribuidas a través de la superficie del apéndice, dorsal, ventral y lateral del apéndice debe tenerse en cuenta. Algunas sensilla eran pocas, pequeñas, y a veces cubiertas, escanean y observan cuidadosamente desde todos los ángulos para encontrar aquellos sensilla que sobresalían completamente la epidermis o que surgen de la depresión. Dado que muchas sensilla eran relativamente largas y pelosas, el efecto de la punta puede ser significativo. Por lo tanto, el voltaje de aceleración del microscopio electrónico no debe ser demasiado alto, 5-20kV era mejor y utilizamos 20kV.
En la incrustación de muestras TEM, la muestra tenía mejor cerca del borde de los moldes de incrustación plana groovein con el fin de ahorrar tiempo al desbaste del bloque de resina. El método TEM tradicional para cortar continuamente la resina es extenso, y por lo general se corta ciegamente utilizando un microscopio óptico17,33. Para mejorar esto, primero exploramos una técnica de localización de sensilla de insectos en bloques incrustados en resina mediante el uso de microscopía de fluorescencia para ver y medir la distancia objetivo al corte. En comparación con el método de recorte TEM tradicional, esta tecnología puede ahorrar tiempo de preparación de muestras y localizar con mayor precisión el sensor de destino. En ausencia de software de medición, se puede colocar una regla escalada en el campo de visión para medir aproximadamente la distancia de destino. La combinación de un ultramicrotome con un microscopio de fluorescencia proporciona observaciones claras del proceso de corte, produciendo cortes precisos de sensilla diana y otros sujetos apropiados.
Divulgaciones
No tenemos ningún conflicto de intereses que revelar.
Agradecimientos
Agradecemos la generosa asistencia del Colegio Vocacional de Agricultura de Beijing, el Instituto para la Aplicación de la Energía Atómica (Academia China de Ciencias Agrícolas), el Centro de Bioinvestigación de la Universidad Forestal de Beijing y el Profesor Shan-gan Zhang del Instituto de Zoología, Academia China de Ciencias. Esta investigación fue apoyada por el Programa Nacional Clave de I+D de China (2017YFD0600103), la Fundación Nacional de Ciencias Naturales de China (Grant No. 31570643, 81774015), Forest Scientific Research in the Public Welfare of China (201504304), Mongolia Interior Plan de inicio de investigación de talento de alto nivel de la Universidad Agrícola (203206038), y proyecto de investigación de educación superior de la región autónoma de Mongolia Interior (NJZZ18047), Inner Mongolia Autonomous Region Linxue "Double First-class" Construction Project (170001).
Materiales
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
Referencias
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215(2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , Springer. 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, Pergamon Press. Oxford. 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. Introduction to Conventional Transmission Electron Microscopy. , Cambridge University Press. Cambridge. 1(2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados