Method Article
طريقة إعداد عينة من المسح الضوئي وانتقال المجهر الإلكتروني لزوائد خنفساء الخشب
In This Article
Summary
من أجل مراقبة البنية الفائقة للsensilla الحشرات ، تم عرض المسح الضوئي والمجهر الإلكتروني للإرسال (SEM و TEM ، على التوالي) بروتوكول إعداد العينة في الدراسة. تمت إضافة Tween 20 إلى المثبت لتجنب تشوه العينة في SEM. كان المجهر الفلوري مفيدًا لتحسين دقة التقطيع في TEM.
Abstract
وصف هذا التقرير طرق إعداد العينة التي تقوم بمسح وانتقال ملاحظات المجهر الإلكتروني ، التي تجلت من خلال إعداد الزوائد من الخنفساء الخشبية ، Chlorophorus caragana Xie & Wang (2012) ، لكلا النوعين من المجهر الإلكتروني. واستند بروتوكول إعداد عينة المجهر الإلكتروني المسح (SEM) على تثبيت عينة الكيميائية، والجفاف في سلسلة من حمامات الإيثانول، والتجفيف، وطلاء البولتر. بإضافة Tween 20 (Polyoxyethylene sorbitan laurate) إلى محلول الغسيل والمثبت ، تم غسل سطح جسم الحشرات من خنفساء الخشب بشكل أكثر نظافة في SEM. هذه الدراسة المجهرية الإلكترونية انتقال (TEM) إعداد عينة شملت سلسلة من الخطوات بما في ذلك التثبيت، وجفاف الإيثانول، والتضمين في الراتنج، وتحديد المواقع باستخدام المجهر الفلوري، والقسمة، وتلطيخ. Fixative مع Tween 20 تمكين اختراق جدار جسم الحشرات من خنفساء الخشب أكثر سهولة مما كان عليه من دون Tween 20 ، وبالتالي أفضل الأنسجة الثابتة والأعضاء في الجسم ، وبالتالي أسفرت عن ملاحظات المجهر الإلكتروني انتقال واضح من الهياكل الفائقة sensilla الحشرات. وكانت الخطوة التالية من هذا الإعداد تحديد مواقف sensilla الحشرات في العينة جزءا لا يتجزأ من كتلة الراتنج باستخدام المجهر الفلوري لزيادة دقة تحديد المواقع sensilla الهدف. هذا تحسين دقة تشريح.
Introduction
المسح المجهري الإلكترون هو أداة هامة في العديد من الدراسات مورفولوجيا، أن SEM يظهر هياكل السطح1،2. نداء المجهر الإلكتروني ناقل الحركة هو أنه يمكن استخدامه لدراسة مجموعة واسعة من الهياكل البيولوجية على مقياس نانومتر، من الهندسة المعمارية للخلايا والبنية الفائقة للorganelles، إلى بنية المجمعات الجزيئية الكلية والبروتينات. TEM يظهر الهياكل الداخلية3،4،5.
Coleoptera هي أكبر مجموعة من الحشرات ، بما في ذلك حوالي 182 أسرة و 350،000 نوع. معظم الحشرات الكولوبثران ، ولا سيما الخنفساء الخشبية ، تتغذى على النباتات ، وكثير منها آفات مهمة من الغابات وأشجار الفاكهة ، مما يسبب أضرارًا مدمرة للأشجار6. في الوقت الحاضر ، والوقاية من ومكافحة السكان من الآفات على أساس نظرية الإيكولوجيا الكيميائية قد تلقت اهتماما متزايدا7. أصبحت أساليب التحكم فعالة ومنخفضة السمية وخالية من التلوث فيرومون طريقة فعالة8. دراسة مورفولوجيا sensilla وultrastructure من الحشرات هو جزء مهم من بحوث البيئة الكيميائية الحشرية. يتم استخدام المجهر الإلكتروني المسح الضوئي وانتقال (SEM و TEM، على التوالي) لتأثير كبير لدراسة مورفولوجيا والتشريح الداخلي. ومع ذلك ، أثناء إعداد عينات الحشرات للمجهر الإلكتروني (EM) ، قد تتأثر موضوعية وأصالة موقع المراقبة9. بشكل عام ، يتطلب إعداد عينة SEM من الحشرات التنظيف ، تثبيت الأنسجة ، الجفاف ، الميتاسب ، التجفيف ، وطلاء السطاق10. نظرًا للبيئة المعقدة التي تعيش فيها الخنفساء الخشبية ، غالبًا ما يكون لسطح الجسم ملوثات مختلفة وغالبًا ما تحتوي الزوائد عليها على العديد من السينسيلا الطويلة الجميلة أو الشعيرات. على وجه الخصوص ، لا تتوفر بعض الحطابين من تربية المختبرات ، والتي تم جمعها مباشرة في الحقل ، ثم وضعها في إصلاح السوائل لضمان نضارة ثم غسلها في المختبر. إذا تم إصلاح العينة أولاثم غسلها، فمن الواضح أنه من الصعب جدا لإزالة الحطام لأن الجلوتارالدهيد يصلح بقوة إلى العينة. Tween 20 هو السطحي11،12،13،14، الذي يلعب دورا هاما في عملية الغسيل ، بما في ذلك الحد من التوتر السطحي للمياه وتحسين قابلية المياه على سطح الغسيل. في هذه الدراسة ، تمت إضافة Tween 20 إلى محلول التثبيت ومحلول تنظيف PBS لتقليل التوتر السطحي للسائل ، ومنع الأوساخ من الترسب على سطح الجسم من الخنفساء الخشبية ، مما جعل سطح الجسم أنظف في SEM.
باستخدام TEM ، يمكن تقطيع sensilla على أعضاء مختلفة من الحشرات إلى شرائح للكشف عن الهياكل الواضحة داخلها ، مما يوفر أساسًا لتحليل وظائف sensilla. عندما تكون الحشرة الخاضعة ، مثل الخنفساء الخشبية ، كبيرة ، وجدار جسمها يحتوي على درجة كبيرة من التصلب ، لذلك قد لا تشبع المثبت أنسجة الأعضاء بالكامل داخل جسم الحشرة. Tween 20 يمكن أن تعزز قدرة التشتت والتعليق من الأوساخ. في هذه الدراسة ، تمت إضافة Tween 20 إلى المثبت لتعزيز تغلغل السوائل المثبت في جدار جسم الحشرات من الخنفساء الخشبية ، وتجنب تشوه وانهيار البشرة11،12،13. وبالإضافة إلى ذلك، وذلك باستخدام تكنولوجيا تشريح العامة، فمن الصعب تحديد بدقة أنواع مختلفة من sensilla، ولا سيما بالنسبة لبعض sensilla الصغيرة15. استنادًا إلى إعداد عينة TEM التقليدية ، جمعت هذه الدراسة بين المجهر الفلوري وSEM لتحديد موقف سينسيلا الحشرات في الكتلة المضمنة ، وبالتالي تحسين دقة التقطيع.
Protocol
تنبيه: راجع أوراق بيانات سلامة المواد الخاصة بالكواشف قبل استخدامها. العديد من المواد الكيميائية المستخدمة أثناء إعداد العينة سامة، مطفرة، مسرطنة، و / أو سامة. استخدام معدات الحماية الشخصية (القفازات، معطف المختبر، والسراويل كامل الطول، والأحذية مغلقة إصبع القدم) والعمل تحت غطاء الدخان أثناء التعامل مع العينة.
1. SEM إعداد عينة والتصوير
- عينة التثبيت والتنظيف
- العمل في منطقة حيث C. كاراغانا تحدث، وجذب البالغين إلى الفخاخ الحقل الطعم مع النباتات الجاذبة، مثل الإيسوفورون16. الحفاظ على الهيئات النظيفة من الكبار C. كاراغانا في 0.1 موللتر -1 الفوسفات العازلة المالحة (PBS, درجة الحموضة 7.2), 2.5% (wt/vol) الجلوتارالدهيد (اللامائية EM غراد), و 0.06% (فول/فول) Tween 20. إصلاح العينة في 4 درجة مئوية خلال عطلة نهاية الأسبوع.
- إزالة الهيئات من السائل حفظ وشطف في عازلة الفوسفات. باستخدام المجسم، وإزالة الزوائد وتنظيفها بالموجات فوق الصوتية (40 كيلو هرتز) في 0.1 مول L-1 الفوسفات العازلة المالحة (درجة الحموضة 7.2) مع 0.06٪ (فول / فول) Tween 20 (PBST). بعد التنظيف لمدة 100 s، نقل العينة إلى المجهر للتحقق مما إذا كان نظيفا. في ظل الظروف العادية، نظيفة لمدة 400s للتأكد من أن العينة كانت نظيفة بما يكفي لمراقبة وليس التالفة.
- عينة الجفاف، وتركيب والتجفيف
- تجفيف العينات باستخدام 20 دقيقة علاجات متتالية في 50٪ ، 60 ٪ ، 70 ٪ ، 80 ٪ ، 85 ٪ ، 90 ٪ ، 95 ٪ ، 100 ٪ ، و 100 ٪ (جميع فول / فول) الإيثانول. تحت المجهر، استخدم شريط لاصق ثنائي الوجهين الكربون لإصلاح بشكل منفصل 3 أسطح المراقبة (الظهرية البطنية والجانبية) على كعوب. لاحظ أنه يجب الحفاظ على جميع أسطح المشاهدة نظيفة وخالية من التلوث. ضع مرحلة العينة في طبق بتري يحتوي على هلام السيليكا المجفف لمدة 48 ساعة.
- سبوتر معطف وعينة الإدراج
- باستخدام هيتاشي كوكي (E-1010) أداة التحجر الأيون، تدوير الصمام الرئيسي إلى موقف مفتوح، وإزالة غطاء غرفة العينة، ووضع العينة في الغرفة. وضع مفتاح الطاقة على، وكان ضوء READY على. تعيين الوقت Sputtering كما 45 ثانية، وسمك الطلاء كما 70.875 Å. مرة واحدة الميكانيكية مضخة فراغ مؤشر الطلب انخفض إلى أقل من 7، اضغط على التفريغ والبدء في رش البلاتين. في نهاية التجربة، قم بإيقاف تشغيل مصدر الطاقة وأخذ العينة من الغرفة. رذاذ سمك الفيلم: د = KIVt ("د" هو سمك الفيلم في وحدة من " Å "; K" هو ثابت، اعتمادا على المعدن المبعثر والغاز. على سبيل المثال، K من الهواء هو 0.07; "I" هو وحدة mA من تدفق البلازما; "V" هو الجهد المطبق في وحدة "KV". "t" هو الوقت في ثوان.
- إدراج كعب الروتين الذي يحتوي على العينة على مرحلة SEM. تأكد من أن مرحلة العينة مع كعب العينة كان ارتفاع كاف للسماح صورة جيدة. افتح برنامج SEM وحدد جهد التشغيل المطلوب، بدءًا من 20 كيلو فولت.
2. TEM إعداد عينة والتصوير
- الحصول على العينة وإصلاحها كما هو الحال في الخطوات 1.1.1 و 1.1.2.
- التنظيف والتثبيت الثانوي والجفاف
- إزالة الكبار C. كاراغانا من السائل حفظ. باستخدام المجسم، وإزالة الزوائد، وغسل العينات في PBST لمدة 3 ح، ومن ثم بعد إصلاحها في 1٪ (wt/vol) الأوميوم tetroxide في PBS ل1h في 25 درجة مئوية. تجفيف العينات باستخدام 20 دقيقة علاجات متتالية في 50٪ ، 60 ٪ ، 70 ٪ ، 80 ٪ ، 85 ٪ ، 90 ٪ ، 95 ٪ ، 100 ٪ ، و 100 ٪ (جميع فول / فول) الإيثانول في درجة حرارة الغرفة.
- تضمين الراتنج والبلمرة
- تضمين العينات في الراتنج في قوالب تضمين مسطحة. كانت العينة في الجزء السفلي من اللوحة وتم وضعها في أقرب وقت ممكن إلى حافة الأخدود الاستراحة. ضع الملصق في الفارغة ثم احتضن الطبق الذي يحتوي على العينة عند درجة حرارة 60 درجة مئوية لمدة 72 ساعة، قم بإزالة الكبسولة من الحاضنة وتحقق من أن الراتنج قد تمبلر.
- عينة المقطعة وتلطيخ
- مرة واحدة تأكد من أن العينة قد تم ترسيخها، ضع كل كتلة الراتنج تحت المجهر الفلوري وتصويرها تحت الضوء الأزرق. حرك مصدر الضوء الفلوري للمجهر حتى يشع العينة من الأعلى. تمكين sensilla في كتلة الراتنج أن يلاحظ بوضوح. تصوير وقياس المسافات لاستهداف sensilla(الشكل 1).
- الرجوع إلى صورة SEM من palps(الشكل 2A)،وقطع ما يقرب من كتلة الراتنج مع شفرة حلاقة لإغلاق مستقبلات الهدف(الشكل 2B).
- بعد ذلك ، باستخدام المجهر الفلوري الأزرق الخفيف ، صور كتلة الراتنج المقطوعة تقريبًا ، وضبط مصدر الضوء من الأعلى بحيث لوحظ sensilla بوضوح. الضوء الأخضر متحمس من الضوء الأزرق خلق ملاحظة مواتية. عند التصوير ، تمت إضافة الميكرومتر الموضوعي (DIV 0.01mm) إلى مرحلة المجهر الفلوري ، ثم تم قياس مسافة الهدف بواسطة برنامج ImageJ (المعهد القومي للصحة في الولايات المتحدة)(الشكل 2C). وقدم مسطرة الصورة من قبل أدوبي فوتوشوب CS5 (أدوبي سيستمز ، وشركة ، سان خوسيه ، كاليفورنيا ، الولايات المتحدة الأمريكية). ثم، لتشريح ultramicrotome، تعيين مسافة القطع، وذلك باستخدام 50-60 نانومتر سمك شريحة، حتى تم التوصل إلى موقف الهدف. استخدام المجهر الفلوري لتحديد المستقبلات المستهدفة.
- قم بتركيب الأقسام على شبكات نحاسية مغلفة بـ Formvar و100 شبكة ، ملطخة بخلات أورانال وسترات الرصاص.
- أولا، إضافة 3.75 ز خلات أورانال إلى 50 مل من 50 ٪ الميثانول. شبكات البقع مع حقنة مصفاة (0.45 ميكرومتر) من محلول مشبع من خلات uranyl في درجة حرارة الغرفة لمدة 10 دقيقة. تغطية المقاطع أثناء تلطيخ لمنع الرواسب الناجمة عن الضوء. شطف 2x في 50 ٪ الميثانول؛ 2x المياه المصفاة degassed.
- ثانيا، إضافة 0.02 غرام من سترات الرصاص إلى 10 مل من المياه المقطرة المزيلة للالغازات في أنبوب الطرد المركزي. إضافة 0.1 مل من 10 ن هيدروكسيد الصوديوم، وختم ويهز لتذوب. شبكات وصمة عار مع حل من سترات الرصاص لمدة 8 دقائق. الطرد المركزي قبل الاستخدام. يجب أن يتم تلطيخ في بيئة خالية من ثاني أكسيد الكربون لمنع تشكيل رواسب كربونات الرصاص. ضع قطرات من البقع على مربعات من أطباق بيتري البلاستيكية. شطف في المياه المصفاة degassed والجافة17. مراقبة لهم عن طريق TEM تعمل في 80 كيلو فولت.
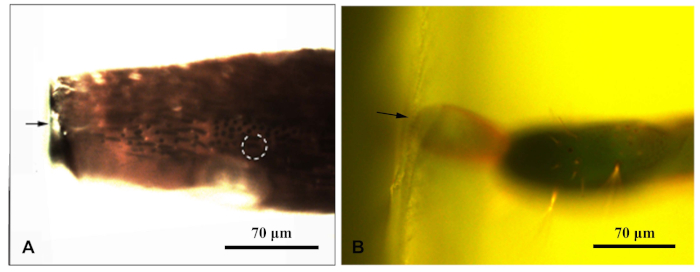
الشكل 1: مجهر الفلورسنت تصوير كتلة الراتنج مرفقة ملحق كاراغانا الكلوروبوهوروس. (أ)كتلة راتنج الهوائي؛ (ب)كتلة الراتنج في نهاية ovipositor. وأشار السهم إلى حافة كتلة الراتنج. الدائرة المنقطة تشير إلى sensilla الهدف. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
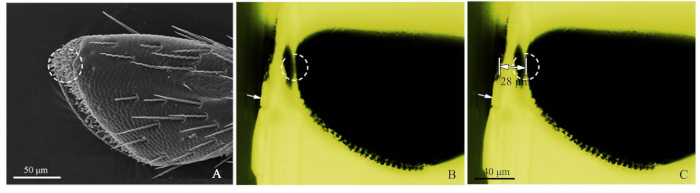
الشكل 2: إجراءات طريقة موقع sensilla الدقيقة. (أ)الجزء الفرعي 4 من palp الفك العلوي من الكلوروبورورس كاراغانا, وأظهرت الدائرة منقط sensilla المستهدفة من قبل SEM. (B) الجزء الفرعي 4 من palp الفك العلوي من C. كاراغانا ينظر إليها المجهر الفلوري. أظهر السهم الأبيض الحافة المقطوعة تقريبًا لكتلة الراتنج وأظهرت الدائرة المنقط ة الموقع الدقيق. (C)المسافة الملحوظة من حافة كتلة الراتنج إلى موقع الهدف العلوي (28 ميكرومتر في هذه العينة). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
باستخدام التنظيف والحل المثبت مع Tween 20 ، لوحظت صورة SEM أنظف من ذلك بدون Tween 20(الشكل 3). Tween 20 حل تحديد اخترقت حل تحديد glutaraldehyde في الأنسجة. وشوهد هيكل Microtubule بوضوح. صورة TEM للهيكل الداخلي للعينة كانت غير واضحة دون Tween 20(الشكل 4).

الشكل 3: sensilla تحديد موقع على هوائي من الكلوروفوراس كاراغانا تحت SEM. مقارنة صورة SEM مع Tween 20(A)وبدون Tween 20(B)، والتي أظهرت أن الصورة A أنظف من الصورة B بشكل عام. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
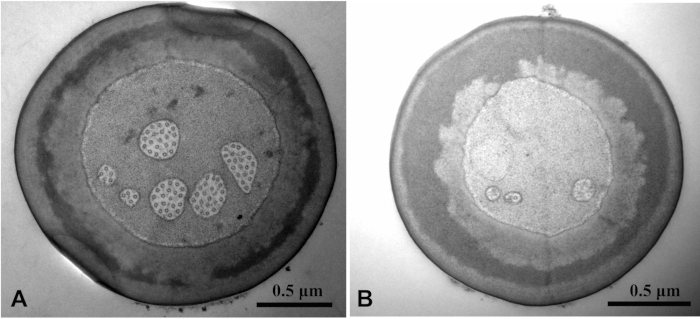
الشكل 4: الكلوروبوحورونا كاراغانا ينظر إليها عن طريق المجهر الإلكتروني انتقال من غصن sensilla الأساسية على palps labial. مقارنة صورة TEM مع توين 20(أ)وبدون توين 20(B). Microtubule هيكل الصورة ألف واضح ، في حين أن من الصورة باء غير واضحة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
استخدمنا SEM لدراسة أنواع وultrastructures من sensilla على palps من C. كاراغانا، العثور على 4 أنواع من sensilla بما في ذلك 10 أنواع فرعية : 1 شعيرات Böhm (BB.) ، 3 sensilla chaetica (Ch.1-Ch.3) ، 1 digitiform sensilla (حفر) ، و 5 sensilla غصن basiconica (S.tb.1-S.tb.5)(الجدول 1). ويستند Sensilla تحديد ultrastructure على مورفولوجياوحجمها 18،19،20،21،22،23. قدمت طرق إعداد العينة لدينا صورًا واضحة للأسطح والهياكل الداخلية الفائقة لsensilla الحشرية.
| عدد | نوع | طول (ميكرومتر)أ | القطر عند القاعدة (μm) | الجدار | تلميح | ماخذ | المسام الكترية | توزيع |
| 1 | Bb. | 5.18 ± 1.25 | 1.70 ± 0.47 | السلس | حاده | واسعه | لا | الفك العلوي بالب، الب الشفر |
| 2 | Ch.1 | 38.59 ± 8.20 | 3.15 ± 0.84 | مخدد | حاده | واسعه | لا | الفك العلوي بالب، الب الشفر |
| 3 | Ch.2 | 81.54 ± 18.07 | 3.75 ± 0.88 | مخدد | حاده | واسعه | لا | الفك العلوي بالب، الب الشفر |
| 4 | Ch.3 | 282.06 ± 22.60 | 6.10 ± 0.70 | مخدد | حاده | واسعه | لا | الب اللافي |
| 5 | حفر. | 24.77 ± 2.98 | 1.24 ± 0.32 | السلس | بلانت | واسعه | لا | الفك العلوي بالب |
| 6 | S.tb.1 | 6.51 ± 1.01 | 2.31 ± 0.25 | مخدد | مع نتوءات | مرفوع وضيق | تلميح المسام | الفك العلوي بالب، الب الشفر |
| 7 | S.tb.2 | 5.91 ± 0.90 | 2.24 ± 0.30 | السلس | بلانت | مرفوع وضيق | تلميح المسام | الفك العلوي بالب، الب الشفر |
| 8 | S.tb.3 | 6.84 ± 0.98 | 1.96 ± 0.35 | السلس | مع نتوءات | مرفوع وضيق | تلميح المسام | الفك العلوي بالب، الب الشفر |
| 9 | S.tb.4 | 2.21 ± 0.59 | 2.86 ± 0.46 | مخدد | مع نتوءات | اثار | تلميح المسام | الفك العلوي بالب، الب الشفر |
| 10 | S.tb.5 | 1.16 ± 0.29 | 1.05 ± 0.19 | السلس | بلانت | مرفوع وواسع | تلميح المسام | الفك العلوي بالب، الب الشفر |
الجدول 1: أنواع sensilla على palps من C. كاراغانا.
لفحص البنية الفائقة داخل sensilla على C. caragana palps، استخدمنا TEM. كان أحد الأمثلة على هذه الدراسات هو الآراء المقطعية المستمرة لربط S.tb.1 على الببس الفكالعلوي. وأظهرت وجهات النظر أن غمد التشجرات تحيط الأجزاء التشجرات الخارجي وتمتد حتى مسام الطرف(الشكل 5A-D). سبعة أجزاء التشجرات الخارجي غير المتفرعة موجودة داخل تجويف الليمفاوية المستقبلة الداخلية، التي كانت محاطة تجويف خارجي(الشكل 5D). تم فصل الجسم الأنبوبي بواسطة غمد التشجرات من الأجزاء التبّاجة الخارجية الأخرى في كل قاعدة محجرة sensillar(الشكل 5E). في المنطقة الهدبية ، لاحظنا 8 تشعبات بأقطار مختلفة ، مما يشير إلى وجود 8 خلايا عصبية ثنائية القطب. وأخيرا، الجزء الهدبي يحتوي على 9 دوبلات microtubule الطرفية(الشكل 5F).

الشكل 5: تيم وجهات النظر من نوع sensilla 1 غصن basiconica (S.tb.1) على الكلوروبوحوروكارا الفك العلوي palp30. (A)S.tb.1 مع خطوط منقط وسم المناطق القريبة من المقاطع العرضية التي اتخذت للتين. بي إي (ب)المقطع العرضي من نتوءات على شكل إصبع تظهر cuticula المتناثرة. (C)المقطع العرضي للمنطقة القاعدية من نتوءات على شكل إصبع تظهر تجاويف الليمفاوية مستقبلات داخلية دون شرائح التشجر الخارجي. (د)المقطع العرضي للمنطقة الوسطى من ربط يظهر غمد التشعب تقسيم تجويف سنسيلوم الليمفاوية في كل من التجاويف الداخلية والخارجية مع 7 أجزاء التشجرات الخارجي في التجويف الداخلي. (E)المنطقة القاعدية من ربط تظهر الجسم أنبوبي محاطة غمد التشجرات وفصلها عن الشرائح التشجرات الخارجي. خلية التورموجين تشكل خارج غمد التبّاج. (واو)المقطع العرضي للمنطقة الهدبية يظهر 8 تشعبات من أقطار مختلفة. الاختصارات: bb، الجسم القاعدي. cs، الجزء الهدبي؛ CW، جدار cuticular؛ DS، غمد التشجرات؛ iRL, التجويف الليمفاوي مستقبلات داخلية; M, microtubule; مي، ميكروفيلي. oD، الجزء التشجر الخارجي؛ oRL, مستقبلات خارجية تجويف الليمفاوية; S.tb.1, نوع 1 غصن sensilla basiconica; السل, الجسم أنبوبي; TH، خلية الثيكوجين؛ إلى, خلية تورموجين; TR، خلية تريشوجين. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذه المقالة ، قدمنا مخطط إعداد عينة للمسح الضوئي والمجهر الإلكتروني لنقل هينخة مملة الخشب. باستخدام ملحق الحشرات كموضوع دراسة تمثيلي ، أظهرنا العديد من التحسينات على طرق إعداد العينة التقليدية.
يتم استحلاب الزيت السائل المنفصل عن السطح الصلب إلى قطرات صغيرة ، والتي يمكن تفريقها وتعليقها بشكل جيد في وسط الغسيل لتقليل إعادة الإيداع على سطح الجسم. يشمل أداء غسيل السطحي جميع الخصائص الأساسية مثل التبلل ، والنفاذية ، والممتلكات المستحلبة ، والتشتت ، والذوبان11،12،13،14. أظهرت آثار المنظفات المختلفة على إعداد عينات إلكترونية مجهرية من Golden Nematode أن Tween 20 كان له أفضل تأثير تنظيف ، يليه بيكربونات الصوديوم ، والماء المقطر24. في هذه الدراسة ، وجدنا أن Tween 20 يمكن استخدامه لتقليل التوتر السطحي للسائل ، ومنع الأوساخ من الترسب على سطح جسم الحشرة ، خاصة بالنسبة للخنفساء الخشبية التي تم جمعها مباشرة في الحقل. تم غسل سطح جسم الحشرات بشكل أكثر نظافة في SEM. مثبت مع Tween 20 اخترق جدار جسم الحشرات بسهولة أكبر ، وبالتالي أفضل الأنسجة الثابتة والأعضاء في الجسم في TEM. وقد تمت دراسة الاستفادة من السطح في إعداد عينة المجهر الإلكتروني على نطاق واسع24،25،26،27،28،29،30،31.
أيضا، اعتمدنا طريقة تعديل الهواء التجفيف لإعداد عينة SEM، التي وضعت عينة المجففة في طبق بتري يحتوي على هلام السيليكا المجففة التي تتبخر تدريجيا عامل الجفاف. أكبر ميزة لهذه الطريقة هو أنها بسيطة، وصيانة سهلة، وأنه يحافظ على الهواء microenvironment الجافة وليس هناك معدات خاصة المطلوبة. طريقة التجفيف الطبيعي هي طريقة بسيطة وعملية وفعالة للبذور والجوز والحفاظ على عينات الحشرات على المدى الطويل. على الرغم من أن حجم العينة يتقلص أثناء عملية التجفيف الطبيعي ، يتم الاحتفاظ بمورفولوجيا العينة الأساسية32. بشكل عام ، تحتوي حشرات Coleoptera على محتوى منخفض نسبيًا من المياه ، ويحيط سطحها بجدران شيتين صلبة. الهواء الجاف قادر على تلبية الاحتياجات. ومع ذلك ، فإن طريقة التجفيف هذه غير مناسبة لتجفيف الأنسجة ذات المحتوى المائي الكبير ، مثل القملة والعث واليرقات ، لأن التوتر السطحي ستشوه العينة أثناء عملية التجفيف.
من أجل مراقبة وحساب نوع وعدد sensilla الموزعة على سطح الملحق ، يجب النظر في الظهرية والبطنية والجانبية للملحق. كانت بعض sensilla قليلة، صغيرة، وأحيانا مغطاة، والمسح الضوئي ومراقبة بعناية من جميع الزوايا للعثور على تلك sensilla جاحظ تماما البشرة أو الناشئة عن الاكتئاب. منذ العديد من sensilla كانت طويلة نسبيا وhairlike، يمكن أن يكون تأثير تلميح كبيرة. لذلك، يجب ألا يكون جهد تسارع المجهر الإلكتروني مرتفعًا جدًا ، وكان 5-20kV أفضل واستخدمنا 20kV.
في تضمين عينة TEM ، كان النموذج أفضل بالقرب من حافة قوالب التضمين المسطحة groovein من أجل توفير الوقت عند خشونة كتلة الراتنج. طريقة TEM التقليدية قطع الراتنج بشكل مستمر واسعة النطاق ، وعادة ما يتم قطع عمياء باستخدام المجهر البصري17،33. لتحسين هذا ، استكشفنا أولاً تقنية توطين sensilla الحشرية في الكتل المضمنة في الراتنج باستخدام المجهر الفلوري لعرض وقياس المسافة المستهدفة للقطع. بالمقارنة مع طريقة التشذيب TEM التقليدية ، يمكن لهذه التكنولوجيا توفير وقت إعداد العينة وتحديد موقع مستشعر الهدف بدقة أكبر. في حالة عدم وجود برامج قياس ، يمكن وضع مسطرة متدرجة في مجال الرؤية لقياس المسافة المستهدفة تقريبًا. يوفر الجمع بين الكائنات فائقة الصغر مع مجهر الفلورسس ملاحظات واضحة لعملية القطع ، مما يؤدي إلى تخفيضات دقيقة للسنسيلا المستهدفة وغيرها من الموضوعات المناسبة.
Disclosures
ليس لدينا تضارب في المصالح للكشف عنه.
Acknowledgements
ونحن نقدر المساعدة السخية التي قدمتها كلية بيجين المهنية للزراعة، ومعهد تطبيق الطاقة الذرية (الأكاديمية الصينية للعلوم الزراعية)، ومركز البحوث البيولوجية التابع لجامعة بيجين للغابات، والبروفيسور شان - غان تشانغ من معهد علم الحيوان، الأكاديمية الصينية للعلوم. تم دعم هذا البحث من قبل البرنامج الوطني للبحث والتطوير الرئيسي في الصين (2017YFD0600103)، والمؤسسة الوطنية للعلوم الطبيعية في الصين (المنحة رقم 31570643، 81774015)، البحث العلمي للغابات في الرفاه العام في الصين (201504304)، منغوليا الداخلية الجامعة الزراعية عالية المستوى خطة بدء تشغيل البحوث المواهب (203206038)، ومنطقة منغوليا الداخلية ذاتية الحكم مشروع بحوث التعليم العالي (NJZZ18047)، منطقة منغوليا الداخلية ذاتية الحكم Linxue "مزدوجة من الدرجة الأولى" مشروع البناء (170001).
Materials
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
References
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215 (2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. . Introduction to Conventional Transmission Electron Microscopy. , 1 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved