Method Article
הכנה לדוגמה שיטת סריקה ומיקרוסקופ אלקטרון שידור לתוספות של החיפושית המשעממת
In This Article
Summary
כדי להתבונן במבנה האולטרסאונד של מבנה החרקים, סריקה והעברה של מיקרוסקופ אלקטרונים (SEM ו-TEM, בהתאמה) פרוטוקול הכנה לדוגמה הוצגו במחקר. יצירת רצף 20 נוספה לתוך התיקונים כדי למנוע דפורמציה לדוגמה ב-SEM. מיקרוסקופ פלואורסצנטית היה מועיל לשיפור דיוק חיתוך ב TEM.
Abstract
דו ח זה תיאר שיטות הכנה למדגם שסורקים ומשנים תצפיות מיקרוסקופ אלקטרונים, הפגינו על ידי הכנת תוספות של חיפושית היער המשעמם, כלוראופורוס caragana Xie &Amp; וואנג (2012), עבור שני סוגים של מיקרוסקופ אלקטרוני. סריקת המיקרוסקופ אלקטרון (SEM) לדוגמה הפרוטוקול היתה מבוססת על קיבוע כימי לדוגמה, התייבשות בסדרה של אמבטיות אתנול, ייבוש, וציפוי sputter. על ידי הוספת רצף 20 (Polyoxyethylene ביתן לוראט) לפתרון התיקונים והשטיפה, משטח גוף החרק של חיפושית הוודנית נשטף ביותר בתוך SEM. שידור זה של המחקר של אלקטרון מיקרוסקופ (TEM) לדוגמה הכנה מעורב סדרה של שלבים כולל קיבעון, התייבשות אתנול, הטבעה שרף, מיצוב באמצעות מיקרוסקופ הזריחה, הצבת, ו כתמים. מתוקן עם רצף 20 זמין לחדור את קיר גוף החרק של חיפושית משעממת בקלות רבה יותר מאשר היה להיות ללא רצף 20, ולאחר מכן רקמות קבועות יותר ואיברים בגוף, ובכך הניב ברור שידור אלקטרון תצפיות מיקרוסקופ של חרק sensilla מבנים. השלב הבא של הכנה זו היה לקבוע את המיקומים של sensilla חרק במדגם מוטבע בלוק שרף באמצעות מיקרוסקופ הזריחה כדי להגדיל את הדיוק של מיצוב היעד sensilla. דיוק זה לחתוך משופר.
Introduction
סריקת מיקרוסקופ אלקטרון הוא כלי חשוב במחקרים מורפולוגיה רבים, SEM מראה מבנים פני השטח1,2. הערעור של המיקרוסקופיה האלקטרונים הוא שניתן להשתמש בו כדי ללמוד מגוון רחב של מבנים ביולוגיים בסולם הננו, מארכיטקטורת התאים ומבנה האולטרהאורגלים, למבנה של מכלולי macromolecular וחלבונים. TEM מראה מבנים פנימיים3,4,5.
Coleoptera היא הקבוצה הגדולה ביותר של חרקים, כולל כ 182 משפחות ו 350,000 מינים. רוב החרקים המתקוטנים, בחיפושית משעממת במיוחד, ניזונים מצמחים, שרבים מהם הם מזיקים חשובים של יערות ועצי פרי, דבר הגורם לנזק הרסני לעצים6. כיום, אוכלוסיית המניעה והבקרה של המזיקים המבוססת על תיאוריית האקולוגיה הכימית קיבלה את תשומת הלב הגוברת7. יעיל, נמוך, רעיל, מזהמים ללא זיהום שיטות שליטה הפכו להיות דרך יעילה8. לימוד המבנה הסגילה ומבנה האולטרסאונד של החרקים הוא חלק חשוב ממחקר האקולוגיה הכימית של החרקים. מיקרוסקופ אלקטרוני סריקה והעברה (SEM ו-TEM, בהתאמה) משמשים להשפעה רבה כדי ללמוד את המבנה שלהם ואת האנטומיה הפנימית. עם זאת, במהלך הכנת דגימות חרקים עבור מיקרוסקופ אלקטרוני (EM), האובייקטיביות והאותנטיות של אתר התצפית עשויים להיות מושפעים9. באופן כללי, הכנת SEM לדוגמה של חרקים דורש ניקוי, קיבוע רקמות, התייבשות, מטאמתזה, ייבוש, ציפוי sputter אטר10. בשל הסביבה המורכבת שבה החיפושית המשעממת חיה, משטח הגוף לעתים קרובות יש מזהמים שונים והתוספות שלהם לעתים קרובות יש הרבה sensilla ארוך ומשובח או זיפים. בפרט, חלק מהעצים אינם זמינים מגידול במעבדה, שנאסף ישירות בתחום, ולאחר מכן הכניסו לתיקון נוזלים כדי להבטיח רעננות ולאחר מכן נשטפו במעבדה. אם המדגם הוא קבוע הראשון ולאחר מכן שטף, ברור שזה הרבה יותר קשה להסיר את הפסולת כי glutarאלדהיד מאוד מתקן אותו למדגם. מפעיל 20 הוא מעין משטח של11,12,13,14, אשר ממלא תפקיד חשוב בתהליך השטיפה, כולל הפחתת מתח הפנים של המים ושיפור הווטביליות של מים על פני הכביסה. במחקר זה, רצף 20 נוספה לפתרון תיקון ופתרון ניקוי PBS כדי להפחית את המתח פני השטח של הנוזל, ולמנוע את הלכלוך מפני הפקדת על משטח הגוף של חיפושית משעממת, אשר עשה את הגוף המנקה משטח ב-SEM.
באמצעות TEM, sensilla על איברים שונים של חרקים ניתן לחתוך כדי לחשוף את מבנים ברורים בתוכם, ובכך לספק בסיס לניתוח פונקציות sensilla. כאשר חרק הנושא, כגון חיפושית משעממת, גדול, ולקיר הגוף שלה יש מידה ניכרת של sclerotization, כך הקיבעון לא יכול למלא רקמות איברים בתוך גוף החרק. רצף 20 יכול לשפר את הפיזור ואת היכולת ההשעיה של הלכלוך. במחקר זה, רצף 20 נוספה כדי קבע כדי לשפר חדירה נוזל קבע לתוך קיר גוף החרק של חיפושית משעממת, הימנעות דפורמציה והתמוטטות של epidermi11,12,13. בנוסף, באמצעות טכנולוגיה כללית לחתוך, קשה לאתר במדויק סוגים שונים של sensilla, במיוחד עבור כמה sensilla קטן15. מבוסס על הכנה לדוגמה המסורתית TEM, מחקר זה משולב מיקרוסקופ זריחה ו-SEM כדי לקבוע את המיקום של sensilla חרק בבלוק מוטבע, ובכך לשפר את דיוק החיתוך.
Protocol
התראה: עיין בגיליונות הנתונים של בטיחות החומרים של ריאגנטים לפני השימוש בהם. כמה מן הכימיקלים המשמשים במהלך הכנת המדגם רעילים, מוטנאיים, קרצינוגני, ו/או reprotoxic. השתמש בציוד הגנה אישי (כפפות, חלוק מעבדה, מכנסיים באורך מלא ונעלי הבוהן סגורות) ועבוד תחת מכסה המנוע תוך טיפול במדגם.
1. SEM הכנה לדוגמה והדמיה
- קיבעון לדוגמא וניקוי
- עבודה באזור שבו C. caragana להתרחש, למשוך מבוגרים לתוך מלכודות בשדה מצוידים עם מושך הצמח, כגון isophorone16. שמור על הגופים הנקיים של בוגרים C. caragana ב 0.1 מול L-1 פוספט-מלוחים באגירה (PBS, pH 7.2), 2.5% (wt/vol) גלוטארלדהיד (ANהידרוOUS EM גראד), ו 0.06% (vol/vol). בסדר. . לתקן את הדגימה ב -4 מעלות צלזיוס בסוף השבוע
- הסירו את הגופות מנוזל השימור ושטפו במאגר פוספט. באמצעות stereomicroscope, להסיר את התוספות ולנקות אותם באולטרסאונד (40 kHz) ב 0.1 מול L-1 פוספט באגירה מלוחים (pH 7.2) עם 0.06% (vol/vol) יצירת רצף 20 (pbst). לאחר ניקוי עבור 100 s, להעביר את המדגם למיקרוסקופ כדי לבדוק אם זה היה נקי. בנסיבות רגילות, נקי 400s כדי להבטיח כי המדגם היה נקי מספיק כדי להתבונן ולא ניזוק.
- לדוגמה התייבשות, הרכבה וייבוש
- מייבשים את הדגימות על ידי שימוש 20 דקות הטיפולים רצופים 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100%, ו 100% (כל vol/vol) אתנול. תחת מstereomicroscope, השתמש בנייר דבק דו צדדי הפחמן כדי לתקן בנפרד 3 משטחי התבוננות (מעבר לרוחב ורוחבי) על הספחים. שים לב כי כל משטחי הצפייה חייבים להישמר נקי ללא זיהום. מניחים את שלב המדגם בצלחת פטרי המכילה סיליקה ג'ל לייבוש 48 h.
- ספאטר-מעיל והחדרת דגימה
- באמצעות Hitachi Koki (E-1010) מכשיר התזה היון, לסובב שסתום ראשי כדי לפתוח את המיקום, להסיר את המכסה החדר לדוגמה, ולשים את המדגם לתוך החדר. הפעל את מתג ההפעלה והנורית המוכנה דולקת. הגדרת זמן התזה כ45 שניות, ועובי ציפוי כ 70.875 Å. לאחר משאבה מכנית אינדקס חיוג ריק ירד מתחת 7, לחץ על פריקה ולהתחיל לרסס פלטינה. בסוף הניסוי, כבו את אספקת החשמל וקחו את הדגימה מהחדר. ספריי עובי הסרט: d = KIVt ("d" הוא עובי הסרט ביחידת "Å"; " K "הוא קבוע, תלוי במתכת ובגז המגמגם. לדוגמה, K of air הוא 0.07; "אני" היא יחידת התואר השני של תזרים הפלזמה; "V" הוא המתח המוחל ביחידת ה-KV. . טי "זה הזמן בשניות"
- הכנס את ה-stub המכיל את המדגם אל השלב של SEM. ודא שלשלב המדגם עם ה-stub לדוגמה היה מספיק גובה כדי לאפשר תמונה טובה. פתח את תוכנת ה-SEM ובחר במתח ההפעלה הרצוי, החל מ-20 kV.
2. TEM הכנה לדוגמה והדמיה
- השג ותקן את המדגם כמו בשלבים 1.1.1 ו-1.1.2.
- ניקוי, קיבעון משני והתייבשות
- הסרת מבוגר בקירוב מנוזל השימור. באמצעות stereomicroscope, להסיר את התוספות, לשטוף את הדגימות ב-pbst עבור 3 h, ולאחר מכן לאחר לתקן אותם ב 1% (wt/vol) אוסמיום tetroxide ב-PBS עבור 1h ב 25 ° c. מייבשים את הדגימות על ידי שימוש 20 דקות הטיפולים הרצופים ב 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100%, ו 100% (כל vol/vol) אתנול בטמפרטורת החדר.
- שרף הטבעה ופולימוניזציה
- להטביע את הדגימות שרף בתוך תבניות הטבעה שטוח. המדגם היה בתחתית הצלחת והוצב קרוב ככל האפשר לקצה של החריץ שקוע. מניחים את התווית בריק ולאחר מכן מודקת את הצלחת המכילה את המדגם ב 60 ° c עבור 72 h. הסר את הקפסולה מן החממה ולוודא כי שרף היה הפילמור.
- הפחתת דגימה וכתמים
- לאחר להבטיח את המדגם היה מתחזק, מקום כל לחסום שרף תחת מיקרוסקופ פלואורסצנטית ולצלם אותם תחת אור כחול. הזז את מקור אור הפלורסנט של המיקרוסקופ כך שהוא הקרינה את המדגם מלמעלה. לאפשר sensilla בבלוק שרף להיות נצפתה בבירור. צולם ולמדוד מרחקים למקד את sensilla (איור 1).
- עיין בתמונת SEM של משושים (איור 2א), וחותכים בערך את הבלוק שרף עם להב תער כדי לסגור את קולטן היעד (איור 2ב).
- הבא, באמצעות כחול אור מיקרוסקופ פלואורסצנטית, צילום לחסום שרף בערך לחתוך, התאמת מקור האור מלמעלה כך sensilla נצפתה בבירור. אור ירוק נרגש על ידי אור כחול יצר התבוננות חיובית. כאשר הדמיה, המיקרומטר האובייקטיבי (DIV 0.01 מ"מ) נוסף לשלב המיקרוסקופ הפלואורסצנטית, ולאחר מכן המרחק של היעד נמדד על ידי תוכנת ImageJ (המכון הלאומי לבריאות) (איור 2ג). השליט התמונה נעשה על ידי אדובי פוטושופ CS5 (אדובי מערכות, Inc., סן חוזה, CA, ארה ב). לאחר מכן, לחיתוך אולטרה-מיקרוטומה, קבעו את מרחק החיתוך, תוך שימוש בעוביים של 50-60 ננומטר, עד לקבלת מיקום היעד. השתמש מיקרוסקופ פלואורסצנטית כדי לאתר את קולטן היעד.
- הר את הסעיפים על Formvar-מצופה, 100-mesh רשתות נחושת, מוכתם פעמיים עם אצטט uranyl ו להוביל ציטראט.
- ראשית, להוסיף 3.75 גרם uranyl אצטט 50 mL של 50% מתנול. רשתות כתם עם מזרק מסונן (0.45 μm) של פתרון רווי של אצטט uranyl בטמפרטורת החדר עבור 10 דקות. מקטעים לכסות במהלך הכתמים כדי לחסום המושרה באור מדגיש. לשטוף 2x ב 50% מתנול; . מים מסוננים של 2 x
- שנית, להוסיף 0.02 g להוביל ציטראט ל 10 מ ל של מים מזוקקים המלח בשפופרת צנטריפוגה. הוסף 0.1 mL של 10 N נתרן הידרוקסיד, חותם לרעוד להתמוסס. כתם רשתות עם פתרון של עופרת ציטראט עבור 8 דקות. צנטריפוגה לפני השימוש. יש לבצע כתמים בסביבה ללא פחמן דו-חמצני, כדי למנוע היווצרות של פחמי עופרת. מניחים טיפות של כתם על ריבועים של מנות פטרי מפלסטיק. שטפו מים מסוננים ויבשים17. להתבונן בהם באמצעות TEM הפעלה ב 80 kV.
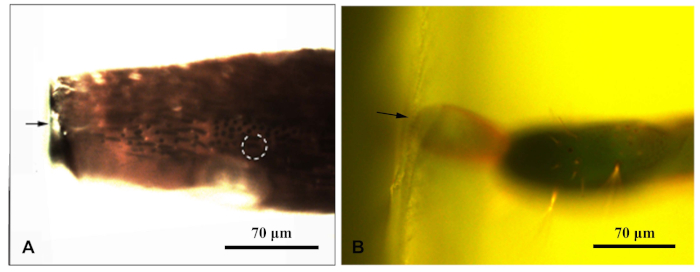
איור 1: מיקרוסקופ פלורסנט צילם בלוק שרף התוחם את התוספת של כלוררופחורוס caragana. (A) שרף אנטנהלחסום; (ב) שרף בלוק בסוף ההטלה. החץ מציין את קצה בלוק שרף; עיגול מנוקד מציין את sensilla היעד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
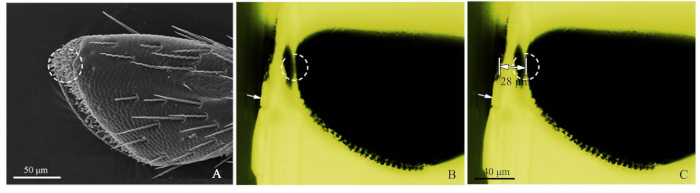
איור 2: הליכים של שיטת המיקום המדויק של sensilla. (א) החלק הרביעי של פלח הלסת הרביעית של כלוראופחורוס caragana, העיגול המנוקד הראה את הסנסגילה המכוון על ידי SEM. (ב) המשנה הרביעית של לום של הלסת התחתית של C. caragana שהוצג על ידי מיקרוסקופ פלואורסצנטית. החץ הלבן הראה את הקצה החתוך בערך של הבלוק שרף העיגול מנוקד הראה את המיקום המדויק. (ג) המרחק המסומן מקצה בלוק השרף למיקום היעד לום הלסת התחתית (28 יקרומטר במדגם זה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
באמצעות ניקוי הפתרון הקבע עם רצף 20, התמונה SEM מנקה נצפתה מזה ללא רצף 20 (איור 3). . מתקן את פתרון התמיסה לרקמות . מבנה מיקרוטוכדורית נראה בבירור תמונה TEM של המבנה הפנימי של המדגם היה מטושטש ללא רצף 20 (איור 4).

איור 3: הסנסגילה מאתרת את האנטנה של כלוראופחורוס caragana תחת SEM. השוואה של תמונת SEM עם רצף 20 (א) וללא הרצף 20 (ב), אשר הראה תמונה זו היא נקייה יותר מאשר תמונה ב' באופן כללי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
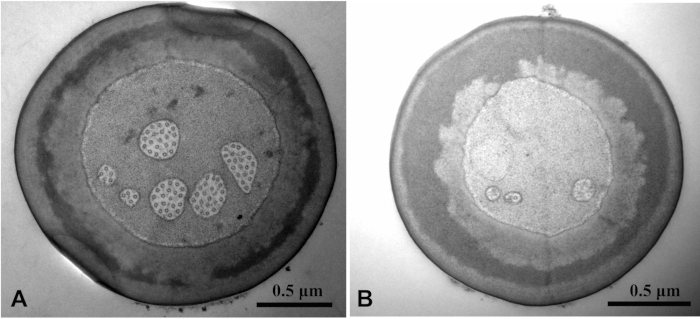
איור 4: כלוראופורוס caragana מוצג על ידי שידור אלקטרון מיקרוסקופ של הענף הססדלה בסיסה על הלוח הלאואלי. השוואה של תמונת TEM עם רצף 20 (א) ו ללא רצף 20 (ב). מבנה מיקרוטובית של התמונה A ברור, בעוד זה של התמונה B הוא מטושטש. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
השתמשנו SEM כדי ללמוד את הסוגים ואת האולטרה מבנים של sensilla על משושים של C. caragana, מציאת 4 סוגים של sensilla כולל 10 תתי סוגי: 1 זיפי בתים (BB.), 3 sensilla שלישי (ch. 1-Ch .3), 1 דיגיטיפורם סאנסגילה (לחפור), ו-5 בסיסה של הזרד (s. tb .1-s. tb. 5) (שולחן 1). זיהוי sensilla ו ultrastructure בנה התבססה על המבנה שלהם בגודל18,19,20,21,22,23. שיטות ההכנה לדוגמה שלנו הפנו תמונות ברורות של המשטחים והמבנים הפנימיים של מבנה החרקים.
| ספר | סוג | אורך (μm)מ | קוטר בבסיס (μm)מ | קיר | עצה | שקע | נקבוביות כשות | פצה |
| 1 | BB. | 5.18 ± 1.25 | 1.70 ± 0.47 | חלק | חדה | רחב | לא | לבנה מירבי |
| 2 | Ch .1 | 38.59 ± 8.20 | 3.15 ± 0.84 | חורץ | חדה | רחב | לא | לבנה מירבי |
| 3 | Ch .2 | 81.54 ± 18.07 | 3.75 ± 0.88 | חורץ | חדה | רחב | לא | לבנה מירבי |
| 4 | Ch .3 | 282.06 ± 22.60 | 6.10 ± 0.70 | חורץ | חדה | רחב | לא | מיכל שלמה |
| מיכל 5 | חפור. | 24.77 ± 2.98 | 1.24 ± 0.32 | חלק | קהה | רחב | לא | כיפת הלסת מירבי |
| 6 | S. tb .1 | 6.51 ± 1.01 | 2.31 ± 0.25 | חורץ | עם בליטות | מוגבה ומתוח | נקבובית של עצה | לבנה מירבי |
| 7 | ש. tb .2 | 5.91 ± 0.90 | 2.24 ± 0.30 | חלק | קהה | מוגבה ומתוח | נקבובית של עצה | לבנה מירבי |
| 8 | ש. tb .3 | 6.84 ± 0.98 | 1.96 ± 0.35 | חלק | עם בליטות | מוגבה ומתוח | נקבובית של עצה | לבנה מירבי |
| 9 | ש. tb .4 | 2.21 ± 0.59 | 2.86 ± 0.46 | חורץ | עם בליטות | גדל | נקבובית של עצה | לבנה מירבי |
| 10 | ש. tb .5 | 1.16 ± 0.29 | 1.05 ± 0.19 | חלק | קהה | גדל ורחב | נקבובית של עצה | לבנה מירבי |
שולחן 1: סוגי sensilla על משושים של ג. caragana.
כדי לבחון את מבנה האולטרה-סאונד בתוך הסנסגילה ב -C. caragana palps, השתמשנו ב-TEM. אחת הדוגמאות למחקרים אלה הייתה מתמשכת, והשקפות מוצלבות של היתד של ה. tb. 1 על הלסת הראשונה. התצוגות הראו כי הנרתיק הדנדריטי הקיף את פלחי הדנדריטים החיצוניים והורחב עד לנקבובית הקצה (איור 5א-ד). שבעה מגזרים דנדריטי החיצוני היה קיים בתוך חלל לימפה הקולטן הפנימי, אשר היה מוקף חלל החיצון (איור 5ד). הגוף הצינורי הופרד באמצעות נדן דנדריטי מקטעים דנדריטים אחרים בבסיס השקע החיצוני (איור 5E). באזור הסילימארי, ציינו 8 דנדטים של קטרים שונים, המציינים את נוכחותם של 8 נוירונים דו-קוטבי. לבסוף, הפלח החד הכיל 9 מיקרוכדורית היקפית (איור 5F).

איור 5: התצוגות TEM של הסוג sensilla 1 בסיסה הענף (S. tb .1) על כלורופורוס caragana מקסימום הלסת הראשונה של30. (א) S. tb .1 עם קווים מנוקדים מסמנים אזורים הקרובים לחלקים הצולבים שנלקחו לאיורים. . בי. אי (ב) חתך רוחב של בליטות בצורת אצבע המראה את הדלוקות המפותלים. (ג) חתך באזור הבסיס של בליטות בצורת אצבע מראה חללים פנימיים לימפה הקולטן ללא מקטעים דנדריטי החיצוני. (ד) חתך של האזור האמצעי של יתד מראה את הנדן הדנדריטי חלוקת החלל sensillum לימפה לתוך חללים פנימיים וחיצוניים עם 7 מגזרים דנדריטים החיצוני בחלל הפנימי. (ה) האזור הבזאלי של יתד מראה את הגוף הצינורי מוקף נדן דנדריטי מופרד מקטעים דנדריטי החיצון. תא של טורמוגן יוצר את החלק החיצוני של המעטפת הדנדריטית. (ו) חתך רוחב של אזור הסילימארי המציג 8 דנדריטים של קטרים שונים. קיצורים: bb, גוף בסיס; מגזר, מקטע סיליארי; CW, הקיר הקושתי; DS, מעטפת דנדריטי; נביאה, חלל לימפה קולטן פנימי; M, כדורית; מי, מיקרווילי; oD, קטע דנדריטי חיצוני; בזן, חלל לימפה הקולטן החיצוני; S. tb .1, סוג 1 sensilla הענף בסיסה; שחפת, גוף צינורי; TH, תא thecogen; אל, תא tormogen; TR, תא trichogen. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
במאמר זה, הצגנו ערכת הכנה לדוגמה לסריקת והעברת מיקרוסקופ אלקטרוני לחיפושית משעממת. השימוש בנספח החרקים כנושא מחקר מייצג, הדגמנו מספר שיפורים בשיטות ההכנה לדוגמה המסורתית.
השמן הנוזלי המנוקל מפני השטח המוצק הוא תחליב לטיפות קטנות, שיכול להיות מפוזר היטב ומושעה במדיום הכביסה כדי להפחית את הכיוון החיצוני על פני העצם. ביצוע כביסה של הארגון כולל את כל המאפיינים הבסיסיים כגון wettability, חדירות, המאפיין אמולסיה, דיביליזציה, מסיסות11,12,13,14. השפעות של חומרי ניקוי שונים על ההכנה של אלקטרון מיקרוסקופי דגימות של Nematode הזהב הראה כי רצף 20 היה אפקט ניקוי הטובה ביותר, ואחריו נתרן ביקרבונט, ו מים מזוקקים24. במחקר זה, מצאנו כי רצף 20 יכול לשמש כדי להפחית את המתח פני השטח של הנוזל, ולמנוע את הלכלוך מהפקדת על משטח הגוף של החרק, במיוחד עבור חיפושית משעממת שנאסף ישירות בשדה. משטח גוף החרקים נשטף בצורה נקייה יותר ב-SEM. תיקונים עם רצף 20 חדרו לקיר גוף החרק ביתר קלות, ולאחר מכן רקמות קבועות ואיברים טובים יותר בגוף TEM. היתרון של מפעילי המחקר הכנה במיקרוסקופיה אלקטרונית למד בהרחבה24,25,26,27,28,29,30,31.
כמו כן, אימצנו שיטה לייבוש האוויר עבור הכנה לדוגמה SEM, שבה המדגם מיובש הושם בצלחת פטרי המכיל לחות סיליקה ג'ל, כי בהדרגה מתאדה את הסוכן הפחתת היובש. היתרון הגדול ביותר של שיטה זו הוא שזה פשוט, מתוחזק בקלות, והוא שומר על האוויר המיקרוסביבה יבש ולא ציוד מיוחד הנדרש. שיטת הייבוש הטבעית היא שיטה פשוטה, מעשית ויעילה לשימור זרע, אגוז ושימור לטווח ארוך של דגימות של חרקים. למרות שנפח המדגם מתכווץ בתהליך הייבוש הטבעי, המבנה הבסיסי של המדגם נשמר32. באופן כללי, לחרקים Coleoptera יש תוכן נמוך יחסית, ומשטח המים שלהם מוקף בקירות כאלה קשים. האוויר היבש מסוגל לעמוד בדרישות. עם זאת, שיטת ייבוש זו אינה מתאימה לייבוש של רקמות עם תכולת מים גדולה, כגון הכינה, קרדית, והזחלים, מכיוון שהמתח החיצוני יגרום לדגימה במהלך תהליך הייבוש.
כדי להתבונן ולחשב את סוג ומספר של sensilla מופץ על פני השטח של הנספח, בראש, ולרוחב של התוספת חייב להיחשב. כמה sensilla היו מעטים, קטנים, ולפעמים מכוסה, לסרוק ולהתבונן בזהירות מכל הזוויות כדי למצוא את sensilla לחלוטין בולטות האפידרמיס או הנובעים הדיכאון. מאז sensilla רבים היו ארוכים יחסית שיער, אפקט הטיפ יכול להיות משמעותי. אז, מתח האצה במיקרוסקופ אלקטרונים לא צריך להיות גבוה מדי, 5-20kV היה הטוב ביותר והשתמשנו 20kV.
בהטבעת לדוגמה TEM, המדגם היה טוב יותר קרוב לקצה של הטבעה ההטבעה שטוח הסדר כדי לחסוך זמן כאשר האלימה בלוק שרף. שיטת TEM מסורתית ברציפות חיתוך שרף הוא נרחב, וזה בדרך כלל לחתוך באופן עיוור באמצעות מיקרוסקופ אופטי17,33. כדי לשפר את זה, אנחנו הראשון בחנו את טכניקת הלוקליזציה של חרק sensilla ב שרף-מוטבע בלוקים באמצעות מיקרוסקופ הזריחה כדי להציג ולמדוד את מרחק היעד לחתוך. בהשוואה לשיטה המסורתית הזמירה TEM, טכנולוגיה זו יכולה לחסוך זמן הכנה לדוגמה ומדויק יותר לאתר את חיישן היעד. בהיעדר תוכנת מדידה, ניתן להציב סרגל שינוי קנה מידה בשדה התצוגה כדי למדוד במידה רבה את מרחק היעד. השילוב של ultramicrotome עם מיקרוסקופ פלואורסצנטית מספק תצפיות ברורות של תהליך הגזירה, מניב חתכים מדויקים של היעד sensilla ונושאים מתאימים אחרים.
Disclosures
. אין לנו ניגוד אינטרסים לגלות
Acknowledgements
אנו מעריכים את הסיוע הנדיב של המכללה התעסוקתית של בייג לחקלאות, המכון ליישום של אנרגיה אטומית (האקדמיה הסינית למדע החקלאי), מרכז המחקר Bioresearch אוניברסיטת בייג יערנות ופרופסור שאן-גן ג'אנג המכון לזואולוגיה, האקדמיה הסינית למדעים. מחקר זה נתמך על ידי תוכנית הלאומית של מפתח R & D של סין (2017YFD0600103), הקרן הלאומית למדע הטבע של סין (גרנט No. 31570643, 81774015), יער מחקר מדעי ברווחה הציבורית של סין (201504304), מונגוליה הפנימית האוניברסיטה החקלאית ברמה גבוהה מחקר כשרונות תוכנית אתחול (203206038), והאזור האוטונומי של מונגוליה הפנימית פרויקט מחקר להשכלה גבוהה (NJZZ18047), האזור האוטונומי של מונגוליה הפנימית Linxue "כפול במחלקה ראשונה" פרויקט בנייה (170001).
Materials
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
References
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215 (2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. . Introduction to Conventional Transmission Electron Microscopy. , 1 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved