Method Article
Probenvorbereitungsmethode des Raster- und Transmissionselektronenmikroskops für die Anhänge von Woodboring Beetle
In diesem Artikel
Zusammenfassung
Zur Beobachtung der Ultrastruktur von Insektensensilla wurden in der Studie Raster- und Transmissionselektronenmikroskopie (SEM bzw. TEM) zur Probenvorbereitung vorgestellt. Tween 20 wurde in das Fixativ aufgenommen, um Probenverformungen in SEM zu vermeiden. Fluoreszenzmikroskopie war hilfreich, um die Schnittgenauigkeit in TEM zu verbessern.
Zusammenfassung
Dieser Bericht beschrieb Probenvorbereitungsmethoden, die Raster- und Transmissionselektronenmikroskop-Beobachtungen, die durch die Vorbereitung von Anhängsel des Holzbohrkäfers Chlorophorus caragana Xie & Wang (2012) für beide Arten der Elektronenmikroskopie demonstriert wurden. Das Rasterelektronenmikroskopieprotokoll (SEM) basierte auf probenchemischer Fixierung, Dehydrierung in einer Reihe von Ethanolbädern, Trocknung und Sputterbeschichtung. Durch Zugabe von Tween 20 (Polyoxyethylen-Sorbitan-Laurat) zur Fixier- und Waschlösung wurde die Insektenkörperoberfläche des Holzbohrkäfers im SEM sauberer gewaschen. Die Probenvorbereitung der Transmissionselektronenmikroskopie (TEM) in dieser Studie umfasste eine Reihe von Schritten, einschließlich Fixierung, Ethanoldehydrierung, Einbettung in Harz, Positionierung mittels Fluoreszenzmikroskopie, Schnittung und Färbung. Fixative mit Tween 20 aktiviert eindringen die Insektenkörperwand von Holzbohrkäfer leichter als es ohne Tween 20 gewesen wäre, und in der Folge bessere feste Gewebe und Organe im Körper, so ergab klare Transmission Elektronenmikroskop Beobachtungen von Insekten sensilla Ultrastrukturen. Der nächste Schritt dieser Vorbereitung war die Bestimmung der Positionen der Insektensensorilla in der im Harzblock eingebetteten Probe durch die Verwendung der Fluoreszenzmikroskopie, um die Präzision der Zielsensilla-Positionierung zu erhöhen. Dies verbesserte die Schnittgenauigkeit.
Einleitung
Die Rasterelektronenmikroskopie ist ein wichtiges Werkzeug in vielen Morphologiestudien, dass SEM Oberflächenstrukturen1,2zeigt. Der Reiz der Transmissionselektronenmikroskopie ist, dass sie verwendet werden kann, um eine breite Palette biologischer Strukturen im Nanometermaßstab zu untersuchen, von der Architektur der Zellen und der Ultrastruktur von Organellen bis hin zur Struktur makromolekularer Komplexe und Proteine. TEM zeigt innere Strukturen3,4,5.
Coleoptera ist die größte Insektengruppe, darunter etwa 182 Familien und 350.000 Arten. Die meisten der coleopteran Insekten, insbesondere Holzbohrkäfer, ernähren sich von Pflanzen, von denen viele wichtige Schädlinge von Wäldern und Obstbäumen sind, die verheerende Schäden an Bäumenverursachen 6. Zur Zeit, Prävention und Kontrolle Der Population von Schädlingen auf der Grundlage der chemischen Ökologie Theorie haben immer mehr Aufmerksamkeit erhalten7. Effiziente, niedriggiftige, schadstofffreie Pheromon-Kontrollmethoden sind zu einem effektiven Weg geworden8. Das Studium der Sensilla-Morphologie und Ultrastruktur von Insekten ist ein wichtiger Teil der chemischen Ökologieforschung in Insekten. Die Raster- und Transmissionselektronenmikroskopie (SEM bzw. TEM) wird zur Untersuchung ihrer Morphologie und inneren Anatomie eingesetzt. Bei der Vorbereitung von Insektenproben für die Elektronenmikroskopie (EM) kann jedoch die Objektivität und Authentizität der Beobachtungsstelle beeinträchtigt werden9. Im Allgemeinen erfordert die SEM-Probenvorbereitung von Insekten Reinigung, Gewebefixierung, Dehydrierung, Metathesen, Trocknung und Sputterbeschichtung10. Aufgrund der komplexen Umgebung, in der Holzbohrkäfer leben, hat die Körperoberfläche oft verschiedene Schadstoffe und ihre Anhängsel haben oft viele feine lange Sensilla oder Borsten. Insbesondere sind einige Holzträger nicht aus der Laboraufzucht erhältlich, die direkt im Feld gesammelt und dann in Befestigungsflüssigkeit gesteckt werden, um frische seramungzumachen und anschließend im Labor zu waschen. Wenn die Probe zuerst fixiert und dann gewaschen wird, ist es offensichtlich viel schwieriger, Schmutz zu entfernen, da Glutaraldehyd sie stark an der Probe fixiert. Tween 20 ist ein Tensid11,12,13,14, das eine wichtige Rolle im Waschprozess spielt, einschließlich der Verringerung der Oberflächenspannung von Wasser und der Verbesserung der Benetzbarkeit von Wasser auf der Oberfläche der Wäsche. In dieser Studie wurde Tween 20 der Befestigungslösung und der PBS-Reinigungslösung hinzugefügt, um die Oberflächenspannung der Flüssigkeit zu reduzieren und zu verhindern, dass sich der Schmutz auf der Körperoberfläche des Holzbohrkäfers ablagert, was die Körperoberfläche in SEM sauberer machte.
Mit TEM können Sensilla an verschiedenen Insektenorganen in Scheiben geschnitten werden, um die klaren Strukturen in ihnen zu offenbaren und so eine Grundlage für die Analyse von Sensilla-Funktionen zu schaffen. Wenn das Subjekt Insekt, wie Holzbohrkäfer, groß ist, und seine Körperwand hat einen erheblichen Grad an Sklerotisierung, so dass das Fixativ kann nicht vollständig gesättigt Organgewebe im Inneren des Insektenkörpers. Tween 20 kann die Dispersions- und Aufhängungskapazität des Schmutzes verbessern. In dieser Studie wurde Tween 20 dem Fixativ hinzugefügt, um das Fixative Flüssigkeitsdurchdringung in die Insektenkörperwand des Holzbohrkäfers zu verbessern, um Verformungen und Denkollaps des Epidermi11,12,13zu vermeiden. Darüber hinaus ist es mit der allgemeinen Schneidetechnologie schwierig, verschiedene Arten von Sensilla genau zu lokalisieren, insbesondere für einige kleine Sensilla15. Basierend auf der traditionellen TEM-Probenvorbereitung kombinierte diese Studie Fluoreszenzmikroskopie und SEM, um die Position von Insektensensilla im eingebetteten Block zu bestimmen und so die Schnittgenauigkeit zu verbessern.
Protokoll
VORSICHT: Konsultieren Sie die Materialsicherheitsdatenblätter der Reagenzien, bevor Sie sie verwenden. Mehrere der bei der Probenvorbereitung verwendeten Chemikalien sind giftig, erbgutverändernd, krebserregend und/oder reprotoxisch. Verwenden Sie persönliche Schutzausrüstung (Handschuhe, Labormantel, Hose in voller Länge und Schuhe mit geschlossener Zehen) und arbeiten Sie unter einer Dunstabzugshaube, während Sie die Probe bearbeiten.
1. SEM Probenvorbereitung und Bildgebung
- Probenfixierung und -reinigung
- Arbeiten in einem Gebiet, in dem C. caragana auftreten, ziehen Erwachsene in Feldfallen mit Pflanzenlockmitteln geködert, wie Isophoron16. Saubere Körper von erwachsenem C. Caragana in 0,1 mol L-1 phosphatgepufferter Salzsäure (PBS, pH 7,2), 2,5% (wt/vol) Glutaraldehyd (Anhydrous EM Grad) und 0,06% (vol/vol) Tween 20. Fixieren Sie die Probe auf 4 °C über das Wochenende.
- Entfernen Sie die Körper aus der Konservierungsflüssigkeit und spülen Sie im Phosphatpuffer ab. Mit Hilfe eines Stereomikroskops die Anhänge entfernen und ultrasonisch (40 kHz) in einer 0,1 molL-1 phosphatgepufferten Saline (pH 7,2) mit 0,06% (vol/vol) Tween 20 (PBST) reinigen. Nach der Reinigung für 100 s, übertragen Sie die Probe auf das Mikroskop, um zu überprüfen, ob es sauber war. Unter normalen Umständen für 400er reinigen, um sicherzustellen, dass die Probe sauber genug war, um zu beobachten und nicht beschädigt.
- Probenentwässerung, Montage und Trocknung
- Dehydrieren Sie die Proben mit 20 min aufeinanderfolgenden Behandlungen in 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100% und 100% (alle vol/vol) Ethanol. Verwenden Sie unter einem Stereomikroskop doppelseitiges Klebeband aus Kohlenstoff, um 3 Beobachtungsflächen (dorsale ventrale und seitliche) getrennt auf Stubs zu fixieren. Beachten Sie, dass alle Sichtflächen sauber und frei von Verunreinigungen gehalten werden müssen. Legen Sie die Probenstufe in eine Petrischale, die ein Kieselgel-Desiccant für 48 h enthält.
- Sputtermantel und Probeneinfügung
- Mit Hitachi Koki (E-1010) Ionen-Sputtergerät drehen Main VALVE in OPEN-Position, entfernen Sie die Probenkammerabdeckung und geben Sie die Probe in die Kammer. Schalten Sie den POWER-Schalter ein, und READY-Licht war eingeschaltet. Stellen Sie die Sputterzeit auf 45 Sekunden und die Schichtdicke auf 70,875 ° fest. Sobald der mechanische Pumpen-Vakuum-Zifferblattindex unter 7 gefallen ist, drücken Sie DISCHARGE und beginnen Sie platin zu sprühen. Schalten Sie am Ende des Experiments die Stromversorgung aus und nehmen Sie die Probe aus der Kammer. Sprühfoliendicke: d = KIVt ("d" ist die Dicke der Folie in der Einheit von " " " K" ist eine Konstante, abhängig von dem gesputterten Metall und Gas. K der Luft ist z. B. 0,07; "I" ist die Einheit mA des Plasmaflusses; "V" ist die Spannung, die in der Einheit von "KV" angelegt wird. "t" ist die Zeit in Sekunden.
- Legen Sie den Stub, der die Probe enthält, auf die Bühne von SEM. Stellen Sie sicher, dass die Probenstufe mit dem Probenstummel genügend Höhe hat, um ein gutes Bild zu ermöglichen. Öffnen Sie die SEM-Software und wählen Sie eine gewünschte Betriebsspannung, beginnend bei 20 kV.
2. TEM Probenvorbereitung und Bildgebung
- Beziehen und fixieren Sie die Probe wie in den Schritten 1.1.1 und 1.1.2.
- Reinigung, Sekundärfixierung und Dehydrierung
- Entfernen Sie erwachsene C. caragana aus der Konservierungsflüssigkeit. Mit einem Stereomikroskop entfernen Sie die Anhänge, waschen Sie die Proben in PBST für 3 h, und fixieren Sie sie dann in 1% (wt/vol) Osmiumtetroxid in PBS für 1h bei 25 °C. Dehydrieren Sie die Proben mit 20 min aufeinanderfolgenden Behandlungen in 50%, 60%, 70%, 80%, 85%, 90%, 95%, 100% und 100% (alle vol/vol) Ethanol bei Raumtemperatur.
- Harzeinbettung und Polymerisation
- Die Proben in Harz in eine flache Einbettform einbetten. Die Probe befand sich an der Unterseite der Platte und wurde so nah wie möglich an den Rand der Einbaunut gelegt. Legen Sie das Etikett in den Rohling und inkubieren Sie dann die Platte, die die Probe enthält, bei 60 °C für 72 h. Entfernen Sie die Kapsel aus dem Inkubator und überprüfen Sie, ob das Harz polymerisiert war.
- Probenschnitt und Färbung
- Stellen Sie jeden Harzblock unter ein Fluoreszenzmikroskop und fotografieren Sie ihn unter blauem Licht, sobald sichergestellt wurde, dass die Probe verfestigt war. Bewegen Sie die fluoreszierende Lichtquelle des Mikroskops, sodass die Probe von oben bestrahlt wird. Ermöglichen Sie eine deutliche Beobachtung der Sensilla im Harzblock. Fotografiert und messen Entfernungen, um die Sensilla anzusprechen (Abbildung 1).
- Siehe SEM-Bild der Palps (Abbildung 2A), und schneiden Sie grob den Harzblock mit einer Rasierklinge, um den Zielrezeptor zu schließen (Abbildung 2B).
- Als nächstes fotografieren Sie mit der Blaulichtfluoreszenzmikroskopie den grob geschnittenen Harzblock und passen die Lichtquelle von oben so an, dass die Sensilla deutlich beobachtet wurde. Grünes Licht, das vom blauen Licht angeregt wurde, erzeugte eine positive Beobachtung. Bei der Bildgebung wurde das objektive Mikrometer (DIV 0,01 mm) der Fluoreszenzmikroskopstufe hinzugefügt, und dann wurde der Abstand des Ziels mit der ImageJ-Software (U.S. National Institute of Health) gemessen (Abbildung 2C). Das Bildlineal wurde von Adobe Photoshop CS5 (Adobe Systems, Inc., San Jose, CA, USA) erstellt. Legen Sie dann für das Schneiden von Ultramikrotome den Schnittabstand mit 50-60 nm Scheibenstärken fest, bis die Zielposition erreicht ist. Verwenden Sie die Fluoreszenzmikroskopie, um den Zielrezeptor zu lokalisieren.
- Montieren Sie die Abschnitte auf Formvar-beschichteten, 100-Mesh-Kupfergittern, doppelt mit Uranylacetat und Bleicitrat befleckt.
- Erstens 3,75 g Uranylacetat zu 50 ml 50 % Methanol hinzufügen. Fleckengitter mit einer gefilterten (0,45 m) Spritze einer gesättigten Lösung von Uranylacetat bei Raumtemperatur für 10 min. Abdeckabschnitte während der Färbung, um lichtinduzierte Ausscheidungen zu blockieren. 2x in 50 % Methanol abspülen; 2x gefiltertes entgastes Wasser.
- Zweitens 0,02 g Bleicitrat zu 10 ml entgastem destilliertem Wasser in zentrifugenrohr hinzufügen. 0,1 ml 10 N Natriumhydroxid hinzufügen, abdichten und schütteln, um sich aufzulösen. Fleckengitter mit einer Lösung aus Bleicitrat für 8 min. Zentrifuge vor Gebrauch. Die Färbung muss in einer kohlendioxidfreien Umgebung erfolgen, um die Bildung von Bleikohlensäureausfällen zu verhindern. Legen Sie Fleckentropfen auf Quadrate von Kunststoff-Petrischalen. Spülen Sie in entgastem gefiltertem Wasser und trocken17. Beobachten Sie sie über TEM mit 80 kV.
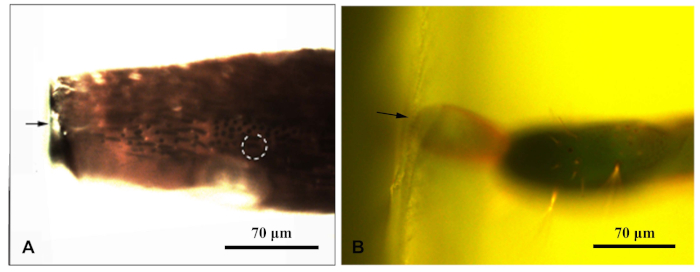
Abbildung 1: Ein Fluoreszenzmikroskop fotografierte einen Harzblock, der das Anhängseln der Chlorophorus caraganaumschließt. (A) Antennenharzblock; (B) Harzblock am Ende des Ovipositors. Der Pfeil zeigte den Rand des Harzblocks an; gepunkteter Kreis zeigt die Zielsensorilla an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
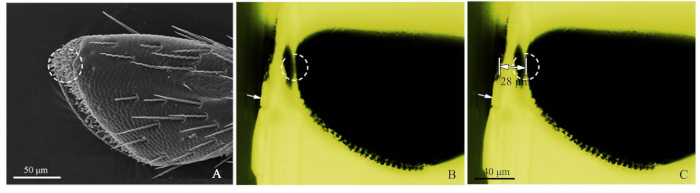
Abbildung 2: Verfahren der genauen Sensilla-Positionsmethode. (A) Das 4. Untersegment eines Oberkiefers von Chlorophorus caraganazeigte die von SEM angestrebte Sensilla. (B) Das 4. Untersegment eines Oberkiefer-Palp von C. caragana, das durch Fluoreszenzmikroskopie betrachtet wurde. Weißer Pfeil zeigte die grob geschnittene Kante des Harzblocks und der gepunktete Kreis zeigte die genaue Position. (C) Der markierte Abstand vom Rand des Harzblocks zur maxillären Palp-Zielposition (in dieser Probe 28 m). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Mit Reinigungs- und Fixierlösung mit Tween 20 wurde ein saubereres SEM-Bild beobachtet als das ohne Tween 20 (Abbildung 3). Tween 20 Befestigungslösung drang in die Glutaraldehyd-Fixierlösung in das Gewebe ein. Die Mikrotubuli-Struktur war deutlich zu sehen. DAS TEM-Bild der internen Struktur der Probe wurde ohne Tween 20 verwischt (Abbildung 4).

Abbildung 3: Die Sensilla, die sich auf der Antenne von Chlorophorus caragana unter SEM befindet. Vergleich des SEM-Bildes mit Tween 20 (A) und ohne Tween 20 (B), das zeigte, dass Bild A sauberer ist als Bild B im Allgemeinen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
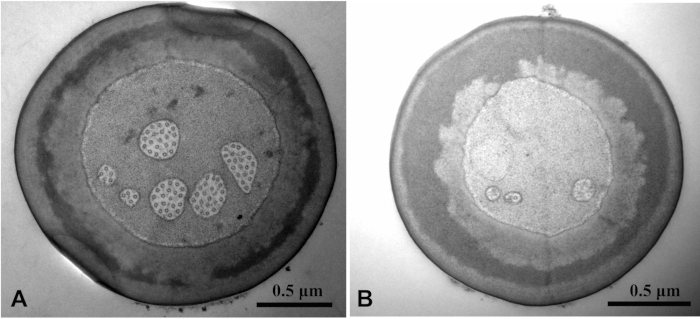
Abbildung 4: Chlorophorus caragana durch Transmissionselektronenmikroskopie von sensilla zweig basiconica auf den Labial-Palps. Vergleich des TEM-Bildes mit Tween 20 (A) und ohne Tween 20 (B). Die Mikrotubuli-Struktur von Bild A ist klar, während die von Bild B verschwommen ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Wir verwendeten SEM, um die Arten und Ultrastrukturen von Sensilla auf den Palps von C. caraganazu untersuchen, und fanden 4 Arten von Sensilla, darunter 10 Subtypen: 1 Böhm-Borsten (BB.), 3 sensilla chaetica (Ch.1-Ch.3), 1 digitiform sensilla (Dig.) und 5 sensilla twig basiconica (S.tb.1-S.tb.5)(Tabelle 1). Sensilla-Identifikation und Ultrastruktur basierten auf ihrer Morphologie und Größe18,19,20,21,22,23. Unsere Probenvorbereitungsmethoden machten klare Bilder der Oberflächen und inneren Ultrastrukturen von Insektensensilla.
| Anzahl | Typ | Länge (m)a | Durchmesser an der Basis (m)a | Wand | Tipp | Socket | Schnittporen | Verteilung |
| 1 | Bb. | 5,18 x 1,25 | 1,70 x 0,47 | Glatt | Scharf | Breite | Nein | oberkieferpalp, labial palp |
| 2 | Ch.1 | 38,59 € 8,20 | 3,15 x 0,84 | Gerillt | Scharf | Breite | Nein | oberkieferpalp, labial palp |
| 3 | Ch.2 | 81,54 € 18,07 | 3,75 x 0,88 | Gerillt | Scharf | Breite | Nein | oberkieferpalp, labial palp |
| 4 | Ch.3 | 282,06 € 22,60 | 6,10 x 0,70 | Gerillt | Scharf | Breite | Nein | labial palp |
| 5 | Graben. | 24,77 € 2,98 | 1,24 x 0,32 | Glatt | Stumpf | Breite | Nein | oberkieferpalp |
| 6 | S.tb.1 | 6,51 x 1,01 | 2,31 x 0,25 | Gerillt | Mit Vorsprüngen | Erhöht und eng | Tip Pore | oberkieferpalp, labial palp |
| 7 | S.tb.2 | 5,91 x 0,90 | 2,24 x 0,30 | Glatt | Stumpf | Erhöht und eng | Tip Pore | oberkieferpalp, labial palp |
| 8 | S.tb.3 | 6,84 € 0,98 | 1,96 € 0,35 | Glatt | Mit Vorsprüngen | Erhöht und eng | Tip Pore | oberkieferpalp, labial palp |
| 9 | S.tb.4 | 2,21 x 0,59 | 2,86 x 0,46 | Gerillt | Mit Vorsprüngen | Ausgelöst | Tip Pore | oberkieferpalp, labial palp |
| 10 | S.tb.5 | 1,16 x 0,29 | 1,05 € 0,19 | Glatt | Stumpf | Aufgezogen und breit | Tip Pore | oberkieferpalp, labial palp |
Tabelle 1: Arten von Sensilla auf den Palps von C. caragana.
Um die Ultrastruktur in der Sensilla auf C. caragana palps zu untersuchen, haben wir TEM verwendet. Ein Beispiel für diese Studien waren kontinuierliche Querschnittsansichten des Peg der S.tb.1 auf Oberkiefer-Palps. Die Ansichten zeigten, dass die dendritische Hülle die äußeren dendritischen Segmente umgab und sich bis zur Spitze pore ausdehnte (Abbildung 5A-D). Sieben unverzweigte äußere dendritische Segmente existierten in der inneren Rezeptor-Lymphhöhle, die von einer äußeren Höhle umgeben war(Abbildung 5D). Der röhrenförmige Körper wurde durch eine dendritische Hülle von anderen äußeren dendritischen Segmenten an jeder Sensillar-Sockelbasis getrennt (Abbildung 5E). In der Ziliarregion stellten wir 8 Dendriten mit unterschiedlichen Durchmessern fest, was auf das Vorhandensein von 8 bipolaren Neuronen hindeutet. Schließlich enthielt das Ziliarsegment 9 periphere Mikrotubuli-Doublets(Abbildung 5F).

Abbildung 5: TEM Ansichten von sensilla Typ 1 Zweig basiconica (S.tb.1) auf einem Chlorophorus caragana maxillary palp30. (A) S.tb.1 mit gepunkteten Linien, die Bereiche in der Nähe der für Feigen genommenen Querschnitte markieren. B-E. (B) Querschnitt von fingerförmigen Vorsprüngen mit verstreuten Cuticula. (C) Querschnitt des Basalbereichs von fingerförmigen Vorsprüngen, die innere Rezeptor-Lymphhöhlen ohne äußere dendritische Segmente zeigen. (D) Querschnitt des mittleren Bereichs des Pflocks, der die dendritische Hülle zeigt, die die Sensillum-Lymphhöhle in innere und äußere Hohlräume mit 7 äußeren dendritischen Segmenten in der inneren Kavität teilt. (E) Basalbereich des Pflocks, der den röhrenförmigen Körper zeigt, der von einer dendritischen Hülle umgeben und von äußeren dendritischen Segmenten getrennt ist. Eine Tormogenzelle bildet die Außenseite der dendritischen Hülle. (F) Querschnitt des Zilienbereichs mit 8 Dendriten unterschiedlicher Durchmesser. Abkürzungen: bb, Basalkörper; cs, Ziliarsegment; CW, Schnittwand; DS, dendritische Hülle; iRL, innere Rezeptor-Lymphhöhle; M, Mikrotubuli; Mi, microvilli; oD, äußeres dendritisches Segment; oRL, äußere Rezeptor-Lymphhöhle; S.tb.1, Typ 1 sensilla zweig basiconica; TB, röhrenförmiger Körper; TH, Thecogen-Zelle; Zu, Tormogenzelle; TR, Trichogenzelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Artikel haben wir ein Probenvorbereitungsschema für die Raster- und Transmissionselektronenmikroskopie für Holzbohrkäfer vorgestellt. Anhand des Insektenanhängsals als repräsentatives Studienfach haben wir einige Verbesserungen gegenüber herkömmlichen Probenvorbereitungsmethoden gezeigt.
Das von der festen Oberfläche gelöste flüssige Öl wird zu kleinen Tröpfchen emulgiert, die gut dispergiert und im Waschmedium aufgehängt werden können, um die Rückablagerung auf der Oberfläche des Objekts zu reduzieren. Die Waschleistung von Tensid umfasst alle grundlegenden Eigenschaften wie Benetzbarkeit, Durchlässigkeit, Emulgierungseigenschaft, Dispergierbarkeit, Löslichkeit11,12,13,14. Die Wirkung verschiedener Waschmittel auf die elektronenmikroskopische Probenherstellung von Golden Nematode zeigte, dass Tween 20 die beste Reinigungswirkung hatte, gefolgt von Natriumbicarbonat und destilliertem Wasser24. In dieser Studie fanden wir heraus, dass Tween 20 verwendet werden kann, um die Oberflächenspannung der Flüssigkeit zu reduzieren und zu verhindern, dass sich der Schmutz auf der Körperoberfläche des Insekts ablagert, insbesondere für Holzbohrkäfer, die direkt im Feld gesammelt werden. Die Insektenkörperoberfläche wurde in SEM sauberer gewaschen. Fixativ mit Tween 20 drang die Insektenkörperwand leichter ein und in der Folge besser fixierte Gewebe und Organe im Körper in TEM. Der Vorteil von Tensid in der Elektronenmikroskopie Probenvorbereitung wurde ausgiebig untersucht24,25,26,27,28,29,30,31.
Außerdem haben wir ein modifiziertes Lufttrocknungsverfahren für die SEM-Probenvorbereitung eingeführt, bei dem die dehydrierte Probe in eine Petrischale mit einem Kieselgel-Trockenmittel gelegt wurde, das das Dehydrierungsmittel nach und nach verdunstet. Der größte Vorteil dieser Methode ist, dass sie einfach, leicht zu warten ist und die Mikroumgebung lufttrocken hält und keine spezielle Ausrüstung benötigt. Die natürliche Trocknungsmethode ist eine einfache, praktische und effektive Methode zur Saatgut-, Nuss- und Langzeitkonservierung von Insektenproben. Obwohl das Probenvolumen während des natürlichen Trocknungsprozesses schrumpft, bleibt die grundlegende Morphologie der Probe32erhalten. Im Allgemeinen haben Coleoptera-Insekten einen relativ niedrigen Wassergehalt, und ihre Oberfläche ist von harten Chitinwänden umgeben. Air-dry ist in der Lage, die Anforderungen zu erfüllen. Dieses Trocknungsverfahren eignet sich jedoch nicht für das Trocknen von Geweben mit einem großen Wassergehalt, wie Laus, Milben und Larven, da die Oberflächenspannung die Probe während des Trocknungsprozesses verformen wird.
Zur Beobachtung und Berechnung der Art und Anzahl der sensilla, die über die Oberfläche des Anhängsels verteilt sind, müssen dorsale, ventrale und seitliche des Anhängsels berücksichtigt werden. Einige Sensilla waren wenige, kleine und manchmal bedeckte, scannen und beobachten sorgfältig aus allen Blickwinkeln, um zu finden, dass die Sensilla vollständig die Epidermis hervorragen oder aus der Depression entstehen. Da viele Sensilla relativ lang und haarig waren, kann der Spitzeneffekt signifikant sein. Die Beschleunigungsspannung des Elektronenmikroskops darf also nicht zu hoch sein, 5-20kV war am besten und wir haben 20kV verwendet.
Bei der EINbettung der TEM-Probe war die Probe besser am Rand der flachen Einbettformen nutgnut, um Beim Schruppen des Harzblocks Zeit zu sparen. Die traditionelle TEM-Methode zum kontinuierlichen Schneiden des Harzes ist umfangreich und wird in der Regel mit einem optischen Mikroskop17,33blind geschnitten. Um dies zu verbessern, untersuchten wir zunächst eine Insektensensorilla-Lokalisierungstechnik in harzeingebetteten Blöcken, indem wir die Fluoreszenzmikroskopie zum Anzeigen und Messen des Zielabstands zum Schnitt nutzten. Im Vergleich zur herkömmlichen TEM-Trimmmethode kann diese Technologie Probenvorbereitungszeit sparen und den Zielsensor genauer lokalisieren. In Ermangelung einer Messsoftware kann ein skaliertes Lineal im Sichtfeld platziert werden, um den Zielabstand grob zu messen. Die Kombination eines Ultramikrotomes mit einem Fluoreszenzmikroskop liefert klare Beobachtungen des Schneidprozesses und liefert genaue Schnitte von Zielsensilla und anderen geeigneten Probanden.
Offenlegungen
Wir haben keinen Interessenkonflikt zu offenbaren.
Danksagungen
Wir schätzen die großzügige Unterstützung des Beijing Vocational College of Agriculture, des Institute for the Application of Atomic Energy (Chinese Academy of Agricultural Science), des Bioresearch Center of Beijing Forestry University und Professor Shan-gan Zhang vom Institut für Zoologie der Chinesischen Akademie der Wissenschaften. Diese Forschung wurde unterstützt durch national Key R&D Program of China (2017YFD0600103), die National Natural Science Foundation of China (Grant No. 31570643, 81774015), Forest Scientific Research in the Public Welfare of China (201504304), Inner Mongolia Agricultural University High-Level Talent Research Startup Plan (203206038) und Inner Mongolia Autonomous Region Higher Education Research Project (NJZZ18047), Inner Mongolia Autonomous Region Linxue "Double First-class" Construction Project (170001).
Materialien
| Name | Company | Catalog Number | Comments |
| Anatomical lens | Chongqing Auto Optical limited liability company | 1425277 | |
| Carbon adhesive tape | SPI Supplies, Division of Structure Probes, Inc. | 7311 | |
| Carbon tetrachloride | Sigma | 56-23-5 | |
| Copper grids | GilderGrids | G300 | |
| Disodium hydrogen phosphate | Sinopharm group chemical reagent co., LTD | 10039-32-4 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Flat embedding molds | Hyde Venture (Beijing) Biotechnology Co., Ltd. | 70900 | |
| Fluorescence microscope | LEICA | DM2500 | |
| Glutaraldehyde | Sigma-Aldrich | 111-30-8 | Anhydrous EM Grade |
| Isophorone | Sigma | 78-59-1 | |
| Lead citrate | Sigma | 512-26-5 | |
| Methanol | Sigma | 67-56-1 | |
| Monobasic sodium phosphate | Its group chemical reagent co., LTD | 7558-80-7 | |
| Objective micrometer | Olympus | 0-001-034 | |
| Osmium tetroxide | Sigma | 541-09-3 | |
| Petri dish | Aldrich | 1998 | |
| Razor blade | Gillette | ||
| Resin | Spurr | ERL4221 | |
| Scalpel | Lianhui | GB/T19001-2008 | |
| SEM | Hitachi | S-3400 | |
| Silica gel desiccant | Suzhou Longhui Desiccant Co., Ltd. | 112926-00-8 | |
| Small brush | Martol | G1220 | |
| Sodium hydroxide | Sigma | 1310-73-2 | |
| Sputter ion instrument | Hitachi Koki Co. Ltd., Tokyo, Japan | E-1010 | |
| Stereo microscope | Leica | EZ4 HD | |
| TEM | Hitachi | H-7500 | |
| Tween 20 | Tianjin Damao Chemical Reagent | 9005-64-5 | |
| Ultramicrotome | Leica | UC6 | |
| Ultrasonic cleaner | GT Sonic | GT-X1 | |
| Uranyl acetate | Sigma | 6159-44-0 |
Referenzen
- Song, Y. Q., Dong, J. F., Sun, H. Z. Scanning Electron Microscope Technology of Insect Material. Hubei Agricultural Sciences. 52, 1064-1065 (2013).
- Liu, C. The development of the scanning electron microscopy (sem) and its application in polymer materials research. Journal of the Graduates Sun Yat-Sen University (Natural Sciences Medicine). 34, 7-12 (2008).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45, 27-56 (2011).
- Lucic, V., Rigort, A., Baumeister, W. Cryo-electron tomography: the challenge of doing structural biology in situ. The Journal of Cell Biology. 202, 407-419 (2013).
- Trepout, S., Bastin, P., Marco, S. Preparation and Observation of Thick Biological Samples by Scanning Transmission Electron Tomography. Journal of Visualized Experiments. (121), e55215 (2017).
- Zhang, X. J., Sun, W., Zhang, J., Zuo, T. T., Wang, Z. Q., Zhao, H. W. Research progress of coleopteran insect species antennal sensilla. Journal of Anhui Agricultural Sciences. 41, 2932-2935 (2013).
- Aldrich, J. R., Bartelt, R. J., Dickens, J. C., Knight, A. L., Light, D. M., Tumlinson, J. H. Insect chemical ecology research in the United States Department of Agriculture-Agricultural Research Service. Pest Management Science. 59, 777-787 (2003).
- Thomas, C. B., Marlin, E. R. Pheromone mating disruption: Novel, non-toxic control of the European corn borer. Leopold Center. 8, 57-60 (1999).
- Chen, X. F., Hu, M. Y. Studies on the specimen preparation techniques of scanning electron microscope of Ficus simplicissima Lour. Journal of Zhongkai Agrotechnical College. 14, 68-70 (2001).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D. Fundamentals of Scanning Electron Microscopy (SEM). Scanning Microscopy for Nanotechnology. , 1-40 (2006).
- Kothekar, S. C., Ware, A. M., Waghmare, J. T., Momin, S. A. Comparative Analysis of the Properties of Tween-20, Tween-60, Tween-80, Arlacel-60, and Arlacel-80. Journal of Dispersion Science and Technology. 28, 477-484 (2007).
- Chai, J. L., Liu, N., Bai, T. T., Zhang, H. M., Liu, N. N., Wang, D. D. Compositions and Physicochemical Properties of Tween Type Surfactants-Based Microemulsions. Journal of Dispersion Science and Technology. 35, 441-447 (2014).
- Zhang, L. D., Zhao, L., Han, F., Xu, B. C. Performance and applications of surfactants (XV) Detergency of surfactants and its applications. China Surfactant Detergent and Cosmetics. 45, 132-137 (2015).
- Waghmare, P. R., Das, S., Mitra, S. K. Under-water superoleophobic glass: unexplored role of the surfactant-rich solvent. Scientific Reports. 3, 1-25 (2013).
- Zhang, Y. R., Ren, L. L., Luo, Y. Q. Microtomy of insect sensilla embedded in resin blocks for transmission electronic microscopy. Chinese Journal of Applied Entomology. 50, 1479-1483 (2013).
- Zong, S. X., Liu, X. H., Cao, C. J., Luo, Y. Q., Ren, L. L., Zhang, H. Development of semiochemical attractants for monitoring and controlling Chlorophorus caragana. Zeitschrift für Naturforschung. 68, 243-252 (2013).
- Sumner, M. J. Epoxy resins for light and transmission electron microscopy. Plant Microtechniques and Protocols. , 83-101 (2015).
- Schneider, D. Insect antennae. Annual Review of Entomology. 9, 103-122 (1964).
- Zacharuk, R. Antennae and sensilla. Comprehensive Insect Physiology, Biochemistry and Pharmacology. 6, 1-69 (1985).
- Zacharuk, R., Albert, P., Bellamy, F. Ultrastructure and function of digitiform sensilla on the labial palp of a larval elaterid (Coleoptera). Canadian Journal of Zoology. 55, 569-578 (1977).
- Shanbhag, S., Müller, B., Steinbrecht, R. Atlas of olfactory organs of Drosophila melanogaster: 1, Types, external organization, innervation and distribution of olfactory sensilla. International Journal of Insect Morphology and Embryology. 28, 377-397 (1999).
- Tarumingkeng, R. C., Coppel, H. C., Matsumura, F. Morphology and ultrastructure of the antennal chemoreceptors and mechanoreceptors of worker Coptotermes formosanus Shiraki. Cell Tissue Res. 173, 173-178 (1976).
- Zacharuk, R. Y. Ultrastructure and function of insect chemosensilla. Annual Review of Entomology. 25, 27-47 (1980).
- Li, Y. Z., Zhong, G. Q. Screening of detergents and floating carriers for treating potato golden nematode cysts to improve the original appearance of electron microscopy. Plant quarantine. 8, 72-75 (1994).
- Marzio, L. D., Marianecci, C., Petrone, M., Rinaldi, F., Carafa, M. Novel pH-sensitive non-ionic surfactant vesicles: comparison between tween 21 and tween 20. Colloids and Surfaces B: Biointerfaces. 82, 18-24 (2011).
- Ren, L. L., Wu, Y., Shi, J., Zhang, L., Luo, Y. Q. Antenna morphology and sensilla ultrastructure of Tetrigus lewisi Candèze (Coleoptera: Elateridae). Micron. 60, 29-38 (2014).
- Ren, L., Shi, J., Zhang, Y., Luo, Y. Antennal morphology and sensillar ultrastructure of Dastarcus helophoroides (Fairmaire) (Coleoptera: Bothrideridae). Micron. 43, 921-928 (2012).
- Teng, X. H., Liu, X. L., Xie, G. Y., Tang, Q. B., Li, W. Z., Zhao, X. C. Morphology and distribution of ovipositor sensilla of female Helicoverpa armigera (Lepidoptera: Noctuidae). The 11th Henan Plant Protection Society, the 10th Henan Insect Society, and the 5th Member Congress and Academic Symposium of Henan Plant Pathology Society. , 138-142 (2017).
- Yang, R., Zhang, L. N., Fan, J. W., Wang, J. L., Fang, K. F., Yu, T. Q., Wang, S. H., Du, Y. L. Insect specimens for scanning electron microscopy. Journal of Beijing University of Agriculture. 29, 33-36 (2014).
- Zhang, Y. R., Ren, L. L., Zhang, L., Wang, R., Yu, Y., Lu, P. F., Luo, Y. Q. Ultrastructure and distribution of sensilla on the maxillary and labial palps of Chlorophorus caragana (Coleoptera: Cerambycidae). Journal of Morphology. 279, 574-588 (2018).
- Harrison, J. D. G. Cleaning and preparing adult beetles (Coleoptera) for light and scanning electron microscopy. African Entomology. 20, 395-401 (2012).
- Xiao, Y., Liu, W., Wang, Y., Zuo, Y. X., Hu, R., Li, T. T., Cui, Z. B. Drying methods of biological sample preparation for scanning electron microscope. Research and Exploration Laboratory. 32, 46-53 (2013).
- Graef, M. D. . Introduction to Conventional Transmission Electron Microscopy. , 1 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten