Method Article
Valutazione delle lesioni-indotta senescenza e In Vivo riprogrammazione nel muscolo scheletrico
In questo articolo
Riepilogo
Qui presentiamo un protocollo dettagliato per rilevare entrambi senescenti e cellule staminali pluripotenti in muscolo scheletrico dopo un danno mentre induce in vivo riprogrammazione. Questo metodo è adatto per valutare il ruolo della senescenza cellulare durante rigenerazione tissutale e riprogrammazione in vivo.
Abstract
La senescenza cellulare è una risposta di sforzo che è caratterizzata da un arresto della crescita cellulare stabile, che è importante per molti processi fisiologici e patologici, quali il cancro e invecchiamento. Recentemente, la senescenza è stata implicata anche nella rigenerazione e riparazione tissutale. Di conseguenza, è diventato sempre più importante per identificare cellule senescenti in vivo. Analisi di β-galattosidasi senescenza-collegata (SA-β-gallone) è il test più ampiamente usato per rilevare le cellule senescenti, sia in coltura che in vivo. Questa analisi è basata sul contenuto lysosomal aumentato nelle cellule senescenti, che permette la rilevazione istochimica di attività lisosomiale della β-galattosidasi a pH trovata (6 o 5.5). In confronto con altri dosaggi, come la citometria a flusso, ciò permette l'individuazione delle cellule senescenti nel loro ambiente residente, che offre importanti informazioni come la posizione relativa all'architettura del tessuto, la morfologia e la possibilità di abbinamento con altri marcatori tramite immunoistochimica (IHC). La limitazione principale del saggio SA-β-gallone è il requisito di campioni freschi o congelati.
Qui, presentiamo un protocollo dettagliato per comprendere la senescenza cellulare come promuove la rigenerazione di tessuto e plasticità cellulare in vivo. Utilizziamo SA-β-gallone per rilevare cellule senescenti in muscolo scheletrico dopo un danno, che è un sistema ben consolidato per studiare la rigenerazione dei tessuti. Inoltre, utilizziamo IHC per rilevare Nanog, un marcatore delle cellule staminali pluripotenti, in un modello di topo transgenico. Questo protocollo consente di esaminare e quantificare la senescenza cellulare nel contesto della plasticità cellulare indotto e in vivo di riprogrammazione.
Introduzione
La senescenza cellulare è una forma di risposta allo stress, caratterizzata da un arresto del ciclo cellulare stabile. Nell'ultimo decennio, la ricerca ha fermamente stabilito che la senescenza è associata con vari processi biologici e patologici, compreso lo sviluppo embrionale, la fibrosi e organismo invecchiamento1,2. La senescenza cellulare è stata identificata in fibroblasti umani alla fine della loro durata di vita ripetitiva innescato da3di riduzione del telomero. Oltre lo stress ripetitivo, ci sono molti altri stimoli che possono indurre senescenza, inclusi danni DNA, stress ossidativo, segnali oncogenici e alterazioni genomiche/epigenomic, che alla fine può attivare le vie p53/p21 e/o pRB stabilire e rafforzare la crescita permanente arresto1. Una delle caratteristiche importanti delle cellule senescenti è che essi rimangono metabolicamente attive e robustamente esprimere un fenotipo secretivo senescenza-collegata (SASP): secrezione di molte citochine infiammatorie, fattori di crescita e matrice extracellulare fattori4. SASP fattori sono stati proposti a giocare un ruolo importante nel mediare e amplificando l'effetto di senescenza, dovuto i loro effetti potenti su attirando le cellule immuni e alterazione del tessuto locale e sistemica ambienti1. È interessante notare che, senescenza è stato recentemente proposto per essere importante per tessuto riparazione e rigenerazione5,6. Inoltre, i dati da diversi laboratori, compreso il nostro, ha suggerito che la senescenza indotta da danni del tessuto potrebbe migliorare la plasticità cellulare, via SASPs, per promuovere la rigenerazione7–9. Di conseguenza, tutti i dati emergenti evidenziano l'importanza di studiare la senescenza in vivo.
Nell'era post-(iPSC) sulle cellule staminali pluripotenti indotte, plasticità cellulare è la capacità di una cellula di acquisire una nuova identità e di adottare un destino alternativo quando esposto a stimoli diversi nella cultura ed in vivo10. È noto che la riprogrammazione completa può essere raggiunto in vivo11,12, dove l'espressione della la cassetta contenente quattro fattori Yamanaka: Oct4, Sox2, Klf4e c-Myc (OSKM) può essere indotta in vivo per promuovere la formazione di teratomi negli organi multipli. Di conseguenza, un modello di topo riprogrammabile (i4F) utilizzabile come un potente sistema per identificare i regolatori critici e vie che sono importanti per plasticità cellulare11.
Un sistema adatto e sensibile in vivo è essenziale per capire la senescenza cellulare come regola la plasticità cellulare nell'ambito della rigenerazione dei tessuti. Qui, presentiamo un sistema robusto e un protocollo dettagliato per valutare il collegamento tra senescenza e plasticità cellulare nell'ambito della rigenerazione dei tessuti. Il danno muscolare di combinazione di con (CTX) indotta nel gruppo del muscolo tibiale anteriore (TA), un sistema ben consolidato per studiare la rigenerazione dei tessuti e il modello del mouse i4F, permette la rilevazione della senescenza cellulare sia in vivo riprogrammazione durante la rigenerazione del muscolo.
Per valutare il collegamento tra plasticità cellulare e senescenza, i4F topi sono feriti con CTX per indurre il danno muscolare acuto e trattati con doxiciclina (0,2 mg/mL) per 7 giorni per indurre in vivo riprogrammazione. Mentre un CTX indotta danno muscolare acuto e protocollo di rigenerazione è stato recentemente pubblicato13, per motivi etici, questa procedura verrà omesso nel protocollo corrente. Saranno raccolti campioni di muscolo TA a 10 giorni post infortunio13, quando il picco delle cellule senescenti sono state precedentemente osservate14. Qui, questo protocollo dettagliato descrive tutti i passaggi necessari per valutare il livello di senescenza (via SA-β-gallone) e riprogrammazione (via IHC che macchia di Nanog).
Dosaggio di beta-galattosidasi senescenza-collegata (SA-β-gallone) è il test più comunemente usato per rilevare cellule senescenti entrambi nella cultura ed in vivo15. Rispetto ad altre analisi, il dosaggio di SA-β-gallone permette l'identificazione delle cellule senescenti nel loro ambiente nativo con architettura di tessuto intatto, che è particolarmente importante per lo Studio in vivo . Inoltre, è possibile accoppiare il saggio SA-β-gallone con altri marcatori utilizzando IHC. Tuttavia, il dosaggio di SA-β-gallone richiedono campioni freschi o congelati, che rimane una limitazione importante. Quando i tessuti freschi o surgelati sono ordinariamente disponibili, come i campioni di muscolo TA congelati, SA-β-gallone è ovviamente il dosaggio più adatto per rilevare cellule senescenti. Nanog è il marcatore utilizzato per rilevare le cellule riprogrammate per due motivi: 1) è un indicatore essenziale per la pluripotenza; 2) più importante, l'espressione non è guidato da doxiciclina (dox), pertanto si rileva pluripotenza indotta piuttosto che l'espressione forzata della cassetta Yamanaka.
È importante notare che i protocolli di colorazione presentati in questo studio possono essere condotto separatamente per semplificare la procedura di quantificazione, ma possono anche essere fatto in una procedura di co-colorazione per visualizzare entrambi senescenti e cellule staminali pluripotenti sulla stessa sezione.
Protocollo
gli animali sono stati trattati secondo le linee guida della Comunità europea e il comitato etico, dei protocolli Institut Pasteur (CETEA) approvato.
1. preparazione delle soluzioni Stock
- preparare i materiali per la fissazione del campione di muscolo. Sciogliere 0,5 g di adragante con 20 mL di acqua a temperatura ambiente per rendere il supporto l'incorporamento di congelamento per la fissazione del muscolo.
- Preparare le soluzioni per la colorazione del SA-β-gallone.
- Preparare le soluzioni di riserva di K 3 Fe(CN) 6 (100 mM), K 4 Fe(CN) 6 (100 mM), MgCl 2 (1m) sciogliendo le rispettive polveri in acqua distillata.
- Preparare la soluzione di riserva di 0,2% C 20 H 6 Br 4 Na 2 O 5 (eosina) di diluirla in acqua.
- Non preparare la soluzione di riserva di C 14 H 15 BrClNO 6 (X-gal) (50 mg/mL) di dissoluzione della polvere di X-gal in C 3 H 7 nessun (dimetilformammide, DMF).
- Store K 3 Fe(CN) 6 e K 4 Fe(CN) 6 soluzioni a 4 ° C e MgCl 2 a RT.
Nota: il X-gal possono essere memorizzati nella aliquota a-20 ° C, fino a 6 mesi. Soluzione di eosina può essere mantenuto a RT e riutilizzato dopo aver filtrato se necessario. K 3 Fe(CN) 6 e K 4 Fe(CN) 6 soluzioni protectedfromthe luce. X-gal soluzione non è stabile in acqua e deve essere protetto dalla luce.
- Preparazione delle soluzioni per la macchiatura Nanog: la soluzione di permeabilizzazione contiene 0.1% Na 3 C 6 H 5 O 7 (citrato trisodico), 0,1% C 14 H 22 Oh (C 2 H 4 O) n (n = 9-10) (Triton X-100) in acqua distillata, che deve essere conservato a 4 ° C. preparare la soluzione di blocco contenente 5% siero bovino fetale (FBS) in tampone fosfato salino (PBS), che deve essere conservato a RT.
2. SA-β-gallone colorazione su Frozen TA muscolare sezione
- preparare il materiale di fissaggio per il muscolo TA introducendo una piccola quantità della gomma adragante gomma su una fetta di sughero.
- Infortunato topi di entrambi i sessi (2 mese vecchio, C57/B6) sono rimasti feriti a 10 giorni prima con con (CDX) come descritto in precedenza 13. Uso non-ferito (iniezione di PBS) TA dallo stesso mouse come controllo negativo. Se in vivo riprogrammazione è desiderato, trattare ogni mouse con Dox (1 mg/mL) nell'acqua potabile nello stesso giorno (protetto dalla luce), subito dopo la ferita di CTX.
Nota: La soluzione di Dox deve essere cambiata ogni 3 giorni per una durata totale del trattamento di 7 giorni.- Isolare entrambi i muscoli di TA (ferito e controllare) dai topi come descritto in precedenza ( Figura 1A) 13. Garantire le sezioni trasversale, inserire il tendine distale del muscolo TA la gomma adragante e lasciare circa ¾ parte del muscolo all'esterno ( Figura 1B) e congelare direttamente in azoto liquido raffreddato isopentano per < 1 min.
Nota: Assicurarsi che il muscolo di TA è in posizione perpendicolare e nel centro del sughero. Campioni possono essere conservati a-80 ° C o direttamente cryosectioned in 10 sezioni µm.
- Isolare entrambi i muscoli di TA (ferito e controllare) dai topi come descritto in precedenza ( Figura 1A) 13. Garantire le sezioni trasversale, inserire il tendine distale del muscolo TA la gomma adragante e lasciare circa ¾ parte del muscolo all'esterno ( Figura 1B) e congelare direttamente in azoto liquido raffreddato isopentano per < 1 min.
- i muscoli di TA di processo come descritto in Figura 1B.
- Distribuisci 1 st -10 th sezioni nell'ordine corretto in dieci diverse diapositive presso la posizione superiore sinistra di ciascuna diapositiva. Posizionare la sezione th 11 adiacente alla sezione st 1 sulla prima diapositiva; la sezione di th 12 seguirà lo stesso ordine per essere posizionato a destra oltre alla sezione 2 nd della seconda diapositiva. Ripetere questo processo fino a 10 sezioni/diapositiva sono ottenuti per dieci diapositive (100 sezioni in totale) per garantire il minimo di 1 mm di distanza tra la prima e l'ultima sezione.
- Fissare le sezioni per 4 min in PBS contenente 1% di paraformaldeide e 0,2% glutaraldeide. Lavare con PBS, 2 x 10 min. Successivamente, incubare le sezioni in PBS (pH = 5.5) per 30 min. eseguire tutti i passaggi a RT.
Nota: La fissazione deve essere delicato per mantenere l'attività enzimatica. Eseguire questo passaggio sotto il cofano. Il pH della PBS è fondamentale e la soluzione X-gal dovrà essere protetti dalla luce. - Sezioni Incubare il X-gal soluzione contenente: 4 mM K3Fe(CN) 6, 4mm K4Fe(CN) 6, 2mm MgCl2 e X-Gal di 400 µ g/mL in PBS, pH = 5.5. Incubare al buio a 37 ° C per un minimo di 24 h. lavare i vetrini con PBS, 3 x 10 min, a RT.
Nota: L'incubazione richiede un minimo di 24 ore e può durare 48 ore massimizzare il segnale SA-β-gallone. La soluzione deve essere cambiato dopo 24 ore di incubazione. Le diapositive devono essere protetti dalla luce. Se solo SA-β-gallone macchiatura è desiderata, passare al punto 2.5. Se co-macchiatura con Nanog è desiderata, andare avanti a passaggio 3.1.
Paraformaldeide - fix diapositive in 1% in PBS per 30 min Lavaggio vetrini con PBS, 3 x 10 minuti controcolorazione con eosina 0,2%. Immergere i vetrini nella soluzione eosina per 1 min e sciacquare brevemente con acqua distillata. Infine, montare i vetrini con mezzo di montaggio acquoso non fluorescente (Vedi Tabella materiali).
Nota: È essenziale per eseguire la post-fissazione. Eseguire questo passaggio sotto il cofano. Tutti i passaggi sono eseguiti presso RT.
3. Immunoistochimica utilizzando anticorpi Anti-Nanog
- fissare le diapositive con PBS contenente paraformaldeide al 4% per 10 min. lavaggio con PBS, 2 x 10 minuti aggiungere 200 µ l della soluzione di permeabilizzazione direttamente sulle diapositive e incubare per 5 min.
- Wash scivoli con PBS, 2 x 5 min e nell'ultimo lavaggio, uso 200 µ l PBS contenente 0,25% BSA direttamente sulle diapositive. Eseguire questa procedura al RT.
Attenzione: Eseguire il passaggio di fissaggio sotto il cofano.
- Wash scivoli con PBS, 2 x 5 min e nell'ultimo lavaggio, uso 200 µ l PBS contenente 0,25% BSA direttamente sulle diapositive. Eseguire questa procedura al RT.
- Diapositive Incubate con l'anticorpo primario anti-Nanog (concentrazione finale: 1.25 ug/mL) durante la notte a 4 ° C in PBS contenente 5% FBS. Lavare i vetrini con PBS, 2 x 10 min e nell'ultimo lavaggio, uso 200 µ l PBS contenente 0,25% BSA per 5 min, eseguire tutto il bucato passi a RT.
Nota: Incubare i vetrini in una scatola con tovagliolo di carta bagnato per evitare l'evaporazione. - Incubare diapositive con 100 µ l di anticorpo secondario rAb-HRP da un pronto per l'uso del kit (Vedi Tabella materiali) per 45 min. lavare le diapositive con PBS, 3 x 5 min, a rimuovere l'anticorpo secondario. Eseguire tutti i passaggi a RT con protezione dalla luce.
- Visualizzazione
- in primo luogo, diluire il 3,3 '-diaminobenzidina (C 12 H 14 N 4 C 12 H 18 Cl 4 N 4 (4 HCl), DAB) in tampone substrato fornito pronto per usare il kit (20 µ l di DAB per 1 mL di soluzione tampone del substrato). Aggiungere 100 µ l di soluzione di DAB direttamente su ogni diapositiva e incubare per un massimo di 10 min a RT.
Nota: La soluzione DAB diluita deve essere preparata fresca e possa essere memorizzata fino a una settimana a 4 ° C. Il tempo di incubazione può essere registrato per ridurre al minimo il segnale di fondo ma deve essere mantenuto lo stesso per tutte le diapositive. - Rimuovere la soluzione DAB risciacquando con acqua. Colorante di contrasto le diapositive con soluzione rosso veloce (pronto da utilizzare, vedere la Tabella materiali) per 20 min. lavare i vetrini con acqua ancora brevemente.
- Li disidrata con etanolo al 95% per 5 min seguito da etanolo al 100%, 2 x 5 min. Infine, montare i vetrini con mezzo di montaggio rapido indurimento (Vedi Tabella materiali).
- Osservare i vetrini al microscopio in campo chiaro alle 20 X per evitare sfondo.
Nota: Soluzione rosso veloce può essere mantenuto a RT e riutilizzata dopo il filtraggio.
- in primo luogo, diluire il 3,3 '-diaminobenzidina (C 12 H 14 N 4 C 12 H 18 Cl 4 N 4 (4 HCl), DAB) in tampone substrato fornito pronto per usare il kit (20 µ l di DAB per 1 mL di soluzione tampone del substrato). Aggiungere 100 µ l di soluzione di DAB direttamente su ogni diapositiva e incubare per un massimo di 10 min a RT.
4. Analisi e quantificazione
- SA-β-gallone quantificazione
- scansione di diapositive e scegliere le migliori sezioni su ogni diapositiva sulla base delle immagini acquisite. Utilizzare almeno 2 sezioni/TA per la quantificazione. Giudicare la sezione ' s qualità basata sull'integrità del tessuto, qualità della colorazione e colorazione di contrasto. Per la quantificazione, scegliere le due sezioni di più alte qualità con la massima distanza possibile tra campioni, che consente una migliore rappresentazione di quantificazione di SA-β-gallone in tutta l'intera muscolatura TA.
- Quantificazione delle cellule positive SA-β-gallone ( Figura 2).
- Determinare il grado della dimensione in pixel selezionando manualmente il più piccolo e il più grande cellule positive di SA-β-gallone.
- Aprire l'immagine digitale della diapositiva digitalizzata utilizzando software ImageJ.
- Nell'interfaccia, fare clic su ' Analyze ' > ' Strumenti ' > ' ROI Manager ' > ' Analyze ' > ' impostare misura ' > ' selezionare Area '. Usate lo strumento selezione e circondano il più piccolo e positivo SA-β-gallone più grande delle cellule e aggiungerlo al gestore di ROI cliccando su ' Aggiungi '. Misurare le dimensioni utilizzando la ' misura ' pulsante e salvare i valori per un utilizzo successivo.
- Regolare il parametro di soglia per assicurarsi che siano selezionate tutte le celle visibili positive.
- Convertire l'immagine in scala di grigi cliccando ' immagine ' > ' tipo ' > ' 8-bit ' ( Figura 2A). Poi, vai a ' immagine ' > ' regola ' > ' soglia ', spostare il cursore di secondo fino a quando tutte le celle di SA-β-gallone positive sono coperti in rosso ( Figura 2B), quindi fare clic su ' applica '.
- Analizza particelle cliccando ' Analyze ' > ' analizzare particelle ' > ' dimensioni (pixel ^ 2) ' e applicare il valore definito nel passaggio 4.1.2.1, immettere ' circolarità ': ' 0.00-1.00 ', fare clic su ' ok '; un riepilogo di tutti il conteggiate particelle è mostrato nel gestore di ROI ( Figura 2D).
- Trasferire tutte le particelle selezionate l'immagine originale. Regolare la selezione manualmente per garantire accurata quantificazione. Aggiungere le cellule positive (freccia verde, Figura 2E) e/o rimuovere cellule positive false (freccia rossa, Figura 2E). Infine, misurare l'area delineando la sezione ( Figura 2D) utilizzando il ' strumento selezione '. Fare clic su ' manager ROI ' > ' Aggiungi ' > ' misura '.
- Importante, normalizzare il numero di cellule positive per l'area della sezione.
- Determinare il grado della dimensione in pixel selezionando manualmente il più piccolo e il più grande cellule positive di SA-β-gallone.
- Nanog quantificazione
- contare le cellule positive di Nanog sotto il microscopio nel campo luminoso manualmente a 20 ingrandimenti.
Nota: La colorazione di contrasto rosso veloce permette buona valutazione della morfologia del muscolo TA. Tuttavia, la colorazione è molto leggera e manca di un chiaro profilo della sezione. Spesso, lo scanner non riesce a identificare il contorno delle sezioni e non messa a fuoco correttamente. È possibile utilizzare il marcatore per i bordi delle sezioni del cerchio prima della scansione o utilizzare uno scanner più sensibile per rilevare la sezione. Per il protocollo attuale, è più efficiente per contare le cellule positive di Nanog manualmente.
- contare le cellule positive di Nanog sotto il microscopio nel campo luminoso manualmente a 20 ingrandimenti.
Risultati
Rilevare la senescenza cellulare indotta da lesione muscolare
Recentemente è stato dimostrato che la lesione del muscolo induce senescenza cellulare transitoria14. A 10 giorni post-infortunio (DPI), la maggior parte dei myofibers danneggiati è in fase di rigenerazione con nuclei in posizione centrale, un segno distintivo della rigenerazione delle fibre muscolari, e l'architettura del muscolo viene ristabilita. Le cellule di infiltrazione infiammatorie si riducono drasticamente pur rimanendo visibile in alcune regioni. 10 DPI è un punto di buon tempo per rilevare cellule senescenti di SA-β-gallone, poiché ci sono poche cellule infiammatorie e necrotiche presenti nel muscolo di interferire con la colorazione. Per determinare la specificità della colorazione, TA iniettato con PBS dal mouse stesso (Figura 1A) viene utilizzato come controllo negativo critico.
Per garantire una migliore e più precisa valutazione delle cellule positive SA-β-gallone, sezioni da diversi piani del muscolo TA vengono inseriti nella stessa diapositiva (Figura 1B). Contatore di colorazione con eosina è importante per la quantificazione automatica delle cellule dal software ImageJ positive SA-β-gallone. Contatore di eosina delinea la sezione, che consente allo scanner digitale rilevare le sezioni con la corretta messa a fuoco. È importante definire accuratamente la gamma e la soglia di rilevazione (Figura 2A-D). Inoltre, un processo manualmente a cura è essenziale per consentire la più accurata rilevazione e quantificazione (Figura 2E).
Facilita la senescenza cellulare in vivo riprogrammazione muscolare
Modello di topo riprogrammabile (i4F) fornisce un sistema ideale per valutare l'impatto della senescenza cellulare plasticità e rigenerazione. Dopo lesione del muscolo, i4F topi vengono trattati con dox a indurre la riprogrammazione in vivo. 7 giorni di trattamento di dox (1 mg/mL) sono sufficiente per indurre la riprogrammazione a livello cellulare, mentre ancora essere ben tollerato dai topi (Figura 3A). Pertanto, abbiamo raccolto i muscoli feriti alle 10 DPIs da i4F topi trattati con dox per 7 giorni.
Sebbene sia possibile eseguire co-macchiatura di SA-β-gallone con Nanog, non è consigliabile per quantificazione a causa di potenziali interferenti colorazione. Come accennato in precedenza, contatore macchiatura è essenziale per il rilevamento di scanner digitale. Il migliore contatore che macchia per la SA-β-gallone insieme Nanog è rosso veloce orhematoxylin. Tuttavia, il contatore macchiatura potrebbe mascherare sopra il SA-β-gallone o Nanog segnale. Pertanto, per la più accurata quantificazione, è meglio effettuare separatamente su diapositive consecutive (Figura 3B). Quantificando SA-β-gallone positiva e Nanog cellule positive da diapositive adiacenti, abbiamo stabilito una correlazione positiva tra di loro (Figura 3), suggerendo un potenziale coinvolgimento di senescenza cellulare plasticità e rigenerazione.
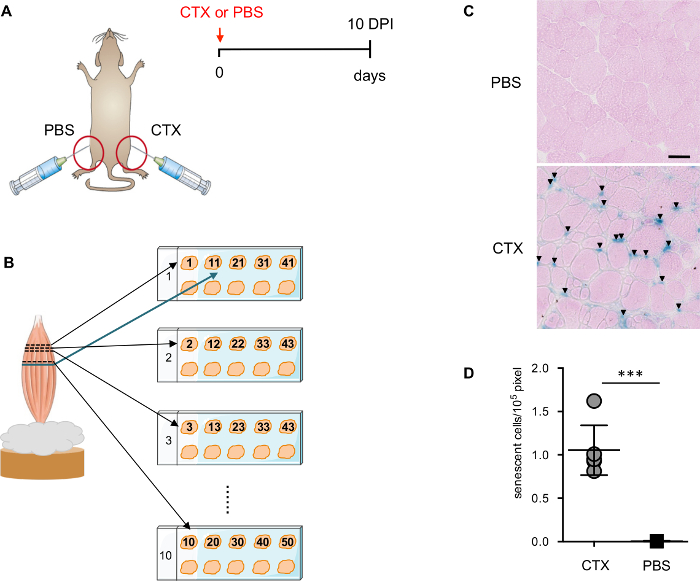
Figura 1: valutare il livello di senescenza dopo lesione del muscolo. (A) rappresentazione schematica della strategia di lesioni muscolo usata per indurre senescenza. (B) rappresentazione schematica della preparazione muscolare sezione. (C) immagini rappresentative di SAβGal colorazione counterstained con eosina. Frecce indicano verso le cellule SA-β-gallone+ . Scala bar = 50 µm. cellule (D) quantificazione del SA-β-Gal+ in TA-muscolo infortunato e non-ferito. Ogni punto corrisponde ad un singolo animale. Significatività statistica è stata valutata tramite la studente t-test a due code: * * * p < 0.001. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Quantificazione delle cellule SA-β-gallone+ dal software ImageJ. (A-D) schermate di una sezione di muscolo nell'interfaccia del software ImageJ. Schermata di conversione di un'immagine di sezione del muscolo per grigio scala (A); Selezionando tutti i SA-β-cellule Gal + nella sezione (B); Analizzando le particelle selezionate (C); Riepilogo di tutte le particelle contati in gestione ROI (D). (E) Screen shot del processo di curatela manuale. Clicca qui per visualizzare una versione più grande di questa figura.
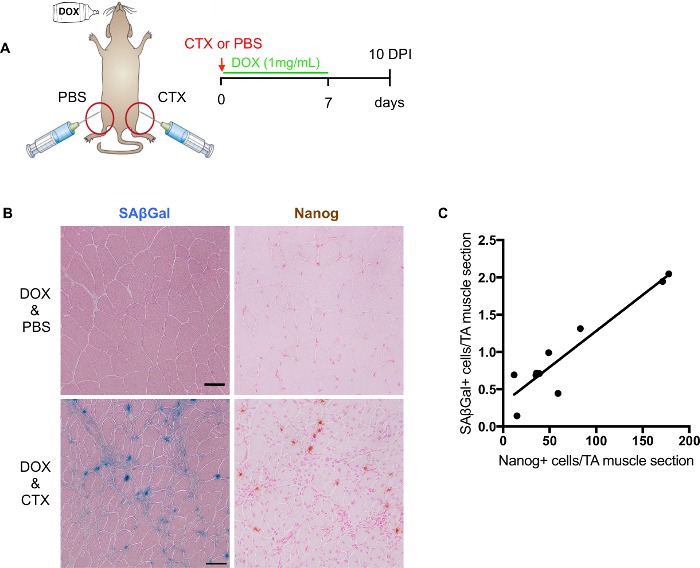
Figura 3: Valutazione in vivo riprogrammazione dopo lesione del muscolo. (A) rappresentazione schematica di valutare in vivo riprogrammazione e senescenza livello dopo lesione del muscolo. (B) immagini rappresentative di SA-β-gallone e Nanog colorazione sulle sezioni congelate del muscolo scheletrico danneggiato. SAβGal counterstained di colorazione con eosina (sinistra); la macchiatura di Immunohistochemical di Nanog controcolorati con veloce rosso (a destra). Muscoli danneggiati non vengono visualizzati sul muscolo superiore e ferito sotto. Scala bar = 50 µm. (C) quantificazione e correlazione di SA-β-gallone + e Nanog+ cellule in sezioni consecutive (n = 9 topi, valore rappresenta la media di 2 sezioni per topo). Clicca qui per visualizzare una versione più grande di questa figura.
| Volume di 50 mL | |
| soluzione madre di6 K3Fe(CN) 100 mM | 2 mL |
| 100 mM magazzino K4Fe(CN)6 soluzione | 2 mL |
| 1 M MgCl2 | 100 ΜL |
| 50 mg/mL X-Gal | 400 ΜL |
| PBS (pH 5,5) | mL 45,50 |
Tabella 1: Composizione di 50 mL soluzione X-gal.
Discussione
Qui, presentiamo un metodo per rilevare entrambi senescenti e cellule staminali pluripotenti in muscolo scheletrico di topi riprogrammabili. Questo metodo potrebbe essere utilizzato per valutare e quantificare sia senescenza e indurre la plasticità cellulare in vivoed esaminare il ruolo della senescenza in rigenerazione e riparazione tissutale.
Nel protocollo attuale, l'analisi di β-galattosidasi senescenza-collegata (SA-β-gallone) è usata per rilevare in vivo le cellule senescenti nel muscolo scheletrico. Questo test rileva l'attività di β-galattosidasi lysosomal aumentata a suboptimum pH (6.0 o 5.5), connesse in particolare con cellule senescenti, mentre attività di questo enzima in genere viene misurata a pH acido 4,516,17. Pertanto, è importante regolare il pH (pH = 6 o 5.5) per garantire una rilevazione specifica di attività senescenza-collegata. Inoltre, il contatore colorazione con eosina è essenziale per la quantificazione automatica di celle SA-β-gallone+ , dove i segnali di deboli e diffusi non vengono conteggiati. Per evitare la potenziale variabilità, è preferibile che la stessa persona esegue l'intera procedura di conteggio.
Anche se il dosaggio di SA-β-gallone è il più ampiamente usato e accettato biomarcatore per cellule senescenti, non si tratta di un esclusivo indicatore per la senescenza. È stato suggerito che cellule di sovra-confluenti nella cultura potrebbero causare false positività per SA-β-gallone18. La sensibilità del dosaggio può essere tipo delle cellule e dei tessuti tipo dipendente in vivo19. Pertanto, è necessario utilizzare altri indicatori canoniche indipendenti, come la mancanza di proliferazione, aumentata espressione di mediatori di senescenza (p16, ARF, p53, p21 e p27) e la secrezione di vari fattori SASP, per confermare e caratterizzare ulteriormente senescenza in vivo. Inoltre, adeguati controlli negativi sono indispensabili per l'interpretazione dei risultati, soprattutto per Studio in vivo .
Nonostante il fatto che SA-β-gallone dosaggio non è perfetto, fornire informazioni particolarmente utili per lo Studio in vivo . Permette la rilevazione delle cellule senescenti nel loro ambiente residente con architettura di tessuto intatto, fornendo informazioni critiche facilitando l'ulteriore comprensione del ruolo delle cellule senescenti in diversi fisiologica e patologica contesti. Inoltre, può essere accoppiato con immunostaining di altri indicatori, quali marcatori di superficie cellulare per determinare l'identità cellulare delle cellule senescenti; o marcatori di staminalità per esaminare il potenziale coinvolgimento di senescenza in rigenerazione e nella tumorigenesi. In precedenza, abbiamo effettuato l'analisi di SA-β-gallone con la macchiatura di immunohistochemical di Nanog nella stessa sezione o in prossimità di indagare la potenziale correlazione tra senescenza e in vivo riprogrammazione8. Mentre questo protocollo è focalizzato sul muscolo scheletrico, può certamente essere esteso ad altri tessuti.
Recentemente, la senescenza cellulare è stata implicata nella riparazione tissutale e rigenerazione, probabilmente via SASPs7,8,9. Comprensione dei meccanismi di come senescenza contribuisce alla rigenerazione e riparazione tissutale avrà certamente un impatto tremendo sulla medicina rigenerativa. Questo test fornisce uno strumento importante e prezioso per facilitare l'identificazione e quantificazione di senescente cellule in vivo.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
Siamo grati a Clemire Cimper per il suo eccellente supporto tecnico. Lavoro nel laboratorio di H.L. è stato finanziato dal Institut Pasteur, Centre National pour la Recherche scientifica e l'Agence Nationale de la Recherche (Laboratoire d'Excellence Revive, Investissement d'Avenir; ANR-10-LABX-73), l'Agence Nationale de la Recherche (ANR-16-CE13-0017-01) e la Fondation ARC (PJA 20161205028). C.C. e C.A. sono finanziate con il dottorato di ricerca e borse di studio post-dottorati dal Consorzio rivivere.
Materiali
| Name | Company | Catalog Number | Comments |
| K3Fe(CN)6 | Sigma | 13746-66-2 | For SA-β Gal staining solution |
| K4Fe(CN)6 | Sigma | 14459-95-1 | For SA-β Gal staining solution |
| MgCl2 | Sigma | 7786-30-3 | For SA-β Gal staining solution |
| X-Gal | Sigma | B4252 | For SA-β Gal staining solution |
| Doxycycline | Sigma | D3447 | For inducing in vivo reprogramming |
| Cardiotoxin | Lotaxan Valence, France | L8102 | For muscle injury |
| Glutaraldehyde | Sigma | 111-30-8 | For Fixation solution |
| Paraformaldehyde | Electron microscopy science | 50-980-487 | For Fixation solution |
| NaCitrate : Sodium Citrate monobasic bioxtra, anhydre | Sigma | 18996-35-5 | For permeabilization solution |
| Triton | Sigma | 93443 | For permeabilization solution |
| Bovine Serum Albumin | Sigma | A3608 | Washing solution |
| Antibody anti- Nanog | Cell signalling | 8822S | Rabbit monoclonal antibody |
| EnVision+ Kits (HRP. Rabbit. DAB+) | Dako | K4010 | For Nanog revelation |
| Eosin 1% | Leica | 380159EOF | Counterstainning |
| Fast red | Vector Laboratories | H-3403 | Counterstainning |
| Thermo Scientific Shandon Immu-Mount | Fisher scientific | 9990402 | Mounting solution |
| Quick-hardening mounting medium for microscopy : Eukitt® | Sigma | 25608-33-7 | Mounting solution |
| Microscope Phase Contrast Brightfield CKX41: 10X-20X-40X objectives | Olympus | CKX41 | Microscope for Nanog quantification |
| Mouse: i4F-A | Abad et al., 2013 | N/A | Reprogrammable mouse model |
| Skeletal muscle, Tibialis Anterior | |||
| Slide Scanner | Zeiss | Axio Scan Z1 | slides scanning |
Riferimenti
- Munoz-Espin, D., Serrano, M. Cellular senescence: from physiology to pathology. Nat Rev Mol Cell Biol. 15 (7), 482-496 (2014).
- Baker, D. J., et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 530 (7589), 184-189 (2016).
- Hayflick, L. The Limited in Vitro Lifetime of Human Diploid Cell Strains. Exp Cell Res. 37, 614-636 (1965).
- Coppe, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu Rev Pathol. 5, 99-118 (2010).
- Yun, M. H., Davaapil, H., Brockes, J. P. Recurrent turnover of senescent cells during regeneration of a complex structure. Elife. 4, (2015).
- Demaria, M., et al. An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA. Dev Cell. 31 (6), 722-733 (2014).
- Mosteiro, L., et al. Tissue damage and senescence provide critical signals for cellular reprogramming in vivo. Science. 354 (6315), (2016).
- Chiche, A., et al. Injury-Induced Senescence Enables In Vivo Reprogramming in Skeletal Muscle. Cell Stem Cell. , (2016).
- Ritschka, B., et al. The senescence-associated secretory phenotype induces cellular plasticity and tissue regeneration. Genes Dev. 31 (2), 172-183 (2017).
- Takahashi, K., Yamanaka, S. A decade of transcription factor-mediated reprogramming to pluripotency. Nat Rev Mol Cell Biol. 17 (3), 183-193 (2016).
- Abad, M., et al. Reprogramming in vivo produces teratomas and iPS cells with totipotency features. Nature. 502 (7471), 340-345 (2013).
- Ohnishi, K., et al. Premature Termination of Reprogramming In Vivo Leads to Cancer Development through Altered Epigenetic Regulation. Cell. 156 (4), 663-677 (2014).
- Guardiola, O., et al. Induction of Acute Skeletal Muscle Regeneration by Cardiotoxin Injection. J Vis Exp. (119), (2017).
- Le Roux, I., Konge, J., Le Cam, L., Flamant, P., Tajbakhsh, S. Numb is required to prevent p53-dependent senescence following skeletal muscle injury. Nat Commun. 6, 8528(2015).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nat Protoc. 4 (12), 1798-1806 (2009).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proc Natl Acad Sci U S A. 92 (20), 9363-9367 (1995).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging Cell. 5 (2), 187-195 (2006).
- Krishna, D. R., Sperker, B., Fritz, P., Klotz, U. Does pH 6 beta-galactosidase activity indicate cell senescence? Mech Ageing Dev. 109 (2), 113-123 (1999).
- Cristofalo, V. J. SA beta Gal staining: biomarker or delusion. Exp Gerontol. 40 (10), 836-838 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon