Method Article
Évaluation des lésions induites par la sénescence et In Vivo reprogrammation dans le Muscle squelettique
Dans cet article
Résumé
Nous présentons ici un protocole détaillé pour détecter toutes deux de sénescence des cellules souches pluripotentes dans le muscle squelettique sur blessure tout en induisant en vivo reprogrammation. Cette méthode convient pour évaluer le rôle de la sénescence cellulaire au cours de la régénération tissulaire et reprogrammation in vivo.
Résumé
Sénescence cellulaire est une réaction de stress qui se caractérise par un arrêt de la croissance cellulaire stable, ce qui est important pour de nombreux processus physiologiques et pathologiques, comme le cancer et le vieillissement. Récemment, la sénescence a également été impliquée dans la régénération et la réparation des tissus. Par conséquent, il est devenu plus en plus critique pour identifier les cellules sénescentes en vivo. Associés à la sénescence β-galactosidase (SA-β-Gal) dosage est le dosage plus largement utilisé pour détecter les cellules sénescentes en culture et in vivo. Cette analyse est basée sur le contenu lysosomal accru dans les cellules sénescentes, qui permet la détection histochimique d’activité β-galactosidase lysosomale à suboptimum pH (6 ou 5.5). En comparaison avec d’autres tests, comme la cytométrie en flux, cela permet l’identification des cellules sénescentes dans leur environnement résident, qui offre des informations précieuses telles que l’emplacement ayant trait à l’architecture tissulaire, la morphologie et le possibilité de couplage avec les autres marqueurs par immunohistochimie (IHC). La limitation majeure de l’essai de SA-β-Gal est l’exigence des échantillons frais ou congelés.
Nous présentons ici un protocole détaillé pour comprendre comment cellulaire sénescence favorise cellulaire plasticité et tissus regeneration in vivo. SA-β-Gal nous permet de détecter les cellules sénescentes dans le muscle squelettique sur blessure, ce qui est un système bien établi pour étudier la régénération des tissus. De plus, nous utilisons IHC pour détecter Nanog, un marqueur des cellules souches pluripotentes, dans un modèle de souris transgénique. Ce protocole permet d’examiner et de quantifier la sénescence cellulaire dans le contexte de la plasticité cellulaire induite et in vivo de reprogrammation.
Introduction
Sénescence cellulaire est une forme de réponse au stress que se caractérise par un arrêt du cycle cellulaire stable. Au cours de la dernière décennie, les recherches ont fermement établi que la sénescence est associée liée divers processus biologiques et pathologiques, y compris le développement embryonnaire, la fibrose et organisme vieillissement1,2. Sénescence cellulaire a été identifiée dans les fibroblastes humains à la fin de leur durée de vie réplicative déclenchée par les télomères de raccourcir de3. Outre le stress réplicatif, il y a beaucoup d’autres stimuli qui peut induire la sénescence, y compris des dommages ADN, stress oxydatif, signaux oncogènes et altérations génomiques/épigénomique, n’importe lequel peut éventuellement activer la p53/p21 et/ou pRB pathways to établir et renforcer la croissance permanente arrestation1. Une des caractéristiques importantes des cellules sénescentes est qu’ils restent un métabolisme actifs et robuste expriment un phénotype sécrétoire associée à la sénescence (SASP) : sécrétion de cytokines inflammatoires, facteurs de croissance et la matrice extracellulaire 4de facteurs. Facteurs de la SASP ont été proposées pour jouer un rôle important dans la médiation et d’amplifier l’effet de la sénescence, à cause de leurs effets puissants sur l’attrait des cellules immunitaires et altérer les tissus locaux et systémiques des milieux1. Fait intéressant, la sénescence a été récemment proposée semble importante pour tissus réparation et régénération de5,6. En outre, les données provenant de plusieurs laboratoires, y compris la nôtre, a suggéré que sénescence induite sur les dommages de tissu pourrait améliorer la plasticité cellulaire, par l’intermédiaire de SASP, pour promouvoir la régénération7–9. Par conséquent, toutes les nouvelles données soulignent l’importance de l’étude in vivode la sénescence.
Dans la période (iPSC) les cellules souches pluripotentes induites, plasticité cellulaire est la capacité d’une cellule d’acquérir une nouvelle identité et d’adopter un autre sort lorsqu’il est exposé à différents stimuli tant en culture et in vivo10. On sait que reprogrammation complète peut être obtenue en vivo11,12, où l’expression de la la cassette contenant les quatre facteurs de Yamanaka : Oct4, Sox2, Klf4et c-Myc de (OSKM) peut être induite en vivo pour promouvoir la formation de tératomes dans plusieurs organes. Donc, un modèle de souris reprogrammable (i4F) peut être utilisé comme un puissant système pour identifier les régulateurs critiques et les voies qui sont importants pour la plasticité cellulaire11.
Un système adapté et sensible le in vivo est essentiel de comprendre comment cellulaire sénescence réglemente la plasticité cellulaire dans le contexte de la régénération tissulaire. Nous présentons ici un système robuste et un protocole détaillé pour évaluer le lien entre la sénescence et la plasticité cellulaire dans le contexte de la régénération tissulaire. La combinaison du cheval (CTX) induite par les lésions musculaires dans le groupe de muscle Tibialis Anterior (TA), un système bien établi pour étudier la régénération tissulaire et le modèle de souris i4F, permet la détection de la sénescence cellulaire et in vivo reprogrammation pendant la régénération du muscle.
Afin d’évaluer le lien entre la plasticité cellulaire et de la sénescence, i4F souris sont blessés avec CTX pour induire des lésions musculaires aiguës et traités avec la doxycycline (0,2 mg/mL) pendant 7 jours pour induire en vivo reprogrammation. Alors qu’un CTX a induit des lésions musculaires aigus et protocole de régénération a été récemment publié13, pour des raisons éthiques, cette procédure va être omise dans le protocole actuel. TA muscle échantillons seront recueillis à 10 jours post blessures13, lorsque le sommet des cellules sénescentes ont été observés auparavant14. Ici, ce protocole détaillé décrit toutes les étapes nécessaires pour évaluer le niveau de la sénescence (via SA-β-Gal) et la reprogrammation (via IHC tachant de Nanog).
Associés à la sénescence bêta-galactosidase (SA-β-Gal) dosage est le dosage plus couramment utilisé pour détecter des cellules sénescentes en culture et in vivo15. Par rapport aux autres épreuves, le SA-β-Gal permet l’identification des cellules sénescentes dans leur environnement natif avec l’architecture de tissus intacts, ce qui est particulièrement important pour l’étude de in vivo . En outre, il est possible de coupler le dosage de SA-β-Gal avec les autres marqueurs à l’aide de IHC. Cependant, le test SA-β-Gal exige des échantillons frais ou congelés, qui reste une limitation majeure. Lorsque les tissus frais ou congelés sont couramment disponibles, tels que les échantillons congelés de muscle TA, SA-β-Gal est évidemment le test plus adéquat pour détecter les cellules sénescentes. Nanog est le marqueur permettant de détecter les cellules reprogramed pour deux raisons : 1) c’est un marqueur essentiel de pluripotence ; 2) plus important encore, son expression n’est pas Poussée par la doxycycline (dox), donc il détecte la pluripotence induite plutôt que l’expression forcée de la cassette de Yamanaka.
Il est important de noter que les protocoles de coloration présentés dans cette étude peuvent être réalisées séparément pour simplifier la procédure de quantification, mais peuvent également être faits dans une méthode de coloration conjointement afin de visualiser les deux sénescentes et cellules souches pluripotentes sur la même section.
Protocole
animaux ont été traités selon les directives de la Communauté européenne et le Comité d’éthique des protocoles de l’Institut Pasteur (CETEA) approuvé.
1. préparation des Solutions Stock
- préparer les documents pour fixation d’échantillon de muscle. Dissoudre 0,5 g de gomme adragante avec 20 mL d’eau à la droite pour rendre le milieu de congélation-enrobage pour la fixation des muscles.
- Préparer les solutions pour la coloration de SA-β-Gal.
- Préparer les solutions mères de K 3 Fe(CN) 6 (100 mM), K 4 Fe(CN) 6 (100 mM), MgCl 2 (1 M) en dissolvant les poudres respectifs dans l’eau distillée.
- Préparer la solution de 0,2 % C 20 H 6 Br 4 Na 2 O 5 (éosine) il diluer dans l’eau.
- Ne préparer la solution C 14 H 15 BrClNO 6 (X-gal) (50 mg/mL) en dissolvant la poudre de X-gal en C 3 H 7 aucun (diméthylformamide, DMF).
- Magasin K 3 Fe(CN) 6 K 4 Fe(CN) 6 solutions et à 4 ° C et MgCl 2 à RT.
Remarque : X-gal peut être stocké dans la partie aliquote à-20 ° C, jusqu'à 6 mois. Solution d’éosine peut être conservée au RT et réutilisée après filtrage si nécessaire. 4 Fe(CN) 6 K 3 Fe(CN) 6 et K sont protectedfromthe lumière. Solution de X-gal n’est pas stable dans l’eau et doit être protégé de la lumière.
- Préparation des solutions de coloration Nanog : la solution de la perméabilisation contient 0,1 % Na 3 C 6 H 5 O 7 (citrate trisodique), 0,1 % C 14 H 22 O (C 2 H 4 O) n (n = 9-10) (Triton X-100) dans l’eau distillée, qui doivent être conservés à 4 ° C. préparer la solution de blocage contenant 5 % de sérum bovin fœtal (SVF) dans la saline tamponnée au phosphate (PBS), qui doit être conservée à température ambiante.
2. SA-β-Gal coloration sur Frozen Section de Muscle TA
- préparer le matériel de fixation pour le muscle TA en plaçant une petite quantité de la gomme adragante, gomme sur une tranche de Liège.
- Blessés souris des deux sexes (2 mois, C57/B6) ont été blessés à 10 jours avant avec cheval (CDX) comme décrit plus haut 13. Utilisation non lésés (injection de PBS) TA de la même souris comme contrôle négatif. Si en vivo reprogrammation est désirée, traiter chaque souris avec Dox (1 mg/mL) dans l’eau potable sur le même jour (abri de la lumière), juste après la blessure CTX.
NOTE : La solution de Dox doit être changé tous les 3 jours pour une durée totale de traitement de 7 jours.- Isoler les deux muscles de TA (blessés et contrôle) des souris comme décrit plus haut ( Figure 1 a) 13. Pour s’assurer que les sections transversales, insérez le tendon distal du muscle TA dans la gomme adragante et laisser environ ¾ partie du muscle à l’extérieur ( Figure 1 b) et congeler directement dans l’azote liquide refroidi isopentane pour < 1 min.
Remarque : Assurez-vous que le muscle TA est dans une position perpendiculaire et dans le centre du bouchon. Échantillons peuvent être conservés à-80 ° C ou directement sectionnés dans 10 sections µm.
- Isoler les deux muscles de TA (blessés et contrôle) des souris comme décrit plus haut ( Figure 1 a) 13. Pour s’assurer que les sections transversales, insérez le tendon distal du muscle TA dans la gomme adragante et laisser environ ¾ partie du muscle à l’extérieur ( Figure 1 b) et congeler directement dans l’azote liquide refroidi isopentane pour < 1 min.
- Traiter les muscles de TA comme décrit le la Figure 1 b.
- Distribuer le 1 st -10 ème sections dans l’ordre correct sur dix toboggans différents à la position supérieure gauche de la lame. Placer la section de th 11 adjacent à la 1 section de st sur la première diapositive ; la section 12 de th suivra le même ordre à placer droit en dehors de la section 2 nd sur la deuxième diapositive. Répétez ce processus jusqu'à ce que 10 sections/diapositive sont obtenus pour les dix diapositives (100 articles au total) pour s’assurer que la distance minimale de 1 mm entre la première section et la dernière section.
- Difficulté les sections pendant 4 min dans du PBS contenant paraformaldéhyde à 1 % et 0,2 % de glutaraldéhyde. Laver avec du PBS, 2 x 10 min. Ensuite, incuber les sections dans du PBS (pH = 5,5) pendant 30 min. effectuer toutes les étapes à RT.
Remarque : La fixation doit être doux pour maintenir l’activité enzymatique. Effectuez cette étape sous le capot. Le pH de la PBS est critique et la solution de X-gal doit être protégée de la lumière. - Sections incuber dans la solution de X-gal contenant : 4 mM K3Fe(CN) 6, 4 mM K4Fe(CN) 6, 2 mM de MgCl2 et 400 µg/mL X-Gal dans du PBS, pH = 5,5. Incuber dans l’obscurité à 37 ° C pendant au moins 24 h. laver les lames avec PBS, 3 x 10 min, à ta.
Remarque : L’incubation nécessite un minimum de 24 heures et peut durer pendant 48 heures afin d’optimiser le signal de SA-β-Gal. La solution doit être changée après 24 heures d’incubation. Les diapositives doivent être protégés de la lumière. Si seulement SA-β-Gal coloration est souhaitée, continuez au point 2.5. Si une coloration conjointement avec Nanog est souhaitée, s’il vous plaît passer à l’étape 3.1.
Paraformaldéhyde - fix diapositives de 1 % dans du PBS pendant 30 min. laver glisse avec du PBS, 3 x 10 min. contre-colorant avec l’éosine de 0,2 %. Plonger les lames dans la solution d’éosine pendant 1 min et rincez-les à l’eau distillée brièvement. Enfin, monter les lames avec milieu de montage aqueux non fluorescence (voir Table des matières).
Remarque : Il est essentiel d’effectuer après la fixation. Effectuez cette étape sous le capot. Toutes les mesures sont effectuées à RT.
3. Immunohistochemistry utilisant des anticorps Anti-Nanog
- fixer les lames avec du PBS contenant 4 % paraformaldéhyde à 10 min. Lavez avec du PBS, 2 x 10 min. Ajouter 200 µL de la solution de perméabilisation directement sur les diapositives et incuber pendant 5 min.
- Lavage glisse avec du PBS, 2 x 5 min et dans le dernier lavage, utilisation 200 µL de PBS contenant 0,25 % de BSA directement sur les diapositives. Effectuer toutes ces étapes à RT.
ATTENTION : Pour effectuer l’étape de fixation sous le capot.
- Lavage glisse avec du PBS, 2 x 5 min et dans le dernier lavage, utilisation 200 µL de PBS contenant 0,25 % de BSA directement sur les diapositives. Effectuer toutes ces étapes à RT.
- Incuber les lames avec l’anticorps anti-Nanog primaire (concentration finale : 1,25 ug/mL) durant la nuit à 4 ° C dans du PBS contenant 5 % FBS. Les lames avec du PBS, 2 x 10 min et dans le dernier lavage, utilisation 200 µL de PBS contenant 0,25 % de BSA pendant 5 min. effectuer tout le linge les étapes à RT.
NOTE : Incuber les lames dans une boîte avec une serviette en papier humide pour éviter une évaporation. - Incuber les lames avec 100 µL d’anticorps secondaire rAb-HRP de prêt à l’emploi du kit (voir Table des matières) 45 min. lavage glisse avec du PBS, 3 x 5 min, à éliminer les anticorps secondaires. Effectuez toutes les étapes à la droite, avec protection contre la lumière.
- Visualisation
- tout d’abord, diluer le 3,3 '-diaminobenzidine (C 12 H 14 N 4 C 12 H 18 Cl 4 N 4 (4 HCl), DAB) dans le tampon de substrat fournies par le prêt à l’emploi kit (20 µL de DAB 1 ml de solution tampon de substrat). Ajouter 100 µL de solution de DAB directement sur chaque diapositive et incuber pendant un maximum de 10 min à température ambiante.
Remarque : La solution diluée de DAB doit être fraîchement préparée et peut être stockée pendant une semaine à 4 ° C. Le temps d’incubation peut être ajusté afin de minimiser le signal de fond mais doit être le même pour toutes les diapositives. - Supprimer la solution DAB en rinçant avec de l’eau. Contre-coloration les diapositives avec solution rapide rouge (prêt à utiliser, voir la Table des matières) pendant 20 min. laver les lames avec de l’eau à nouveau brièvement.
- Les déshydrater avec l’éthanol à 95 % pour 5 msuivie en éthanol à 100 %, 2 x 5 min. Enfin, monter les lames avec support de montage rapide-durcissement (voir Table des matières).
- Observer les diapositives sous le microscope en champ lumineux à 20 X pour éviter fond.
NOTE : Solution rapide rouge peut être conservée au RT et réutilisée après filtrage.
- tout d’abord, diluer le 3,3 '-diaminobenzidine (C 12 H 14 N 4 C 12 H 18 Cl 4 N 4 (4 HCl), DAB) dans le tampon de substrat fournies par le prêt à l’emploi kit (20 µL de DAB 1 ml de solution tampon de substrat). Ajouter 100 µL de solution de DAB directement sur chaque diapositive et incuber pendant un maximum de 10 min à température ambiante.
4. Analyse et Quantification
- du SA-β-Gal quantification numériser les diapositives et sélectionner les meilleures sections sur chaque diapositive basées sur les images acquises. Utilisez au moins 2 sections/TA pour la quantification. Juge de la section ' s qualité basée sur l’intégrité des tissus, qualité de la coloration et contre-coloration. Pour la quantification, choisissez les deux sections de qualité plus élevées avec la distance maximale possible entre les échantillons, qui permet une meilleure représentation de SA-β-Gal quantification dans tout le muscle entier de TA.
- Quantification des cellules positives SA-β-Gal ( Figure 2).
- Déterminer le rang de la taille du pixel en sélectionnant manuellement la plus petite et les plus grandes cellules positives de SA-β-Gal.
- Ouvrez l’image numérique de la diapo scannée à l’aide de logiciels ImageJ.
- Dans l’interface, cliquez sur ' Analyze ' > ' outils ' > ' ROI Manager ' > ' analyse ' > ' mesure la valeur ' > ' choisir la zone '. Utilisez l’outil Sélection et entourent le plus petit et positif SA-β-Gal plus grande cellule et ajoutez-le au gestionnaire du ROI en cliquant sur ' Add '. Mesurer les tailles à l’aide de la ' mesure ' bouton et enregistrer les valeurs pour une utilisation ultérieure.
- Régler le paramètre de seuil pour s’assurer que toutes les cellules positives visibles sont sélectionnés.
- Convertir l’image à l’échelle de gris en cliquant sur ' Image ' > ' type ' > ' 8-bit ' ( Figure 2 a). Ensuite, allez dans ' Image ' > ' réglage ' > ' seuil ', déplacez le curseur de second jusqu'à ce que toutes les cellules de SA-β-Gal positifs sont couverts en rouge ( Figure 2 b), puis cliquez sur ' appliquer '.
- Analyser les particules en cliquant ' Analyze ' > ' analyser les particules ' > ' taille (pixel ^ 2) ' et appliquer la valeur définie à l’étape 4.1.2.1, entrez ' circularité ' : ' 0,00-1.00 ', cliquez sur ' OK ' ; un résumé de tous les particules comptés s’affiche dans le gestionnaire de ROI ( Figure 2D).
- Transférer toutes les particules sélectionnés à l’image d’origine. Ajuster la sélection manuellement afin d’assurer une quantification précise. Ajouter des cellules positives (flèche verte, Figure 2E) et/ou éliminer les cellules de positifs fausses (flèche rouge, Figure 2E). Enfin, mesurer l’aire en indiquant la section ( Figure 2D) en utilisant le ' outil de sélection '. Cliquez sur ' gestionnaire de ROI ' > ' Add ' > ' mesure '.
- Important, normaliser le nombre de cellules positives par l’aire de la section.
- Déterminer le rang de la taille du pixel en sélectionnant manuellement la plus petite et les plus grandes cellules positives de SA-β-Gal.
- Nanog quantification
- compter les cellules positives Nanog au microscope dans le champ lumineux manuellement à un grossissement de 20 X.
Remarque : La contre-coloration rapide rouge permet la bonne évaluation de la morphologie du muscle TA. Cependant, la coloration est très léger et ne dispose pas d’un aperçu clair de la section. Souvent, le scanner ne parvient pas à identifier les limites des sections et ne peut pas se concentrer correctement. Il est possible d’utiliser des marqueurs pour encercler les bords des sections avant la numérisation ou utiliser un scanner plus sensible pour détecter la section. Pour le protocole actuel, il est plus efficace de compter les cellules positives Nanog manuellement.
- compter les cellules positives Nanog au microscope dans le champ lumineux manuellement à un grossissement de 20 X.
Résultats
Détection de la sénescence cellulaire induite par des blessures musculaires
Il a été démontré récemment que blessure musculaire induit la sénescence cellulaire transitoire14. À 10 jours après la lésion (DPI), la majorité des myofibres endommagés est en cours de régénération avec noyaux situés au centre, une caractéristique de la régénération des fibres musculaires, et l’architecture du muscle est rétablie. L’infiltration des cellules inflammatoires sont considérablement réduits tout en restant visible dans certaines régions. 10 DPI est un bon moment pour détecter les cellules sénescentes par SA-β-Gal, puisqu’il y a moins de cellules nécrotiques et inflammatoires présents dans le muscle d’interférer avec la coloration. Pour déterminer la spécificité de la coloration, TA injecté avec du PBS de la même souris (Figure 1 a) est utilisé comme contrôle négatif critique.
Afin d’assurer une évaluation plus précise et mieux des cellules positives SA-β-Gal, des sections de différents plans du muscle TA sont placées dans la même lame (Figure 1 b). Compteur de coloration avec l’éosine est important pour la quantification automatique des cellules positives par ImageJ software SA-β-Gal. Éosine compteur coloration décrit la section, qui permet à l’analyseur numérique détecter les sections avec mise au point correcte. Il est important de définir soigneusement la gamme et le seuil de détection (Figure 2 a-D). En outre, un processus manuellement curated est essentiel pour permettre le plus précis de détection et de quantification (Figure 2E).
Facilite la sénescence cellulaire in vivo reprogrammation dans le muscle
Modèle de souris reprogrammable (i4F) fournit un système idéal pour évaluer l’impact de la sénescence sur la plasticité cellulaire et la régénération. Lors d’une blessure musculaire, i4F souris sont traités avec dox pour induire la reprogrammation in vivo. 7 jours de traitement dox (1 mg/mL) est suffisante pour induire la reprogrammation au niveau cellulaire, tandis que toujours étant bien toléré par les souris (Figure 3 a). Par conséquent, nous récoltons des muscles blessés à 10 DSIP i4F souris traitées avec dox pendant 7 jours.
Bien qu’il soit possible d’effectuer la coloration de SA-β-Gal avec Nanog, il n’est pas recommandé pour la quantification en raison de l’interférence éventuelle coloration. Comme mentionné ci-dessus, compteur coloration est essentielle pour la détection du scanner numérique. Le meilleur compteur coloration pour le SA-β-Gal avec Nanog est orhematoxylin rapide rouge. Compteur de coloration pourrait masquent cependant plus de signal Nanog ou SA-β-Gal. Par conséquent, pour la quantification plus précise, il est préférable de les exécuter séparément sur des diapositives consécutives (Figure 3 b). En quantifiant positif SA-β-Gal et Nanog cellules positives des lames adjacentes, nous avons établi une corrélation positive entre eux (Figure 3), suggérant une implication potentielle de la sénescence sur la plasticité cellulaire et la régénération.
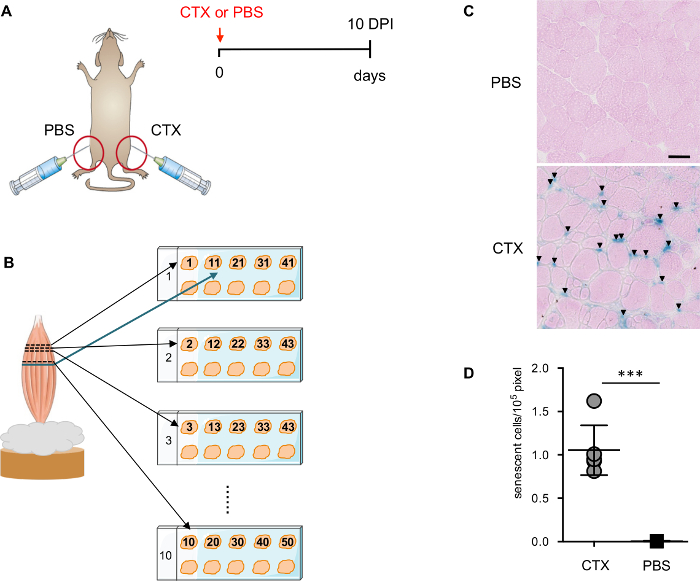
Figure 1 : évaluer le niveau de sénescence après une blessure musculaire. (A) représentation schématique de la stratégie de blessure musculaire utilisée pour induire la sénescence. (B) représentation schématique de la préparation de section du muscle. (C) des images représentatives de SAβGal taches colorées avec l’éosine. Flèche pointe vers les cellules de SA-β-Gal+ . Barreaux de l’échelle = 50 µm. Quantification (D) de SA-β-Gal+ cellules dans TA-muscle lésé et non lésés. Chaque point correspond à un animal. Signification statistique a été évaluée par le t-test des Student´s bilatéral : *** p < 0,001. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Quantification des cellules SA-β-Gal+ de logiciels ImageJ. Des captures d’écran (A-D) d’une section de muscle dans l’interface du logiciel ImageJ. Capture d’écran de la conversion d’une image de section du muscle pour gray scale (A); En sélectionnant tous le SA-β-Gal + cellules dans la section (B); Analyser les particules sélectionnés (C); Résumé de tous les pulvériser comptés dans le gestionnaire de ROI (D). Capture d’écran (E) du processus manuel de curation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
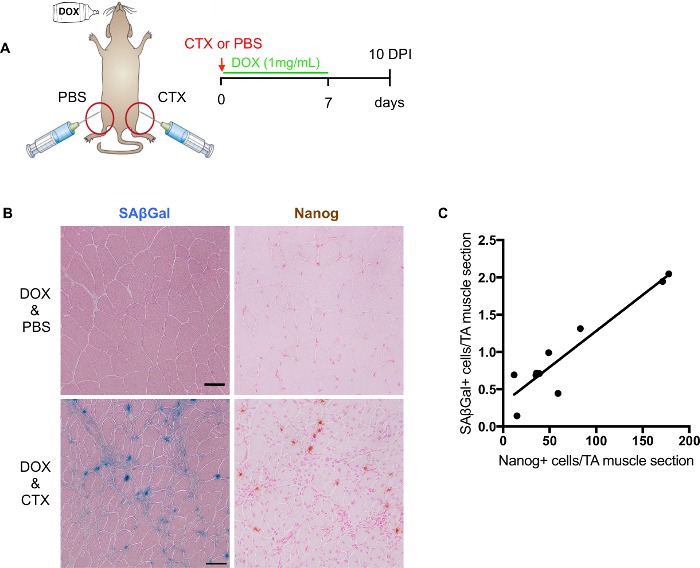
Figure 3 : Evaluation of in vivo la reprogrammation après une blessure musculaire. (A) représentation schématique pour évaluer in vivo la reprogrammation et la sénescence niveau après une blessure musculaire. (B) les images représentatives de SA-β-Gal et Nanog coloration sur coupes congelées de muscles squelettiques endommagés. SAβGal taches colorées avec l’éosine (à gauche) ; coloration immunohistochimique de Nanog Eosine rapide rouge (à droite). Muscles non-blessés figurent sur le muscle haut et blessé ci-dessous. Barreaux de l’échelle = 50 µm. (C) la Quantification et la corrélation des SA-β-Gal + et cellules de Nanog+ dans les sections consécutives (n = 9 souris, valeur représente la moyenne des 2 sections par souris). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Volume de 50 mL | |
| solution mère de6 K3Fe(CN) 100 mM | 2 mL |
| 100 mM en stock K4Fe(CN)6 solution | 2 mL |
| 1 M MgCl2 | 100 ΜL |
| 50 mg/mL X-Gal | 400 ML |
| PBS (pH 5,5) | mL 45,50 |
Tableau 1 : Composition de 50 mL de solution de X-gal.
Discussion
Ici, nous présentons une méthode pour détecter toutes deux de sénescence des cellules souches pluripotentes dans le muscle squelettique de souris reprogrammables. Cette méthode pourrait être utilisée pour évaluer et quantifier les deux sénescence et induire une plasticité cellulaire in vivoet examiner le rôle de la sénescence dans la réparation des tissus et la régénération.
Dans le protocole actuel, le dosage de la sénescence associées aux β-galactosidase (SA-β-Gal) est utilisé pour détecter in vivo des cellules sénescentes dans le muscle squelettique. Ce test détecte l’activité accrue de β-galactosidase lysosomale à pH suboptimum (6.0 ou 5.5), associée spécifiquement les cellules sénescentes, tandis que l’activité de cette enzyme est généralement mesurée à un pH acide 4,516,17. Par conséquent, il est important d’ajuster le pH (pH = 6 ou 5.5) afin d’assurer une détection spécifique de l’activité associée à la sénescence. En outre, compteur de coloration avec l’éosine est essentiel pour la quantification automatique des cellules SA-β-Gal+ , où la faible et diffuse les signaux n’est pas comptée. Pour éviter de variabilité, il est préférable que la même personne effectue toute la procédure de comptage.
Bien que l’essai de SA-β-Gal est le plus largement utilisé et accepté biomarqueur pour cellules sénescentes, il n’est pas un marqueur exclusive de sénescence. Il a été suggéré que des cellules en culture anastomosé excessive pourraient causer fausse positivité pour SA-β-Gal18. La sensibilité de l’essai peut être de type cellulaire et tissulaire de type dépendant en vivo19. Par conséquent, il est nécessaire d’utiliser d’autres marqueurs canoniques indépendants, tels que l’absence de prolifération, une expression accrue des médiateurs de la sénescence (p16, ARF, p53, p21 et p27) et la sécrétion de divers facteurs de la SASP, à confirmer et à caractériser sénescence in vivo. En outre, des contrôles négatifs appropriés sont indispensables pour interpréter les résultats, en particulier aux in vivo de l’étude.
Malgré le fait que SA-β-Gal dosage n’est pas parfait, il fournit des informations particulièrement précieuses pour in vivo de l’étude. Il permet la détection des cellules sénescentes dans leur environnement résident avec l’architecture de tissus intacts, fournissant des renseignements cruciaux facilitant l’une meilleure compréhension du rôle des cellules sénescentes en différents physiologique et pathologique contextes. En outre, il peut être couplé avec l’immunomarquage d’autres marqueurs comme marqueurs de surface cellulaire pour déterminer l’identité cellulaire des cellules sénescentes ; ou des marqueurs de stemness pour examiner l’implication potentielle de la sénescence chez la régénération et la tumorigenèse. Auparavant, nous avons effectué l’essai de SA-β-Gal avec coloration immunohistochimique de Nanog dans la même section ou à proximité pour étudier le lien éventuel entre la sénescence et en vivo reprogrammation8. Si ce protocole se concentre sur le muscle squelettique, il peut être certainement étendue à d’autres tissus.
Récemment, la sénescence cellulaire a été impliquée dans la réparation des tissus et la régénération, probablement par l’intermédiaire de SASP7,8,9. La compréhension des mécanismes de comment la sénescence contribue à la régénération et la réparation des tissus auront certainement un impact énorme sur la médecine régénérative. Ce test constitue un outil important et utile pour faciliter l’identification et la quantification de la sénescence des cellules en vivo.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrentes.
Remerciements
Nous sommes redevables à Clemire Cimper pour son excellent support technique. Travail dans le laboratoire de H.L. a été financée par l’Institut Pasteur, Centre National pour la Recherche scientifique et l’Agence Nationale de la Recherche (Laboratoire d’excellence Revive, Investissement d’avenir ; ANR-10-LABX-73), l’Agence Nationale de la Recherche (ANR-16-CE13-0017-01) et la Fondation ARC (PJA 20161205028). C.C. et A.C. sont financés par le doctorat et bourses de recherche postdoctorales du Consortium revivre.
matériels
| Name | Company | Catalog Number | Comments |
| K3Fe(CN)6 | Sigma | 13746-66-2 | For SA-β Gal staining solution |
| K4Fe(CN)6 | Sigma | 14459-95-1 | For SA-β Gal staining solution |
| MgCl2 | Sigma | 7786-30-3 | For SA-β Gal staining solution |
| X-Gal | Sigma | B4252 | For SA-β Gal staining solution |
| Doxycycline | Sigma | D3447 | For inducing in vivo reprogramming |
| Cardiotoxin | Lotaxan Valence, France | L8102 | For muscle injury |
| Glutaraldehyde | Sigma | 111-30-8 | For Fixation solution |
| Paraformaldehyde | Electron microscopy science | 50-980-487 | For Fixation solution |
| NaCitrate : Sodium Citrate monobasic bioxtra, anhydre | Sigma | 18996-35-5 | For permeabilization solution |
| Triton | Sigma | 93443 | For permeabilization solution |
| Bovine Serum Albumin | Sigma | A3608 | Washing solution |
| Antibody anti- Nanog | Cell signalling | 8822S | Rabbit monoclonal antibody |
| EnVision+ Kits (HRP. Rabbit. DAB+) | Dako | K4010 | For Nanog revelation |
| Eosin 1% | Leica | 380159EOF | Counterstainning |
| Fast red | Vector Laboratories | H-3403 | Counterstainning |
| Thermo Scientific Shandon Immu-Mount | Fisher scientific | 9990402 | Mounting solution |
| Quick-hardening mounting medium for microscopy : Eukitt® | Sigma | 25608-33-7 | Mounting solution |
| Microscope Phase Contrast Brightfield CKX41: 10X-20X-40X objectives | Olympus | CKX41 | Microscope for Nanog quantification |
| Mouse: i4F-A | Abad et al., 2013 | N/A | Reprogrammable mouse model |
| Skeletal muscle, Tibialis Anterior | |||
| Slide Scanner | Zeiss | Axio Scan Z1 | slides scanning |
Références
- Munoz-Espin, D., Serrano, M. Cellular senescence: from physiology to pathology. Nat Rev Mol Cell Biol. 15 (7), 482-496 (2014).
- Baker, D. J., et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 530 (7589), 184-189 (2016).
- Hayflick, L. The Limited in Vitro Lifetime of Human Diploid Cell Strains. Exp Cell Res. 37, 614-636 (1965).
- Coppe, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu Rev Pathol. 5, 99-118 (2010).
- Yun, M. H., Davaapil, H., Brockes, J. P. Recurrent turnover of senescent cells during regeneration of a complex structure. Elife. 4, (2015).
- Demaria, M., et al. An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA. Dev Cell. 31 (6), 722-733 (2014).
- Mosteiro, L., et al. Tissue damage and senescence provide critical signals for cellular reprogramming in vivo. Science. 354 (6315), (2016).
- Chiche, A., et al. Injury-Induced Senescence Enables In Vivo Reprogramming in Skeletal Muscle. Cell Stem Cell. , (2016).
- Ritschka, B., et al. The senescence-associated secretory phenotype induces cellular plasticity and tissue regeneration. Genes Dev. 31 (2), 172-183 (2017).
- Takahashi, K., Yamanaka, S. A decade of transcription factor-mediated reprogramming to pluripotency. Nat Rev Mol Cell Biol. 17 (3), 183-193 (2016).
- Abad, M., et al. Reprogramming in vivo produces teratomas and iPS cells with totipotency features. Nature. 502 (7471), 340-345 (2013).
- Ohnishi, K., et al. Premature Termination of Reprogramming In Vivo Leads to Cancer Development through Altered Epigenetic Regulation. Cell. 156 (4), 663-677 (2014).
- Guardiola, O., et al. Induction of Acute Skeletal Muscle Regeneration by Cardiotoxin Injection. J Vis Exp. (119), (2017).
- Le Roux, I., Konge, J., Le Cam, L., Flamant, P., Tajbakhsh, S. Numb is required to prevent p53-dependent senescence following skeletal muscle injury. Nat Commun. 6, 8528(2015).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nat Protoc. 4 (12), 1798-1806 (2009).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proc Natl Acad Sci U S A. 92 (20), 9363-9367 (1995).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging Cell. 5 (2), 187-195 (2006).
- Krishna, D. R., Sperker, B., Fritz, P., Klotz, U. Does pH 6 beta-galactosidase activity indicate cell senescence? Mech Ageing Dev. 109 (2), 113-123 (1999).
- Cristofalo, V. J. SA beta Gal staining: biomarker or delusion. Exp Gerontol. 40 (10), 836-838 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon