Method Article
Evaluación de la senescencia inducida por la lesión y en Vivo de reprogramación en el músculo esquelético
En este artículo
Resumen
Aquí presentamos un protocolo detallado para detectar ambos senescentes y células madre pluripotentes en el músculo esquelético por lesión mientras que inducen reprogramación en vivo . Este método es adecuado para evaluar el papel de la senescencia celular durante la regeneración del tejido y la reprogramación en vivo.
Resumen
Senescencia celular es una respuesta de estrés que se caracteriza por una detención del crecimiento celular estable, que es importante para muchos procesos fisiológicos y patológicos, como cáncer y envejecimiento. Recientemente, senescencia también se ha implicado en la regeneración y reparación del tejido. Por lo tanto, se ha vuelto cada vez más crítica para identificar las células senescentes en vivo. Asociada a la senescencia de β-galactosidasa (SA-β-Gal) es el ensayo más ampliamente utilizado para detectar células senescentes tanto en cultivo como in vivo. Este ensayo se basa en el contenido lisosomal aumentado en las células senescentes, que permite la detección histoquímica de la actividad β-galactosidasa lysosomal en pH subóptimo (6 o 5.5). En comparación con otros ensayos, como citometría de flujo permite la identificación de las células senescentes en su entorno residente, que ofrece información valiosa, como la situación relativa a la arquitectura del tejido, la morfología y la posibilidad de acoplamiento con otros marcadores mediante inmunohistoquímica (IHQ). La limitación principal del ensayo SA-β-Gal es el requisito de muestras frescas o congeladas.
Aquí, presentamos un protocolo detallado para entender cómo celular senescencia promueve celular regeneración del tejido y la plasticidad en vivo. Utilizamos SA-β-Gal para detectar las células senescentes en el músculo esquelético a la lesión, que es un sistema bien establecido para el estudio de regeneración de los tejidos. Además, utilizamos IHC para detectar Nanog, un marcador de las células madre pluripotentes, un modelo de ratón transgénico. Este protocolo nos permite analizar y cuantificar la senescencia celular en el contexto de plasticidad celular inducida y reprogramación en vivo .
Introducción
Senescencia celular es una forma de respuesta al estrés, caracterizada por una detención del ciclo celular estable. En la última década, investigación ha establecido firmemente que la senescencia se asocia con varios procesos biológicos y patológicos como desarrollo embrionario, fibrosis,1,2del envejecimiento del organismo. Senescencia celular primero fue identificada en fibroblastos humanos al final de su vida replicativa por3el acortamiento del telómero. Además de estrés replicativo, hay muchos otros estímulos que pueden inducir senescencia, incluyendo daño de ADN, estrés oxidativo, señales oncogénicas y alteraciones genómicas/epigenómica, cualquiera de las cuales eventualmente puede activar las vías de p53/p21 o pRB para establecer y reforzar el crecimiento permanente de detención1. Una de las características importantes de las células senescentes es que siguen siendo metabólicamente activas y enérgicamente expresan un fenotipo secretorio asociada a la senescencia (spas): secreción de citoquinas proinflamatorias, factores de crecimiento y matriz extracelular factores4. Factores de spas se han propuesto para jugar un papel importante en mediar y amplificar el efecto de la senescencia, debido a sus potentes efectos en atraer las células inmunes y alterar el tejido local y sistémica ambientes1. Curiosamente, la senescencia se ha propuesto recientemente importantes para tejido reparación y regeneración de5,6. Además, datos de varios laboratorios, incluido el nuestro, ha sugerido que la senescencia inducida por daño de tejido podría mejorar plasticidad celular, via SASPs, promover regeneración7–9. Por lo tanto, todos los datos emergentes destacan la importancia de estudiar el envejecimiento in vivo.
En la era posterior a pluripotentes inducidas (iPSC) de la célula de vástago, plasticidad celular es la capacidad de una célula para adquirir una nueva identidad y adoptar un destino alternativo cuando se expone a diferentes estímulos tanto en cultivo como in vivo10. Se conoce que reprogramación completo puede ser logrado en vivo11,12, donde la expresión de la cassette que contiene cuatro factores Yamanaka: Oct4, Sox2, Klf4y c-Myc (OSKM) puede ser inducida en vivo para promover la formación de teratomas en múltiples órganos. Por lo tanto, un modelo de ratón reprogramable (i4F) puede utilizarse como un sistema de gran alcance para identificar reguladores críticos y rutas que son importantes para la plasticidad celular11.
Un sistema adecuado y sensible en vivo es fundamental para comprender la senescencia celular cómo regula plasticidad celular en el contexto de la regeneración de los tejidos. Aquí, presentamos un sistema robusto y un protocolo detallado para evaluar el vínculo entre senescencia y plasticidad celular en el contexto de la regeneración de los tejidos. El combinación de cardiotoxin (CTX) inducida por daño del músculo en el grupo del músculo tibial Anterior (TA), un sistema bien establecido para el estudio de regeneración de los tejidos y el modelo de ratón i4F, permite la detección de senescencia celular y vivo en reprogramación en la regeneración muscular.
Para evaluar la relación entre la plasticidad celular y senescencia, i4F ratones son heridos con CTX para inducir daño muscular aguda y tratados con doxiciclina (0,2 mg/mL) durante 7 días para inducir la reprogramación en vivo . Mientras que una CTX induce daño muscular aguda y Protocolo de regeneración ha sido recientemente publicado13, por razones éticas, este procedimiento será omitido en el actual protocolo. Se recogerán muestras de músculo de TA a los 10 días post lesión13cuando el pico de las células senescentes se han observado previamente14. Aquí, este protocolo detallado describe todos los pasos necesarios para evaluar el nivel de senescencia (vía SA-β-Gal) y reprogramación (a través de la coloración de IHC de Nanog).
Ensayo de la senescencia asociada a beta-galactosidasa (SA-β-Gal) es el ensayo más utilizado para detectar las células senescentes en cultura en vivo15. En comparación con otros ensayos, el ensayo SA-β-Gal permite la identificación de las células senescentes en su entorno nativo con la arquitectura del tejido intacto, que es particularmente importante para el estudio en vivo . Además, es posible acoplar el ensayo SA-β-Gal con otros marcadores con IHC. Sin embargo, el análisis de SA-β-Gal requieren muestras frescas o congeladas, que sigue siendo una limitación importante. Cuando los tejidos frescos o congelados están rutinariamente disponibles, como muestras de músculo de TA congeladas, SA-β-Gal obviamente es el ensayo más adecuado para detectar las células senescentes. Nanog es el marcador utilizado para detectar células reprogramarlo por dos razones: 1) es un marcador esencial de pluripotencia; 2) más importante aún, su expresión no es conducida por doxiciclina (dox), por lo tanto detecta pluripotencia inducida por más que la expresión forzada de la cassette de Yamanaka.
Es importante tener en cuenta, los protocolos de tinción presentados en este estudio pueden realizarse por separado para simplificar el procedimiento de cuantificación, pero también se pueden hacer en un procedimiento de tinción Co para visualizar ambos senescentes y pluripotentes células madre en la misma sección.
Protocolo
los animales fueron tratados según las directrices de la Comunidad Europea y el Comité de ética de los protocolos de Institut Pasteur (CETEA) aprobado.
1. preparaciones de las soluciones Stock
- preparar los materiales para la fijación de la muestra de músculo. Disolver 0,5 g de goma del tragacanto con 20 mL de agua a temperatura ambiente para hacer el medio de inclusión de congelación para la fijación del músculo.
- Preparar las soluciones para tinción SA-β-Gal.
- Preparar las soluciones madre de K 3 Fe(CN) 6 (100 mM), K 4 Fe(CN) 6 mM (100), MgCl 2 (1 M) disolviendo los respectivos polvos en agua destilada.
- Prepare la solución de 0,2% C 20 H 6 Br 4 Na 2 O 5 (eosina) por dilución en agua.
- No prepare la solución de C 14 H 15 BrClNO 6 (X-gal) (50 mg/mL) disolviendo el polvo de X-gal en C 3 H 7 (dimetilformamida, DMF).
- Tienda K 3 Fe(CN) 6 K 4 Fe(CN) 6 soluciones y a 4 ° C y MgCl 2 en RT.
Nota: X-gal puede ser almacenado en alícuota a-20 ° C, hasta 6 meses. Solución de eosina puede mantenerse a temperatura ambiente y reutilizar después de filtrar si es necesario. Soluciones de 4 Fe(CN) 6 K y 3 K de Fe(CN) 6 son protectedfromthe luz. Solución de X-gal no es estable en agua y tiene que ser protegido de la luz.
- Preparación de las soluciones para la tinción de Nanog: la permeabilización de la solución contiene 0.1% Na 3 C 6 H 5 O 7 (citrato trisódico), 0.1% C 14 H 22 O (C 2 H 4 O) n (n = 9-10) (Triton X-100) en agua destilada, que debe almacenarse a 4 ° C. preparar la solución de bloqueo que contiene 5% de suero bovino fetal (FBS) en tampón fosfato salino (PBS), que debe ser almacenado en RT.
2. Tinción de SA-β-Gal en la sección de músculo TA congelado
- preparar el material de fijación para los músculos TA colocando una pequeña cantidad del tragacanto goma sobre una rodaja de corcho.
- Herido ratones de ambos sexos (2 mes de edad, C57/B6) resultaron heridos 10 días antes con cardiotoxin (CDX) como se describe anteriormente 13. Uso no traumatizados (inyección de PBS) TA desde el mismo ratón como control negativo. Si se desea en vivo reprogramación, tratar cada ratón con Dox (1 mg/mL) en el agua potable en el mismo día (protegido de la luz), justo después de lesión CTX.
Nota: La solución de Dox debe cambiarse cada 3 días para una duración total del tratamiento de 7 días.- Aislar ambos músculos TA (herido y control) de los ratones, como se ha descrito anteriormente ( figura 1A) 13. Para asegurar las secciones transversales, inserte el tendón distal del músculo TA en la goma de tragacanto y dejar más o menos ¾ parte del músculo del exterior ( figura 1B) y congelar directamente en nitrógeno líquido refrigerado por isopentano para < 1 mínimo
Nota: Asegúrese de que el músculo de la TA está en una posición perpendicular y en el centro del corcho. Las muestras pueden conservarse a-80 ° C o directamente cryosectioned en 10 secciones μm.
- Aislar ambos músculos TA (herido y control) de los ratones, como se ha descrito anteriormente ( figura 1A) 13. Para asegurar las secciones transversales, inserte el tendón distal del músculo TA en la goma de tragacanto y dejar más o menos ¾ parte del músculo del exterior ( figura 1B) y congelar directamente en nitrógeno líquido refrigerado por isopentano para < 1 mínimo
- Los músculos TA del proceso como se describe en la figura 1B.
- Distribuir la 1 st -10 th secciones en el orden correcto en diez distintas diapositivas en la posición superior izquierda de cada diapositiva. Coloque la sección 11 de mayo junto a la 1 sección de st en la primera diapositiva; la sección 12 de mayo seguirá el mismo orden a derecho además de la sección 2 y en la segunda diapositiva. Repita este proceso hasta 10 secciones o diapositiva se obtienen para diez diapositivas (100 secciones en total) para asegurar la distancia mínima de 1 mm entre la primera sección y la sección pasada.
- Fijar las secciones de 4 minutos en PBS con paraformaldehído al 1% y el glutaraldehído de 0,2%. Lavar con PBS, 2 x 10 min. A continuación, incubar las secciones en PBS (pH = 5.5) para 30 minutos realice todos los pasos en RT.
Nota: La fijación tiene que ser suave para mantener la actividad enzimática. Realizar este paso bajo el capó. El pH del PBS es crítico y la solución de X-gal debe ser protegida de la luz. - Secciones de incubar en la solución de X-gal, que contiene: 4 mM K3Fe(CN) 6, 4 mM K4Fe(CN) 6, 2 mM MgCl2 y 400 μg/mL X-Gal en PBS, pH = 5,5. Incubar en la oscuridad a 37 º C durante un mínimo de 24 h. lavar los portaobjetos con PBS, 3 x 10 min, a RT.
Nota: La incubación requiere un mínimo de 24 horas y puede durar 48 horas maximizar la señal de SA-β-Gal. La solución debe cambiarse después de 24 horas de incubación. Las diapositivas deben ser protegidas de la luz. Si sólo se desea SA-β-Gal la coloración, continúe con el paso 2.5. Si Co tinción con Nanog se desea, por favor, saltar al paso 3.1.
Paraformaldehido - diapositivas de fix en 1% en PBS durante 30 minutos lavado diapositivas con PBS, 3 x 10 min contratinción con eosina 0.2%. Sumerja los portaobjetos en la solución de eosina durante 1 minuto y enjuagar con agua destilada brevemente. Por último, montar las diapositivas con medio de montaje acuoso no fluorescentes (véase Tabla de materiales).
Nota: Es imprescindible realizar la fijación posterior. Realizar este paso bajo el capó. Todos los pasos se realizan en RT.
3. Inmunohistoquímica utilizando anticuerpos de Anti-Nanog
- fijar las diapositivas con PBS conteniendo paraformaldehído al 4% para el lavado de 10 minutos con PBS, 2 x 10 minutos añadir 200 μL de la solución de permeabilización directamente en las diapositivas e incubar durante 5 minutos. Colada de
- diapositivas con PBS, 2 x 5 min y en el último lavado, uso 200 μL PBS con BSA 0.25% directamente sobre las diapositivas. Realice todos estos pasos en RT.
PRECAUCIÓN: Realizar el paso de fijación bajo el capó.
- diapositivas con PBS, 2 x 5 min y en el último lavado, uso 200 μL PBS con BSA 0.25% directamente sobre las diapositivas. Realice todos estos pasos en RT.
- Diapositivas de incubar con el anticuerpo primario anti-Nanog (concentración final: 1.25 ug/mL) durante la noche a 4 ° C en PBS con 5% FBS. Lavar los portaobjetos con PBS, 2 x 10 min y en el último lavado, uso 200 μL PBS con BSA de 0.25% por 5 min realizar el lavado pasos en RT.
Nota: Incubar los portaobjetos en una caja con toalla de papel húmeda para evitar la evaporación. - Incubar los portaobjetos con 100 μl de anticuerpo secundario de rAb-HRP del listo para usar kit (véase Tabla de materiales) para 45 min lavado diapositivas con PBS, 3 x 5 min, para retirar el anticuerpo secundario. Realizar todos los pasos a temperatura ambiente con la protección de la luz.
- Visualización
- primero, diluir el 3,3 '-diaminobenzidina (C 12 H 14 N 4 C 12 H 18 Cl 4 N 4 (4 HCl), DAB) en el tampón de sustrato proporcionado por la lista para usar kit (20 μl de DAB para 1 mL de solución de tampón sustrato). Añada 100 μl de solución de DAB directamente sobre cada diapositiva e incubar durante un máximo de 10 min a TA.
Nota: La solución diluida de DAB debe ser preparada recientemente y puede conservarse hasta una semana a 4 ° C. El tiempo de incubación se puede ajustar para reducir al mínimo la señal de fondo pero debe mantenerse el mismo para todas las diapositivas. - Quitar la solución de DAB mediante enjuague con agua. Contratinción los portaobjetos con solución rápido rojo (listo para utilizar, consulte la Tabla de materiales) durante 20 min lavado de los portaobjetos con agua otra vez brevemente.
- Los deshidrate con etanol al 95% para m 5en seguida etanol al 100%, 2 x 5 minutos. Por último, montar las diapositivas con medio de montaje de endurecimiento rápido (véase Tabla de materiales).
- Observar los portaobjetos al microscopio en campo brillante 20 X para evitar fondo.
Nota: Solución rápido rojo puede mantenerse a temperatura ambiente y reutilizado después de filtrar.
- primero, diluir el 3,3 '-diaminobenzidina (C 12 H 14 N 4 C 12 H 18 Cl 4 N 4 (4 HCl), DAB) en el tampón de sustrato proporcionado por la lista para usar kit (20 μl de DAB para 1 mL de solución de tampón sustrato). Añada 100 μl de solución de DAB directamente sobre cada diapositiva e incubar durante un máximo de 10 min a TA.
4. Análisis y cuantificación
- cuantificación SA-β-Gal
- escanear las diapositivas y escoge las mejores secciones de cada diapositiva basado en las imágenes adquiridas. Utilice por lo menos 2 secciones/TA para la cuantificación. Juez de la sección de ' s de calidad basada en la integridad del tejido, calidad de la tinción y contratinción. Para la cuantificación, elegir las dos secciones de más alta calidad con la máxima distancia posible entre las muestras, que permite la mejor representación de cuantificación SA-β-Gal en todo el conjunto músculo TA.
- Cuantificación de células positivas SA-β-Gal ( figura 2).
- Determine el rango del tamaño del pixel seleccionando manualmente el más pequeño y el más grande células positivas de SA-β-Gal.
- Abre la imagen digital de la diapositiva escaneada utilizando el software ImageJ.
- En la interfaz, haga clic en ' analizar ' > ' herramientas ' > ' ROI Manager ' > ' analizar ' > ' sistema de medición ' > ' seleccione área '. Utilice la herramienta Selección y rodean el más pequeño y más grande positivo SA-β-Gal de la célula y añadir al Gerente de ROI haciendo clic en ' Add '. Medir los tamaños usando los ' medida ' botón y guardar los valores para su posterior uso.
- Ajustar el parámetro de umbral para asegurar se seleccionan todas las celdas visibles positivas.
- Convertir la imagen a escala de grises haciendo clic en ' imagen ' > ' tipo ' > ' 8 bits ' ( figura 2A). A continuación, vaya a ' imagen ' > ' ajuste ' > ' umbral ', mover el cursor de segundo hasta que se cubran todas las células positivas de SA-β-Gal en rojo ( figura 2B), a continuación, haga clic en ' aplicar '.
- Analizar partículas haciendo clic en ' analizar ' > ' analizar partículas ' > ' tamaño (pixel ^ 2) ' y aplicar el valor definido en el paso 4.1.2.1, entra ' circularidad ': ' 0.00 1.00 ', haga clic en ' ok '; un resumen de todo el contado partículas se muestra en el administrador de ROI ( Figura 2D).
- Transferencia de todas las partículas seleccionadas a la imagen original. Ajustar la selección manualmente para asegurar la cuantificación exacta. Añadir las células positivas (flecha verde Figura 2E) y eliminar las células positivas falsas (flecha roja Figura 2E). Por último, medir el área de esquematización de la sección ( Figura 2D) utilizando el ' herramienta de selección '. Haga clic en ' Gerente de ROI ' > ' Add ' > ' medida '.
- Importante, normalizar el número de células positivas por el área de la sección de.
- Determine el rango del tamaño del pixel seleccionando manualmente el más pequeño y el más grande células positivas de SA-β-Gal.
- Cuantificación de Nanog
- contar las células positivas de Nanog bajo el microscopio en el campo brillante manualmente con 20 aumentos.
Nota: La contratinción de acuerdo rápido rojo permite buena evaluación de la morfología del músculo TA. Sin embargo, la tinción es muy ligera y carece de un esquema claro de la sección. El escáner a menudo es incapaz de identificar el límite de las secciones y no enfoque correctamente. Es posible utilizar el marcador para los bordes de las secciones del círculo antes de escanear o use un scanner más sensible para detectar la sección. El protocolo actual, es más eficaz contar manualmente las células positivas de Nanog.
- contar las células positivas de Nanog bajo el microscopio en el campo brillante manualmente con 20 aumentos.
Resultados
Detección de senescencia celular inducida por la lesión muscular
Se ha demostrado recientemente que la lesión del músculo induce senescencia celular transitoria14. En 10 días posterior a la lesión (PPP), la mayoría de myofibers dañados está experimentando regeneración con núcleos centralmente localizados, un sello de regenerar myofibers, y la arquitectura del músculo se restablece. Las infiltración de las células inflamatorias se reducen notoriamente permaneciendo visible en ciertas regiones. 10 DPI es un buen momento para detectar las células senescentes por SA-β-Gal, puesto que hay menos células necróticas e inflamatorias presentes en el músculo para interferir con la tinción. Para determinar la especificidad de la tinción, TA inyectado con PBS desde el mismo ratón (figura 1A) se utiliza como control negativo crítico.
Para asegurar una mejor y más exacta evaluación de las células positivas SA-β-Gal, secciones de los diferentes planos del músculo TA se colocan en la misma diapositiva (figura 1B). Contador de tinción con eosina es importante para la cuantificación automática de las células positivas SA-β-Gal por el software ImageJ. Contador de eosina describe la sección, que permite al analizador digital detectar las secciones con el enfoque correcto. Es importante definir cuidadosamente el rango y el umbral de la detección (figura 2A-D). Además, un proceso manualmente curado es esencial para permitir la precisa detección y cuantificación (Figura 2E).
Senescencia celular facilita en vivo reprogramación en músculo
Modelo de ratón reprogramable (i4F) proporciona un sistema ideal para evaluar los efectos de la senescencia en la regeneración y la plasticidad celular. En lesiones musculares, i4F ratones son tratados con dox para inducir la reprogramación en vivo. 7 días de tratamiento dox (1 mg/mL) son suficiente para inducir la reprogramación a nivel celular, todavía es bien tolerada por los ratones (Figura 3A). Por lo tanto, cosechamos los músculos lesionados en 10 PPP de i4F ratones tratados con dox por 7 días.
Aunque es posible realizar co tinción de SA-β-Gal con Nanog, no se recomienda para la cuantificación debido a posibles interferencias tinción. Como se mencionó anteriormente, tinción de contador es esencial para la detección de escáner digital. El mejor contador de coloración para la SA-β-Gal junto a Nanog es rápido rojo orhematoxylin. Sin embargo, contador tinción podría enmascarar sobre señal SA-β-Gal o Nanog. Por lo tanto, para la cuantificación más precisa, es mejor hacerlo por separado en diapositivas consecutivas (figura 3B). Mediante la cuantificación de SA-β-Gal positivos y las células positivas de Nanog de diapositivas adyacentes, establecimos una correlación positiva entre ellos (figura 3), sugiriendo una posible participación de la senescencia en la regeneración y la plasticidad celular.
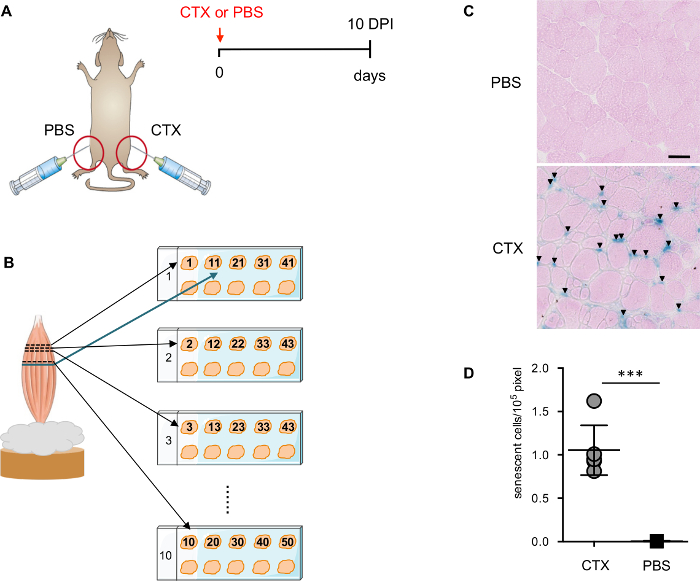
Figura 1: evaluar el nivel de senescencia después de lesión del músculo. (A) representación esquemática de la estrategia de lesión de músculo utilizada para inducir la senescencia. (B) representación esquemática de la preparación de la sección de músculo. (C) imágenes representativas de SAβGal tinción counterstained con eosina. Las flechas apuntan a las células de+ SA-β-Gal. Barras de escala = 50 μm. (D) cuantificación de SA-β-Gal+ de las células en TA-músculo lesionado y no lesionado. Cada punto corresponde a un animal individual. Significación estadística fue determinada por el dos colas Student´s t-test: *** p < 0.001. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cuantificación de las células+ SA-β-Gal por software ImageJ. Capturas de pantalla (A-D) de una sección del músculo en la interfaz del software ImageJ. Captura de pantalla de convertir una imagen de sección muscular para gris escala (A); Seleccionar todos lo SA-β-Gal + de las células en la sección (B); Analizar las partículas seleccionadas (C); Resumen de todos los particals contados en el gestor del retorno de la inversión (D). (E) captura de pantalla del proceso de curación manual. Haga clic aquí para ver una versión más grande de esta figura.
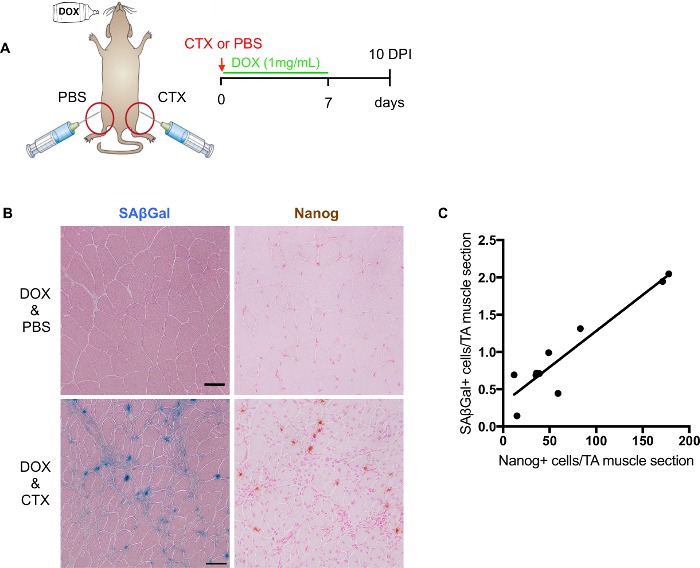
Figura 3: Evaluación de en vivo reprogramación después de lesión del músculo. (A) representación esquemática para evaluar en vivo nivel de reprogramación y senescencia después de lesión del músculo. (B) imágenes representativas de SA-β-Gal y Nanog tinción de secciones congeladas de músculo esquelético dañado. SAβGal tinción counterstained con eosina (izquierda); la coloración de Immunohistochemical de Nanog contratinción con rápido rojo (derecha). Los músculos lesionados no aparecen en el músculo superior y lesionado a continuación. Barras de escala = 50 μm. (C) cuantificación y correlación de las células de Nanog+ en secciones consecutivas y SA-β-Gal + (n = 9 ratones, valor representa el promedio de 2 secciones por ratón). Haga clic aquí para ver una versión más grande de esta figura.
| Volumen de 50 mL | |
| K3Fe(CN)6 solución 100 mM | 2 mL |
| 100 mM stock K4Fe(CN)6 solución | 2 mL |
| 1 M de MgCl2 | 100 ΜL |
| 50 mg/mL X-Gal | 400 ΜL |
| PBS (pH 5.5) | mL 45,50 |
Tabla 1: Composición de 50 mL de solución X-gal.
Discusión
Aquí, presentamos un método para detectar ambos senescentes y células madre pluripotentes en el músculo esquelético de ratones reprogramables. Este método podría utilizarse para evaluar y cuantificar tanto la senescencia e inducir plasticidad celular en vivoy examinar el papel de la senescencia en la reparación de los tejidos y la regeneración.
En el protocolo actual, el ensayo asociados a senescencia de β-galactosidasa (SA-β-Gal) se utiliza para detectar en vivo las células senescentes en el músculo esquelético. Este ensayo detecta la actividad β-galactosidasa lysosomal aumento en pH subóptimo (6.0 o 5.5), asociado específicamente a las células senescentes, mientras que la actividad de esta enzima se mide típicamente en el pH ácido de 4,516,17. Por lo tanto, es importante ajustar el pH (pH = 6 o 5.5) para asegurar una detección específica de la actividad asociada a la senescencia. Además, contador de tinción con eosina es esencial para la cuantificación automática de células SA-β-Gal+ , donde no se cuentan las señales de débiles y difusas. Para evitar la potencial variabilidad, es preferible que la misma persona realiza todo el procedimiento de conteo.
Aunque el ensayo SA-β-Gal es el más ampliamente utilizan y aceptaron biomarcador para las células senescentes, no es un marcador exclusivo de senescencia. Se ha sugerido que las células confluentes exceso en cultivo pueden causar falsa positividad para SA-β-Gal18. La sensibilidad del ensayo puede ser tipo de la célula y tejido tipo dependiente en vivo19. Por lo tanto, es necesario utilizar marcadores canónicas independientes, tales como falta de proliferación, aumento de la expresión de mediadores de la senescencia (p16, ARF, p53, p21 y p27) y la secreción de diversos factores de spas, para confirmar y caracterizar senescencia en vivo. Por otra parte, controles negativos adecuados son indispensables para la interpretación de los resultados, especialmente para el estudio en vivo .
A pesar del hecho de que SA-β-Gal no es perfecto, proporciona información especialmente valiosa para el estudio en vivo . Permite la detección de las células senescentes en su entorno residente con la arquitectura del tejido intacto, proporcionando información crítica para facilitar la comprensión posterior del papel de las células senescentes en diferentes fisiológica y patológica contextos. Por otra parte, se combina con la inmunotinción de otros marcadores, tales como marcadores de superficie celular para determinar la identidad celular de las células senescentes; o marcadores de troncalidad para examinar la implicación potencial de la senescencia en regeneración y tumorigenesis. Previamente, se realizó el ensayo SA-β-Gal con la coloración de immunohistochemical de Nanog en la misma sección o en proximidad cercana a investigar el posible vínculo entre senescencia y en vivo 8de reprogramación. Si bien este protocolo se centra en músculo esquelético, puede ser extendido sin duda a otros tejidos.
Recientemente, la senescencia celular se ha implicado en la reparación de los tejidos y la regeneración, probablemente via SASPs7,8,9. Comprensión de los mecanismos de cómo la senescencia contribuye a la regeneración y reparación de los tejidos tendrán un tremendo impacto en medicina regenerativa. Este ensayo constituye una herramienta importante y valiosa para facilitar la identificación y cuantificación de la senescencia de las células en vivo.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
Estamos agradecidos a Clemire Cimper por su excelente soporte técnico. Trabajo en el laboratorio de H.L. fue financiado por el Instituto Pasteur, Centro Nacional para la investigación científica y la Agence Nationale de la Recherche (Laboratoire d ' la excelencia Revive, Investissement Avenir; ANR-10-LABX-73), la Agence Nationale de la Recherche (ANR-16-CE13-0017-01) y la Fundación arco (PJA 20161205028). C.C. y C.A. son financiados por el doctorado y becas postdoctorales del consorcio revivir.
Materiales
| Name | Company | Catalog Number | Comments |
| K3Fe(CN)6 | Sigma | 13746-66-2 | For SA-β Gal staining solution |
| K4Fe(CN)6 | Sigma | 14459-95-1 | For SA-β Gal staining solution |
| MgCl2 | Sigma | 7786-30-3 | For SA-β Gal staining solution |
| X-Gal | Sigma | B4252 | For SA-β Gal staining solution |
| Doxycycline | Sigma | D3447 | For inducing in vivo reprogramming |
| Cardiotoxin | Lotaxan Valence, France | L8102 | For muscle injury |
| Glutaraldehyde | Sigma | 111-30-8 | For Fixation solution |
| Paraformaldehyde | Electron microscopy science | 50-980-487 | For Fixation solution |
| NaCitrate : Sodium Citrate monobasic bioxtra, anhydre | Sigma | 18996-35-5 | For permeabilization solution |
| Triton | Sigma | 93443 | For permeabilization solution |
| Bovine Serum Albumin | Sigma | A3608 | Washing solution |
| Antibody anti- Nanog | Cell signalling | 8822S | Rabbit monoclonal antibody |
| EnVision+ Kits (HRP. Rabbit. DAB+) | Dako | K4010 | For Nanog revelation |
| Eosin 1% | Leica | 380159EOF | Counterstainning |
| Fast red | Vector Laboratories | H-3403 | Counterstainning |
| Thermo Scientific Shandon Immu-Mount | Fisher scientific | 9990402 | Mounting solution |
| Quick-hardening mounting medium for microscopy : Eukitt® | Sigma | 25608-33-7 | Mounting solution |
| Microscope Phase Contrast Brightfield CKX41: 10X-20X-40X objectives | Olympus | CKX41 | Microscope for Nanog quantification |
| Mouse: i4F-A | Abad et al., 2013 | N/A | Reprogrammable mouse model |
| Skeletal muscle, Tibialis Anterior | |||
| Slide Scanner | Zeiss | Axio Scan Z1 | slides scanning |
Referencias
- Munoz-Espin, D., Serrano, M. Cellular senescence: from physiology to pathology. Nat Rev Mol Cell Biol. 15 (7), 482-496 (2014).
- Baker, D. J., et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 530 (7589), 184-189 (2016).
- Hayflick, L. The Limited in Vitro Lifetime of Human Diploid Cell Strains. Exp Cell Res. 37, 614-636 (1965).
- Coppe, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu Rev Pathol. 5, 99-118 (2010).
- Yun, M. H., Davaapil, H., Brockes, J. P. Recurrent turnover of senescent cells during regeneration of a complex structure. Elife. 4, (2015).
- Demaria, M., et al. An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA. Dev Cell. 31 (6), 722-733 (2014).
- Mosteiro, L., et al. Tissue damage and senescence provide critical signals for cellular reprogramming in vivo. Science. 354 (6315), (2016).
- Chiche, A., et al. Injury-Induced Senescence Enables In Vivo Reprogramming in Skeletal Muscle. Cell Stem Cell. , (2016).
- Ritschka, B., et al. The senescence-associated secretory phenotype induces cellular plasticity and tissue regeneration. Genes Dev. 31 (2), 172-183 (2017).
- Takahashi, K., Yamanaka, S. A decade of transcription factor-mediated reprogramming to pluripotency. Nat Rev Mol Cell Biol. 17 (3), 183-193 (2016).
- Abad, M., et al. Reprogramming in vivo produces teratomas and iPS cells with totipotency features. Nature. 502 (7471), 340-345 (2013).
- Ohnishi, K., et al. Premature Termination of Reprogramming In Vivo Leads to Cancer Development through Altered Epigenetic Regulation. Cell. 156 (4), 663-677 (2014).
- Guardiola, O., et al. Induction of Acute Skeletal Muscle Regeneration by Cardiotoxin Injection. J Vis Exp. (119), (2017).
- Le Roux, I., Konge, J., Le Cam, L., Flamant, P., Tajbakhsh, S. Numb is required to prevent p53-dependent senescence following skeletal muscle injury. Nat Commun. 6, 8528(2015).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nat Protoc. 4 (12), 1798-1806 (2009).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proc Natl Acad Sci U S A. 92 (20), 9363-9367 (1995).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging Cell. 5 (2), 187-195 (2006).
- Krishna, D. R., Sperker, B., Fritz, P., Klotz, U. Does pH 6 beta-galactosidase activity indicate cell senescence? Mech Ageing Dev. 109 (2), 113-123 (1999).
- Cristofalo, V. J. SA beta Gal staining: biomarker or delusion. Exp Gerontol. 40 (10), 836-838 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados