Method Article
Bewertung von Verletzungen-Induzierte Seneszenz und In Vivo eine Anpassung in der Skelettmuskulatur
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein detailliertes Protokoll, beide seneszenten erkennen und pluripotenten Stammzellen in der Skelettmuskulatur bei Verletzungen während der Induktion in Vivo Umprogrammierung. Diese Methode eignet sich für die Bewertung der Rolle der zellulären Seneszenz während der Geweberegeneration und Umprogrammierung in Vivo.
Zusammenfassung
Zelluläre Seneszenz ist eine Stress-Reaktion zeichnet sich durch ein stabiles Zellwachstum Verhaftung, die für viele physiologische und pathologische Prozesse, wie Krebs und Altern wichtig ist. Vor kurzem hat Seneszenz auch in Gewebe-Reparatur und Regeneration verwickelt. Daher ist es immer entscheidend, alternde Zellen in Vivozu identifizieren geworden. Seneszenz-assoziierten β-Galaktosidase (SA-β-Gal) Assay ist die am häufigsten verwendeten Assay, alternde Zellen in Kultur und in Vivozu erkennen. Dieser Assay basiert auf den erhöhten lysosomale Inhalt in den seneszenten Zellen, wodurch die histochemische Erkennung von lysosomalen β-Galaktosidase Aktivität bei bedenklich pH (6 oder 5,5). Im Vergleich zu anderen Tests, z. B. Durchflusszytometrie, dies erlaubt die Identifikation der alternde Zellen in ihrem Wohnsitz Umfeld, bietet wertvolle Informationen wie die Lage in Bezug auf die Gewebearchitektur, der Morphologie und der Möglichkeit der Kopplung mit anderen Markern über immunhistochemische (IHC). Die größte Beschränkung des SA-β-Gal-Assays ist die Anforderung von frischen oder gefrorenen Proben.
Hier präsentieren wir ein detailliertes Protokoll um zu verstehen, wie zelluläre Seneszenz fördert zelluläre Plastizität und Tissue Regeneration in Vivo. Wir verwenden SA-β-Gal um zu erkennen seneszenten Zellen in der Skelettmuskulatur bei Verletzungen, die ein etabliertes System, Geweberegeneration zu studieren ist. Darüber hinaus verwenden wir IHC Nanog, eine Markierung von pluripotenten Stammzellen in einem transgenen Mausmodell zu erkennen. Dieses Protokoll ermöglicht es uns, prüfen und zelluläre Seneszenz im Rahmen des induzierten zelluläre Plastizität und in Vivo Umprogrammierung zu quantifizieren.
Einleitung
Zelluläre Seneszenz ist eine Form von Stress-Reaktion zeichnet sich durch eine stabile Zellzyklus Festnahme. In den letzten zehn Jahren hat Forschung etabliert, dass Seneszenz mit verschiedenen biologischen und pathologische Prozesse einschließlich der Embryonalentwicklung, Fibrose und Organismus Altern1,2verbunden ist. Zelluläre Seneszenz wurde zuerst in menschlichen Fibroblasten am Ende ihrer replikativen Lebensdauer ausgelöst durch Telomerverkürzung3gekennzeichnet. Neben replikativen Stress gibt es viele andere Reize, die Seneszenz, einschließlich DNA-Schäden, oxidativer Stress, onkogenen Signale und genomische/epigenomischen Veränderungen, die schließlich die p53/p21 und/oder pRB Wege zum aktivieren kann auslösen können Aufbau und die Konsolidierung der permanenten Wachstums Verhaftung1. Eines der wichtigen Merkmale der alternde Zellen ist, dass sie metabolisch aktiv bleiben und kräftig einen Seneszenz-assoziierten sekretorischen Phänotyp (SASP ausdrücken): Sekretion von inflammatorischen Zytokinen, Wachstumsfaktoren und extrazelluläre Matrix Faktoren-4. SASP Faktoren sind vorgeschlagen worden, um eine wichtige Rolle bei der Vermittlung und Verstärkung des Seneszenz Effekts aufgrund ihrer potenten Wirkung auf Immunzellen zieht und lokale und systemische Gewebe Milieus1zu verändern. Interessanterweise hat Seneszenz vor kurzem vorgeschlagen worden, für Gewebe Reparatur und Regeneration5,6wichtig sein. Darüber hinaus hat die Daten aus mehreren Labors, einschließlich der unsrigen, vorgeschlagen, dass Gewebe Schaden-Induzierte Seneszenz zellulärer Plastizität, über SASPs, Förderung der Regeneration7–9verbessern könnte. Daher, die entstehenden Daten unterstreichen die Bedeutung des Studiums Seneszenz in Vivo.
In der Post-induzierte pluripotente Stammzellen (iPSC) Ära ist zelluläre Plastizität die Fähigkeit einer Zelle, eine neue Identität zu erwerben und eine alternative Schicksal wenn verschiedene Reize in Kultur und in Vivo10ausgesetzt zu verabschieden. Es ist bekannt, dass vollständige Neuprogrammierung kann erreicht in Vivo11,12, wo der Ausdruck der der Kassette mit vier Yamanaka Faktoren: Oct4, Sox2, Klf4und c-Myc (OSKM) kann induzierte in Vivo , darum Bildung in mehreren Organen zu fördern werden. Daher ein programmierbar Mausmodell (i4F) als ein leistungsfähiges System lässt sich identifizieren wichtige Regulatoren und Signalwege, die für die zelluläre Plastizität11wichtig sind.
Eine geeignete und sensibel in Vivo -System ist wichtig zu verstehen, wie zelluläre Seneszenz reguliert zelluläre Plastizität im Zusammenhang mit der Geweberegeneration. Hier präsentieren wir Ihnen ein robustes System und ein detailliertes Protokoll, das Bindeglied zwischen Seneszenz und zelluläre Plastizität im Zusammenhang mit der Geweberegeneration zu bewerten. Die Kombination von Cardiotoxin (CTX) induzierte Schädigung der Muskulatur in den m. Tibialis Anterior (TA) Muskel-Gruppe, ein etabliertes System, Geweberegeneration und i4F Mausmodell zu studieren ermöglicht die Erkennung von zellulären Seneszenz und in vivo Umprogrammierung während der Muskelregeneration.
Um die Verbindung zwischen zelluläre Plastizität und Seneszenz zu bewerten, i4F Mäuse mit CTX induzieren akute Muskelschäden verletzt und behandelt mit Doxycyclin (0,2 mg/mL) innerhalb von 7 Tagen, in Vivo Umprogrammierung zu induzieren. Während eine CTX akuten Muskelschäden induzierten und Regeneration Protokoll kürzlich veröffentlichten13, aus ethischen Gründen wurde, wird dieses Verfahren in das aktuelle Protokoll weggelassen werden. TA-Muskel-Proben werden bei 10 Tagen Post Verletzungen13, erhoben, wenn der Höhepunkt der alternde Zellen wurden bisher14beobachtet. Dieses ausführliche Protokoll beschreibt hier, alle erforderlichen Schritte, um die Ebene der Seneszenz (über SA-β-Gal) und Neuprogrammierung (über IHC beflecken von Nanog) zu bewerten.
Seneszenz-assoziierten Beta-Galaktosidase (SA-β-Gal) Assay ist die am häufigsten verwendeten Assay, beide seneszenten Zellen in Kultur und in Vivo15zu erkennen. Im Vergleich zu anderen Tests, ermöglicht der SA-β-Gal-Test die Identifikation der alternde Zellen in ihrer natürlichen Umgebung mit intaktem Gewebearchitektur, die besonders wichtig für in-Vivo -Studie ist. Darüber hinaus ist es möglich, die SA-β-Gal-Assay mit anderen Markern mit IHC zu koppeln. Allerdings erfordert der SA-β-Gal-Assay frische oder gefrorene Proben, bleibt eine große Einschränkung. Wenn frisches oder gefrorenes Gewebe wie gefrorene TA Muskel Proben routinemäßig verfügbar sind, ist SA-β-Gal offensichtlich die am besten geeigneten Assay seneszenten Zellen zu erkennen. NANOG ist der Marker verwendet, um neuprogrammiert Zellen aus zwei Gründen: 1) Es ist eine wesentliche Marker für Pluripotenz; (2) Darüber hinaus seinen Ausdruck wird nicht durch Doxycyclin (Dox) angetrieben, deshalb erkennt es induzierten Pluripotenz anstatt der erzwungenen Ausdruck der Yamanaka-Kassette.
Es ist wichtig zu beachten, die Färbung Protokolle präsentiert in dieser Studie können separat durchgeführt werden, um die Quantifizierung Verfahren zu vereinfachen, sondern können auch in eine Co Färbeverfahren, beide seneszenten zu visualisieren und pluripotente Stammzellen im selben Abschnitt durchgeführt werden.
Protokoll
Tiere wurden gemäß den Leitlinien der Europäischen Gemeinschaft und der Ethik-Kommission des Institut Pasteur (CETEA) genehmigt Protokolle behandelt.
1. Vorbereitungen für die Lager-Lösungen
- bereiten die Materialien für Muskel Probe Fixierung. Lösen Sie 0,5 g Tragant Kaugummi mit 20 mL Wasser bei RT das Einfrieren Einbettung Medium für Muskel-Fixierung machen.
- SA-β-Gal-Färbung der Lösungen vorbereiten.
- Bereiten die Stammlösungen von K 3 Fe(CN) 6 (100 mM), K 4 Fe(CN) 6 (100 mM), MgCl 2 (1 M) durch die jeweiligen Pulver in destilliertem Wasser auflösen.
- Bereiten Vorratslösung 0,2 % C 20 H 6 Br 4 Na 2 O 5 (Eosin) von in Wasser verdünnen.
- Vorbereitung der Stammlösung C 14 H 15 BrClNO 6 (X-gal) (50 mg/mL) durch Auflösen der X-gal-Pulver in C 3 H 7 keine (Dimethylformamid, DMF).
- Store K 3 Fe(CN) 6 und K 4 Fe(CN) 6 Lösungen bei 4 ° C und MgCl 2 bei RT
Hinweis: X-gal kann in aliquoten bei-20 ° C bis zu 6 Monate gespeichert werden. Eosin-Lösung kann bei RT aufbewahrt und nach dem Filtern bei Bedarf wiederverwendet werden. K 3 Fe(CN) 6 und K 4 Fe(CN) 6 Lösungen sind Protectedfromthe Licht. X-gal-Lösung ist nicht stabil im Wasser und muss vor Licht geschützt werden.
- Vorbereitung der Lösungen für Nanog Färbung: die Permeabilisierung Lösung enthält 0,1 % Na 3 C 6 H 5 O 7 (Trinatrium Citrat), 0,1 % C 14 H 22 O (C 2 H 4 O) n (n = 9-10) (Triton x-100) in destilliertem Wasser, sollten die gespeichert werden, bei 4 ° c bereiten Sie die blockierende Lösung mit 5 % fetalen bovine Serum (FBS) in Phosphat-gepufferte Kochsalzlösung (PBS), die bei RT gespeichert werden sollen
2. SA-β-Gal-Färbung auf gefrorene TA Muscle Section
- bereiten das Befestigungsmaterial für den TA-Muskel indem man eine kleine Menge der Tragant Kaugummi auf ein Stück Kork.
- Verletzte Mäusen beiderlei Geschlechts (2 Monate alt, C57/B6) wurden 10 Tage vor mit Cardiotoxin (CDX) verletzt, wie zuvor beschrieben 13. Verwenden Sie nicht verletzt (PBS-Injektion) TA von der gleichen Maus, als die negativ-Kontrolle. Nach Wunsch in Vivo Umprogrammierung behandeln jede Maus mit Dox (1 mg/mL) im Trinkwasser am selben Tag (lichtgeschützt), direkt nach einer Verletzung CTX.
Hinweis: Die Dox-Lösung alle 3 Tage für eine vollständige Behandlung dauert 7 Tage geändert werden soll.- Beide TA Muskeln (verletzt und Steuern) von Mäusen wie zuvor beschrieben ( Abbildung 1A) 13 isolieren. Zu gewährleisten die Querschnitte, legen die distale Sehne des Muskels TA in der Gum Tragant und verlassen etwa ¾ Teil des Muskels vor ( Abbildung 1 b) und Einfrieren in flüssigem Stickstoff gekühlt Isopentane für < 1 min.
Hinweis: Stellen Sie sicher, dass der TA-Muskel in eine senkrechte Position und in der Mitte des Korkens. Proben können bei-80 ° C oder direkt Cryosectioned in 10 µm Abschnitten gelagert werden.
- Beide TA Muskeln (verletzt und Steuern) von Mäusen wie zuvor beschrieben ( Abbildung 1A) 13 isolieren. Zu gewährleisten die Querschnitte, legen die distale Sehne des Muskels TA in der Gum Tragant und verlassen etwa ¾ Teil des Muskels vor ( Abbildung 1 b) und Einfrieren in flüssigem Stickstoff gekühlt Isopentane für < 1 min.
- TA Muskeln zu verarbeiten, wie in der Abbildung 1 b.
- Verteilen die 1 St-10 th Abschnitte in der richtigen Reihenfolge auf zehn verschiedene Folien an der oberen linken Position der einzelnen Folien. Platzieren Sie Abschnitt 11 th neben Abschnitt 1 St auf der ersten Folie; Abschnitt 12 th folgen die gleiche Reihenfolge rechts neben den 2 Nd-Abschnitt auf der zweiten Folie platziert werden. Wiederholen Sie diesen Vorgang, bis 10 Sektionen/Folie ergeben sich für zehn Folien (100 Abschnitten insgesamt) um mindestens 1 mm Abstand zwischen dem ersten und den letzten Abschnitt zu gewährleisten.
- In den Abschnitten 4 min in PBS mit 1 % Paraformaldehyd und 0,2 % Glutaraldehyd zu beheben. Waschen Sie mit PBS, 2 x 10 min. Als nächstes inkubieren Sie die Abschnitte mit PBS-Puffer (pH = 5,5) für 30 min. alle Schritte bei RT
Hinweis: Die Fixierung ist mild, enzymatische Aktivität beizubehalten. Führen Sie diesen Schritt unter der Haube. Der pH-Wert des öffentlich-rechtlichen Rundfunks ist entscheidend und die X-gal-Lösung muss vor Licht geschützt werden. - Inkubieren Abschnitte in der X-gal-Lösung enthält: 4 mM K3Fe(CN) 6, 4 mM K4Fe(CN) 6, 2 mM MgCl2 und 400 µg/mL X-Gal mit PBS-Puffer, pH = 5,5. Im Dunkeln bei 37 ° C für mindestens 24 Std. Waschen die Folien mit PBS, 3 x 10 min bei RT inkubieren
Hinweis: Die Inkubation erfordert ein Minimum von 24 Stunden und dauert 48 Stunden um das SA-β-Gal-Signal zu maximieren. Die Lösung muss nach 24 Stunden Inkubation geändert werden. Die Folien sollten vor Licht geschützt werden. Wenn nur SA-β-Gal-Färbung gewünscht wird, fahren Sie mit Schritt 2.5. Wenn Co Färbung mit Nanog gewünscht wird, bitte vorwärts überspringen Sie Schritt 3.1. - Fix Folien in 1 % Paraformaldehyd in PBS für 30 min. Waschen gleitet mit PBS, 3 x 10 min. Gegenfärbung mit 0,2 % Eosin. Tauchen Sie die Folien in der Eosin-Lösung für 1 min und kurz mit destilliertem Wasser abspülen. Zu guter Letzt montieren die Folien mit wässrigen nicht fluoreszieren Eindeckmedium (siehe Tabelle der Werkstoffe).
Hinweis: Es ist wichtig, die Post-Fixierung durchführen. Führen Sie diesen Schritt unter der Haube. Alle Schritte werden ausgeführt, bei RT
3. Immunohistochemistry mittels Anti-Nanog Antikörper
- befestigen Sie die Folien mit PBS mit 4 % Paraformaldehyd für 10 min. Waschen mit PBS, 2 x 10 min. Fügen Sie 200 µL der Permeabilisierung Lösung direkt auf die Folien und 5 min inkubieren.
- Wash Folien mit PBS, 2 x 5 min. und in der letzten Wäsche, Nutzung 200 µL PBS mit 0,25 % BSA direkt auf den Folien. Führen Sie diese Schritte bei RT
Achtung: Führen Sie die Fixierung Schritt unter der Haube.
- Wash Folien mit PBS, 2 x 5 min. und in der letzten Wäsche, Nutzung 200 µL PBS mit 0,25 % BSA direkt auf den Folien. Führen Sie diese Schritte bei RT
- Inkubieren Folien mit dem primären Anti-Nanog Antikörper (Endkonzentration: 1,25 Ug/mL) über Nacht bei 4 ° C in PBS mit 5 % FBS. Objektträger mit PBS, 2 x 10 min waschen und in der letzten Wäsche Gebrauch 200 µL PBS mit 0,25 % BSA für 5 min. Perform Schritte das Waschen bei RT
Hinweis: Inkubieren Sie Folien in einer Box mit feuchten Papiertuch um Verdunstung zu verhindern. - Inkubieren Folien mit 100 µL der rAb-HRP Sekundärantikörper aus eine gebrauchsfertige kit (siehe Tabelle der Materialien), für 45 min. Waschen mit PBS, 3 x 5 min, zu Folien Sekundärantikörper zu entfernen. Alle Schritte bei RT mit Schutz vor Licht.
- Visualisierung
- zuerst, verdünnen die 3,3 '-Diaminobenzidine (C 12 H 14 N 4 C 12 H 18 Cl 4 N 4 (4 HCl), DAB) im Substratpuffer durch die gebrauchsfertige Kit (20 µL DAB für 1 mL Substrat Pufferlösung) bereitgestellt. 100 µL der DAB-Lösung direkt in jede Folie hinzufügen und maximal 10 min bei RT inkubieren
Hinweis: Die verdünnte Lösung DAB sollte frisch zubereitet werden und kann bis zu einer Woche bei 4 ° c gelagert werden Die Inkubationszeit kann angepasst werden, um das Hintergrundsignal zu minimieren aber das gleiche für alle Folien gehalten werden müssen. - Die DAB-Lösung durch das Ausspülen mit Wasser entfernen. Counterstain den Folien mit schnell rote Lösung (bereit zu verwenden, siehe die Tabelle der Materialien) für 20 min. Waschen die Folien mit Wasser noch einmal kurz.
- Entwässern sie mit 95 % igem Ethanol für 5 min 100 % Ethanol, 2 x 5 min. gefolgt. Zu guter Letzt montieren Sie die Folien mit schnell aushärtende Eindeckmedium (siehe Tabelle der Werkstoffe).
- Beobachten die Folien unter dem Mikroskop im Hellfeld bei 20 X Hintergrund zu vermeiden.
Hinweis: Schnell rote Lösung kann bei RT gehalten und nach dem Filtern wiederverwendet.
- zuerst, verdünnen die 3,3 '-Diaminobenzidine (C 12 H 14 N 4 C 12 H 18 Cl 4 N 4 (4 HCl), DAB) im Substratpuffer durch die gebrauchsfertige Kit (20 µL DAB für 1 mL Substrat Pufferlösung) bereitgestellt. 100 µL der DAB-Lösung direkt in jede Folie hinzufügen und maximal 10 min bei RT inkubieren
4. Analyse und Quantifizierung
- SA-β-Gal Quantifizierung
- Dias scannen und wählen die besten Abschnitte auf jeder Folie anhand der aufgenommenen Bilder. Verwenden Sie mindestens 2 Abschnitte/TA für die Quantifizierung. Beurteilen im Abschnitt ' s-Qualität basiert auf Gewebe Integrität, Qualität der Färbung und der Gegenfärbung. Wählen Sie für die Quantifizierung der höchsten Qualität zweiteilig mit die maximale Distanz zwischen Proben, ermöglicht bessere Darstellung des SA-β-Gal Quantifizierung in der ganzen TA Muskel.
- Quantifizierung der SA-β-Gal-positiven Zellen ( Abbildung 2).
- Bestimmen den Rang eines die Pixelgröße von manuell auswählen, die kleinste und die größte positive SA-β-Gal-Zellen.
- Öffnen Sie das digitale Bild des gescannten Dias mit ImageJ-Software.
- In der Benutzeroberfläche, klicken Sie ' Analyze ' > ' Tools ' > ' ROI Manager ' > ' Analyze ' > ' Messung eingestellt ' > ' wählen Sie Bereich '. Verwenden Sie das Auswahlwerkzeug und surround-die kleinste und größte positive SA-β-Gal Zell und fügen sie Sie des ROI-Managers durch Klicken auf ' Add '. Messen der Größen, die mit der ' Maßnahme ' button und speichern Sie die Werte für den späteren Gebrauch.
- Einstellen des Parameters "Schwelle" gewährleisten die sichtbaren positiven Zellen ausgewählt sind.
- Convert Graustufen durch Klicken auf das Bild ' Bild ' > ' Typ ' > ' 8-Bit ' ( Abbildung 2A). Als nächstes gehen Sie zu ' Bild ' > ' einstellen ' > ' Schwelle ', den zweiten Cursor bis rot ( Abb. 2 b) die positive SA-β-Gal-Zellen bedeckt sind, und klicken Sie dann ' anwenden '.
- Analysieren Partikel durch Klicken auf ' Analyze ' > ' analysieren Partikel ' > ' Größe (Pixel ^ 2) ', und den Wert im Schritt 4.1.2.1 definiert anzuwenden, geben Sie ' Zirkularität ': ' 0,00-1,00 ', klicken Sie ' ok '; eine Zusammenfassung aller die gezählten Partikel zeigt sich in der ROI-Manager ( Abb. 2D).
- Die ausgewählten Partikel auf das ursprüngliche Bild übertragen. Passen Sie die Einstellungen manuell, um genaue Quantifizierung zu gewährleisten. Fügen Sie positive Zellen (grüner Pfeil, Abb. 2E hinzu) bzw. Entfernen Sie falsche positive Zellen (roter Pfeil, Abb. 2E). Messen Sie schließlich den Bereich umreißen den Abschnitt ( Abb. 2D) mit der ' Auswahl-Werkzeug '. Klicken Sie ' ROI-Manager ' > ' Add ' > ' Maßnahme '.
- Wichtiger ist, die Anzahl der positiven Zellen durch die Fläche des Abschnitts zu normalisieren.
- Bestimmen den Rang eines die Pixelgröße von manuell auswählen, die kleinste und die größte positive SA-β-Gal-Zellen.
- Nanog Quantifizierung
- zählen die Nanog positive Zellen unter dem Mikroskop im hellen Bereich manuell mit 20 X Vergrößerung.
Hinweis: Schnell rot Gegenfärbung ermöglicht gute Beurteilung der Morphologie des TA-Muskels. Aber die Färbung ist sehr leicht und fehlt eine klare Gliederung des Abschnitts. Der Scanner oft nicht die Grenze der Abschnitte identifizieren und kann nicht richtig konzentrieren. Es ist möglich, verwenden Sie Marker, um Kreis die Kanten der Teile vor dem Scannen oder einen empfindlicheren Scanner verwenden, um den Abschnitt zu erkennen. Für das aktuelle Protokoll ist es am effizientesten, die Nanog positive Zellen manuell zählen.
- zählen die Nanog positive Zellen unter dem Mikroskop im hellen Bereich manuell mit 20 X Vergrößerung.
Ergebnisse
Erkennung von Muskel-Verletzungen-induzierte zellulären Seneszenz
Es wurde kürzlich nachgewiesen, dass Muskelverletzung transiente zellulären Seneszenz14induziert. 10 Tage nach der Verletzung (DPI) der Großteil der beschädigten Myofibers sind in der Regeneration mit zentral gelegenen Kerne, ein Markenzeichen Myofibers, zu regenerieren und die Architektur des Muskels ist wieder hergestellt. Die eindringende Entzündungszellen werden stark reduziert, während die übrigen in bestimmten Regionen sichtbar. 10 DPI ist ein guter Zeitpunkt, alternde Zellen durch SA-β-Gal, zu erkennen, da gibt es weniger nekrotische und entzündliche Zellen in den Muskel zu stören die Färbung. Um die Besonderheit der Färbung zu bestimmen, wird TA injiziert mit PBS von der gleichen Maus (Abbildung 1A) als kritische Negativkontrolle verwendet.
Um eine bessere und genauere Auswertung der SA-β-Gal positive Zellen zu gewährleisten, werden Abschnitte aus verschiedenen Ebenen des TA-Muskels in derselben Folie (Abbildung 1 b) gelegt. Zähler mit Eosin Färbung ist wichtig für die automatische Quantifizierung der SA-β-Gal positive Zellen von ImageJ-Software. Eosin Färbung Zähler skizziert Abschnitt, die mit dem digitalen Scanner, die Abschnitte mit den richtigen Fokus zu erkennen kann. Es ist wichtig, sorgfältig zu definieren, die Reichweite und die Schwelle der Erkennung (Abbildung 2A-D). Darüber hinaus ist ein manuell kuratierter Prozess wesentlich genauere Erkennung und Quantifizierung (Abb. 2E) zu ermöglichen.
Zelluläre Seneszenz erleichtert in Vivo Reprogrammierung im Muskel
Programmierbar Mausmodell (i4F) bietet ein ideales System zur Bewertung der Auswirkungen der Seneszenz auf zelluläre Plastizität und Regeneration. Bei Muskel-Verletzungen sind i4F Mäuse mit Dox induzieren Neuprogrammierung in Vivobehandelt. 7 Tage Dox (1 mg/mL) Behandlung ist ausreichend induzieren Umprogrammierung auf zellulärer Ebene, während von den Mäusen (Abbildung 3A) noch gut toleriert. Deshalb ernten wir verletzte Muskeln bei 10 Pulverinhalatoren i4F Mäuse mit Dox für 7 Tage behandelt.
Es ist, zwar möglich, Co Färbung des SA-β-Gal mit Nanog durchführen empfiehlt es sich nicht zur Quantifizierung durch mögliche störende Verfärbungen. Wie oben erwähnt, ist es essentiell für digitale Scanner-Entdeckung Zähler Färbung. Der beste Counter für die SA-β-Gal zusammen mit Nanog Färbung ist schnell rot Orhematoxylin. Allerdings könnte Zähler Färbung über die SA-β-Gal oder Nanog Signal maskieren. Daher ist es für eine genauere Quantifizierung besser separat auf aufeinander folgenden Folien (Abb. 3 b) durchführen. Durch Quantifizierung der SA-β-Gal positiv und Nanog positive Zellen aus angrenzenden Folien, gründeten wir eine positive Korrelation zwischen ihnen (Abbildung 3), was auf eine mögliche Beteiligung der Seneszenz auf zelluläre Plastizität und Regeneration.
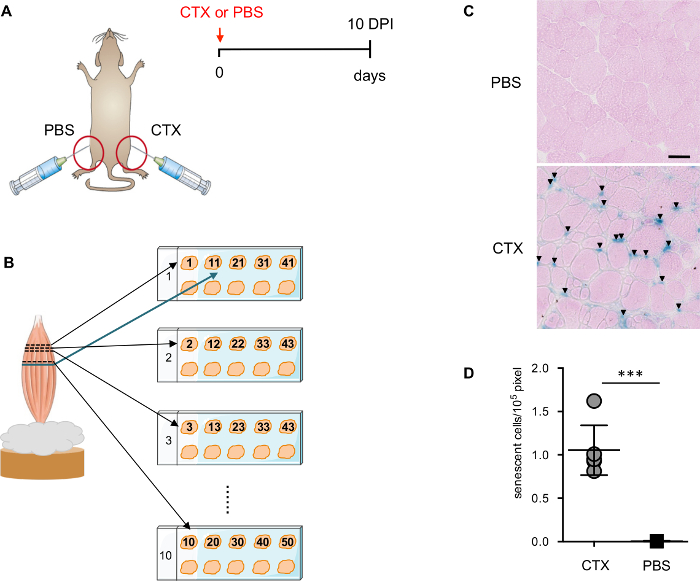
Abbildung 1: Seneszenz Ebene nach Muskelverletzung zu bewerten. (A) schematische Darstellung der Muskel Verletzung Strategie zur Seneszenz induzieren. (B) schematische Darstellung der Muskel Abschnitt Vorbereitung. (C) repräsentative Bilder von SAβGal Färbung mit Eosin counterstained. Pfeile zeigen auf die SA-β-Gal+ -Zellen. Skalieren von Balken = 50 µm. (D) Quantifizierung der SA-β-Gal+ Zellen in verletzten und nicht verletzt TA-Muskel. Jeder Punkt entspricht einem einzelnen Tier. Statistischer Signifikanz wurde durch den zweiseitigen Student t-Test beurteilt: *** p < 0,001. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Quantifizierung der SA-β-Gal+ Zellen von ImageJ-Software. (A-D) Screenshots einer Muskel-Sektion in der Softwareoberfläche ImageJ. Screenshot der Umwandlung ein Muskel Abschnitt Image Skala (A)grau; Auswahl der SA-β-Gal + Zellen im Bereich (B); Analysieren die ausgewählten Partikel (C); Übersicht über alle gezählten Particals im ROI-Manager (D). (E) Screenshot des manuellen Kuration Prozesses. Bitte klicken Sie hier für eine größere Version dieser Figur.
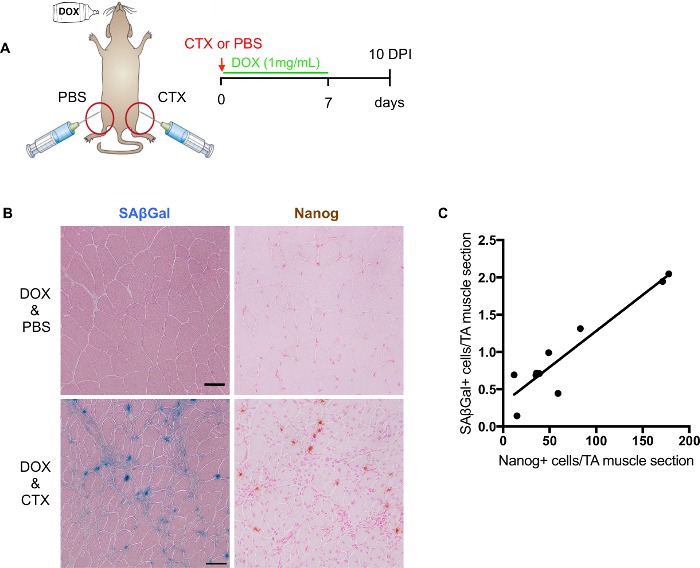
Abbildung 3: Bewertung der Reprogrammierung nach Muskelverletzung in Vivo . (A) schematische Darstellung, in Vivo -Umprogrammierung und Seneszenz Level nach Muskelverletzung zu bewerten. (B) repräsentative Bilder von SA-β-Gal und Nanog Färbung auf Gefrierschnitte von beschädigten Skelettmuskel. SAβGal counterstained Färbung mit Eosin (links); immunhistochemische Färbung des Nanog counterstained mit schnell rot (rechts). Non-verletzte Muskeln sind auf den oberen und verletzten Muskel unten gezeigt. Skalieren Sie Bars = 50 µm. (C) Quantifizierung und Korrelation von SA-β-Gal + und Nanog+ Zellen in aufeinander folgenden Abschnitten (n = 9 Mäuse Wert entspricht dem Durchschnitt der 2 Abschnitte per Mausklick). Bitte klicken Sie hier für eine größere Version dieser Figur.
| Volumen für 50 mL | |
| 100 mM K3Fe(CN)6 Stammlösung | 2 mL |
| 100 mM K4Fe(CN)6 Lösung auf Lager | 2 mL |
| 1 M MgCl2 | 100 ΜL |
| 50 mg/mL X-Gal | 400 ΜL |
| PBS (pH 5,5) | 45,50 mL |
Tabelle 1: Zusammensetzung von 50 mL X-gal-Lösung.
Diskussion
Hier stellen wir eine Methode, um beide seneszenten erkennen und pluripotenten Stammzellen in der Skelettmuskulatur programmierbar Mäuse. Diese Methode kann verwendet werden, bewerten beide Seneszenz zu quantifizieren und induzieren zelluläre Plastizität in Vivound untersuchen die Rolle der Seneszenz in Gewebe-Reparatur und Regeneration.
In dem aktuellen Protokoll dient der Seneszenz-assoziierten β-Galaktosidase (SA-β-Gal) Assay in Vivo seneszenten Zellen in der Skelettmuskulatur zu erkennen. Dieser Test erkennt die erhöhte lysosomale β-Galaktosidase Aktivität bei bedenklich pH (6.0 oder 5.5), speziell mit seneszenten Zellen verbunden, während dieses Enzym-Aktivität in der Regel mit sauren pH-Wert 4,516,17gemessen wird. Daher ist es wichtig, den pH-Wert einzustellen (pH = 6 oder 5,5) um einen spezifischen Nachweis der Seneszenz verbundene Tätigkeit zu gewährleisten. Darüber hinaus ist Färbung mit Eosin Zähler für die automatische Quantifizierung der SA-β-Gal+ Zellen, wo die schwachen und diffuse Signale nicht gezählt werden. Um mögliche Variabilität zu vermeiden, ist es vorzuziehen, dass die gleiche Person die gesamte Zählung Prozedur führt.
Obwohl die SA-β-Gal-Assay ist am häufigsten verwendet und Biomarker für alternde Zellen akzeptiert, ist es keine exklusive Marker für Seneszenz. Es wurde vermutet, dass übermäßige Zusammenfluss Zellen in Kultur falsch Positivität für SA-β-Gal18verursachen könnten. Die Empfindlichkeit des Tests kann Zelltyp und Gewebe geben Sie abhängige in Vivo19. Daher ist es notwendig, verwenden andere unabhängige kanonische Marker, wie das Fehlen von Proliferation, erhöhte Expression von Seneszenz Mediatoren (p16, ARF, p53, p21 und p27) und der Sekretion von verschiedenen SASP Faktoren zu bestätigen und zu charakterisieren Seneszenz in Vivo. Darüber hinaus sind geeignete negative Kontrollen unentbehrlich für die Interpretation der Ergebnisse, insbesondere bei in-Vivo -Studie.
Trotz der Tatsache, dass SA-β-Gal-Assay nicht perfekt, es besonders wertvoll für in-Vivo -Studie bietet Informationen. Es ermöglicht die Erfassung der alternde Zellen in ihrem Wohnsitz Umfeld mit intaktem Gewebearchitektur, bietet wichtigen Informationen erleichtern das weitere Verständnis der Rolle der alternde Zellen in verschiedenen physiologischen und pathologischen Kontexten. Darüber hinaus ist es mit der Immunostaining andere Marker wie Zelle Oberflächenmarker, die zelluläre Identität der alternde Zellen ermitteln koppelbar; oder Stemness Marker, die mögliche Beteiligung der Seneszenz in Regeneration und Tumorgenese zu untersuchen. Bisher haben wir die SA-β-Gal-Assay mit immunhistochemischen Färbung von Nanog im gleichen Abschnitt oder in der Nähe zu untersuchen, die mögliche einer Verbindung zwischen Seneszenz und in Vivo Umprogrammierung8durchgeführt. Während dieses Protokolls auf die Skelettmuskulatur fokussiert ist, kann es sicherlich an anderen Geweben erweitert werden.
Vor kurzem hat zellulären Seneszenz in Gewebe-Reparatur und Regeneration, wahrscheinlich über SASPs7,8,9verwickelt. Verständnis der Mechanismen der Seneszenz wie zur Gewebereparatur und Regeneration beiträgt haben sicherlich einen enormen Einfluss auf die regenerative Medizin. Dieser Test stellt ein wichtiges und wertvolles Instrument um die Identifikation zu erleichtern und Quantifizierung der alternde Zellen in Vivo.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Wir sind verpflichtet, Clemire Cimper für ihre ausgezeichneten technischen Support. Arbeit im Labor von H.L wurde finanziert vom Institut Pasteur, Centre National Pour la Recherche Scientific, und die Agence Nationale De La Recherche (Laboratoire d ' Excellence Revive, Investissement Avenir; ANR-10-LABX-73), die Agence Nationale De La Recherche (ANR-16-CE13-0017-01) und Fondation ARC (PJA 20161205028). C.c. und A.C. finanziert die Promotion und Postdoc-Stipendien aus dem Konsortium wieder zu beleben.
Materialien
| Name | Company | Catalog Number | Comments |
| K3Fe(CN)6 | Sigma | 13746-66-2 | For SA-β Gal staining solution |
| K4Fe(CN)6 | Sigma | 14459-95-1 | For SA-β Gal staining solution |
| MgCl2 | Sigma | 7786-30-3 | For SA-β Gal staining solution |
| X-Gal | Sigma | B4252 | For SA-β Gal staining solution |
| Doxycycline | Sigma | D3447 | For inducing in vivo reprogramming |
| Cardiotoxin | Lotaxan Valence, France | L8102 | For muscle injury |
| Glutaraldehyde | Sigma | 111-30-8 | For Fixation solution |
| Paraformaldehyde | Electron microscopy science | 50-980-487 | For Fixation solution |
| NaCitrate : Sodium Citrate monobasic bioxtra, anhydre | Sigma | 18996-35-5 | For permeabilization solution |
| Triton | Sigma | 93443 | For permeabilization solution |
| Bovine Serum Albumin | Sigma | A3608 | Washing solution |
| Antibody anti- Nanog | Cell signalling | 8822S | Rabbit monoclonal antibody |
| EnVision+ Kits (HRP. Rabbit. DAB+) | Dako | K4010 | For Nanog revelation |
| Eosin 1% | Leica | 380159EOF | Counterstainning |
| Fast red | Vector Laboratories | H-3403 | Counterstainning |
| Thermo Scientific Shandon Immu-Mount | Fisher scientific | 9990402 | Mounting solution |
| Quick-hardening mounting medium for microscopy : Eukitt® | Sigma | 25608-33-7 | Mounting solution |
| Microscope Phase Contrast Brightfield CKX41: 10X-20X-40X objectives | Olympus | CKX41 | Microscope for Nanog quantification |
| Mouse: i4F-A | Abad et al., 2013 | N/A | Reprogrammable mouse model |
| Skeletal muscle, Tibialis Anterior | |||
| Slide Scanner | Zeiss | Axio Scan Z1 | slides scanning |
Referenzen
- Munoz-Espin, D., Serrano, M. Cellular senescence: from physiology to pathology. Nat Rev Mol Cell Biol. 15 (7), 482-496 (2014).
- Baker, D. J., et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 530 (7589), 184-189 (2016).
- Hayflick, L. The Limited in Vitro Lifetime of Human Diploid Cell Strains. Exp Cell Res. 37, 614-636 (1965).
- Coppe, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu Rev Pathol. 5, 99-118 (2010).
- Yun, M. H., Davaapil, H., Brockes, J. P. Recurrent turnover of senescent cells during regeneration of a complex structure. Elife. 4, (2015).
- Demaria, M., et al. An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA. Dev Cell. 31 (6), 722-733 (2014).
- Mosteiro, L., et al. Tissue damage and senescence provide critical signals for cellular reprogramming in vivo. Science. 354 (6315), (2016).
- Chiche, A., et al. Injury-Induced Senescence Enables In Vivo Reprogramming in Skeletal Muscle. Cell Stem Cell. , (2016).
- Ritschka, B., et al. The senescence-associated secretory phenotype induces cellular plasticity and tissue regeneration. Genes Dev. 31 (2), 172-183 (2017).
- Takahashi, K., Yamanaka, S. A decade of transcription factor-mediated reprogramming to pluripotency. Nat Rev Mol Cell Biol. 17 (3), 183-193 (2016).
- Abad, M., et al. Reprogramming in vivo produces teratomas and iPS cells with totipotency features. Nature. 502 (7471), 340-345 (2013).
- Ohnishi, K., et al. Premature Termination of Reprogramming In Vivo Leads to Cancer Development through Altered Epigenetic Regulation. Cell. 156 (4), 663-677 (2014).
- Guardiola, O., et al. Induction of Acute Skeletal Muscle Regeneration by Cardiotoxin Injection. J Vis Exp. (119), (2017).
- Le Roux, I., Konge, J., Le Cam, L., Flamant, P., Tajbakhsh, S. Numb is required to prevent p53-dependent senescence following skeletal muscle injury. Nat Commun. 6, 8528(2015).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nat Protoc. 4 (12), 1798-1806 (2009).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proc Natl Acad Sci U S A. 92 (20), 9363-9367 (1995).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging Cell. 5 (2), 187-195 (2006).
- Krishna, D. R., Sperker, B., Fritz, P., Klotz, U. Does pH 6 beta-galactosidase activity indicate cell senescence? Mech Ageing Dev. 109 (2), 113-123 (1999).
- Cristofalo, V. J. SA beta Gal staining: biomarker or delusion. Exp Gerontol. 40 (10), 836-838 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten