Method Article
Un
In questo articolo
Riepilogo
Abbiamo sviluppato uno In vitro Malaria-HIV-1 co-infezione da modello per studiare l'impatto di Plasmodium falciparum Sul ciclo replicativo di HIV-1 in primarie umane derivate da monociti macrofagi. Questo sistema versatile può essere facilmente adattato ad altri tipi di cellule primarie sensibili a HIV-1.
Abstract
Plasmodium falciparum, l'agente eziologico della forma mortale di malaria, e da virus dell'immunodeficienza umana di tipo 1 (HIV-1) sono tra i problemi di salute più importanti del mondo, essendo responsabile per un totale di 4 milioni di decessi all'anno 1. Grazie alla loro sovrapposizione ampie nelle regioni in via di sviluppo, specialmente nell'Africa Sub-sahariana, co-infezioni da malaria e HIV-1 sono comuni, ma l'interazione tra le due malattie è poco conosciuta. Rapporti epidemiologici hanno suggerito che l'infezione malarica aumenta transitoriamente replicazione dell'HIV-1 e aumenta il carico virale HIV-1 in co-infezione da 2,3. Poiché questo viremia rimane alta per diverse settimane dopo il trattamento con antimalarici, questo fenomeno potrebbe avere un impatto sulla progressione della malattia e la trasmissione.
I meccanismi immunologici cellulari alla base di queste osservazioni sono stati studiati solo a malapena. I pochi studi in vitro investigdall'uso della impatto della malaria su HIV-1 hanno dimostrato che l'esposizione ad antigeni solubili malarici può aumentare da HIV-1 e riattivazione in cellule immunitarie. Tuttavia, questi studi hanno utilizzato estratti di cellule intere di P. falciparum stadio schizonte parassiti e cellule mononucleari del sangue periferico (PBMC), il che rende difficile decifrare quale componente della malaria (s) è responsabile degli effetti osservati e quali sono le cellule bersaglio ospiti erano 4,5. Studi recenti hanno dimostrato che l'esposizione di immature derivate da monociti cellule dendritiche al pigmento emozoina malarica aumentato la loro capacità di trasferire HIV-1 di cellule T CD4 + 6,7, ma che è diminuito da HIV-1 di macrofagi 8. Per far luce su questo processo complesso, l'analisi sistematica delle interazioni tra il parassita della malaria e l'HIV-1 in differenti popolazioni umane rilevanti cellulari primarie è criticamente necessaria.
Diverse tecniche per indagare l'impatto della HIV-1 sulla fagocitosi dei microrganismi e l'effetto di tali patogeni in replicazione dell'HIV-1 sono stati descritti. Noi qui presentiamo un metodo per studiare gli effetti di P. falciparum-infetti eritrociti sulla replicazione di HIV-1 in primarie umane derivate da monociti macrofagi. L'impatto di esposizione parassita HIV-1 trascrizionali / traduzionale eventi viene monitorata mediante virus singolo ciclo pseudotyped in cui un gene reporter della luciferasi ha sostituito il gene Env, mentre l'effetto sulla quantità di virus rilasciato dai macrofagi infettati è determinata misurando la HIV-1 proteina del capside p24 mediante ELISA in supernatanti cellulari.
Protocollo
Nota: Esperimenti con HIV-1 e il Plasmodium falciparum devono essere eseguite nel corretto livello di biosicurezza laboratori (BSL2 per i parassiti, e BSL3 per l'HIV-1 e co-infezioni) e precauzione particolare deve essere posta nell'uso potenzialmente infetto sangue umano.
1. Le cellule mononucleari del sangue periferico (PBMC) Purificazione (Basato su 8 e 9)
- Iniziare con sangue umano fresco da donatori sani (500 ml) trattati con anticoagulanti (eparina, citrato, destrosio citrato acido o destrosio citrato fosfato). Utilizzare priva di endotossina reagenti quando purificare e isolare PBMC e per tutto il resto del protocollo.
- Disinfettare la sacca di sangue, compreso il tubo, con il 70% di etanolo, tagliare il tubo e trasferire con cautela il sangue in un pallone T150.
- Preparare 16 provette con 15 ml di separazione Medio Linfociti (Ficoll) per tubo da 50 ml (assicurarsi che Ficoll ha raggiunto la temperatura ambiente).Cautela strato 30 ml di sangue fresco sulla parte superiore.
- Centrifugare a 400 xg per 30 min a 20 ° C con interrompe.
- Durante la centrifugazione, la preparazione 8 x 50 ml provette coniche con 25 ml di soluzione salina bilanciata di Hank temperatura ambiente (HBSS) per provetta.
- Trasferire accuratamente l'anello nuvoloso cella a livello di interfaccia (contiene PBMC) al tubo 50 ml contenente il HBSS (piscina 2 anelli cellulari per ogni tubo). Completa volumi fino a 50 ml con HBSS.
- Centrifugare a 150 xg per 15 min a 20 ° C con rotture sul.
- Durante la centrifugazione dell'anello cella nuvoloso, raccogliere lo strato giallo superiore dal punto Ficoll, piscina per il plasma per riempire un tubo da 50 ml. Inattivare il complemento nel plasma riscaldando il tubo da 50 ml a 56 ° C per 30 minuti e centrifuga 10 min a 1.800 x g. Mantenere il supernatante (contiene plasma autologo diluito che può essere utilizzato come mezzo integratore a passi successivi).
- Rimuovere con cura il supernatante e resuspend il pellet di cellule dal punto 1.7 in 25 ml di HBSS e piscina 2 pellets per tubo da 50 ml. Spin a 300 xg per 8 minuti a 20 ° C.
- Rimuovere il surnatante con cura e risospendere il pellet in 10 ml di HBSS e piscina in un tubo da 50 ml.
- Prelevare un 'aliquota, eseguire l'esclusione blu trypan per valutare la mortalità e poi contare PBMC.
- Completa il volume a 50 ml con HBSS e spin 10 min a 300 x g. Rimuovere il surnatante e risospendere le cellule in RPMI 1640 a 5x10 6 cellule / ml (si dovrebbe ottenere circa 400-500 x 10 6 PBMC da 500 ml di sangue).
2. I monociti-macrofagi derivati (MDM) Differenziazione (Basato su 8 e 9)
- Seed circa 1,25 x 10 8 PBMC in 15 piatti cm con RPMI 1640 (25 ml / piatto).
- Lasciare cellule aderiscono per 1-2 ore a 37 ° C con 5% CO 2 atmosfera.
- Trasferire cellule non aderenti in un pallone nuovo e lavare con 15 ml piastra priva di endotossina PBS due volte (5min, 300 xg). Le cellule aderenti sono monociti isolati.
- Per consentire monociti isolate di fresco a differenziarsi in MDM, aggiungere 20 ml di terreno RPMI 1640 supplementato con 5% di plasma autologo (dal passaggio 1,8). Aggiungere umano ricombinante fattore stimolante le colonie di macrofagi (M-CSF, 25 ng / ml) e soluzione di penicillina / streptomicina (PS, 100 U / ml penicillina, 100 pg / ml streptomicina). Incubare per 2 giorni, modificare medie e incubare 2-3 giorni supplementari a 37 ° C in 5% CO 2 atmosfera.
- Rimuovere vecchio mezzo e lavare con PBS privo di endotossine una volta, aggiungere la PBS delicatamente e aspirare immediatamente. Per staccare MDM completamente differenziate, cellule trattare con ~ 7 ml Accutase (Accutase, una miscela disponibile in commercio e attività di proteasi collagenolitica che consentono il distacco delle cellule dal piatto di plastica) per 15-20 minuti a 37 ° C in una CO 5% 2 atmosfera, cullare dolcemente a metà tempo.
- Aggiungere 3-5 ml di plasma autologo (dal punto 1.8) in ciascun piatto (per aiutare a proteggere le cellule, mentreraschiatura).
- Raschiare delicatamente le cellule facendo attenzione che media copre le cellule di tutti i tempi e di trasferimento / piscina in una provetta da 50 ml.
- Lavare le piastre con PBS privo di endotossine per recuperare le celle numero possibile.
- Spin 5 min a 200 xg, eliminare il surnatante.
- Risospendere il pellet in 5 ml di terreno di coltura MDM (RPMI 1640 supplementato con 10% complemento-inattivato Siero fetale bovino (IFB), PS, 25 mM HEPES) e cellule di conteggio (MDM resa generalmente 2-8% del totale PBMC). Nota: una aliquota di MDM potrebbero essere prese in questa fase di valutare la purezza della popolazione cellulare mediante citometria di flusso, di solito il 99% di MDM ottenuto espressa CD14.
- Seme 1x10 5 MDM in 600 pl di mezzo di coltura MDM per pozzetto in piastre da 24 pozzetti.
- Incubare per una notte a 37 ° C in 5% CO 2 atmosfera prima infezioni.
3. Produzione e quantificazione di HIV-1 Stocks virali
- Produrre azioni virali utilizzando fosfato di calcio transfezione in cellule HEK293T Folloala il protocollo di Fortin et al. dieci.
- Per ottenere virus singolo ciclo contenenti la luciferasi-codifica gene reporter, co-trasfezione cellule HEK293T sia con 20 pg di NL4.3 Luc + Env - R + e 10 pg di pHCMV-G, o 15 microgrammi di NL4.3 Luc + Env - R + e 15 microgrammi di pJRFL env. Uso 30 microgrammi di NL4.3 Luc + Env - R + per generare controllo della glicoproteina-carenti virus. Per il virus replicativa completamente, utilizzare 30 microgrammi di NL4.3Bal env. I vettori pHCMV-G e pJRFL env codificare le glicoproteine del virus della stomatite vescicolare (VSV-G) e di un CXCR5-tropico HIV-1 (diverso NL4.3Bal env), rispettivamente. Ulteriori informazioni sui plasmidi possono essere ottenuti da 8. I plasmidi possono essere ottenute attraverso il NIH AIDS Research and Program Reference (NIAID, NIH).
- Quantificare tutti gli stock virali mediante ELISA per la proteina HIV-1 p24 del capside 11, E verificare il loro potenziale infettiva prima dell'uso. Valutiamo l'infettività delle nostre riserve di virus attraverso l'uso di TZM-bl cellule indicatrici 12.
4. Cultura di parassiti Plasmodium falciparum (Basato su 13)
4,1 cultura generale e la manutenzione dei parassiti
- Mantenere P. falciparum parassiti fase 3D7 asessuali di eritrociti umani (gruppo O +) ad un ematocrito del 4% in RPMI 1640 (tamponato con HEPES 25 mM e 25 mM NaHCO 3) supplementato con 0,5% (w / v) Albumax II, 25 pg / ml gentamicina e ipoxantina 370μM a 37 ° C in una miscela gassosa di ossigeno 1% / anidride carbonica 5% in azoto.
- Parassitemia può essere controllata facendo un velo di cultura e colorazione con una soluzione Giemsa 15%.
- Mantenere sempre un cellule non infettate globuli rossi (uRBC) piatto di coltura nelle stesse condizioni come parassiti da utilizzare come un controllo.
Per ottenere Parasit fine stagees (trofozoiti / schizonti primi), sincronizzare i parassiti come segue:
4,2 Parasite sincronizzazione
- Al mattino, raccogliere la cultura parassita, spin 5 min a 300 xg ed eliminare il surnatante.
- Risospendere le sfere in 5 volumi ematocrito con 5% (w / v), D-sorbitolo e incubare 5 min a 37 ° C.
- Spin 5 min a 300 x g, eliminare il surnatante, risospendere il pellet in 30 ml di mezzo la cultura e la rimessa in incubatrice.
- Circa 8 ore dopo, ripetere i passaggi da 4.2.1 a 4.2.3 in modo da ottenere parassiti ben sincronizzati. Parassiti fase avanzata (trofozoiti / schizonti primi) può quindi essere raccolte la mattina seguente per eseguire l'esperimento. Prima di purificazione, eseguire la colorazione Giemsa per confermare la fase del ciclo di vita.
4.3 Plasmodium falciparum-globuli rossi infetti (iRBC) depurazione
- Sterilizzare il separatore VarioMacs (stand e magnete) con il 70% di etanolo e ppizzo sotto il cofano biologico.
- Fissare la valvola a tre vie a colonna in basso a CS.
- Tagliare la fine della protezione dell'ago plastica con la taglierina Miltenyi speciale e fissare l'ago al fondo rubinetto.
- Bloccare la colonna all'interno del magnete con attenzione.
- Rimuovere le bolle d'aria nella colonna iniettando lentamente 10 ml di terreno di coltura MDM con il kit-chiuso siringa avvitato sul lato sinistro del rubinetto.
- Lavare la colonna con circa 20 ml di terreno di coltura MDM.
- Harvest RBC dalla piastra di coltura, lavare una volta con 10 ml di mezzo MDM (300 xg, 5 min) e risospendere il pellet in 12 RBC terreno di coltura MDM ml. Aggiungere lentamente alla colonna e lasciare che il flusso di sospensione attraverso (solo le cellule infettate globuli rossi contenenti parassiti nel trofozoite o stage schizonte sarà trattenuto dal campo magnetico a causa della presenza di cristalli emozoina).
- Risciacquare una volta con 20 ml di mezzo e arrestare il flusso di liquido quando raggiunge il disco bianco sulla parte superiore della colonna.
- Rimuovere la colonna dal magnete e iRBC eluire in una provetta pulita sterile con 12 ml di terreno di coltura MDM.
- Macchia un'aliquota del iRBC recuperato ed eseguire la colorazione Giemsa per confermare la fase di ciclo di vita.
- Contare iRBC recuperato utilizzando un emocitometro (isolato RBC sono al 100% iRBC).
- Celle a pellet (300 xg, 5 min), eliminare il surnatante e trattare le cellule con 500 microlitri AB + fresca di siero umano (opsonizzazione passo 14).
- Incubare per 30 min a 37 ° C in 5% CO 2 atmosfera.
- Risciacquare una volta con 10 ml di terreno di coltura MDM (300 x g, 5 minuti), e risospendere iRBC alla concentrazione desiderata. Di solito, un 10% di parassitemia 15 centimetri piatto di coltura dà circa ~ 0.5-1x10 8 iRBC ben sincronizzati.
5. L'esposizione di MDM di Plasmodium falciparum
- Per esporre la MDM di uRBC o iRBC, le cellule devono essere risospese in mezzo di coltura MDM per ottenere un rapporto di uRBC / iRBC: MDM di 75:1. In precedenzapreparate piastre da 24 pozzetti contenenti MDM, aggiungere volume appropriato sospensione RBC in ciascun pozzetto. Eseguire tutti gli esperimenti, in triplice copia.
- Incubare co-colture per 4 ore a 37 ° C in 5% CO 2 atmosfera.
- Lavare le cellule con 600 microlitri di endotossina-free PBS 3 volte, aggiungere il PBS delicatamente e aspirare immediatamente.
- Per lisare il restante RBC, lavare i pozzetti aggiungendo 200 microlitri di acqua ghiacciata sterile per 20 sec e aspirato.
- Aggiungere 600 pl terreno di coltura MDM e incubare 24 ore a 37 ° C in 5% CO 2 atmosfera.
6. L'infezione di MDM con un replicativa completamente HIV-1
- Per valutare l'effetto di P. falciparum sulla replicazione dell'HIV-1 in MDM, aggiungere, secondo lo schema illustrato in Figura 1A, 10 ng di p24 (in 300 pl di MDM media) del virus NL4.3Bal env nel caso pozzetti, aggiungere solo mezzo MDM in pozzetti di controllo .
- Incubare 2 ore a 37 ° C in 5% Di CO 2 nell'atmosfera.
- Lavare le cellule con PBS privo di endotossine 3 volte, aggiungere il PBS delicatamente e aspirare immediatamente. Aggiungere 600 microlitri di terreno MDM fresca per bene.
- Incubare a 37 ° C in 5% CO 2 atmosfera.
- Al giorno 3, 6, 9 e 12 dopo l'inizio di infezione virale, raccolto 200 pl di ciascun supernatante, aggiungendo 200 pl di mezzo fresco MDM successivamente. Mantenere i surnatanti raccolti a -20 ° C per la quantificazione dei principali HIV-1 proteina del capside p24 mediante ELISA seguito Fortin et al. 10.
7. L'infezione di MDM con un singolo Luciferase Encoding Virus Cycle
- Per determinare l'impatto del parassita su HIV-1 espressione genica in MDM, aggiungere, secondo lo schema illustrato nella figura 1B, 10 ng p24 (in 300 pl di mezzo MDM) di una NL4.3 Luc + Env - R + ( VSV-G), NL4.3 Luc + Env - R + (JRFL env) o NL4.3 Luc +Env - R + virus nei pozzetti corrispondenti.
- Incubare 2 ore a 37 ° C in 5% CO 2 atmosfera.
- Lavare le cellule con 600 microlitri di endotossina-free PBS 3 volte, aggiungere il PBS delicatamente e aspirare immediatamente. Aggiungere 600 microlitri di terreno MDM fresca per bene.
- Incubare a 37 ° C in 5% CO 2 atmosfera.
- Rimuovere il supporto di 72 ore seguenti l'infezione e aggiungere 200 microlitri di tampone di lisi 1X (fornita con il kit di analisi luciferasi). Lasciate che le cellule lisare a temperatura ambiente, con agitazione delicata. Conservare a -20 ° C.
- Scongelare la piastra e trasferire 40 microlitri di lisato ad una piastra a 96 pozzetti luminometro; aggiungere 100 ul di substrato luciferasi (fornita con il kit di analisi luciferasi) e misurare la luciferasi (luciferasi Firefly) attività in un luminometro seguendo le istruzioni del produttore.
8. Risultati rappresentativi
Utilizzando il nostro modello di co-infezione, si dimostra che exposure di P. falciparum alla MDM diminuisce la loro suscettibilità alle infezione da HIV-1. Infatti, una diminuzione significativa (p <0,05; 2 ANOVA, giorno 12) per il rilascio di particelle virali, come misurato da HIV-1 p24 proteina del capside del supernatante, si osserva in MDM pretrattati con parassiti (Figura 2A). Questa osservazione è confermata in cellule infettate da virus che codificano un gene reporter luciferasi. MDM con infezione da virus di questo tipo si annidano sia esogena VSV-G o HIV-1 glicoproteine conduce in modo significativo (p <0,05, di Student t-test) produzione di luciferasi meno in cellule esposte a P. falciparum (Figura 2B). È interessante notare che VSV-G-pseudotyped virus prodotto molto maggiore attività di luciferasi che le loro controparti JRFLenv: ciò è dovuto alla maggiore efficienza di infezione VSV-G particelle pseudotyped 15. Dato che parassita esposizione agli impatti MDM entrambi i tipi di virus, questo suggerisce che influisce in qualche passo ex gene viralepressione (Figura 2B). È inoltre importante ricordare che la vitalità cellulare non è stata influenzata dalla MDM esposizione alla iRBC (dati non mostrati), indicando che l'inibizione osservata è specifico e non causa di mortalità cellulare.
Figura 1. A) schema di Piastra MDM di infezione con un virus replicativa pienamente Mock:. Cellule non infettate. uRBC: cellule esposte a infettate globuli rossi. iRBC: cellule esposte a Plasmodium falciparum-globuli rossi infetti. Bal: cellule infettate con NL4.3Bal env Bal / uRBC:. Cellule esposte a uRBC e infettati con NL4.3Bal env Bal / iRBC:.. Cellule esposte a iRBC e infettati con NL4.3Bal env B) Schema Piastra per l'infezione da MDM con singolo ciclo di luciferasi virus Mock-encoding:. cellule non infettate. uRBC: cellule esposte a infettate globuli rossi. iRBC: le cellule esposte a Plasmodium falciparum-infected globuli rossi. Δenv: cellule infettate con NL4.3 Luc + Env - R + JRFL:. Cellule infettate con NL4.3 Luc + Env - R + (JRFL env). VSV-g: cellule infettate con NL4.3 Luc + Env - R + (VSV-g) Δenv / uRBC:.. cellule esposte a uRBC e infettati con NL4.3 Luc Env +-R + Δenv / iRBC: le cellule esposte a iRBC e infettati con NL4.3 Luc + Env - R + JRFL / uRBC: cellule esposte a uRBC e infettati con NL4.3 Luc + Env - R + (JRFL env).. JRFL / iRBC: cellule esposte a iRBC e infettati con NL4.3 Luc + Env - R + (JRFL env). vsv-g/uRBC: le cellule esposte a uRBC e infettati con NL4.3 Luc + Env - R + (VSV-G): vsv-g/iRBC. cellule esposte a iRBC e infettati con NL4.3 Luc + Env - R + (VSV-g).
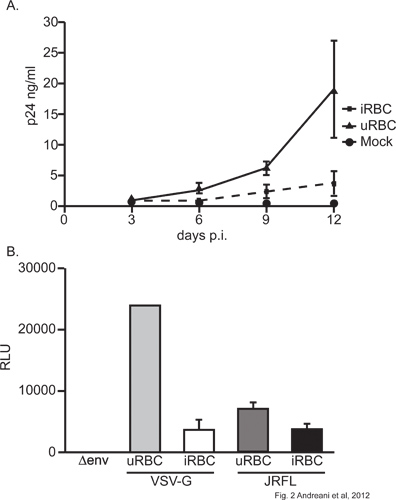
Figura 2. . A) Effetto del Plasmodium falciparum in materia di HIV-1 la produzione virale in MDM MDM sono stati esposti a uRBC o iRBC con un rapporto 75:1 (uRBC / iRBC: MDM) per 4 ore e ampiamente lavato. Le cellule sono state infettate con 10ng di NL4.3Bal p24 per 2 h env. Produzione virale è stata monitorata mediante ELISA per HIV-1 p24 in cellule privo supernatante a tempi diversi dopo l'infezione virale iniziale. Un esperimento rappresentativo è mostrato B) Effetto del Plasmodium falciparum in materia di HIV-1 la trascrizione virale in MDM MDM sono stati infettati con uRBC o iRBC con un rapporto 75:1 (uRBC / iRBC:.. MDM). Le cellule sono state poi infettate con 10ng di p24 del virus a ciclo unico (sia NL4.3 Luc + Env - R +, NL4.3 Luc + Env - R + (JRFL env) o NL4.3 Luc + Env - R + (VSV- g)). Espressione della luciferasi è stata valutata in lisati cellulari 72 ore dopo l'infezione virale iniziale. Un esperimento rappresentativo viene mostrato.
Discussione
Abbiamo illustrato qui due diversi approcci per analizzare l'impatto del parassita della malaria sul HIV-1 ciclo virale, vale a dire analizzando sia l'espressione genica virale o virus produzione di progenie e replica in monociti-macrofagi derivati. Simili approcci sono stati usati per altre HIV-1-parassita co-infezioni 16. Tuttavia, questi nuovi dati sono un passo avanti nelle indagini della malaria-HIV-1 co-infezioni. ., Infatti, Diou et al 8 studiato l'effetto di emozoina, i parassiti non dal vivo, il replicazione dell'HIV-1, in accordo con i nostri risultati, hanno osservato che emozoina era per sé sufficiente a inibire la produzione virale da MDM, e non MDM.
Utilizzando il layout descritto sperimentale, abbiamo osservato che P. falciparum esercita un chiaro effetto negativo sul ciclo replicativo di HIV-1 nei macrofagi: una significativa inibizione della produzione virale si osserva nei macrofagi pre-esposti a parassiti (Figure 2A) e un peso specifico del parassita sulla trascrizione virale è illustrato nella figura 2B. Tuttavia, non possiamo lasciare eventuali ulteriori effetti del parassita su ingresso del virus o la fusione (decapsidation), o su post-integrazione di meccanismi, come la sintesi proteica o montaggio di particelle virali e in erba. Inoltre, è possibile che un diverso impatto sulla replicazione dell'HIV-1 si otterrebbe se il parassita sono stati aggiunti sia al tempo stesso o infezione MDM seguente con il virus.
Il nostro in vitro co-infezione modello fornisce un potente strumento per effettuare indagini dettagliate di HIV-1 / P. interazioni falciparum nella cellula ospite. Ad esempio, la combinazione di questo schema sperimentale con altre tecniche come tempo reale PCR quantitativa, che può bersagliare e quantificare fasi specifiche retrotrascrizione virale e integrazione del genoma virale per genoma della cellula ospite, sono abbastanza fattibile e dovrebbe fornire ulteriori all'interghts nei meccanismi coinvolti nella co-infezioni. Inoltre, saggi specifici per valutare fasi iniziali del ciclo virale (virale fusione, decapsidation, quantificazione ingresso) può essere applicato a questo protocollo di base per analizzare ulteriormente l'effetto sulla replicazione virale. Queste modifiche mostrano come flessibile questo protocollo è relativa HIV-1 e quantificazione di rilevamento: infatti, anche standard di HIV-1 trascrittasi inverse saggi di quantificazione utilizzando marcata con tritio nucleotidi potrebbe concepibilmente sostituire la ELISA per HIV-1 p24. Oltre a MDM, ci aspettiamo il sistema sia adattabile ad altri tipi di cellule competenti per HIV-1-malaria interazioni, come monociti e cellule dendritiche. Il fatto che MDM sono cellule aderenti facilita la loro manipolazione, per facilitare il lavaggio di iRBC che non sono state prese in, o che sono in contatto con MDM, senza eliminando eventuali macrofagi. Tale vantaggio non si applica alle cellule dendritiche e monociti, che sono coltivate in sospensione, complicando la separazione di iRBC uRBC e gratuito con tali cellule e stiamo affrontando questo problema. Il nostro sistema potrebbe anche essere utile per studiare le interazioni più complesse quali gli effetti di Plasmodium-esposti cellule derivate da monociti sul ciclo virale HIV-1 in altre cellule immunitarie come CD4-positive cellule T in esperimenti di co-coltura. Infine, il nostro protocollo potrebbe essere adatto per gli esperimenti che cercano l'effetto di P. iRBCs falciparum in materia di HIV-1 riattivazione in PBMC per HIV-1 individui infetti.
Etica dichiarazione
PBMC umani sono stati ottenuti dal sangue di donatori sani, in conformità con le linee guida del Comitato di bioetica del Centre Hospitalier de l'Centro di Ricerca Université Laval. Un consenso scritto è stato ottenuto da tutti i donatori di sangue.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto dal Canadian Institutes of Health Research attraverso un catalizzatore Co-infezioni e co-morbidità e di sovvenzione. Eritrociti umani sono stati forniti dal Centre Hospitalier de banca del sangue l'Université Laval.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| RPMI 1640 | Multicell | 350-000-CL | |
| PBS-endotossina libera | Sigma | D8662 | |
| FBS | Bisonte | 080-150 | Inattivato al calore a 56 ° C per 30 min |
| Accutase | eBiosciences | 00-4555-56 | |
| Albumax II | Gibco | 11021-037 | Disciolto in RPMI 1640, sterilizzata con filtro |
| Separazione media dei linfociti | Multicell | 305-010-CL | |
| Piastre luminometro Bianco | Promega | Z3291 | |
| CS Mac separazione columms | Miltenyi Biotech | 130-041-305 | |
| VarioMacs separatore | Miltenyi Biotech | 130-090-282 | |
| Penicillina / streptomicina soluzione | Bisonte | 450-201-EL | |
| D-sorbitolo | Sigma-Aldrich | S1876 | |
| Cella raschietto (25 cm) | Sarstedt | 83,1830 | |
| 24-Well piastre di coltura cellulare | BD Falcon | 353047 | |
| 150 x 20 mm piastra di coltura | Sarstedt | 83.1803.003 | |
| M-CSF | GenScript | Z02001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Siero umano AB + | Biomedical Valley | HP1022 | |
| HBSS | Bisonte | 311-505-CL | |
| Gentamicina | Sigma-Aldrich | G1397 | |
| Ipoxantina | Sigma-Aldrich | H9636 | |
| NaHCO 3 | Sigma-Aldrich | S5761 | |
| Test del sistema luciferasi | Promega | E1500 | |
| Globuli rossi umani | Ottenuto purificata da banca del sangue CHUL. |
Riferimenti
- WHO. . World Malaria Report. , (2005).
- Kublin, J. G., Patnaik, P., Jere, C. S. Effect of Plasmodium falciparum malaria on concentration of HIV-1-RNA in the blood of adults in rural Malawi: a prospective cohort study. Lancet. 365, 233-240 (2005).
- Cuadros, D. F., Branscum, A. J., Crowley, P. H. HIV-malaria co-infection: effects of malaria on the prevalence of HIV in East sub-Saharan Africa. Int. J. Epidemiol. 40, 931-939 (2011).
- Xiao, L., Owen, S. M., Rudolph, D. L., Lal, R. B., Lal, A. A. Plasmodium falciparum antigen-induced human immunodeficiency virus type 1 replication is mediated through induction of tumor necrosis factor-alpha. J. Infect. Dis. 177, 437-445 (1998).
- Froebel, K., Howard, W., Schafer, J. R. Activation by malaria antigens renders mononuclear cells susceptible to HIV infection and re-activates replication of endogenous HIV in cells from HIV-infected adults. Parasite Immunol. 26, 213-217 (2004).
- Diou, J., Tardif, M. R., Barat, C., Tremblay, M. J. Dendritic cells derived from hemozoin-loaded monocytes display a partial maturation phenotype that promotes HIV-1 trans-infection of CD4+ T cells and virus replication. J. Immunol. 184, 2899-2907 (2010).
- Diou, J., Tardif, M. R., Barat, C., Tremblay, M. J. Malaria hemozoin modulates susceptibility of immature monocyte-derived dendritic cells to HIV-1 infection by inducing a mature-like phenotype. Cell Microbiol. 12, 615-625 (2010).
- Diou, J., Gauthier, S., Tardif, M. R. Ingestion of the malaria pigment hemozoin renders human macrophages less permissive to HIV-1 infection. Virology. 395, 56-66 (2009).
- Davies, J. Q., Gordon, S. Isolation and culture of human macrophages. Methods Mol. Biol. 290, 105-116 (2005).
- Fortin, J. F., Cantin, R., Lamontagne, G., Tremblay, M. Host-derived ICAM-1 glycoproteins incorporated on human immunodeficiency virus type 1 are biologically active and enhance viral infectivity. J. Virol. 71, 3588-3596 (1997).
- Bounou, S., Leclerc, J. E., Tremblay, M. J. Presence of host ICAM-1 in laboratory and clinical strains of human immunodeficiency virus type 1 increases virus infectivity and CD4(+)-T-cell depletion in human lymphoid tissue, a major site of replication in vivo. J. Virol. 76, 1004-1014 (2002).
- Wei, X., Decker, J. M., Liu, H. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy. Antimicrob. Agents Chemother. 46, 1896-1905 (2002).
- Trager, W., Jensen, J. B. Human malaria parasites in continuous culture. Science. 193, 673-675 (1976).
- Turrini, F., Ginsburg, H., Bussolino, F., Pescarmona, G. P., Serra, M. V., Arese, P. Phagocytosis of Plasmodium falciparum-infected human red blood cells by human monocytes: involvement of immune and nonimmune determinants and dependence on parasite developmental stage. Blood. 80, 801-808 (1992).
- Akkina, R. K., Walton, R. M., Chen, M. L., Li, Q. X., Planelles, V., Chen, I. S. High-efficiency gene transfer into CD34+ cells with a human immunodeficiency virus type 1-based retroviral vector pseudotyped with vesicular stomatitis virus envelope glycoprotein G. J. Virol. 70, 2581-2585 (1996).
- Zhao, C., Papadopoulou, B., Tremblay, M. J. Leishmania infantum enhances human immunodeficiency virus type-1 replication in primary human macrophages through a complex cytokine network. Clinical Immunol. 113, 81-88 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon