Method Article
Un
Dans cet article
Résumé
Nous avons développé un In vitro Le paludisme et le VIH-1 co-infection modèle pour étudier l'impact de la Plasmodium falciparum Sur le cycle réplicatif du VIH-1 dans les primaires humaines dérivées de monocytes macrophages. Ce système polyvalent peut facilement être adapté à d'autres types de cellules primaires sensibles à l'infection VIH-1.
Résumé
Plasmodium falciparum, l'agent causal de la forme la plus mortelle du paludisme, et virus d'immunodéficience humaine de type 1 (VIH-1) sont parmi les problèmes de santé les plus importants à travers le monde, étant responsable d'un total de 4 millions de décès annuels 1. En raison de leurs chevauchement important dans les régions en développement, en particulier en Afrique subsaharienne, les co-infections avec le paludisme et le VIH-1 sont communs, mais l'interaction entre les deux maladies est mal comprise. Les rapports épidémiologiques ont suggéré que l'infection palustre augmente transitoirement la réplication du VIH-1 et augmente la charge virale VIH-1 dans les personnes co-infectées 2,3. Parce que cette virémie reste élevée pendant plusieurs semaines après le traitement par des antipaludiques, ce phénomène pourrait avoir un impact sur la progression de la maladie et la transmission.
Les mécanismes immunologiques cellulaires sous-tendent ces observations ont été étudié uniquement à peine. Les quelques études in vitro InvestigUTILISER LE impact du paludisme sur le VIH-1 ont démontré que l'exposition à antigènes solubles du paludisme peut augmenter le VIH-1 infection et de réactivation dans les cellules immunitaires. Cependant, ces études ont utilisé des extraits de cellules entières de P. falciparum stade schizonte et les cellules mononucléées du sang périphérique (PBMC), ce qui rend difficile à déchiffrer quel composant du paludisme (s) était responsable des effets observés et quelles sont les cellules hôtes cibles étaient 4,5. Des travaux récents ont démontré que l'exposition de cellules dendritiques immatures dérivées de monocytes à le pigment palustre hémozoïne augmenté leur capacité à transférer le VIH-1 à cellules T CD4 + 6,7, mais qu'il a diminué le VIH-1 infection des macrophages 8. Pour faire la lumière sur ce processus complexe, une analyse systématique des interactions entre le parasite du paludisme et le VIH-1 dans différentes populations cellulaires de l'homme pertinents primaires est extrêmement nécessaire.
Plusieurs techniques pour enquêter sur l'impact de HIV-1 sur la phagocytose des micro-organismes et l'effet de ces agents pathogènes sur le VIH-1 de réplication ont été décrits. Nous présentons ici une méthode pour étudier les effets de P. érythrocytes infectés par P. falciparum sur la réplication du VIH-1 chez l'humain primaires dérivées de monocytes macrophages. L'impact de l'exposition du parasite sur le VIH-1 transcription / traduction événements est surveillée en utilisant des virus à cycle unique pseudotypés dans lequel un gène rapporteur luciférase a remplacé le gène Env tandis que l'effet de la quantité de virus libérés par les macrophages infectés est déterminée en mesurant la VIH-1 protéine de capside p24 par ELISA dans les surnageants cellulaires.
Protocole
Remarque: Les expériences avec le VIH-1 et Plasmodium falciparum doit être effectuée dans le bon niveau de biosécurité des laboratoires (BSL2 pour les parasites, et BSL3 pour le VIH-1 et les co-infections) et des précautions particulières doivent être prises lors de l'utilisation potentiellement infectés du sang humain.
1. Les cellules mononucléaires du sang périphérique (PBMC) Purification (Basé sur 8 et 9)
- Commencez avec le sang humain frais provenant de donneurs sains (500 ml) traités par des anticoagulants (héparine, citrate, dextrose citrate acide ou citrate-phosphate-dextrose). Utilisez des endotoxines libres réactifs lors de la purification et l'isolement de PBMC et dans le reste du protocole.
- Désinfecter la poche de sang, y compris le tube, avec de l'éthanol 70%, couper le tube et transférer soigneusement le sang dans une fiole T150.
- Préparer 16 tubes avec 15 ml de milieu de séparation lymphocytes (Ficoll) pour 50 ml tube conique (assurez-vous que Ficoll a atteint la température ambiante).Ml couche soigneusement 30 de sang frais sur le dessus.
- Centrifuger à 400 xg pendant 30 min à 20 ° C avec des pauses de repos.
- Au cours de la centrifugation, préparer 8 x tubes de 50 ml coniques avec 25 ml de la solution de la température ambiante saline équilibrée de Hank (HBSS) par tube.
- Transférer avec précaution l'anneau de cellules trouble à l'interface (contient PBMC) sur le tube de 50 ml contenant du HBSS (anneaux de piscine de cellules 2 par tube). Remplissez des volumes allant jusqu'à 50 ml avec du HBSS.
- Centrifuger à 150 xg pendant 15 min à 20 ° C avec des pauses sur.
- Lors de la centrifugation de l'anneau de cellules nuageux, recueillir la couche supérieure jaune de l'étape de Ficoll, piscine le plasma pour remplir un tube conique de 50 ml. Inactiver le complément dans le plasma par chauffage du tube de 50 ml à 56 ° C pendant 30 min et faites tourner 10 min à 1800 x g. Garder le surnageant (contenant du plasma dilué autologue qui peut être utilisé comme supplément de milieu à des étapes ultérieures).
- Retirez délicatement le surnageant et resuspend le culot cellulaire de l'étape 1.7 dans 25 ml de HBSS et la piscine 2 pastilles par tube de 50 ml. Centrifuger à 300 xg pendant 8 min à 20 ° C.
- Retirez soigneusement le surnageant et remettre en suspension les pastilles dans 10 ml de HBSS et piscine dans un tube de 50 ml.
- Prélever une partie aliquote, effectuez exclusion au bleu trypan pour évaluer la mortalité et de compter des PBMC.
- Le volume complet à 50 ml avec HBSS et de spin 10 min à 300 x g. Eliminer le surnageant et remettre en suspension les cellules dans du milieu RPMI 1640 à 5x10 6 cellules / ml (on devrait obtenir environ 400 à 500 x 10 6 PBMC à partir de 500 ml de sang).
2. Les monocytes-macrophages dérivés (MDM) Différenciation (Basé sur 8 et 9)
- Graine d'environ 1,25 x 10 8 PBMC en 15 plats cm avec RPMI 1640 (25 ml / boîte).
- Laissez cellules adhèrent pendant 1-2 heures à 37 ° C avec atmosphère de CO 2 5%.
- Transfert non collée cellules dans un nouveau flacon et laver la plaque avec 15 ml deux fois par endotoxine PBS (5min, 300 xg). Les cellules ont adhéré sont des monocytes isolés.
- Pour permettre monocytes fraîchement isolés à se différencier en MDM, ajouter 20 ml de milieu RPMI 1640 supplémenté avec 5% de plasma autologue (de l'étape 1.8). Ajouter humaine recombinante du facteur stimulant colonie granulocyte macrophage (M-CSF, 25 ng / ml) et une solution de pénicilline / streptomycine (PS, 100 U / ml de pénicilline, 100 pg / ml de streptomycine). Incuber pendant 2 jours, changement de milieu et incuber 2-3 jours supplémentaires à 37 ° C dans 5% de CO 2 atmosphère.
- Retirer ancien milieu et laver avec de l'endotoxine libre PBS fois, ajouter le PBS et aspirer doucement immédiatement. À détacher MDM totalement différenciées, traiter les cellules avec ~ Accutase 7 ml (Accutase, un mélange de protéases disponible dans le commerce et de l'activité collagénolytique qui permettent le détachement des cellules de la vaisselle en plastique) pour 15-20 min à 37 ° C dans une 5% de CO 2 atmosphère, bercer doucement à mi-temps.
- Ajouter 3-5 ml de plasma autologue (de l'étape 1.8) dans chaque assiette (pour aider à protéger les cellules tout enraclage).
- Grattez délicatement les cellules en veillant à ce que le milieu recouvre les cellules à tout moment et le transfert de la piscine / dans un tube de 50 ml.
- Rincer les plaques à l'endotoxine PBS sans pour récupérer autant de cellules que possible.
- Spin 5 min à 200 xg, éliminer le surnageant.
- Resuspendre le culot dans 5 ml de milieu de culture de MDM (RPMI 1640 supplémenté avec 10% du complément inactivé sérum de veau foetal (IFBS), PS, 25 mM d'HEPES) et les cellules de comptage (MDM céder généralement 2-8% du total des PBMC). Remarque: une partie aliquote de MDM qui pourraient être prises à cette étape pour évaluer la pureté de la population de cellules par cytométrie en flux, généralement de 99% de MDM a obtenu expresse CD14.
- Seed 1x10 5 MDM dans 600 ul de milieu de culture MDM par puits dans des plaques 24 puits.
- Incuber pendant une nuit à 37 ° C dans une atmosphère de CO 2 à 5% avant infections.
3. Production et quantification du VIH-1 des stocks viraux
- Produire des stocks viraux à l'aide de transfection au phosphate de calcium dans les cellules HEK293T Folloaile du protocole de Fortin et al. 10.
- Pour obtenir des virus à cycle unique contenant le gène rapporteur de la luciférase-encodage, les cellules de co-transfecter HEK293T soit avec pg 20 de NL4.3 Luc + Env - R + et 10 pg de pHCMV-G, ou 15 pg de NL4.3 Luc + Env - R + et 15 pg de pJRFL env. Utilisez 30 pg de NL4.3 Luc + Env - R + pour générer de contrôle glycoprotéine-déficientes virus. Pour le virus réplicatif pleinement, utilisez 30 pg de NL4.3Bal env. Les vecteurs pHCMV-G et pJRFL env coder les glycoprotéines d'enveloppe du virus de la stomatite vésiculeuse (VSV-G) et d'un CXCR5-tropique VIH-1 (autre que NL4.3Bal env), respectivement. Des informations supplémentaires sur les plasmides peuvent être obtenus auprès de 8. Les plasmides peuvent être obtenus à travers la recherche des NIH sida et du programme de référence (NIAID, NIH).
- Quantifier tous les stocks viraux par ELISA pour la protéine p24 du VIH-1 capside 11, Et de vérifier leur potentiel infectieux avant de les utiliser. Nous évaluons l'infectiosité de nos stocks de virus grâce à l'utilisation de cellules indicatrices TZM-bl 12.
4. Culture des parasites Plasmodium falciparum (Basé sur 13)
4.1 Une culture générale et l'entretien des parasites
- Maintenir P. falciparum parasites 3D7 stade asexué dans les érythrocytes humains (groupe sanguin O +) à un taux d'hématocrite de 4% dans du RPMI 1640 (tamponné avec 25 mM d'HEPES et 25 mM NaHCO 3) supplémenté avec 0,5% (p / v) Albumax II, 25 pg / ml de gentamicine et hypoxanthine 370μM à 37 ° C dans un mélange gazeux d'oxygène de 1% / dioxyde de carbone de 5% dans de l'azote.
- Parasitémie peut être contrôlé en faisant un frottis mince de la culture et de la coloration avec une solution de Giemsa à 15%.
- Toujours maintenir une des cellules non infectées globules rouges (URBC) boîte de culture dans les mêmes conditions que les parasites à utiliser comme un contrôle.
Pour obtenir parasit stade tardifes (trophozoïtes / schizontes début), de synchroniser les parasites comme suit:
4,2 synchronisation Parasite
- Dans la matinée, la récolte de la culture du parasite, spin 5 min à 300 xg et jeter le surnageant.
- Resuspendre le culot dans 5 volumes de cellules remplies de 5% (p / v) D-sorbitol et incuber 5 min à 37 ° C.
- Spin 5 min à 300 x g, éliminer le surnageant, Resuspendre le culot dans 30 ml du milieu de culture et de remettre dans l'incubateur.
- Environ 8 heures plus tard, répétez les étapes 4.2.1 à 4.2.3 afin d'obtenir des parasites étroitement synchronisés. Parasites au stade tardif (trophozoïtes / schizontes début) peut alors être récoltés le lendemain matin pour effectuer l'expérience. Avant purification, effectuer la coloration de Giemsa pour confirmer étape du cycle de vie.
4.3 Plasmodium falciparum-globules rouges infectés (CISR) de purification
- Stériliser le séparateur VarioMacs (stand et aimant) avec de l'éthanol 70% et ple lacer sous la hotte biologique.
- Fixer le robinet à trois voies en bas de colonne CS.
- Coupez l'extrémité de l'aiguille de protection en plastique avec le couteau spécial et Miltenyi fixer l'aiguille vers le bas robinet.
- Verrouiller la colonne dans l'aimant avec soin.
- Retirer des bulles d'air dans la colonne par injection lente de 10 ml de milieu de culture MDM avec la seringue Kit-joint vissé sur le côté gauche du robinet d'arrêt.
- Laver la colonne avec ~ 20 ml de milieu de culture de MDM.
- Récolte RBC de la plaque de la culture, se laver une fois avec 10 ml MDM moyennes (300 xg, 5 min) et remettre en suspension le culot dans 12 RBC ml de milieu de culture de MDM. Ajouter lentement à la colonne et laisser couler la suspension à travers (seulement les globules rouges infectés contenant des parasites dans le trophozoïte ou stade schizonte seront conservés par le champ magnétique dû à la présence de cristaux hémozoïne).
- Laver une fois avec 20 ml de milieu et d'arrêter l'écoulement du liquide quand il atteint le disque blanc sur le dessus de la colonne.
- Supprimez la colonne de l'aimant et CISR éluer dans un tube propre et stérile avec 12 ml de milieu de culture de MDM.
- Étaler une aliquote de la CISR récupéré et effectuer Giemsa coloration pour confirmer étape du cycle de vie.
- Comptez récupéré CISR en utilisant un hémocytomètre (isolé RBC sont 100% CISR).
- Cellules Pellet (300 xg, 5 min), éliminer le surnageant et traiter les cellules avec 500 pi frais AB + sérum humain (14 étape opsonisation).
- Incuber pendant 30 min à 37 ° C dans un atmosphère de CO 2 5%.
- Laver une fois avec 10 ml de milieu de culture de MDM (300 x g, 5 min), et remettre en suspension CISR à la concentration souhaitée. Habituellement, une parasitémie 10% 15 cm boîte de culture donne à peu près ~ 0,5 1x10 8 CISR étroitement synchronisés.
5. L'exposition de MDM à Plasmodium falciparum
- Pour exposer la MDM à URBC ou CISR, les cellules doivent être remises en suspension dans un milieu de culture de MDM pour obtenir un ratio de URBC / CISR: MDM de 75:1. En précédemmentpréparés plaques à 24 puits contenant MDM, ajouter de volume appropriée en suspension RBC dans chaque puits. Effectuez toutes les expériences, en trois exemplaires.
- Incuber les co-cultures pendant 4 heures à 37 ° C dans un atmosphère de CO 2 5%.
- Laver les cellules avec 600 ul de PBS sans endotoxine 3 fois, ajouter le PBS et aspirer doucement immédiatement.
- Pour lyser le reste RBC, laver les puits par addition de 200 ul de l'eau glacée stérile pendant 20 sec et aspirer.
- Ajouter 600 ul de la culture moyenne MDM et incuber 24 h à 37 ° C dans un atmosphère de CO 2 5%.
6. L'infection de MDM avec un réplicative entièrement le VIH-1
- Afin d'évaluer l'effet de P. falciparum sur le VIH-1 dans la réplication MDM, ajouter, selon le schéma présenté dans la figure 1A, 10 ng de p24 (dans 300 pi de MDM médias) de virus env NL4.3Bal dans le puits approprié; ajouter seulement à moyen MDM dans le contrôle des puits .
- Incuber 2 heures à 37 ° C dans un 5% Atmosphère de CO 2.
- Laver les cellules avec l'endotoxine PBS sans 3 fois, ajouter le PBS et aspirer doucement immédiatement. Ajouter 600 ul de milieu de MDM frais par puits.
- Incuber à 37 ° C dans un atmosphère de CO 2 5%.
- Aux jours 3, 6, 9 et 12 après le début de l'infection virale, la récolte 200 pi de chaque surnageant, l'ajout de 200 ul de milieu de MDM frais par la suite. Gardez les surnageants récoltés à -20 ° C pour la quantification de l'épidémie majeure de VIH-1 protéine p24 de capside par la méthode ELISA à la suite Fortin et al. 10.
7. L'infection de MDM avec la luciférase cycle d'encodage unique Virus
- Afin de déterminer l'impact du parasite sur le VIH-1 dans l'expression des gènes MDM, ajouter, selon le schéma indiqué dans la figure 1B, 10 ng p24 (dans 300 l de milieu MDM) de l'une NL4.3 Luc + Env - R + ( VSV-G), NL4.3 Luc + Env - R + (JRFL env) ou NL4.3 Luc +Env - R + virus dans les puits correspondants.
- Incuber 2 heures à 37 ° C dans un atmosphère de CO 2 5%.
- Laver les cellules avec 600 ul de PBS sans endotoxine 3 fois, ajouter le PBS et aspirer doucement immédiatement. Ajouter 600 ul de milieu de MDM frais par puits.
- Incuber à 37 ° C dans un atmosphère de CO 2 5%.
- Retirez le support 72 h infection suivant et ajouter 200 ul de tampon de lyse 1X (fourni avec le kit de dosage de luciférase). Laissez-la lyse des cellules à la température ambiante sous agitation douce. Conserver à -20 ° C.
- Décongeler la plaque et transférer 40 ul du lysat sur une plaque de 96 puits luminomètre, ajouter 100 ul de substrat luciférase (fourni avec le kit de dosage de luciférase) et de mesurer la luciférase (la luciférase de luciole) activité dans un luminomètre en suivant les instructions du fabricant.
8. Les résultats représentatifs
Grâce à notre modèle de co-infection, nous montrons que exposure de P. falciparum à la MDM diminue leur susceptibilité au VIH-1 infection. En effet, une diminution significative (p <0,05; 2 voies ANOVA, jour 12) à la libération de particules virales, telles que mesurées par le VIH-1 protéine de capside p24 dans le surnageant, on observe dans MDM prétraité par des parasites (figure 2A). Cette observation est confirmée dans les cellules infectées par des virus codant pour un gène de la luciférase-reporter. L'infection par des virus tels MDM hébergeant soit exogène VSV-G ou du VIH-1 glycoprotéines conduit à de façon significative (p <0,05, t de Student-test) de production moins la luciférase dans des cellules exposées à P. falciparum (figure 2B). Il est à noter que le VSV-G-pseudotypés virus a donné beaucoup plus d'activité luciférase que leurs homologues JRFLenv; cela est dû à l'efficacité plus grande infection de VSV-G particules pseudotypés 15. Compte tenu de ce parasite exposé aux impacts MDM deux types de virus, ce qui suggère qu'il influe sur certaines étapes dans l'ex gène viralpression (figure 2B). Il est également important de mentionner que la viabilité des cellules n'a pas été affectée par MDM exposition à CISR (données non présentées), ce qui indique que l'inhibition observée est spécifique et non en raison de la mortalité cellulaire.
Figure 1. Régime la planche A) pour une infection par un virus MDM réplicative pleinement Mock:. Cellules non infectées. URBC: des cellules exposées à des globules rouges non infectées. CISR: des cellules exposées à Plasmodium falciparum globules rouges infectés. Bal: les cellules infectées par NL4.3Bal env Bal / URBC:. Les cellules exposées à URBC et infectés par le NL4.3Bal env Bal / CISR:.. Régime Plate cellules exposées à des CISR et infectées avec NL4.3Bal env B) pour l'infection avec MDM seul cycle luciférase-encodage virus Mock:. cellules non infectées. URBC: des cellules exposées à des globules rouges non infectées. CISR: les cellules exposées à Plasmodium falciparum-infected globules rouges. Δenv: les cellules infectées par NL4.3 Luc + Env - R + JRFL:. Les cellules infectées par NL4.3 Luc + Env - R + (JRFL env). VSV-G: les cellules infectées par NL4.3 Luc + Env - R + (VSV-G) Δenv / URBC:.. cellules exposées à URBC et infectés par le NL4.3 Luc + Env-R + Δenv / CISR: cellules exposées à CISR et infectées par le NL4.3 Luc + Env - R + JRFL / URBC: les cellules exposées à URBC et infectés par le NL4.3 Luc + Env - R + (JRFL env).. JRFL / CISR: les cellules exposées à CISR et infectés par le NL4.3 Luc + Env - R + (JRFL env). vsv-g/uRBC: les cellules exposées à URBC et infectés par le NL4.3 Luc + Env - R + (VSV-G): vsv-g/iRBC. les cellules exposées à CISR et infectés par le NL4.3 Luc + Env - R + (VSV-G).
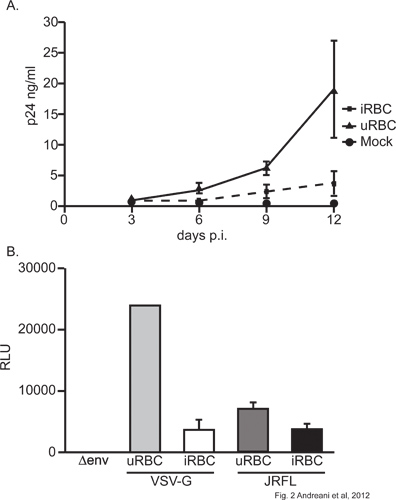
Figure 2. . A) Effet de Plasmodium falciparum sur le VIH-1 production virale dans les MDM MDM ont été exposés à URBC ou CISR à un rapport (URBC / CISR 75:1: MDM) pendant 4 heures et abondamment lavé. Les cellules ont été infectées par le 10ng de p24 NL4.3Bal pendant 2 heures env. La production virale a été contrôlée par la méthode ELISA pour le VIH-1 p24 dans une cellule sans surnageant à différents moments après l'infection virale initiale. Une expérience représentative est montré B) Effet de Plasmodium falciparum sur le VIH-1 dans la transcription virale MDM MDM ont été infectés par le URBC ou CISR à un rapport (URBC / CISR 75:1:.. MDM). Les cellules ont ensuite été infectées avec 10 ng de p24 du virus de cycle unique (soit NL4.3 Luc + Env - R +, NL4.3 Luc + Env - R + (JRFL env) ou NL4.3 Luc + Env - R + (VSV- g)). Expression de la luciférase a été évaluée dans des lysats cellulaires 72 h après l'infection initiale du virus. Une expérience représentative est montrée.
Discussion
Nous avons illustré ici deux approches différentes pour analyser l'impact du parasite du paludisme sur le VIH-1 cycle viral, c'est à dire en analysant soit l'expression du gène viral ou la production de virus et la réplication dans la descendance des monocytes-macrophages dérivés. Des approches similaires ont été utilisés pour d'autres le VIH-1-parasite co-infections 16. Toutefois, ces nouvelles données sont un pas en avant dans l'enquête sur le paludisme et le VIH-1 co-infections. . En effet, Diou et al 8 ont étudié l'effet de l'hémozoïne, les parasites vivent pas, sur le VIH-1 de réplication, en accord avec nos résultats, ils ont observé que l'hemozoin était elle-même suffisante pour inhiber la production virale par MDM, et non MDM.
Utilisation de la mise en page décrit expérimentale, nous avons observé que P. falciparum exerce un effet néfaste sur la claire du cycle réplicatif du VIH-1 dans les macrophages: une inhibition significative de la production virale est observée dans les macrophages pré-exposés aux parasites (Figure 2A) et un impact spécifique du parasite sur la transcription virale est illustré dans la figure 2B. Cependant, nous ne pouvons pas laisser de côté les effets additionnels du parasite sur l'entrée du virus ou de fusion (décapsidation), ou sur la post-intégration des mécanismes, tels que la synthèse des protéines ou l'assemblage et le bourgeonnement de particules virales. En outre, il est possible que un impact différent sur le VIH-1 de réplication qui serait obtenu si le parasite ont été ajoutés, soit au moment même ou d'une infection MDM suivante avec le virus.
Notre in vitro la co-infection modèle fournit un outil puissant pour effectuer des enquêtes approfondies de VIH-1 / P. interactions falciparum dans la cellule hôte. Par exemple, la combinaison de ce dispositif expérimental avec d'autres techniques telles que quantitative PCR en temps réel, ce qui permet de cibler et de quantifier des mesures spécifiques dans rétrotranscription virale et l'intégration du génome viral dans le génome cellule hôte, sont tout à fait faisable et devrait apporter d'autres INSISMTG dans les mécanismes impliqués dans les co-infections. Par ailleurs, des essais spécifiques pour évaluer les étapes précoces du cycle viral (virus de fusion, la quantification d'entrée décapsidation,) peut être appliquée à ce protocole de base pour analyser plus en détail l'effet sur la réplication virale. Ces modifications montrent la souplesse de ce protocole est sur le VIH-1 quantification et de détection: en effet, même standards du VIH-1 inverse tests de quantification de la transcriptase utilisant marqué au tritium nucléotides pourrait éventuellement remplacer le test ELISA pour le VIH-1 p24. En plus de MDM, nous nous attendons à notre système pour être adaptable à d'autres types cellulaires pertinents pour le VIH-1-paludisme interactions, telles que les monocytes et les cellules dendritiques. Le fait que MDM sont des cellules adhérentes facilite leur manipulation, ce qui facilite le lavage de CISR qui n'ont pas été prises, ou qui sont en contact avec MDM, sans pour autant éliminer les macrophages. Un tel avantage ne s'applique pas aux cellules dendritiques et les monocytes, qui sont cultivées en suspension, ce qui complique la soiparation de la CISR URBC et libre avec de telles cellules et nous sommes en train de traiter cette question. Notre système pourrait également être utile pour étudier les interactions plus complexes tels que les effets de Plasmodium-exposés dérivées de monocytes des cellules sur le cycle viral du VIH-1 dans d'autres cellules immunitaires telles que CD4-positifs dans les lymphocytes T de co-culture des expériences. Enfin, notre protocole pourrait être adaptée pour des expériences qui cherchent à l'effet de P. iRBCs falciparum sur le VIH-1 dans la réactivation des PBMC pour le VIH-1 des individus infectés.
Déclaration d'éthique
Human PBMC ont été obtenues à partir du sang de donneurs sains, conformément aux directives du Comité de bioéthique du Centre Hospitalier de l'Université Centre de recherche de Laval. Un consentement écrit a été obtenu à partir de tous les donneurs de sang.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par les Instituts canadiens de recherche en santé à travers un catalyseur Co-infections et des co-morbidités de subvention. Érythrocytes humains ont été fournies par le Centre Hospitalier de l'Université de banque de sang à Laval.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| RPMI 1640 | Multicell | 350-000-CL | |
| PBS-endotoxines | Sigma | D8662 | |
| FBS | Wisent | 080-150 | Inactivé par la chaleur à 56 ° C pendant 30 min |
| Accutase | eBiosciences | 00-4555-56 | |
| Albumax II | Gibco | 11021-037 | Dissous dans du RPMI 1640, stérilisée par filtration |
| Milieu de séparation des lymphocytes | Multicell | 305-010-CL | |
| Plaques blanches luminomètre | Promega | Z3291 | |
| CS séparation Mac columms | Miltenyi Biotech | 130-041-305 | |
| Séparateur VarioMacs | Miltenyi Biotech | 130-090-282 | |
| Pénicilline / streptomycine solution | Wisent | 450-201-EL | |
| D-sorbitol | Sigma-Aldrich | S1876 | |
| Grattoir à cellules (25 cm) | Sarstedt | 83.1830 | |
| Plaques à 24 puits de culture cellulaire | BD Falcon | 353047 | |
| 150 x 20 mm boîte de culture | Sarstedt | 83.1803.003 | |
| M-CSF | GenScript | Z02001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Sérum humain AB + | Vallée biomédicale | HP1022 | |
| HBSS | Wisent | 311-505-CL | |
| La gentamicine | Sigma-Aldrich | G1397 | |
| Hypoxanthine | Sigma-Aldrich | H9636 | |
| NaHCO 3 | Sigma-Aldrich | S5761 | |
| Luciferase Assay System | Promega | E1500 | |
| Des globules rouges humains | Obtenu purifiée à partir de la banque de sang du CHUL. |
Références
- WHO. . World Malaria Report. , (2005).
- Kublin, J. G., Patnaik, P., Jere, C. S. Effect of Plasmodium falciparum malaria on concentration of HIV-1-RNA in the blood of adults in rural Malawi: a prospective cohort study. Lancet. 365, 233-240 (2005).
- Cuadros, D. F., Branscum, A. J., Crowley, P. H. HIV-malaria co-infection: effects of malaria on the prevalence of HIV in East sub-Saharan Africa. Int. J. Epidemiol. 40, 931-939 (2011).
- Xiao, L., Owen, S. M., Rudolph, D. L., Lal, R. B., Lal, A. A. Plasmodium falciparum antigen-induced human immunodeficiency virus type 1 replication is mediated through induction of tumor necrosis factor-alpha. J. Infect. Dis. 177, 437-445 (1998).
- Froebel, K., Howard, W., Schafer, J. R. Activation by malaria antigens renders mononuclear cells susceptible to HIV infection and re-activates replication of endogenous HIV in cells from HIV-infected adults. Parasite Immunol. 26, 213-217 (2004).
- Diou, J., Tardif, M. R., Barat, C., Tremblay, M. J. Dendritic cells derived from hemozoin-loaded monocytes display a partial maturation phenotype that promotes HIV-1 trans-infection of CD4+ T cells and virus replication. J. Immunol. 184, 2899-2907 (2010).
- Diou, J., Tardif, M. R., Barat, C., Tremblay, M. J. Malaria hemozoin modulates susceptibility of immature monocyte-derived dendritic cells to HIV-1 infection by inducing a mature-like phenotype. Cell Microbiol. 12, 615-625 (2010).
- Diou, J., Gauthier, S., Tardif, M. R. Ingestion of the malaria pigment hemozoin renders human macrophages less permissive to HIV-1 infection. Virology. 395, 56-66 (2009).
- Davies, J. Q., Gordon, S. Isolation and culture of human macrophages. Methods Mol. Biol. 290, 105-116 (2005).
- Fortin, J. F., Cantin, R., Lamontagne, G., Tremblay, M. Host-derived ICAM-1 glycoproteins incorporated on human immunodeficiency virus type 1 are biologically active and enhance viral infectivity. J. Virol. 71, 3588-3596 (1997).
- Bounou, S., Leclerc, J. E., Tremblay, M. J. Presence of host ICAM-1 in laboratory and clinical strains of human immunodeficiency virus type 1 increases virus infectivity and CD4(+)-T-cell depletion in human lymphoid tissue, a major site of replication in vivo. J. Virol. 76, 1004-1014 (2002).
- Wei, X., Decker, J. M., Liu, H. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy. Antimicrob. Agents Chemother. 46, 1896-1905 (2002).
- Trager, W., Jensen, J. B. Human malaria parasites in continuous culture. Science. 193, 673-675 (1976).
- Turrini, F., Ginsburg, H., Bussolino, F., Pescarmona, G. P., Serra, M. V., Arese, P. Phagocytosis of Plasmodium falciparum-infected human red blood cells by human monocytes: involvement of immune and nonimmune determinants and dependence on parasite developmental stage. Blood. 80, 801-808 (1992).
- Akkina, R. K., Walton, R. M., Chen, M. L., Li, Q. X., Planelles, V., Chen, I. S. High-efficiency gene transfer into CD34+ cells with a human immunodeficiency virus type 1-based retroviral vector pseudotyped with vesicular stomatitis virus envelope glycoprotein G. J. Virol. 70, 2581-2585 (1996).
- Zhao, C., Papadopoulou, B., Tremblay, M. J. Leishmania infantum enhances human immunodeficiency virus type-1 replication in primary human macrophages through a complex cytokine network. Clinical Immunol. 113, 81-88 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon