Method Article
Ein
In diesem Artikel
Zusammenfassung
Wir haben ein entwickelten In-vitro- Malaria-HIV-1-Co-Infektion Modell, um die Auswirkungen zu studieren Plasmodium falciparum Auf der HIV-1-Replikationszyklus in primären menschlichen Monozyten abgeleiteten Makrophagen. Dieses vielseitige System kann leicht an andere primäre Zelltypen anfällig für HIV-1 Infektion angepasst werden.
Zusammenfassung
Plasmodium falciparum, dem Erreger der tödlichsten Form von Malaria, und Human Immunodeficiency Virus Typ-1 (HIV-1) gehören zu den wichtigsten Gesundheitsprobleme weltweit, verantwortlich für insgesamt 4 Millionen Todesfälle pro Jahr ein. Durch ihre weitgehende Überschneidungen bei der Entwicklung von Regionen, insbesondere Afrika südlich der Sahara, Co-Infektionen mit Malaria und HIV-1 sind häufig, aber das Zusammenspiel zwischen den beiden Krankheiten ist bisher wenig bekannt. Epidemiologische Berichte lassen vermuten, dass Malaria-Infektion vorübergehend erhöht HIV-1-Replikation und erhöht die HIV-1-Viruslast bei co-infizierten Individuen 2,3. Da diese Virämie bleibt hoch für einige Wochen nach der Behandlung mit Malariamittel, könnte dieses Phänomen einen Einfluss auf den Krankheitsverlauf und Übertragung.
Die zellulären immunologischen Mechanismen hinter diesen Beobachtungen wurden nur kaum untersucht. Die wenigen in-vitro-Studien InvestigBetrieb dieses Auswirkungen von Malaria auf HIV-1 haben gezeigt, dass die Exposition gegenüber löslichen Malaria-Antigene HIV-1 Infektion und Reaktivierung in Immunzellen zu erhöhen. Jedoch verwendet diese Studien Ganzzellextrakten von P. falciparum-Parasiten Schizonten und peripheren mononukleären Blutzellen (PBMC), so dass es schwer zu entziffern, welche Malaria-Komponente (n) verantwortlich für die beobachteten Effekte und was die Ziel-Host-Zellen waren 4,5 war. Neuere Arbeiten haben gezeigt, dass die Exposition von unreifen Monozyten abgeleitete dendritische Zellen der Malaria Pigment Hämozoin ihre Fähigkeit, HIV-1 an CD4 + T-Zellen 6,7 ausbreitet, sondern dass sie HIV-1 Infektion von Makrophagen 8 reduziert. Um Licht in dieses komplexen Prozesses, eine systematische Analyse der Wechselwirkungen zwischen dem Malariaparasiten und HIV-1 in verschiedenen relevanten primären humanen Zellpopulationen vergossen wird dringend benötigt.
Verschiedene Techniken zur Untersuchung der Auswirkungen von HIV-1 auf die Phagozytose von Mikroorganismen und deren Wirkung auf Krankheitserreger HIV-1-Replikation sind beschrieben worden. Wir stellen hier eine Methode, um die Auswirkungen zu untersuchen P. falciparum-infizierten Erythrozyten auf die Replikation von HIV-1 in humanen primären Monozyten abgeleiteten Makrophagen. Die Auswirkungen der Parasitenexposition auf HIV-1 transkriptionalen / translationalen Ereignisse mit einzelnen Zyklus pseudotypisierte Viren, in dem ein Luciferase-Reportergen das Env-Gen ersetzt wurde überwacht, während der Effekt auf die Menge des Virus von der infizierten Makrophagen durch Messen der bestimmt wird, HIV-1 Capsid-Protein p24 mittels ELISA in Zellüberständen.
Protokoll
Hinweis: Experimente mit HIV-1 und Plasmodium falciparum ist in der Ausführung Biosicherheitsstufe Laboratorien durchgeführt werden (BSL2 für Parasiten und BSL3 für HIV-1 und Co-Infektionen) und besondere Vorsicht walten, wenn Sie möglicherweise infizierten menschlichen Blutes werden.
1. Periphere Blut-mononukleäre Zellen (PBMC) Reinigung (Basierend auf 8 und 9)
- Starten Sie mit frischem menschlichem Blut von gesunden Spendern (500 ml) mit Antikoagulanzien (Heparin, Citrat, saures Citrat Dextrose oder Citrat-Phosphat-Dextrose) behandelt. Verwendung Endotoxin-freie Reagenzien bei der Reinigung und Isolierung PBMC und in den Rest des Protokolls.
- Desinfizieren Sie die Blutbeutel, einschließlich der Röhre, mit 70% Ethanol, die Leitung zu übertragen und sorgfältig das Blut in einen Kolben T150.
- Bereiten 16 Röhrchen mit 15 ml Lymphozyten Trennmedium (Ficoll) pro 50 ml konischen Röhrchen (stellen Sie sicher, dass Ficoll Raumtemperatur erreicht hat).Vorsichtig 30 ml frisches Blut an der Spitze.
- Zentrifuge bei 400 xg für 30 min bei 20 ° C mit Pausen ab.
- Während der Zentrifugation, bereiten 8 x 50 ml konische Röhrchen mit 25 ml Balanced Salt Raumtemperatur Hank-Lösung (HBSS) pro Röhrchen.
- Sorgfältig überweisen Sie den Ring bewölkt Zelle an der Schnittstelle (enthält PBMC) auf die 50 ml Röhrchen mit dem HBSS (Pool 2 Zelle Ringen pro Röhre). Komplette Jahrgänge bis zu 50 ml mit HBSS.
- Zentrifuge bei 150 xg für 15 min bei 20 ° C mit Pausen auf.
- Während des Laufs des wolkigen Zelle Ring, sammeln Sie die gelbe obere Schicht aus dem Ficoll Schritt, die Plasma-Pool zu füllen, ein 50 ml konischen Röhrchen. Inaktivieren ergänzen im Plasma durch Erhitzen des 50 ml-Röhrchen bei 56 ° C für 30 min und 10 min zu drehen, bei 1.800 × g. Halten Sie den Überstand (enthält verdünnt autologem Plasma, das als Medium Zuschlag bei späteren Schritten verwendet werden können).
- Entfernen Sie vorsichtig den Überstand und resuspend das Zellpellet aus Schritt 1.7 in 25 ml HBSS und Pool 2 Pellets pro 50 ml Tube. Zentrifugieren bei 300 × g für 8 Minuten bei 20 ° C
- Entfernen Sie den Überstand vorsichtig und Sediment resuspendieren in 10 ml HBSS und Pool in einer 50 ml Tube.
- Man entnimmt einen aliquoten, führen Trypanblau-Ausschluss, um die Sterblichkeit zu bewerten und dann zählen PBMC.
- Komplette Volumen von 50 ml mit HBSS und Spin 10 min bei 300 x g. Entfernen Sie den Überstand und die Zellen in RPMI 1640 auf 5x10 6 Zellen / ml (sollte man rund 400 bis 500 x 10 6 PBMC von 500 ml Blut zu erhalten).
2. Monozyten-abgeleiteten Makrophagen (MDM) Differenzierung (Basierend auf 8 und 9)
- Seed etwa 1,25 x 10 8 PBMC in 15 cm Schalen mit RPMI 1640 (25 ml / Schale).
- Lassen Zellen für 1-2 Stunden halten bei 37 ° C mit 5% CO 2 Atmosphäre.
- Übertragen Sie nicht anhaftenden Zellen in einem neuen Kolben und waschen Teller mit 15 ml Endotoxin-freiem PBS zweimal (5min, 300 xg). Die anhaftenden Zellen isolierten Monozyten sind.
- Damit frisch isolierten Monozyten in MDM unterscheiden, mit 20 ml RPMI 1640-Medium mit 5% autologem Plasma (aus Schritt 1.8) ergänzt. In humanen rekombinanten Makrophagen-Kolonie stimulierender Faktor (M-CSF, 25 ng / ml) und Penicillin / Streptomycin-Lösung (PS, 100 U / ml Penicillin, 100 ug / ml Streptomycin). Inkubieren Sie für 2 Tage, ändern Medium und Inkubation 2-3 zusätzliche Tage bei 37 ° C in 5% CO 2-Atmosphäre.
- Entfernen Sie alte Medium waschen und mit Endotoxin-freiem PBS einmal, fügen Sie den PBS sanft und sofort absaugen. Um vollständig differenziert MDM lösen, zu behandeln Zellen mit ~ 7 ml Accutase (Accutase, ein im Handel erhältliches Gemisch aus Proteasen und kollagenolytische Aktivität, die die Ablösung von Zellen von der Kunststoff-Schale zu ermöglichen) für 15-20 min bei 37 ° C in einem 5% CO 2-Atmosphäre, schaukeln in der Mitte der Zeit.
- Fügen Sie 3-5 ml autologem Plasma (aus Schritt 1.8) in jeder Platte (zum Schutz der Zellen währendKratzen).
- Vorsichtig kratzen Zellen dafür sorgen, dass mittelfristig die Zellen zu allen Zeiten und Transfer / Pool in einer 50 ml Tube deckt.
- Spülen Sie Platten mit Endotoxin-freiem PBS, um so viele Zellen wie möglich zu erholen.
- Spin 5 min bei 200 xg, Überstand verwerfen.
- Pellet in 5 ml MDM Kulturmedium (RPMI 1640, ergänzt mit 10% Komplement-inaktiviertem fötalem Rinderserum (IFB), PS, 25 mM HEPES) und Zählen von Zellen (MDM liefern in der Regel 2-8% des gesamten PBMC). Hinweis: ein Aliquot von MDM kann in diesem Schritt getroffen werden, um Zellpopulation Reinheit mittels Durchflusszytometrie zu beurteilen, in der Regel 99% der MDM Express CD14 erhalten.
- Seed 1x10 5 MDM in 600 ul MDM Kulturmedium pro Well in 24-Well-Platten.
- Inkubieren über Nacht bei 37 ° C in einem 5% CO 2-Atmosphäre vor Infektionen.
3. Produktion und die Quantifizierung von HIV-1 viralen Stammlösungen
- Produzieren Sie viralen Bestände mit Calciumphosphat-Transfektion in HEK293T Zellen FolloFlügel das Protokoll von Fortin et al. 10.
- R + und 10 ug pHCMV-G, oder 15 ug NL4.3 Luc - Um Single-Cycle-Viren, die das Luciferase-Reporter-Gen kodiert, Co-Transfektion HEK293T Zellen mit entweder 20 ug NL4.3 Luc + Env erhalten + Env - R + und 15 ug pJRFL env. Verwenden Sie 30 ug NL4.3 Luc + Env - R +, um die Kontrolle Glykoprotein-defizienten Viren zu generieren. Für die voll replizierende Viren, verwenden 30 ug NL4.3Bal env. Die Vektoren pHCMV-G und pJRFL env kodieren die Hüllproteine des Virus der vesikulären Stomatitis (VSV-G) und einer CXCR5-tropen HIV-1 (anders als NL4.3Bal env) sind. Zusätzliche Informationen über die Plasmide können aus 8 erhalten werden. Plasmide können durch das NIH AIDS Research and Reference Program (NIAID, NIH) erhalten werden.
- Quantifizierung aller viralen Stammlösungen unter Verwendung eines ELISA für die HIV-1 p24 Capsid Protein 11, Und überprüfen Sie ihre infektiösen Potential vor dem Gebrauch. Wir beurteilen die Infektiosität des Virus unsere Bestände durch den Einsatz von TZM-bl-Indikator Zellen 12.
4. Kultur des Parasiten Plasmodium falciparum (Basierend auf 13)
4.1 Allgemeine Kultur und Pflege von Parasiten
- Pflegen P. falciparum 3D7 asexuellen Parasiten in menschlichen Erythrozyten (Blutgruppe O +) in einem 4% Hämatokrit in RPMI 1640 (gepuffert mit 25 mM HEPES und 25 mM NaHCO 3) mit 0,5% (w / v) Albumax II, 25 ug / ml Gentamicin ergänzt und 370μM Hypoxanthin bei 37 ° C in einem Gasgemisch von 1% Sauerstoff / 5% Kohlendioxid in Stickstoff.
- Parasitämie kann, indem eine dünne Schicht der Kultur und der Färbung mit einer 15% Giemsa-Lösung überwacht werden.
- Halten Sie immer eine nicht infizierte rote Blutkörperchen (uRBC) Kulturschale in den gleichen Bedingungen wie Parasiten als Kontrolle nutzen zu können.
Zur späten Stadium parasit erhaltenES (Trophozoiten / frühen Schizonten), synchronisieren Sie die Parasiten wie folgt:
4,2 Parasite Synchronisation
- Am Morgen ernten, den Parasiten Kultur, Spin 5 min bei 300 xg und den Überstand verwerfen.
- Pellet in 5 Hämatokritwerte mit 5% (w / v) D-Sorbit und inkubieren 5 min bei 37 ° C
- Spin 5 min bei 300 x g, Überstand verwerfen, Pellet in 30 ml Kulturmedium und wieder im Inkubator.
- Etwa 8 Stunden später, wiederholen Sie die Schritte 4.2.1 bis 4.2.3, um eng synchronisierte Parasiten zu erhalten. Spätstadium Parasiten (Trophozoiten / frühen Schizonten) kann dann am nächsten Morgen geerntet werden, um das Experiment durchzuführen. Vor der Reinigung durchführen Giemsa-Färbung hin zum Lifecycle der Bühne zu bestätigen.
4,3 Plasmodium falciparum-infizierten roten Blutkörperchen (iRBC) Reinigung
- Sterilisieren Sie den VarioMacs Separator (Ständer und Magnet) mit 70% Ethanol und pschnüren sie unter dem biologischen Kapuze.
- Befestigen Sie den Dreiwegehahn auf CS Sumpf.
- Schneiden Sie das Ende der Nadel Kunststoff-Protektor mit der Miltenyi spezielle Fräser und befestigen Sie die Nadel, um den Hahn unten.
- Verriegeln Sie die Säule in den Magneten vorsichtig.
- Entfernen aller Luftblasen in der Säule durch Einspritzen langsam 10 ml Kulturmedium MDM mit dem Kit beiliegenden-Spritze auf der linken Seite des Absperrventils verschraubt.
- Waschkolonne mit ~ 20 ml Kulturmedium MDM.
- Ernte RBC von der Kulturplatte, einmal Waschen mit 10 ml MDM Medium (300 × g, 5 min) und resuspendieren RBC Pellet in 12 ml Kulturmedium MDM. Langsam bis Spalte hinzugefügt und die Suspension Strömung durch (nur infizierte rote Blutkörperchen, die mit Parasiten im Trophozoit oder Schizonten Phase wird durch das Magnetfeld aufgrund des Vorhandenseins des Hämozoins Kristalle beibehalten werden).
- Waschen einmal mit 20 ml Medium und Anschlag Flüssigkeitsflusses, wenn sie die weiße Scheibe auf der Kolonne erreicht.
- Entfernen Sie die Säule aus dem Magneten und eluieren iRBC in einem sauberen sterilen Röhrchen mit 12 ml MDM Kulturmedium.
- Abstrich wurde ein Aliquot der iRBC erholt und führen Giemsa-Färbung hin zum Lifecycle der Bühne zu bestätigen.
- Zählen Sie erholte iRBC unter Verwendung eines Hämocytometers (isolierte RBC sind 100% iRBC).
- Pellet-Zellen (300 xg, 5 min), Überstand verwerfen und zu behandeln Zellen mit 500 ul frisch AB + Humanserum (Opsonisierung Schritt 14).
- Inkubieren für 30 min bei 37 ° C in einem 5% CO 2 Atmosphäre.
- Waschen einmal mit 10 ml Kulturmedium MDM (300 × g, 5 min), und resuspendieren iRBC auf die gewünschte Konzentration. Gewöhnlich wird eine 10% Parasitämie 15 cm Kulturschale etwa hast ~ 0,5-1x10 8 dicht synchronisiert iRBC.
5. Die Exposition von MDM zu Plasmodium falciparum
- Um die MDM uRBC oder iRBC machen, müssen Zellen in Kulturmedium resuspendiert MDM werden, um ein Verhältnis von uRBC / iRBC zu erhalten: MDM von 75:1. In den bishervorbereitete 24-Well-Platten, die MDM, fügen Sie entsprechende Volumen RBC-Suspension in jede Vertiefung. Führen Sie alle Experimente in dreifacher Ausfertigung.
- Inkubieren Co-Kulturen für 4 Stunden bei 37 ° C in einem 5% CO 2 Atmosphäre.
- Waschen Sie die Zellen mit 600 ul Endotoxin-freiem PBS 3 mal, fügen Sie den PBS sanft und sofort absaugen.
- Um die verbleibende RBC lysieren, waschen Sie die Wells durch Zugabe von 200 ul eiskaltem sterilem Wasser für 20 Sekunden und absaugen.
- Fügen Sie 600 ul MDM Kulturmedium und inkubieren Sie 24 Stunden bei 37 ° C in einer 5% igen CO 2-Atmosphäre.
6. Die Infektion von MDM mit einem voll replikative HIV-1
- Um zu beurteilen, die Wirkung von P. falciparum auf HIV-1-Replikation in MDM, zu ergänzen, nach dem Schema in Abbildung 1a, 10 ng p24 (in 300 ul MDM Medien) von NL4.3Bal env Viren in die entsprechenden Vertiefungen skizziert; fügen Sie nur MDM Medium in Kontrollvertiefungen .
- Inkubieren 2 Stunden bei 37 ° C in einer 5% CO 2-Atmosphäre.
- Waschen Sie die Zellen mit Endotoxin-freiem PBS 3 mal, fügen Sie den PBS sanft und sofort absaugen. In 600 ml frisches MDM Medium pro Vertiefung.
- Bei 37 ° C in einem 5% CO 2 Atmosphäre.
- An den Tagen 3, 6, 9 und 12 nach der Start der viralen Infektion, Ernte 200 ul von jedem Überstand, Zugabe von 200 ml frisches Medium MDM danach. Halten die Überstände geerntet bei -20 ° C für die Quantifizierung der großen HIV-1-Kapsid-Protein p24 durch ELISA nach Fortin et al. 10.
7. Die Infektion von MDM mit Single-Cycle-Virus Luciferase
- Um des Parasiten Auswirkungen auf HIV-1-Genexpression in MDM bestimmen, zu ergänzen, nach dem Schema in Abbildung 1B dargestellt, 10 ng p24 (in 300 ul Medium MDM) von entweder NL4.3 Luc + Env - R + ( VSV-G), NL4.3 Luc + Env - R + (JRFL env) oder NL4.3 Luc +Env - R + Viren in die entsprechenden Vertiefungen.
- Inkubieren 2 Stunden bei 37 ° C in einem 5% CO 2 Atmosphäre.
- Waschen Sie die Zellen mit 600 ul Endotoxin-freiem PBS 3 mal, fügen Sie den PBS sanft und sofort absaugen. In 600 ml frisches MDM Medium pro Vertiefung.
- Bei 37 ° C in einem 5% CO 2 Atmosphäre.
- Entfernen Sie das Medium 72 Stunden nach der Infektion und mit 200 &mgr; l Lysepuffer 1X (im Lieferumfang des Luciferase-Assay-Kit). Lassen Sie die Zellen bei Raumtemperatur unter leichtem Schütteln lysieren. Lagerung bei -20 ° C.
- Tauen Sie die Platte übertragen und 40 mu l des Lysats auf einer 96-Well Platte Luminometer, fügen Sie 100 ul Luciferase-Substrat (im Lieferumfang des Luciferase-Assay-Kit) und messen Sie die Luciferase (Firefly Luciferase)-Aktivität in einem Luminometer nach den Anweisungen des Herstellers.
8. Repräsentative Ergebnisse
Mit unserem Co-Infektion Modell zeigen wir, dass exposure von P. falciparum zu MDM senkt ihre Anfälligkeit für HIV-1 Infektion. Tatsächlich wurde eine signifikante Abnahme (p <0,05, 2 ANOVA, Tag 12) in der Freigabestellung der viralen Partikel, wie durch HIV-1 p24 Capsid-Protein im Überstand gemessen, in MDM vorbehandelt mit Parasiten (2A) beobachtet. Diese Beobachtung wird in den Zellen durch Viren, die für eine Luciferase-Reportergen infiziert bestätigt. MDM Infektion mit solchen Viren beherbergen entweder exogene VSV-G-oder HIV-1-Glykoproteine führt zu signifikant (p <0,05, Student t-Test) weniger Luciferase-Produktion in Zellen, die P. falciparum (Abbildung 2B). Es ist bemerkenswert, dass VSV-G-pseudotypisierte Viren viel größer Luciferaseaktivität als ihre Gegenstücke JRFLenv ergab, das ist aufgrund der größeren Infektionseffizienz von VSV-G-pseudotypisierten Partikel 15. Da die Exposition gegenüber Parasiten MDM Auswirkungen beide Arten von Viren, dies deutet darauf hin, dass es einige Schritt in virale Gen ex beeinflusstpression (Abbildung 2B). Es ist auch wichtig zu erwähnen, dass die Lebensfähigkeit der Zellen nicht durch MDM Exposition iRBC (Daten nicht gezeigt) Dies weist darauf hin, dass die Hemmung beobachtet spezifisch und nicht wegen einer Zellenbelastung Mortalität ist.
Abbildung 1. A) Plate System für den MDM-Infektion mit einem voll replizierende Virus Mock:. Nicht infizierten Zellen. uRBC: Zellen, die nicht infizierten Erythrozyten. iRBC: Zellen, die Plasmodium falciparum-infizierten roten Blutkörperchen. Bal: Zellen mit NL4.3Bal env Bal / uRBC infiziert:. Zellen zu uRBC ausgesetzt und infiziert mit NL4.3Bal env Bal / iRBC:.. Zellen, die infizierte iRBC und mit NL4.3Bal env B) Plate System für den MDM-Infektion mit Single-Cycle-Luziferase-kodierende Virus Mock:. nicht infizierten Zellen. uRBC: Zellen, die nicht infizierten Erythrozyten. iRBC: Zellen auf Plasmodium falciparum-i ausgesetztnfected roten Blutkörperchen. Δenv: Zellen mit NL4.3 Luc + Env infiziert - R + JRFL:. Zellen mit NL4.3 Luc + Env infiziert - R + (JRFL env). VSV-G: Zellen mit NL4.3 Luc + Env infiziert - R + (VSV-G) Δenv / uRBC.. Zellen uRBC belichtet und infiziert mit NL4.3 Luc + Env-R + Δenv / iRBC: Zellen ausgesetzt iRBC und infiziert mit NL4.3 Luc + Env - R + JRFL / uRBC: Zellen, die uRBC und infiziert mit NL4.3 Luc + Env - R + (JRFL env).. JRFL / iRBC: Zellen, die iRBC und infiziert mit NL4.3 Luc + Env - R + (JRFL env). vsv-g/uRBC: Zellen, die uRBC und infiziert mit NL4.3 Luc + Env - R + (VSV-G) vsv-g/iRBC. Zellen iRBC belichtet und infiziert mit NL4.3 Luc + Env - R + (VSV-G).
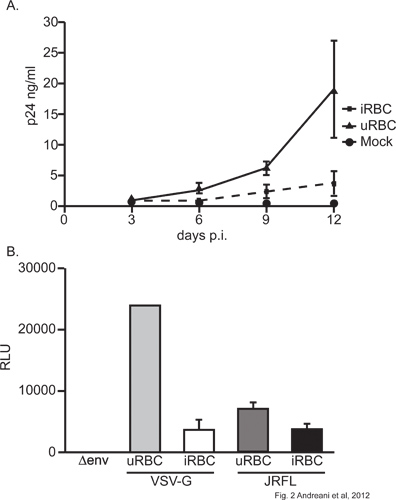
Abbildung 2. . MDM) für 4 Stunden und ausgiebig gewaschen: A) Effekt von Plasmodium falciparum auf HIV-1 Virus-Produktion in MDM MDM wurden uRBC oder iRBC im Verhältnis 75:1 (uRBC / iRBC ausgesetzt. Die Zellen wurden mit 10 ng der NL4.3Bal env p24 für 2 h infiziert. Virale Produktion wurde mittels ELISA für HIV-1 p24 in zellfreien Überstand zu unterschiedlichen Zeitpunkten nach der ursprünglichen viralen Infektion überwacht. . Ein repräsentatives Experiment B) Effekt von Plasmodium falciparum auf HIV-1 virale Transkription in MDM gezeigt MDM wurden mit uRBC oder iRBC im Verhältnis 75:1 (uRBC / iRBC infiziert:. MDM). R +, NL4.3 Luc + Env - - R + (JRFL env) oder NL4.3 Luc + Env - Zellen wurden dann mit 10 ng von p24 von Single-Cycle-Virus (entweder NL4.3 Luc + Env infiziert R + (VSV- g)). Luciferase-Expression wurde in Zelllysaten 72 Stunden nach der ersten Virus-Infektion untersucht. Ein repräsentatives Experiment gezeigt.
Diskussion
Wir haben hier zwei verschiedene Ansätze dargestellt, um die Auswirkungen der Malaria-Parasiten auf dem HIV-1 viralen Zyklus, dh durch Analysieren einer viralen Genexpression oder Nachkommen-Virus Produktion und Replikation in Monozyten abgeleiteten Makrophagen zu analysieren. Ähnliche Ansätze für andere HIV-1-Parasiten Co-Infektionen 16 verwendet. Allerdings sind diese neuen Daten ein Schritt nach vorn bei der Untersuchung von Malaria-HIV-1-Co-Infektionen. . Tatsächlich Diou et al 8 untersuchten die Wirkung von Hämozoin, nicht lebenden Parasiten, auf HIV-1-Replikation; in Übereinstimmung mit unseren Ergebnissen beobachteten sie, dass Hämozoin selbst ausreichend, um virale Produktion von MDM zu hemmen war, und nicht MDMs.
Mit der beschriebenen Versuchsanordnung beobachteten wir, dass P. falciparum übt eine klare nachteilige Wirkung auf die HIV-1-Replikationszyklus in Makrophagen: eine signifikante Hemmung der Virusproduktion in Makrophagen Parasiten vorbelichtet beobachtet (Figure 2A) und eine spezifische Wirkung der Parasiten auf die virale Transkription wird in 2B dargestellt. Dennoch können wir nicht weglassen keine zusätzlichen Effekte des Parasiten auf das Eindringen des Virus oder Fusion (decapsidation), oder auf Post-Integration-Mechanismen wie die Proteinsynthese oder Viruspartikelzusammenlagerung und Knospung. Weiterhin ist es möglich, dass eine unterschiedliche Auswirkungen auf HIV-1-Replikation erhalten würde, wenn die Parasiten wurden entweder gleichzeitig oder nach MDM Infektion mit dem Virus zugegeben werden.
Unsere in vitro Co-Infektion Modell ist ein leistungsstarkes Tool, um detaillierte Untersuchungen von HIV-1 / P. durchführen falciparum Wechselwirkungen in der Wirtszelle. Zum Beispiel sind die Kombination dieser Versuchsanordnung mit anderen Techniken, wie quantitative Echtzeit-PCR, die gezielt quantifizieren können spezifische Schritte in dem viralen Retrotranskription und viralen Genoms Integration in das Genom der Wirtszelle, durchaus möglich und sollte weiter zu ergeben Insights in die Mechanismen in Co-Infektionen beteiligt. Darüber hinaus spezifische Tests auswerten frühen Schritte des viralen Zyklus (virale Fusion, decapsidation, Quantifizierung Eintrag) können auf diese grundlegende Protokoll angewendet werden, um weiter zu analysieren die Wirkung auf die virale Replikation. Diese Änderungen zeigen, wie flexibel dieses Protokoll in Bezug auf HIV-1-Quantifizierung und Nachweis: ja, auch Standard-HIV-1-Reverse-Transkriptase-Quantifizierungsassayverfahren mit Tritium-markierten Nukleotiden denkbar ersetzen die ELISA für HIV-1 p24. Zusätzlich zu MDM, erwarten wir unser System anpassungsfähig sein, um anderen Zelltypen, die für HIV-1-Malaria-Wechselwirkungen, wie zB Monozyten und dendritischen Zellen. Die Tatsache, dass MDM adhärente Zellen sind, erleichtert ihre Handhabung, erlaubt eine einfache Auswaschen iRBC, die nicht in getroffen worden, oder die in Kontakt mit MDM sind, ohne Eliminierung keine Makrophagen. Ein solcher Vorteil wäre nicht zu dendritischen Zellen und Monozyten, die in Suspension kultiviert werden gelten, was bisher die sichbereitung von uRBC und kostenlos iRBC mit solchen Zellen, und wir sind derzeit Lösung dieses Problems. Unser System könnte auch nützlich sein, komplexere Interaktionen wie die Auswirkungen von Plasmodium-exponierten Monozyten abgeleiteten Zellen auf der HIV-1 viralen Zyklus in anderen Immunzellen wie CD4-positive T-Zellen in Co-Kultivierung von studieren. Schließlich könnte unser Protokoll geeignet sein für Experimente Blick auf die Wirkung von P. falciparum iRBCs auf HIV-1-Reaktivierung in PBMC für die HIV-1 infizierten Personen.
Ethik-und Verlustrechnung
Humane PBMC wurden aus dem Blut gesunder Spender gewonnen, in Übereinstimmung mit den Leitlinien der Bioethik-Ausschuss des Centre Hospitalier de l'Université Laval Research Center. Eine schriftliche Einverständniserklärung wurde von allen Blutspendern gewonnen.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von der kanadischen Institutes of Health Research durch einen Katalysator Co-Infektionen und Komorbiditäten Zuschuss unterstützt. Menschliche Erythrozyten wurden durch das Centre Hospitalier de l'Université Laval Blutbank zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| RPMI 1640 | Multicell | 350-000-CL | |
| PBS-Endotoxin-frei | Sigma | D8662 | |
| FBS | Wisent | 080-150 | Bei 56 ° C für 30 min hitzeinaktiviert |
| Accutase | eBiosciences | 00-4555-56 | |
| Albumax II | Gibco | 11021-037 | Gelöst in RPMI 1640, filtersterilisiert |
| Lymphozyten-Separationsmedium | Multicell | 305 bis 010-CL | |
| Weiße Platten-Luminometer | Promega | Z3291 | |
| CS Macs Trennung columms | Miltenyi Biotech | 130-041-305 | |
| VarioMacs Abscheider | Miltenyi Biotech | 130-090-282 | |
| Penicillin / Streptomycin-Lösung | Wisent | 450 bis 201-EL | |
| D-Sorbit | Sigma-Aldrich | S1876 | |
| Zellenabstreifer (25 cm) | Sarstedt | 83,1830 | |
| 24-Well-Zellkulturplatten | BD Falcon | 353047 | |
| 150 x 20 mm Kulturschale | Sarstedt | 83.1803.003 | |
| M-CSF | Genscript | Z02001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Humanes Serum AB + | Tal Biomedizinische | HP1022 | |
| HBSS | Wisent | 311 bis 505-CL | |
| Gentamicin | Sigma-Aldrich | G1397 | |
| Hypoxanthin | Sigma-Aldrich | H9636 | |
| NaHCO 3 | Sigma-Aldrich | S5761 | |
| Luciferase Assay System | Promega | E1500 | |
| Menschliche rote Blutkörperchen | Gewonnen aus CHUL Blutbank gereinigt. |
Referenzen
- WHO. World Malaria Report. , (2005).
- Kublin, J. G., Patnaik, P., Jere, C. S. Effect of Plasmodium falciparum malaria on concentration of HIV-1-RNA in the blood of adults in rural Malawi: a prospective cohort study. Lancet. 365, 233-240 (2005).
- Cuadros, D. F., Branscum, A. J., Crowley, P. H. HIV-malaria co-infection: effects of malaria on the prevalence of HIV in East sub-Saharan Africa. Int. J. Epidemiol. 40, 931-939 (2011).
- Xiao, L., Owen, S. M., Rudolph, D. L., Lal, R. B., Lal, A. A. Plasmodium falciparum antigen-induced human immunodeficiency virus type 1 replication is mediated through induction of tumor necrosis factor-alpha. J. Infect. Dis. 177, 437-445 (1998).
- Froebel, K., Howard, W., Schafer, J. R. Activation by malaria antigens renders mononuclear cells susceptible to HIV infection and re-activates replication of endogenous HIV in cells from HIV-infected adults. Parasite Immunol. 26, 213-217 (2004).
- Diou, J., Tardif, M. R., Barat, C., Tremblay, M. J. Dendritic cells derived from hemozoin-loaded monocytes display a partial maturation phenotype that promotes HIV-1 trans-infection of CD4+ T cells and virus replication. J. Immunol. 184, 2899-2907 (2010).
- Diou, J., Tardif, M. R., Barat, C., Tremblay, M. J. Malaria hemozoin modulates susceptibility of immature monocyte-derived dendritic cells to HIV-1 infection by inducing a mature-like phenotype. Cell Microbiol. 12, 615-625 (2010).
- Diou, J., Gauthier, S., Tardif, M. R. Ingestion of the malaria pigment hemozoin renders human macrophages less permissive to HIV-1 infection. Virology. 395, 56-66 (2009).
- Davies, J. Q., Gordon, S. Isolation and culture of human macrophages. Methods Mol. Biol. 290, 105-116 (2005).
- Fortin, J. F., Cantin, R., Lamontagne, G., Tremblay, M. Host-derived ICAM-1 glycoproteins incorporated on human immunodeficiency virus type 1 are biologically active and enhance viral infectivity. J. Virol. 71, 3588-3596 (1997).
- Bounou, S., Leclerc, J. E., Tremblay, M. J. Presence of host ICAM-1 in laboratory and clinical strains of human immunodeficiency virus type 1 increases virus infectivity and CD4(+)-T-cell depletion in human lymphoid tissue, a major site of replication in vivo. J. Virol. 76, 1004-1014 (2002).
- Wei, X., Decker, J. M., Liu, H. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy. Antimicrob. Agents Chemother. 46, 1896-1905 (2002).
- Trager, W., Jensen, J. B. Human malaria parasites in continuous culture. Science. 193, 673-675 (1976).
- Turrini, F., Ginsburg, H., Bussolino, F., Pescarmona, G. P., Serra, M. V., Arese, P. Phagocytosis of Plasmodium falciparum-infected human red blood cells by human monocytes: involvement of immune and nonimmune determinants and dependence on parasite developmental stage. Blood. 80, 801-808 (1992).
- Akkina, R. K., Walton, R. M., Chen, M. L., Li, Q. X., Planelles, V., Chen, I. S. High-efficiency gene transfer into CD34+ cells with a human immunodeficiency virus type 1-based retroviral vector pseudotyped with vesicular stomatitis virus envelope glycoprotein G. J. Virol. 70, 2581-2585 (1996).
- Zhao, C., Papadopoulou, B., Tremblay, M. J. Leishmania infantum enhances human immunodeficiency virus type-1 replication in primary human macrophages through a complex cytokine network. Clinical Immunol. 113, 81-88 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten