אינטראקציה בסיס חומצה לואיס ב Ph3P-BH3
Overview
מקור: תמרה מ. פאוורס, המחלקה לכימיה, אוניברסיטת טקסס A&M
אחת המטרות של הכימיה היא להשתמש במודלים המסבירים מגמות ומספקים תובנות על תכונות המגיבים התורמים לתגובה. חומרים סווגו כחומצות ובסיסים מאז ימי היוונים העתיקים, אך ההגדרה של חומצות ובסיסים שונתה והורחבה לאורך השנים. 1
היוונים הקדומים היו מאפיינים חומרים לפי טעם, והגדירו חומצות כמו אלה שהיו טעימים חמוץ, כגון מיץ לימון וחומץ. המונח "חומצה" נגזר מהמונח הלטיני ל"טעימה חמוצה". הבסיסים התאפיינו ביכולתם לנטרל או לנטרל חומצות. הבסיסים הראשונים שאופיינו היו אלה של אפר משריפה, אשר היו מעורבבים עם שומנים כדי להפוך את הסבון. למעשה, המונח "אלקליין" נגזר מהמילה הערבית "צלייה". ואכן, זה כבר ידוע מאז ימי קדם כי חומצות ובסיסים ניתן לשלב כדי לתת מלח ומים.
התיאור הנפוץ הראשון של חומצה הוא זה של הכימאי השוודי, סוונטה ארניוס, אשר בשנת 1894 הגדיר חומצות כחומרים המתנתקים במים כדי לתת יונים הידרוניום, ובסיסים כחומרים אשר להתנתק במים לתת יונים הידרוקסיד. הגדרה זו מוגבלת אפוא לחומצות מימיות ומחייבת שחומצה תתרום פרוטון. 2 לדוגמה, במים, HCl היא חומצה, כפי שהוא dissociates לתת יון הידרוניום (H3O)+ ואת יון כלוריד. בורון טריכלוריד לא ייחשב לחומצה, כמו במים זה hydrolyzes לתת B(OH)3 ו 3 HCl; המוצר HCl אף הוא חומצת ארניוס.
בשנת 1923, יוהנס ניקולאוס ברונסד ומרטין לאורי הגדירו באופן עצמאי חומצות ובסיסים על יכולתם לתרום ולקבל יונים מימן, או פרוטונים. כך הגיע הרעיון של זוגות מצומדים בסיס חומצה, והרחבת ההגדרה של חומצות ובסיסים בממסים שאינם מים. לדוגמה, אמוניום הוא חומצה, כפי שהוא יכול לתרום פרוטון וליצור אמוניה. אמוניה יכולה לקבל פרוטון, לתת אמוניום. לכן, אמוניה היא הבסיס ההנגדי של אמוניום. תגובה זו בסיס חומצה יכול להתרחש במים, אמוניה, או ממיסים אחרים.
סרטון זה עוסק בהגדרת הבסיס החומצי של הכימאי האמריקאי, גילברט נ. לואיס, שהגדיר גם חומצות ובסיסים בשנת 1923. אכן, זה אותו לואיס ממבנים של לואיס-דוט בכימיה כללית. גישתו אינה מתמקדת ביכולתם של חומצות ובסיסים לתרום ולקבל פרוטונים, אלא ביכולתם לקבל ולתרום זוגות אלקטרונים, בהתאמה. זה מקיף את ההגדרה Brønsted-לאורי, כמו H+ מקבל זוג אלקטרונים מבסיס Brønsted במהלך פרוטוניציה. עם זאת, זה מאוד מרחיב את ההגדרה של חומצה, עכשיו מקיף יונים מתכת ותרכובות הקבוצה העיקרית. כאן, אנו משווים את 31P NMR של תוספת בסיס חומצת לואיס Ph3P-BH3 כדי טריפנילפוספין חינם.
Principles
תן דעתך לקשר בין טריפנילפוספין לבוראן. ראשית נשקול כיצד נראות שתי המולקולות לפני שהן יוצרות תוסף לואיס.
זכור מבני נקודות לואיס, ותיאוריה של מעטפת אלקטרונים -זוג ערכית (VSEPR), מכימיה כללית. מבנה הנקודות של לואיס של טריפנילפוספין מוצג באיור 1. ישנם שלושה קשרים קוולנטיים בין אטום הזרחן לאחד מאטומי הפחמן בכל אחת משלוש טבעות פניל. שני אלקטרונים (זוג בודד) שוכנים על האטום הזרחן כדי להשלים את האוקטט. מרכז הזרחן הוא sp3 היברידי ויש לו גיאומטריה אלקטרונית tetrahedral, עם זוג בודד של אלקטרונים המתגוררים במסלול sp3. טריפנילפוספין יש זוג בודד שניתן לתרום למולקולה אחרת ולכן מסווג כבסיס לואיס.
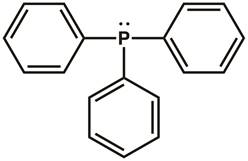
איור 1. מבנה הנקודות של לואיס של טריפנילפוספין.
מבנה הנקודות של לואיס של בוראן מוצג באיור 2. ישנם שלושה קשרים קוולנטיים בין אטום הבורון לבין אטומי המימן. במקרה זה, במרכז בורון יש רק שישה אלקטרונים ערכיים ולכן אינו פועל לפיכלל 8 e. בוראן הוא אפוא מנדר ו sp2 היברידי, עם sp2 מסלולית ויוצר קשרים אטומי המימן ואת המסלול p הבודד להיות ריק. בוראן הוא אפוא חומצת לואיס.

איור 2. מבנה הנקודות של לואיס של בוראן.
מאז הזרחן ב טריפנילפוספין יש מסלול מלא ואת בורון של בוראן יש מסלול ריק, תוספת בסיס חומצה לואיס יכול להיווצר, עם טריפנילפוספין תורם שני האלקטרונים שלה בורון. עם היווצרות תוספת, מרכז בורון הופך sp3 היברידית (משוואה 1).
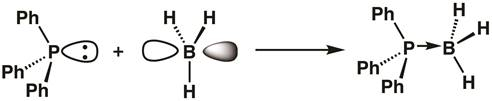 (1)
(1)
משוואה 1 מדגימה את הרעיון של חומציות לואיס, כאשר חומצות לואיס מקבלות זוגות בודדים של אלקטרונים, ובסיסי לואיס תורמים זוגות אלקטרונים. לפעמים, חומצות לואיס נקראות אלקטרופילים, ולואיס בסיסי כמו נוקלופילים. קשרים בין חומצות ובסיסים של לואיס נקראים לעתים קרובות קשרים קוולנטיים או דיבנטים, ולעיתים מיועדים לחצים בניגוד לקווים.
Procedure
1. הגדרת קו שלנק לסינתזה של מתחם בוראנה טריפנילפוספין
הערה: לקבלת הליך מפורט יותר, אנא עיין בסרטון "העברת קווי שלנק של ממס" בסדרת יסודות הכימיה האורגנית). בטיחות קו שלנק יש לבחון לפני ביצוע ניסוי זה. כלי זכוכית יש לבדוק עבור סדקים כוכב לפני השימוש. יש להקפיד על כך ש- O2 אינו מרוכז במלכודת הקו שלנק אם משתמשים בנוזל N2. בטמפרטורת N2 נוזלית, O2 מעבים והוא נפץ בנוכחות ממיסים אורגניים. אם יש חשד כי O2 כבר מרוכז או נוזל כחול נצפה במלכודת הקרה, להשאיר את המלכודת קרה תחת ואקום דינמי. אין להסיר את מלכודת N2 הנוזלית או לכבות את משאבת הוואקום. עם הזמן, הנוזל O2 יתאדה לתוך המשאבה; זה יהיה בטוח רק כדי להסיר את המלכודת N2 נוזלי פעם אחת כל O2 התאדה.
- סגור את שסתום שחרור הלחץ.
- הפעל את גז N2 ואת משאבת ואקום.
- כאשר הוואקום של קו Schlenk מגיע ללחץ המינימלי שלו, להכין את המלכודת הקרה עם נוזל N2 או קרח / אצטון יבש.
- להרכיב את המלכודת הקרה.
2. סינתזה של קומפלקס בוראן טריפנילפוספין3
- הוסף 5.3 גרם (20.3 mmol) של טריפנילפוספין לאגף שלנק 250 מ"ל והכן את אגף שלנק להעברת הצינורית של ממס.
- הוסף 20 מ"ל של THF יבש / גיהוי לבקבוק שלנק A באמצעות העברת צינורית. מערבבים את התמיסה כדי להמיס את הטריפנילפוספין.
- הכן בקבוקון שלנק שני (B) המכיל 1.15 גרם (30.5 mmol) NaBH4 להעברת צינורית.
- מצננים גם את אגף שלנק א' וגם את ב' באמבט קרח.
- קנולה מעבירה את תכולתו של שלנק אגף א' לבקבוק שלנק ב'.
- עם לחץ N2 חיובי, להחליף את מחיצת הגומי על בקבוק שלנק B עם משפך נוסף מצויד במחיצת גומי.
- למשפך התוספת, להוסיף 8 מ"ל של THF יבש / מגולח על ידי העברת צינורית.
- עם לחץ N2 חיובי, להסיר את המחיצה מראש משפך הפלה ולהוסיף 2 מ"ל של חומצה אצטית קרחונית משפך תוספת.
- שמירה על אגף שלנק B באמבט קרח, מוסיפים את חומצת ה-THF/קרחונים אצטית טיפה למעלה מ-30 דקות. במהלך התוספת, קצף עלול להתרחש. ודא כי התגובה היא ערבוב במרץ כדי למזער את זה.
- לאחר התוספת, לאפשר את התגובה לחום לטמפרטורת החדר ומערבבים במשך שעה נוספת.
- הסר את משפך הטלת לאט להוסיף 20 מ"ל של מים.
- הכן פתרון של 2 מ"ל חומצה אצטית קרחונית ב 25 מ"ל של מים. לאט לאט להוסיף תערובת זו לתגובה.
- אם גבישים אינם נוצרים באופן ספונטני, לקרר את התגובה באמבט קרח כדי לקדם התגבשות.
- סנן את המוצר על ידי יניקה באמצעות משפך מ fritted. לשטוף את מוצק וכתוצאה מכך עם 20 מ"ל של מים 3 פעמים.
- אפשר למוצר להתייבש במכסה המנוע לפני הכנת המדגם לניתוח NMR.
3. 31P ניתוח NMR של קומפלקס בוראן טריפנילפוספין
- הכינו דגימת NMR של מתחם טריפנילפוספין ובוראן טריפנילפוספין ב- CDCl3.
- לאסוף 31P NMR של כל מדגם (מוזכר חומצה זרחתית) ולבחון כיצד האות הזרחן של טריפנילפוספין משתנה בתיאום בוראן.
Results
קומפלקס בוראנה טריפנילפוספין:
31 P NMR (כלורופורם-d, 500 מגה-הרץ, δ, ppm): 20.7 (כפול רחב)
טריפנילפוספין:
31 P NMR (כלורופורם-d, 500 מגה-הרץ, δ, ppm): -5.43
האות 31P NMR של מתחם בוראן טריפנילפוספין הוא במורד המגרש יחסית טריפנילפוספין חינם. זה עולה בקנה אחד עם הסרת צפיפות אלקטרונים ממרכז הזרחן, אשר deshielded על היווצרות adduct.
Application and Summary
קומפלקס הבוראן טריפנילפוספין הוא דוגמה לתסביך לואיס, לפיו בסיס לואיס תורם אלקטרונים לחומצה של לואיס. למרות ש-BH3 ו-PPh3 לא בהכרח ייחשבו לחומצה ובסיס, בהתאמה, תוך שימוש בתיאוריות אחרות של בסיס חומצה, תיאוריית בסיס החומצה של לואיס מנבאת נכונה שהמולקולות יוצרות תוסף יציב.
הפעלת מולקולה קטנה:
בעוד שיוני מתכת מעבר נחשבו היסטורית לחומצות לואיס, הרעיון שהם יכולים לשמש כבסיסי לואיס מתקדם. לדוגמה, ג'ונאס פיטרס ושותפיו לעבודה בקלטק הראו כי מתחמי מתכת-בוראן, שיכולים לתרום אלקטרונים לחומצת לואיס בוראן (ליגנד מסוג Z), יכולים להוליד תגובתיות חדשנית. מין בוראן ניקל הוכח להוסיף באופן הפיך H2, הטרולית לבקע את הקשר H-H. 4 המין H2 -הוסיףהוא זרז עבור הידרוגנציות של אולפינים. הקבוצה דיווחה גם כי מתחמי ברזל-בוראן יכולים להפחית קטליטית חנקן לאמוניה. 5 זו הייתה הדוגמה הראשונה לזרז הומוגני מבוסס ברזל לתגובה מאתגרת אך ביקורתית זו.
זוגות לואיס מתוסכלים:
תחום מחקר עדכני נוסף הוא זה של "זוגות לואיס המתוסכלים", או FLPs. אלה הם לואיס חומצה בסיס "adducts" כי בשל סיבות steric, לא יכול ליצור קשר dative. 6 דאגלס סטפן ושותפיו לעבודה מאוניברסיטת טורונטו שקלו איזו תגובתיות תהיה לתוספים כאלה, במיוחד עם הרעיון להשתמש בהם להפעלת מולקולות קטנות וזרז. במחשבה על מתחמי מתכת מעבר, שיכולים לקבל ולתרום צפיפות אלקטרונים אל וממצעים, הם שיערו תכונות תורם / מקבל של מה שהם כינו "זוגות לואיס מתוסכלים" עשויים להיות לגבי תגובתיות.
בשנת 2006, סטפן ושותפיו לעבודה דיווחו במדע כי zwitterionic (C6H2Me3)2PH(C6F4)BH(C6F5)2 מאבד באופן הפיך H2 לתת (C6H2Me3)2P(C6F4)B(C6F5)2. 7 זו הייתה הדוגמה הראשונה להפעלת H2 הפיכה עם רכיבי קבוצה עיקריים, ואחריה דוגמאות אחרות (איור 3). מחקר זה סלל את הדרך להתפתחות מחקר FLP. מאז פותחו FLPs שהם זרזים הידרוגנציאליים מוסמכים, ויכולים להפעיל מגוון מולקולות קטנות כולל CO2. זהו תחום מחקר חדש ומרגש.
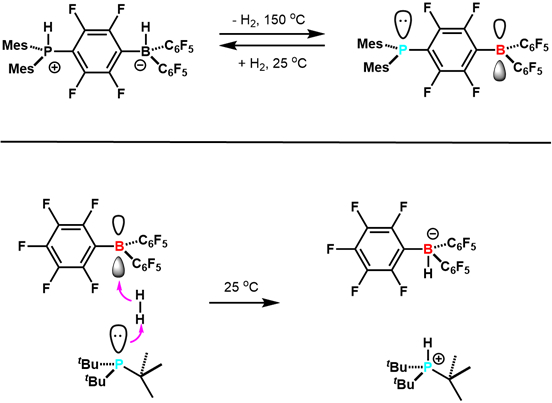
איור 3. דוגמאות מוקדמות של תגובתיות של FLPs עם H2. מותאם מהפניה 5.
References
- Lesney, Today's Chemist at Work, 2003, 47-48.
- Miessler, P. J. Fischer and D. A. Tarr, Inorganic Chemistry, Pearson, 2014.
- McNulty, J.; Zhou, Y. Tetrahedron Letters, 2004, 45, 407-409.
- Harman and J. C. Peters, J. Am. Chem. Soc., 2012, 134, 5080-5082.
- Anderson, J. Rittle and J. C. Peters, Nature, 2013, 501, 84-87.
- Stephan, J. Am. Chem. Soc., 2015, 137, 10018-10032.
- Welch, R. R. S. Juan, J. D. Masuda and D. W. Stephan, Science, 2006, 314, 1124-1126.
Tags
Skip to...
Videos from this collection:

Now Playing
אינטראקציה בסיס חומצה לואיס ב Ph3P-BH3
Inorganic Chemistry
38.9K Views

סינתזה של מטלוקן Ti(III) בטכניקת קו שלנק
Inorganic Chemistry
31.6K Views

חיישני תא כפפות וטילמאה
Inorganic Chemistry
18.6K Views

טיהור פרוקן על ידי תת-הכרתיות
Inorganic Chemistry
54.6K Views

שיטת אוונס
Inorganic Chemistry
68.6K Views

עקיפה של קריסטל ואבקה
Inorganic Chemistry
104.5K Views

ספקטרוסקופיית תהודה פרמגנטית אלקטרונית (EPR)
Inorganic Chemistry
25.5K Views

Mössbauer Spectroscopy
Inorganic Chemistry
22.0K Views

מבנה פרוקן
Inorganic Chemistry
79.6K Views

יישום תורת הקבוצות לספקטרוסקופיית IR
Inorganic Chemistry
45.3K Views

תורת מסלולית מולקולרית (MO)
Inorganic Chemistry
35.4K Views

גלגלי משוטים מרופדים ממתכת מתכתית
Inorganic Chemistry
15.3K Views

תאים סולאריים רגישים לצבע
Inorganic Chemistry
15.8K Views

סינתזה של קומפלקס קובלט נושא חמצן(II)
Inorganic Chemistry
51.7K Views

ייזום פוטוכימי של תגובות פילמור רדיקליות
Inorganic Chemistry
16.8K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved