Method Article
Subcloning Plus ההכנסה (SPI) - Recombineering שיטה חדשה לבנייה המהירה של וקטורי גן המיקוד
In This Article
Summary
Gene targeting methodologies can be used to generate transgenic mice with knockout, knock-in and tagged alleles. Here, we describe an improved method of recombineering in E. coli, that we term ‘subcloning plus insertion’, which can be used to generate custom gene targeting vectors rapidly.
Abstract
Gene targeting refers to the precise modification of a genetic locus using homologous recombination. The generation of novel cell lines and transgenic mouse models using this method necessitates the construction of a ‘targeting’ vector, which contains homologous DNA sequences to the target gene, and has for many years been a limiting step in the process. Vector construction can be performed in vivo in Escherichia coli cells using homologous recombination mediated by phage recombinases using a technique termed recombineering. Recombineering is the preferred technique to subclone the long homology sequences (>4kb) and various targeting elements including selection markers that are required to mediate efficient allelic exchange between a targeting vector and its cognate genomic locus. Typical recombineering protocols follow an iterative scheme of step-wise integration of the targeting elements and require intermediate purification and transformation steps. Here, we present a novel recombineering methodology of vector assembly using a multiplex approach. Plasmid gap repair is performed by the simultaneous capture of genomic sequence from mouse Bacterial Artificial Chromosome libraries and the insertion of dual bacterial and mammalian selection markers. This subcloning plus insertion method is highly efficient and yields a majority of correct recombinants. We present data for the construction of different types of conditional gene knockout, or knock-in, vectors and BAC reporter vectors that have been constructed using this method. SPI vector construction greatly extends the repertoire of the recombineering toolbox and provides a simple, rapid and cost-effective method of constructing these highly complex vectors.
Introduction
הפיתוח של טכנולוגיות מיקוד גן אפשר הבנייה של שורות תאים ובמודלים עכבר כדי לחקור מערכות ביולוגיות שונות 1-3. שלב ראשון מפתח בשינוי של רצף הגנומי הוא התכנון והבנייה של גן מיקוד וקטור 4. וקטורי מיקוד הם בונה פלסמיד הנושאות את האלל של עניין המכיל את השינויים הרצויים (ים) מוקף סמן בחירה (למשל, נאומיצין), ואזורים הגנומי ארוכים הנדרשים לרקומבינציה ההומולוגית יעילה בתאי יונקים 5. שינוי גנטי מדויק מושגת על ידי כניסתה של וקטור המיקוד לתאי גזע עוברי (ES) 6 או 7 תאים סומטיים, לפי רקומבינציה הומולוגית בין מתיחות זהות של רצף ה- DNA על וקטור המיקוד ואת תוצאות המוקד הגנומי בהעברת השינוי המיועד לגנום על ידי המרה גן 8. modifi כזהניתן להזריק תאי גזע עובריים לed blastocysts עכבר כדי לייצר צאצאים (תעתועים), כי אז יכולים לשדר אללים שונה אלה באמצעות תאי המין 9. תוואי חלופי כדי לייצר עכברים הטרנסגניים כרוך microinjection של וקטור ביטוי גנים לzygotes עכבר תאי יחיד, מה שמוביל לשילוב של הווקטור בגנום העכבר 10 האקראי. שיטות מסורתיות של בניית וקטור יש לסמוך על קונבנציונלי "לגזור ולהדביק" שיבוט באמצעות אנזימי הגבלה וligases DNA לשבט הסמן שונה בחירה ושברים הגנומי לשדרת וקטור. עם זאת, גורם טבוע הגבלה של שיבוט מסורתי הוא הבחירה של אתרי הגבלה והמיצוב, במיוחד עם רצפי DNA עוד. זה לעתים קרובות מחייב צעדי subcloning מרובים וגם מציג רצפי DNA זרים לתוך הווקטור, אשר מוביל לעתים קרובות ליעילות נמוכה של גן המיקוד.
Recombineering (eng recombinogenicineering) היא טכנולוגית הנדסת DNA שמתגברת על מגבלות אלה באמצעות רקומבינציה ההומולוגית (HR) בתיווכו של חלבוני רקומבינציה הפאג בE. תאי coli 11,12. מאז כל אזור של רצף הומולוגי יכול לשמש כמצע של recombineering, אילוצי הזמינות של אתרי הגבלה יוסרו. רצפי DNA גדולים יכולים להיות שונה בצורה חלקה ישירות in vivo, וכך גם שמירה על השלמות המבנית שלהם 13. Recombineering הוא מאוד יעיל עם הומולוגיות קצרות (50 נ"ב) 14 ולכן זרועות הומולוגיה (HA) יכולות להיות משולבות בצורה נוחה רצפי אוליגו סינטטיים. בניסוי טיפוסי recombineering, אוליגו או שבר כפול DNA גדילים (dsDNA) המכיל HA הוא electroporated לתוך E. המוסמך recombineering תאי coli המכילים את היעד ממוקם גם על כרומוזום או על פלסמיד 15. פוטנציאל רקומבינציה מוענק על ידי ביטוי מושרה של rec האדוםombination חלבונים של הפאג 16,17 או חלבוני RecET של prophage RAC 18. Exonuclease האדום / Rece ממיר dsDNA ליניארי לדנ"א חד-גדילים (ssDNA) ביניים, שהוא חייב לאחר מכן על ידי שותפתה, אדום / rect, חלבון חד-גדילי חישול (SSAP) 19. חישול של ssDNA ארוך או קצר לאוליגו רצף היעד המשלים שלה מתרחש בגדיל המפגר של מזלג השכפול ומוביל לשילוב של הרצף באתר היעד. מפגר רקומבינציה ssDNA גדיל הוא בסיס ליעילות הגבוהה של recombineering ויכול להיות מתואר על ידי 20,21 מודל רקומבינציה 'ביתא'.
עבודה recombineering אופיינית לבנות וקטור גן מיקוד כרוך אחד משני המסלולים הבאים. מסלול אחד כרוך subcloning אזור גנומי הרצוי משיבוט BAC העכבר לפלסמיד ואחרי ההחדרה רציפה של אתרי רקומבינציה LoxP, סמן בחירה 22 וכו ', או את המסלול החלופי כרוך מיקוד המוקד הגנומי BAC עם אלמנטי וקטור מיקוד השונים על ידי מספר סיבובים של recombineering 10,23 ולאחר מכן subcloning המוקד שונה לפלסמיד על ידי תיקון פער שיבוט 24,25. וריאציות על הנושא הזה כבר בשימוש בצינורות recombineering תפוקה גבוהה שונים, כחלק מתוכניות ייצור עכבר גדול 26,27. עם זאת, הליכים אלה כרוכים בשלבים מסובכים וארוכים, דורשים השימוש בוקטורים מיוחדים וא coli זנים (למשל, Cre לבטא בתאים) ולנצל את צעדי ביניים אחת או יותר מטיהור DNA וקטור מחדש שינוי (טבלה 1). Subcloning הכנסה בתוספת (SPI) הוא טכניקת recombineering רומן המשלבת רקומבינציה בטא ותיקון פער שיבוט לתהליך יחיד (איור 1). ההרכבה וקטור SPI היא פשוטה, מהירה וגמישה, ומציעה שיפור משמעותי בrecombi הסטנדרטיneering גישות (טבלת 1). הנה, אנחנו מדגימים את הקלות ואת השירות של שימוש SPI עבור יישומי בניית וקטור שונים עם דגש מיוחד על בניית עיצובי וקטור שאינם סטנדרטיים ומאתגרים. מקרי מבחן כללו בניית וקטור להתרפק כתב ניאון, וקטור להתרפק ביטוי חלבון מתויג כפול, וקטור כתב ניאון BAC ווקטור נוקאאוט מותנה. אלה בחנו דרכים שונות הדרישה למקם קולט פני תא, לטהר מורכב חלבון גרעיני או על תנאי לקטוע הביטוי של גן.
Protocol
1. גן מיקוד עיצוב
- להזמין שיבוט מתאים BAC המכסה את האזור הגנומי של עניין. ודאו שזה isogenic לסוג של תאי גזע עובריים להיות שונה למשל, שיבוטים RPCI-23 וRPCI-24 BAC לגן מיקוד עם C57BL / 6 ES תאים.
- החל גן קונבנציונלי מיקוד קריטריונים בעת תכנון וקטור המיקוד. פרמטרים עיקריים כוללים אם נדרש השינוי להיות מכונן או מותנה, הגדרת אקסונים קריטיים (CE) למחיקה באסטרטגיה גן בנוקאאוט ומרווח ומיקום של קלטות אינטרוניים.
הערה: כל אחד מהם כבר דן בפירוט במקום אחר 10. - בחר אזורים הגנומי כל אחד מ5-6 קילו איגוף אתר שינוי היעד.
הערה: הגודל של להכניס את subcloned לכן בדרך כלל 10-12 קילו, אם כי הגבול העליון יכול להיות גבוה ככל 80 kb עם העתק נמוך subcloning פלסמיד כמו p15A, pBR322 וכו 'ועד 200 kb עם BACוקטור.
2. Multiplex Recombineering oligos
- oligos עיצוב לשדרת פלסמיד (פלסמיד subcloning) והסמן לבחירה (קלטת הכנסה). עיצוב כל אוליגו כך שהוא מכיל 180 HA נ"ב איגוף אתר היעד הגנומי ו -20 נ"ב של רצף תחול ספציפי של קלטת ההכנסה או פלסמיד subcloning (איור 2).
הערה: זרועות הומולוגיה לא צריכים להכיל את כל אלמנטים חוזרים, הנוכחות של אלמנטים חוזרים תגרום למיקוד וsubcloning שגויים. ניתן לאתר אלמנטים חוזרים על ידי שימוש בכלים מבוסס אינטרנט כגון '' חזור Masker ''. - כולל אתר ייחודי אנזים הגבלה (RE) באחת מoligos הווקטור כדי linearize וקטור גן מיקוד לתאי גזע עובריים מיקוד (איור 2).
- בדקו פרמטרים אוליגו באמצעות תכנית מנתח אוליגו. תשמור על עצמך, כדי למנוע מבנים משניים באזור תחולs.
- קצר יותר HA (50 נ"ב) של קלטת ההכנסה נסבלת ומניב מספר נמוך יותר של recombinants אבל להבטיח שפלסמיד subcloning HA הוא תמיד ארוך יותר (180 נ"ב).
- לקבוע את הכיוון של להכניס את הדנ"א הגנומי של השיבוט בפרט BAC תוך שימוש בכלים מבוסס אינטרנט כמו '' cloneDB ''. להקים את הכיוון של שכפול מOris על ידי לבדוק את המפה של עמוד השדרה פלסמיד BAC המשמשת לבניית ספריית BAC.
הערה: Oris הוא בדרך כלל הפוך לכיוון תעתיק של סמן כלורמפניקול (CHL) לכל פלסמידים BAC הנפוצים. - הוסף שתי איגרות חוב מסוף phosphorothioate (PTO) עד סוף '5 של אוליגו שהוא מנוגד לכיוון של שכפול על שיבוט BAC. הוסף שינוי 5 פוספט 'לאוליגו ההפוך (איור 2).
הערה: קלטת PCR phosphorothioated א-סימטרית על עיכול אדום מייצרת ssDNA ביניים שראש יכול גדיל מפגרשל מזלג השכפול.
הערה: מקסימאלי תדירות רקומבינציה זמנית הוא ציין עם הקלטות מוגנות הגדיל המפגר. גדיל מוביל מוגן או קלטות מוגנות כפולים לא יכולות לייצר את יעילות רקומבינציה שווה בכמה לוקוסים. - להזמין oligos עם עמוד או טיהור HPLC.
3. שינוי Clone BAC עם pSC101 BADgbaA Recombineering פלסמיד.
- על מנת להפוך את ה זן coli הנושא את recombineering BAC הבקיא, להפוך אותו עם פלסמיד pSC101 BADgbaA המכיל את הגנים אדומים 16.
הערה: פלסמיד pSC101 BADgbaA מכיל את הגנים אדומים וRecA תחת השליטה של אמרגן arabinose מושרה ARAÇ-P BAD, סמן בחירת טטרציקלין וreplicon pSC101 רגיש לטמפרטורה.- לדקור קצה פיפטה סטרילית בתרבות אגר BAC ולחסן 5.0 מיליליטר של מרק lysogeny pH 8.0 המכיל 12.5 (LB)56; g מיליליטר -1 Chl. לגדול ב 37 מעלות צלזיוס למשך 5 שעות רועדות ב 200 סל"ד.
- צ'יל 10% (v / v) פתרון גליצרול, צינורות microcentrifuge וcuvettes electroporation על קרח. מגניב צנטריפוגה בקירור גדולה וmicrocentrifuge עד 4 מעלות צלזיוס.
- לקבוע את הצפיפות האופטית (OD) של התרבות באמצעות ספקטרופוטומטר ולמדוד הספיגה ב 600 ננומטר. הכן תאי electrocompetent (כמפורט להלן) כאשר מגיעה קריאת 600 OD של 0.3 עד 0.8.
- ספין למטה תאים בצינור צנטריפוגה 50 מיליליטר בצנטריפוגה גדולה ב1,216 XG במשך 5 דקות על 4 מעלות צלזיוס.
- לשטוף את התאים עם 1 מיליליטר של גליצרול 10% המצוננים ומסובב את תאים ב17949 XG במשך 20 שניות על 4 מעלות צלזיוס. לבצע שטיפת צעד כוללת של 3 פעמים.
- Resuspend התאים בהיקף כולל של 50 μl של גליצרול 10% ולהוסיף 10-200 ng של פלסמיד recombineering pSC101 BADgbaA. לקבל השעיה תא בודדת על ידי pipettingמעלה ומטה מספר פעמים ולאחר מכן להעביר את התאים קובט electroporation פער 1 מ"מ טרום צונן.
- Electroporate התאים עם הגדרה של 1.8 KV, 25 μF ו -200 Ω.
הערה: בדוק את ההגדרות הנכונות עבור כל מותג של electroporator. קבוע זמן של electroporation פחות מ -4 מעיד על קיומו של מלח וזיהומים אחרים. - מייד לשחזר את התאים ב 1 מיליליטר של LB ולהעביר את תאי צינור צנטריפוגות 50 מיליליטר.
- לגדול תרבות gbaA BAC ב 30 מעלות צלזיוס למשך 2 שעות רועדות ב 200 סל"ד.
הערה: פלסמיד pSC101 BADgbaA הולך לאיבוד כאשר תאים גדלים על 37 מעלות צלזיוס בשל איון של גורם שכפול RepE הטמפרטורה רגישה. לגדל תאי gbaA על 30 מעלות צלזיוס כדי לשמור על פונקציות recombineering. - הוסף 9 מיליליטר של LB המכיל 12.5 מיקרוגרם מיליליטר -1 Chl ו -4 מיקרוגרם מיליליטר -1 טטרציקלין (ט) לתרבות gbaA BAC התאוששה. לגדולO BAC gbaA התרבות / N ליום 30 ב ° C רועד ב 200 סל"ד.
הערה: יעילות השינוי של electroporating פלסמיד gbaA supercoiled היא גבוהה מספיק כדי לאפשר O צמיחת הרוויה / N בתקשורת נוזלית.
4. הכנת הכנסת קלטות וsubcloning פלסמידים
- לשלב HA לקלטת ההכנסה (ים) ופלסמיד subcloning, לבצע תגובת השרשרת של פולימראז (PCR), תוך שימוש oligos הארוכה שונה כמפורט להלן.
- אופציונאלי: כדי למנוע שריד פלסמיד לתגובת recombineering, להשתמש מוצא R6K או תבנית פלסמיד טווח מארח הצר דומה כדי להגביר את קלטת ההכנסה.
- לחלופין, linearize תבנית פלסמיד באמצעות לעכל RE (טבלה 2). בחר RE שחותך מחוץ לאזור ההגברה PCR וחום מומת. חום להשבית RE כפי שהומלץ על ידי manufacturer.
- הגדר את תגובת השרשרת של פולימראז (PCR), תוך שימוש במערכת ה- DNA פולימראז hotstart באיכות גבוהה. הכן תערובת אמן PCR כמפורט (לוח 3). לבצע רכיבה תרמית כפי שמוצג (לוח 3).
- לנתח מוצרי ה- PCR על ידי ג'ל אלקטרופורזה agarose. עומס 1-5 μl של כל PCR על 1% (w / v) agarose ג'ל המכיל 0.5 מ"ג מיליליטר -1 Ethidium ברומיד (EtBr).
הערה: הנוכחות של מוצרי הגברה שאינן ספציפיים אינה מתערבת בתגובת recombineering. במקרים מסוימים עם זאת, פריימר-הדימרים עלולים להפחית את יעילות recombineering. - לטהר מוצרי PCR באמצעות ערכת טיהור PCR.
- אופציונאלי: להסיר את תבנית פלסמיד מPCRs על ידי טיפול עם DpnI אחריו לנקות PCR. DNA Elute בנפח מינימאלי של מים ללא יונים סטרילי (כפי שהומלץ על ידי היצרן).
הערה: תוספת של DpnI לקנה בלתי תוצאות PCR תגובות ביעילות מופחתת של מחשוף של התבנית ה- DNA פלסמיד מפוגל דואר.
- אופציונאלי: להסיר את תבנית פלסמיד מPCRs על ידי טיפול עם DpnI אחריו לנקות PCR. DNA Elute בנפח מינימאלי של מים ללא יונים סטרילי (כפי שהומלץ על ידי היצרן).
- לכמת DNA PCR מוגבר על ידי ניתוח agarose ג'ל נגד קבוצה ידועה של תקני ה- DNA למשל, λ HindIII לעכל או באמצעות ספקטרופוטומטר nanodrop.
5. subcloning Plus הכנסה
- לדלל את O / לקפל N BAC gbaA תרבות 50 על ידי הוספת 200 μl 10 מיליליטר LB + Chl + ט. לגדול ב 30 ° C רועד ב 200 סל"ד עבור שעה 1 50 דקות. כולל מדגם לשמש כביקורת שלילית.
- צ'יל כל חומרים והציוד לrecombineering 4 ° C כמתואר בשלב 3.1.2.
- יוצקים pH אגר LB 8 צלחות המכילות ריכוז הנכון של האנטיביוטיקה המתאימה סלקטיבית (ים) שתאפשר בחירה של בר דנ"א, כמו גם לבחירה של וקטור subcloning (לוח 4).
הערה: אנטיביוטיקה חלקם pH רגיש. השימוש LBpH אגר 8 ככלל. - הכן 10% (w / v) פתרון של L-arabinose. סנן לעקר דרך פילטר מזרק 0.2 מיקרומטר.
הערה: arabinose גורם ביטוי של חלבוני recombineering מפלסמיד gbaA. - בדוק את OD של תרבות gbaA BAC באמצעות ספקטרופוטומטר. ברגע שOD 600 של .25-0.3 הוא הגיע, לגרום לחלבוני recombineering כפי שמתוארת בשלב הבא.
- הוסף 200 μl של פתרון arabinose 10% עד 10 מיליליטר של תרבות BAC כדי להשיג ריכוז סופי של arabinose של 0.2%. כולל תרבות uninduced (ללא arabinose) לשמש כביקורת שלילית.
- העבר את תרבות BAC ל-37 ° רועד C חממה וגורם לביטוי אדום במשך 45 דקות רועדות בסל"ד 230.
הערה: הביטוי של חלבונים אדומים הוא לא יעיל ליום 30 במעלות צלזיוס. - ספין למטה תאים ולשטוף עם גליצרול 10% 3 פעמים כמתואר בשלב 3.1.5.
- להוסיף 600-1,000 ng כל אחד מפלסמיד subcloning וקלטת ההכנסה (ים) תגובת recombineering. כולל וקטור בלבד ווקטור תוספת בקרות להוסיף יחידים לבדוק את מיומנות רקומבינציה ויושרה של הווקטור והקלטות.
- לקבל השעיה תא בודדת על ידי pipetting מעלה ומטה. בצע electroporation כמתואר בשלב 3.1.7 והתאוששות שלאחר מכן ב 1 מיליליטר LB ב 37 מעלות צלזיוס במשך שעה 1 לרב-עותק פלסמידים או 10 מיליליטר של LB ב 37 מעלות צלזיוס במשך 3 שעות עבור וקטורי BAC.
- דילולים שונים צלחת למשל התרבות התאושש, 90%, 10%, 1% על הצלחות אגר בחירה הכפולה ולגדול ב 37 ° C במשך 16 שעות.
6. ניתוח של recombinants
- אופציונאלי: בחר 6-12 מושבות ולבצע מושבה PCR באמצעות פריימר איגוף HA ופריימר הספציפי להוסיף. כולל פלסמיד subcloning וCAS ההכנסהפלסמיד Sette כמו גם שיבוט BAC ההורה כפקדים שליליים.
- ביצוע ניתוח agarose ג'ל של PCRs המושבה. לזהות שיבוטים חיוביים על ידי הנוכחות של להקה בהירה בגודל הצפוי.
הערה: היעילות הגבוהה של תהליך שיבוט SPI מייצרת recombinants הנכון בעיקר.
- ביצוע ניתוח agarose ג'ל של PCRs המושבה. לזהות שיבוטים חיוביים על ידי הנוכחות של להקה בהירה בגודל הצפוי.
- פיק מושבות לתוך 5 מיליליטר pH LB 8 המכיל אנטיביוטיקה סלקטיבית ולגדול O / N על 37 מעלות צלזיוס.
- הכן minipreps DNA באמצעות ערכת טיהור עמודה לפי הוראות היצרן.
- הכן BAC miniprep DNA באמצעות בידוד פנול, כלורופורם סטנדרטי או פרוטוקול דומה.
- בצע מעכלים RE על DNA miniprep. DNA נפרד על ידי ג'ל אלקטרופורזה agarose. לנתח את דפוסי RE לזהות שיבוטים המכילים את גדלי שברים הצפויים של וקטור המיקוד הנכון. בחר RE שמפלה בין להכניס הווקטור חסר (ים) ואת הווקטור המכיל את התוסף (ים) באופן ברור.
- Optioסופי: להשיג תאים שהם מחוסרים BAC, שעדיין קיים בE. coli לאחר recombineering, להשתמש DNA פלסמיד miniprep להפוך DH5alpha או DH10B E. תאי coli.
- לבצע רצפי DNA על פני HA וקלטת הכנסה כדי לבדוק שגיאות סינתזת אוליגו.
תוצאות
וקטורים להתרפק
וקטורי מיקוד להתרפק משקפים את הצורך להציג תכונת רצף רומן בגנום כולל החלפה אחת זוג בסיס באזור חלבון קידוד, שילוב של סמן פלואורסצנטי או תג זיקה לחלבון או שילוב של קלטת ביטוי גנים. כדי לבדוק את היישום של SPI באסטרטגיות בניית וקטור להתרפק, שני מקרי מבחן שונים נבדקו. Dnttip1 מקודד את deoxynucleotidyltransferase, המסוף, אינטראקציה 1A חלבון (TDIF1) שביחד עם כיתה אני היסטון deacetylase (HDAC) יוצר מורכב deacetylase mitotic (MiDAC) 28. כדי לחקור את התפקיד של Dnttip1 בחלוקת תא, גישת תיוג טנדם-זיקה נלקחה לבודד את TDIF1 אינטראקציה חלבונים. ניסיונות קודמים subclone חלק של גן Dnttip1 באמצעות וקטור p15A מכיל אזורי הומולוגיה ארוכים הביאו ליעילות תיקון פער הנמוךnd מוצרי רקומבינציה חריגים תכופים (מידע לא מוצגים). כך, הבנייה של וקטור להתרפק על מוקד Dnttip1 סיפקה תרגיל recombineering מאתגר. אסטרטגית SPI נועדה subclone סעיף 12 KB של גן Dnttip1 פורש אקסון האחרון (אקסון 13) לוקטור העותק p15A נמוך ולהכניס קלטת בחירת תג זיקה כפולה לאקסון 13 בו זמנית, החלפת קודון העצירה (איור 3 א ). חלבון FLAG-calmodulin מחייב 2X (CBP) צמוד FRT-PGK-em7-נאומיצין (Neo) הקלטת (2.0 kb) -BGhpA-FRT היה מוגבר מRE לינארית פלסמיד באמצעות oligos שונה PTO הכפול שהכיל 120 HA נ"ב איגוף Dnttip1 להפסיק קודון. וקטור Zeo p15A Dnttip1 subcloning (1.7 kb) נבנה שהכיל אזורים הומולוגיים לקצוות של רצף Dnttip1 200 נ"ב להיות subcloned. פלסמיד subcloning Dnttip1 מחדש לינארית וPCR מוגבר באמצעות 20 oligos נ"ב שונהשנוצר וקטור גדיל מוביל מוגן. מוצרי PCR טופלו DpnI, מטוהר ושיתוף electroporated לDnttip1 BAC E. המוסמך recombineering תאי coli, כמו גם תאי שליטת uninduced. תגובות SPI היו מצופות על Zeocin (Zeo) וKanamycin (Kan) המכיל צלחות אגר (איור 3). SPI מיוצר הווקטור להתרפק Dnttip1 השתנה באופן נכון בכל recombinants 12 ניתח (איור 3 ג). רצפי DNA אימתו את העדר כל שגיאות הנובעות מסינתזת אוליגו או ההגברה PCR.
דוגמא נוספת של SPI מעורב ההכנסה במסגרת של חלבון פלואורסצנטי צהוב משופר (EYFP) צמודה קלטת בחירה בגן P2rx1. גן P2rx1 מקודד קולט G-מצמידים חלבון המשמש כערוץ יון מגודר-ATP 29. הצמדה לקרינת YFP מאפשרת המעקב של הקולטן P2x1 על פני התא בvaמבחני פונקציונליים rious. P2rx1 הוא מוקד קשה אחר שהציג בעיות משמעותיות עם מתודולוגיות recombineering קונבנציונליות (מידע לא מוצג). שימוש SPI, קטע 12 KB של גן P2rx1 מקיף את אקסון המסוף (אקסון 12) היה subcloned לתוך וקטור Zeo p15A ושונה עם ההכנסה המשותפת של קלטת ניאו EYFP -LoxP מוקפת החלפת קודון העצירה באקסון 12 לבנות P2rx1-EYFP וקטור להתרפק (איור 3D). בדוגמא זו, הווקטור המפגר הגדיל המוגן p15A (1.7 kb) הכיל 230 נ"ב HA וקלטת EYFP הכילה 50 נ"ב HA וגם נשארה ללא שינוי. קלטת הכנסת EYFP (2.7 kb) נערכה על ידי החפיפה שחבור PCR של גן EYFP, PCR המוגבר מpEYFP-C1, ואת קלטת LoxP- PGK-BGhpA-LoxP-em7 ניאו, PCR מוגבר מpL452 (NCI, פרדריק) . תגובת SPI פיק מאות מושבות (מידע לא מוצג). RE ניתוח DNAminipreps הכין מ -11 שיבוטים הראה הרוב כלול הווקטור להתרפק P2rx1-EYFP התאסף כראוי (איור 3E). אימות נוספות על ידי רצפי DNA הראתה הכנסה נקיה משגיאות של קלטת EYFP. עם זאת, חלק מהשיבוטים הראה פרופילים של הפער לא מתויג תוקן ופלסמידים פער תיקון מתויגים באותו התא (נתיבים 6-9). כמה דוגמאות הכילו גם באופן שגוי פער תיקון (מסלול 2) או פלסמידים mistargeted (נתיבים 4 ו -5). הכישלון של subcloning במקביל והמיקוד בחלק recombinants SPI מדגיש את המגבלות של שיבוט SPI יעיל בעת שימוש בקלטות גדולות (> 3 קילו), שנובעים מהאילוצים על processivity האדום של שברי DNA הארוכים 30, או אם באמצעות HA הקצר. ואכן, הגדלת HA של קלטת EYFP 200 נ"ב התייעלות SPI והמיקוד הנכון של הקלטת (מידע לא מוצגים). גן מיקוד עם P2rx1 - הווקטור להתרפק EYFP בJM8.N4תאי העכבר ES (C57BL / 6 זן) שנוצרו 6 שיבוטים חיוביים מתוך 96, שהכילו את רצף P2rx1-EYFP הממוקד בצורה הנכונה (איור 3F).
BAC כתב וקטורים
שיבוט BAC של גן המטרה לעתים קרובות מכיל את כל אלמנטים הדרושים מעלה או במורד רגולציה למשל, משפרי, UTRs וכו ', כמו גם אמרגן אנדוגני לנהוג ביטוי גנים ברמות טבעיות 31. וקטור כתב BAC לכן הרכב המועדף לשחזר את דפוס הביטוי אנדוגני של גן 32. עם זאת, גודלו של פלסמיד BAC (עד 200 kb) מציג בעיות מעשיות משמעותיות עם transfecting BAC שלם לתאים 33. הקטנת הגודל של להכניס את הגנומי BAC דרך BAC זמירה 34,35, תוך שמירה על האלמנטים הרגולטוריים הנדרשים של גן, מאפשר טיפול קל יותר של BAC והתוצאות בtransfecti יעיל יותרעל. טכנולוגית הנדסת BAC הנוכחית כרוכה סבבים רבים של recombineering להשגת מטרה זו 35. כדי להדגים את התועלת של SPI בBAC זמירה, וקטור pBeloBAC11 BAC שימש לsubclone רצף הגנומי 30 kb כולל את גן P2rx1 באורך המלא מkb 168 P2rx1 BAC יחד עם ההכנסה בו זמני של קלטת EYFP בגן P2rx1 (איור 4 א). עמוד השדרה pBeloBAC11 וקטור Zeo (6.5 kb) המכיל 180 נ"ב HA היה PCR מוגבר עם oligos שונה שנוצרה וקטור מוגן גדיל המפגר. אותו קלטת EYFP ניאו (3 kb), המשמשת לבניית הווקטור להתרפק P2rx1 הקודם, הייתה PCR מוגבר באמצעות oligos המוגן גדיל המפגר המכיל 180 נ"ב HA וממוקד אקסון P2rx1 12 החלפת קודון העצירה. בעקבות electroporation המשולב של קלטת EYFP ווקטור Zeo pBeloBAC11 לexpr תאי P2rx1 BACessing חלבוני recombineering gbaA, התרבות הייתה התאוששה 10 מיליליטר LB pH 8 במשך 3 שעות ב37C להפריד פלסמידים BAC. recombinants הטהור נבחרו על Zeo וKan צלחות אגר ונצפו בתדירות של 2 x 10 -6. ניתוח genotyping המושבה PCR חשף BAC המוצלח זמירה ב3 מתוך 6 שיבוטים שנותחו (איור 4). טווח ארוך הגברה PCR על פני הכניסה לאתר EYFP אישרה התאגדות הקלטת הנכונה בשלושת השיבוטים החיוביים (איור 4). שלושה השיבוטים חסרים להוסיף EYFP היו גם באופן שגוי פער תוקן ב5 'סוף, אם כי הסיבה לmistargeting של קלטת EYFP בשיבוטים אלה עשויה להיות נפרדת לסגירה הנכונה של 5' סוף BAC. שלושה השיבוטים BAC החיובי EYFP נותחו נוספים עם מעכל RE והראו הדפוס הצפוי של BAC הגזוז בצורה הנכונה EYFP רקומביננטי (איור 4C </ Strong>). ניתוח רצף חשף היעדר השגיאות בקלטת EYFP רק 1 שיבוט מתוך 3 התוצאות החיוביות.
Knockout המותנה וקטורים (cko)
אבלציה המותנה של ביטוי גנים היא כלי חשוב לחקור תהליכים התפתחותיים או ללמוד מערכות ביולוגיות בנקודת זמן מסוימת. אסטרטגית נוקאאוט גן מותנית בדרך כלל כרוכה במיקום של אתרי רקומבינציה LoxP מקיפים אקסון קריטי (CE). המחיקה של CE על ביטוי Cre או הפעלה מייצרת frameshift וקודון עצירה מוקדם, וכתוצאה מכך השפלה של mRNA בשל ריקבון שטויות בתיווך (NMD). הבנייה של וקטור גן מיקוד מותנה היא משימה מורכבת וכוללת מספר שלבים של subcloning, מיקוד ושינוי 22. SPI מציע מסלול נוח כדי לפשט את התהליך הזה. כמקרה מבחן, אלל מותנה של גן Zrsr2 נבנהבאמצעות מתודולוגיה SPI (איור 5 א). גן Zrsr2 מקודד גורם שחבור ועותק יחיד נמצא על כרומוזום X. המצב המותנה של מחיקת גן הוא חשוב במיוחד במקרה זה כדי לשלוט על האפשרות של תאי הסתגלות לחוסר Zrsr2 במהלך בחירה בתאי גזע עובריים באסטרטגיה מחיקת גן המיקוד מכוננת. SPI בוצע לsubclone חלק 10 kb של גן ZrSr2 עם הכנסה מקבילה של שתי קלטות בחירת LoxP מוקפות שונות. FRT-PGK-em7-FRT-LoxP ניאו-הקלטת (2 KB) הייתה PCR מוגבר מRE מתעכל pL451 באמצעות מפגר oligos גדיל מוגן שהכילה 180 נ"ב HA מיקוד ZrSr2 אינטרון 2. קלטת שנייה מכילה רוקס-PGK-em7- Blasticidin (BSD) -Rox-LoxP (2 KB) היה PCR מוגבר מפלסמיד R6K עם oligos המוגנת הגדיל המפגר המכילה 180 נ"ב HA זהה לאזור במורד הזרם באינטרון 3. שני אתרי LoxP המוקף אקסון 3, CE ד שeletion על תוצאות הפעלת Cre מותנות בframeshift ומציג קודון עצירה מוקדם. פלסמיד subcloning Zrsr2 (1.6 kb) היה PCR מוגבר מפלסמיד Zeo p15A RE linearised באמצעות מפגר oligos גדיל מוגן המכילה 180 נ"ב HA הקצוות של רצף Zrsr2 10 kb התאמה. תגובות SPI בוצעו כמתואר לפני ומצופה על צלחות Zeo + ניאו + BSD. וקטור המיקוד מותנה ZrSr2 הורכב בהצלחה ברוב של 12 recombinants שנבדק (איור 5). ניתוח רצפי DNA נוסף הראה הכנסה נכונה של שני סמני הבחירה בוקטור ZrSr2 cko.

איור 1. SPI שיבוט. סקירה כללית של תהליך שיבוט SPI שילוב החדרת קלטת וsubcloning בשלב אחד. (א) שיבוט BAC הוא טראןsformed עם פלסמיד pSC101 BADgbaA וגדל ב30C. (ב) בעקבות האינדוקציה arabinose לבטא חלבונים אדומים, קלטת א-סימטרית שונה החדרת פלסמיד וsubcloning מוכנסת שיבוט BAC ונבחרו עם שני סמני ההכנסה וsubcloning ליצור הווקטור הסופי. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של נתון זה.
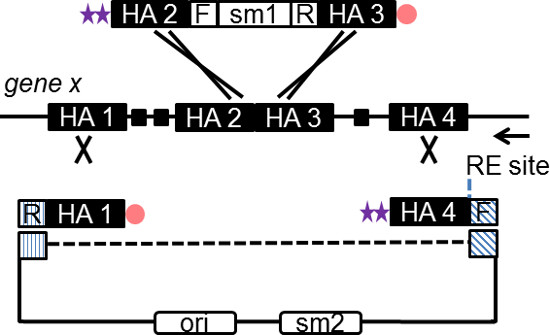
איור 2. סכמטי הממחיש את העיצוב של oligos recombineering SPI. פלסמיד subcloning וקלטת ההכנסה שניהם נוצרו על ידי PCR באמצעות שילוב של PTO המסוף ופוספט oligos שונה. בר PCR על עיכול אדום in vivo, מייצר ssDNA ביניים, שanneals לגדיל המפגר של מזלג השכפול. GenHA הספציפי הדואר של 50-180 נ"ב הוא שולב כל אוליגו כפי שמוצג. החץ מציין את הכיוון של שכפול הדנ"א ברחבי גן מועמד. קו מקווקו מייצג רצף פלסמיד subcloning לא שולב במוצר ה- PCR. אתר RE, אתר אנזים ההגבלה ליניארי של וקטור סופי; F, רצף קדימה (20 נ"ב) ספציפי לפלסמיד subcloning או קלטת הכנסה; R, רצף הפוך משלים (20 נ"ב) של פלסמיד או קלטת; מ"ר, סמן בחירה. לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. SPI מאפשר בנייה של וקטורים להתרפק קשים. () סכמטי של אסטרטגית SPI המשמשת לבנייה של כפול Dnttip1 מתויג וקטור. חץ הזמנה אישיקייטס הכיוון של שכפול על שיבוט BAC. תוצאות ציפוי (B) של דגימות uninduced והמושרות של ניסוי Dnttip1 SPI. (C) EcoRI תקציר של שיבוטים Dnttip1 SPI. M, סולם kb 1 (חוד); C, פער p15A Dnttip1 תיקון פלסמיד חסר קלטת התג הכפולה. גדלי בר הם: 9.2 + 4.4 + 2.2 kb מתויג,; שליטה; 9.2 4.6 + kb. בניית (D) SPI מבוסס P2rx1-EYFP להתרפק וקטור. (E) EcoRI התקציר של שיבוטים P2rx1-EYFP SPI. M, 1 kb + סולם (Invitrogen); C, פער p15A P2rx1 תיקון פלסמיד חסר קלטת EYFP. גדלי בר הם: 8.3 + 4.4 + 3.1 + 0.03 kb מתויג,; שליטה; 8.3 + 3.1 + 1.8 + 0.03 kb (F) ניתוח כתם דרום של P2rx1 -. גן EYFP מיקוד בתאי תא JM8.N4 ES. פנל עליון, כתם דרום עם חללית סוף '3 באמצעות PshAI לעכל. מוצג הוא תוצאת הקרנת 5 שיבוטים. פנל תחתון, דרום למחוק באמצעות5 'הבדיקה הסוף וSpeI התקציר של התוצאות החיוביות זיהו מן 3' הקרנת הסוף. אתר PshAI RE; S, אתר SpeI RE. קו מקווקו מייצג את סוף HA הווקטור. קופסא שחורה מציינת בדיקה דרום. שברי הגבלה צפויים הם, PshAI: WT, 8.9 kb; EYFP-הניאו, 11.5 kb; SpeI:. WT, 6.9 kb; EYFP-הניאו, 7.6 kb אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
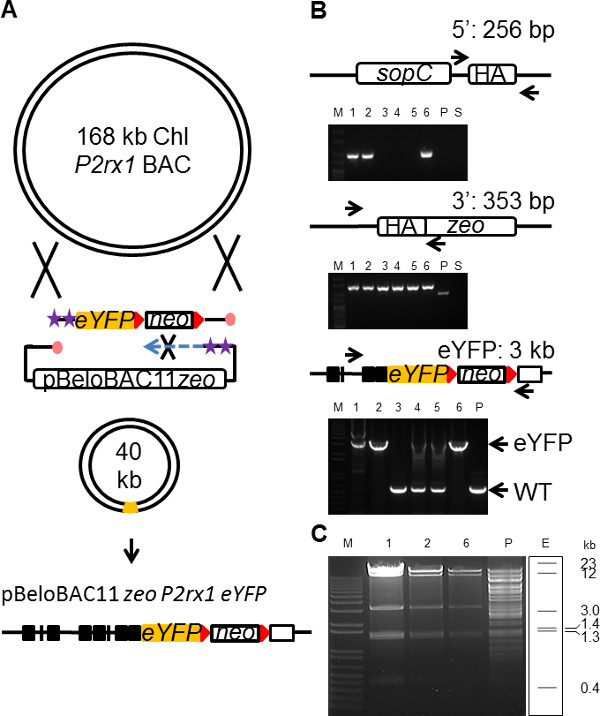
איור 4. פשוטה BAC זמירה באמצעות SPI. (א) סכמטי הממחיש את הרעיון של BAC זמירה באמצעות SPI. מפתח לסימנים מתואר באיור 1. הגברה (B) PCR על פני 5 'ו 3' מסתיימת של להכניס את subcloned ומעבר לinsertio P2rx1-EYFPאתר n. אסטרטגית ההקרנה מוצגת לכל סוג של PCR. M (פנל עליון), נ"ב Hyperladder 25, (לוחות תחתון), 1kb +; P, P2rx1 BAC; . S, פלסמיד Zeo pBeloBAC11 subcloning (C) HindIII לעכל של השיבוטים SPI BAC החיוביים שלושה EYFP מ( B); E, צפוי דפוס הגבלת HindIII של BAC EYFP הגזוז. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
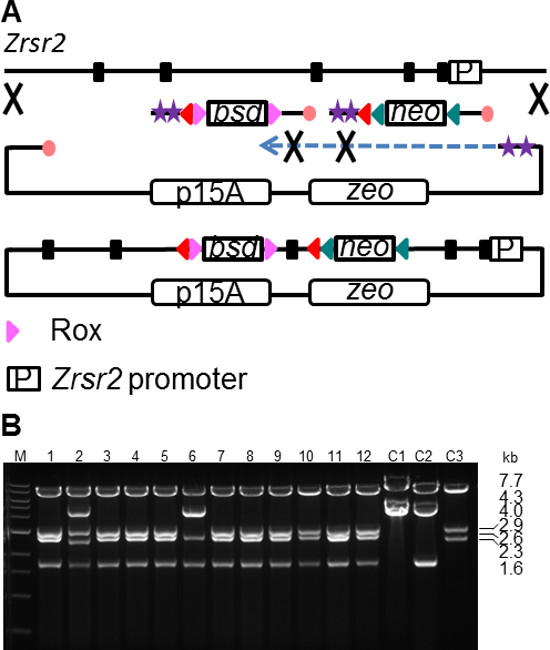
5. דור איור מותנה וקטור נוקאאוט באמצעות שיבוט SPI. סכמטי (א) להכנסה בו זמנית של שתי קלטות בחירת LoxP מוקפות שונות במהלך subcloning של אלל Zrsr2. מפתח לסימנים מתואר באיור 1. (ב) </ מעכל strong> EcoRI של שיבוטים Zrsr2 SPI. L, סולם kb 1 (חוד); C1, פלסמיד פער תיקון p15A ZrSr2, C2, פער p15A ZrSr2 תיקון פלסמיד המכיל את התוסף הניאו; C3, פער p15A ZrSr2 תיקון פלסמיד המכיל את תוסף BSD. גדלי בר הם: cko, 7.7 + 2.9 + 2.6 + 1.6 kb; C1, 7.7 4.0 + kb; C2, 7.7 + 4.3 + 1.6 kb; C3, 7.7 + 2.9 + 2.3 kb. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| אין צעדים | צינור recombineering הקונבנציונלי | ב recombineering Multiplex |
| שלב 1 | טרנספורמציה של פלסמיד recombineering למארח BAC | טרנספורמציה של פלסמיד recombineering למארח BAC. הכנת וקטורי מיקוד קלטות וsubcloning. |
| צעד2 | החדרה של קלטת R1 / R2 Gateway | שיבוט תיקון פער Multiplex |
| שלב 3 | החדרה של קלטת Kan floxed | O / תרבות N ממושבות אחת |
| שלב 4 | תיקון פער לפלסמיד R3 / R4 | הכנת פלסמיד ואימות |
| שלב 5 | הפיכת Cre + E. coli | |
| שלב 6 | הכנת פלסמיד ואימות | |
| שלב 7 | O / N משולש תגובת Gateway | |
| שלב 8 | שינוי של שלוש דרך תגובת Gateway לDH10B E. תאי coli | |
| שלב 9 | תרבות לילה ממושבות אחת | |
| שלב 10 | הכנת פלסמיד ואימות רצף | |
| הזמן הממוצע ב -4 ימים לשיבוט מאומת | ||
טבלת 1: השוואה בין recombineering הקונבנציונלי עם SPI בבנייה של וקטורים בנוקאאוט על תנאי.
| מאגר RE | 5 μl |
| DNA | 1 מיקרוגרם פלסמיד או מוצרי PCR מטוהרים |
| RE | 1 μl (5 יחידות או יותר) |
| TE | עד 50 μl |
| לדגור על 37 מעלות צלזיוס במשך שעה לפחות 1. מחממים inacitvate בהתאם להוראות היצרנים | |
טבלה 2: RE לעכל.
| חומרי PCR | ריכוז סופי |
| חיץ PCR | 1x |
| dNTP | 200 ננומטר |
| 4 MgSO | 1.5 מ"מ |
| Betaine | 1.3 M |
| DMSO | 1% |
| פריימר קדימה | 200 ננומטר |
| פריימר הפוך | 200 ננומטר |
| DNA פולימראז | 1 U |
| תבנית | 10 ng של פלסמידים multicopy או 2.5 μl של DNA miniprep לPCRs genotyping |
| מים | עד 50 μl |
| לתגובת PCR סטנדרטית 50 μl עם פלסמידים multicopy. PCRs genotyping טווח ארוך הוקם ב -25 PCR תגובות μl. | |
| תנאי PCR | |
| 95 ° C | 2 דקות |
| 92 ° C | 10 שניות |
| 55 ° C | 30 שניות |
| 72 ° C | 30 שניות |
| 30 ב מחזורים | |
| מחזור ב לא ניתן להאריך עד 35 לgenotyping BAC PCR | |
לוח 3: PCR Set-up והגבלות.
| אנטיביוטיקה | ריכוז (-1 מיליליטר מיקרוגרם) |
| Ampicllin | 50 |
| Blasticidin ב | 40 |
| כלורמפניקול | 12.5 |
| גנטמיצין | 2 |
| Hygromycin ג | 30 |
| Kanamycin ב | 15 |
| טטרציקלין | 4 |
| Trimethoprim ג | 10 |
| Zeocin | 5 |
| מומלץ לשימוש עם BACS ופלסמידים multicopy בעת שימוש בשילובים בrecombineering זמנית | |
| ב Blasticidin (35 מיקרוגרם מיליליטר -1) וKanamycin (6 מיקרוגרם מיליליטר -1) בעת שימוש יחד בשילוב | |
| ג hygromycin וTrimethoprim אינם מומלצים לבחירה עם BACS עותק יחיד. | |
ריכוזי אנטיביוטיקה לוח 4. מומלצת לשימוש בניסויי SPI.
Discussion
בנייה של שורות תאי גזע עובריים ומודלי עכבר היסטורי מעורבת גן המיקוד באמצעות בונה פלסמיד המכילה את האלל שונה 4. עם זאת, הבנייה של וקטורי גן המיקוד המורכבים אלה הוכיחה את עצמו צוואר בקבוק משמעותי בזמן הייצור של מודלים כאלה. פיתוח אסטרטגיות בניית וקטור recombineering מבוסס אפשר עיצובי וקטור משופרים והרכבת וקטור יעילה יותר. עם זאת, פרוטוקולי recombineering הנוכחיים עדיין כרוכים שלבים מרובים, דורשים טיהור פלסמיד ביניים ולהשתמש זני חיידקים שונים. Subcloning הכנסה בתוספת מציע גישה חדשנית לבניית וקטור שניתן לבצע באירוע electroporation אחד בזן מארח BAC תושב. השירות של SPI במיקוד גן נבדק כאן במגוון רחב של יישומי בניית וקטור. בכל המקרים שנבדקו כאן, SPI הוכיח להיות יעיל ופלסמיד רקומביננטי הנכון הופק.ברוב המכריע של המקרים, הקלטות שונות מרובות הוכנסו בצורה נכונה בוקטור המיקוד. קלטות DNA גדולות ווקטורים שוכנו בקלות בפרוטוקול SPI והפגינו הגמישות של מערכת זו.
SPI מסתמך על השימוש ברצפי הומולוגיה ארוכים והגנת phosphorothioate (PTO) של קלטות DNA ליניארי. שינוי PTO מקנה הגנה מפני exonucleases לDNA ליניארי 20,21 וHA הארוך מגביר את יעילות רקומבינציה להתיר ריבוב. עם זאת, סינתזה של רצפי אוליגו יותר מגדילה את הסיכוי של צבירת שגיאות במיוחד מחיקות. מוטציות באוליגו יכולות להיות הרסניות, במיוחד אם הם מכסים אזורי חלבון קידוד. רצפי DNA על פני HA ומכסה את האורך המלא של הקלטת הוכנסה מומלץ מאוד לחסל את השיבוטים עם כל שינויי רצף. שימוש במערכת ה- DNA פולימראז באיכות גבוהה גם הציעה להימנע מהקדמה שלשגיאות y PCR. האורך ובהרכב של HA של פלסמיד subcloning הוא יותר קריטי ביחס לזה של קלטת ההכנסה (מידע לא מוצג). עבור יישומים רגישים במיוחד כמו הבנייה של וקטורים להתרפק, שבו מוטציות כל באזורי אקסון אינן נסבלות, HA של קלטת ההכנסה יכול להתקצר (50-120 נ"ב), כדי למנוע בעיות הקשורות לoligos הארוכה. קלטת ההכנסה גם ניתן להשאיר phosphorothioated ללא שינוי או הכפול (שבו ידע של הכיוון של שכפול אינו זמין). אבל ריבוב במקרים אלה עדיין דורש מוגנים ארוך פלסמידים subcloning HA. אזהרה של אסטרטגיה המסוימת הזה היא הפחתת יעילות ריבוב שעשוי להשפיע על שיבוט SPI בלוקוסים שונים.
האורך של קלטת ההכנסה ופלסמיד subcloning הוא עוד פרמטר חשוב בשיבוט SPI. מולקולות DNA גדולות electroporate פחות ביעילות ובהשפעה מצטברת, ניתנו מחדשquirement להציג את כל הקלטות באותו התא (מידע לא מוצג). הריבוב הוא יעיל ביותר עם קלטות הכנסה קטנות יותר. DNA שברים גדולים יותר מאשר 3 kb גם להציב גבול על עיבוד ssDNA האדום בתיווך, שהוא יעיל ביותר עד 3 kb 30. קלטות הכנסה עולה על 3 קילו הן כפולים resected ולשלב מחדש בצורה פחות יעיל באמצעות מסלול עצמאי בטא 20. לכן, הקרנה של מושבות מספיק כדי לזהות את השיבוט הנכון הופכת להיות חשובה במקרים אלה. משך זמן ארוך יותר של פוסט electroporation רקומבינציה גם מגדיל את סיכויי ההחלמה של השיבוט הנכון בתרגילי SPI קשים. עד ארבע קלטות קטנות (<1.5 kb) יכול להיות מוכנסת בו זמנית עם תהליך SPI, אם כי יעילות הריבוב יורדת עם כל קלטת נוספת (מידע לא מוצג). עם זאת, זה משקף את התוצאה של ניסוי SPI אופטימלי ורצוי לשקול את גבולות ריבוב בעת שימוש רבים קלטות גדולות.
הפיתוח של כלים לעריכת הגנום כמו חזרות palindromic קצרות interspaced באופן קבוע התקבצו מערכת (CRISPR) endonuclease -cas9 אפשרה יצירת שינויי הגנום רומן והובילה להנדסת הגנום יעילה יותר 36. עם זאת, טכנולוגיות חדשות יותר אלה משלימים וקטורי גן מיקוד ולא תפסו את מקומן. זה שחזה כי מערכת CRISPR-CAS יכולה להחליף בחירת אנטיביוטיקה ולהמשיך ולעדכן את פרוטוקול recombineering זמנית.
Disclosures
T.R.R is the inventor of a British patent application on multiplex recombineering technology.
Acknowledgements
T.R.R conceived the project, designed and performed experiments and prepared the manuscript. E.J.K and S.E.M performed experiments. All authors contributed intellectually to the final manuscript. This work was funded by a University of Leicester Innovation Fellowship to SEM and by a UK Medical Research Council (MRC) Senior Research Fellowship to S.M.C (MR/J009202/1). DNA sequencing was performed by Protein and Nucleic Acid Laboratories (PNACL), Centre for Core Biotechnology Services, University of Leicester. We wish to thank A. Francis Stewart for providing the Rox and Dre plasmids. pL451 and pL452 plasmids were obtained from National Cancer Institute (NCI), Frederick, USA.
Materials
| Name | Company | Catalog Number | Comments |
| Antibiotics except Zeocin | Sigma: http://www.sigmaaldrich.com | Ampicillin, A9518-5G; Chloramphenicol , C1919-5G; Blasticidin, 15205-25MG; Gentamicin, G1264-50MG; Hygromycin, H3274-50MG; Kanamycin,: K1876-1G; Tetracycline hydrochloride, T7660-5G; Trimethoprim, 92131-1G | |
| Zeocin | Invivogen: | ant-zn-1 | Zeocin is also available from Life technologies/Fisher |
| C57BL/6 BAC clones | CHORI: https://bacpac.chori.org/ | RPCI-23 or RPCI-24 BAC libraries | 129/Sv BAC clones can be obtained from Invivogen or Life technologies/Fisher |
| KOD hotstart DNA polymerase system | Millipore: https://www.merckmillipore.com | 71086-3 | |
| L-Arabinose | Sigma: http://www.sigmaaldrich.com | A3256-25G | |
| Long oligos | IDT: https://www.idtdna.com; Gene link: https://www.genelink.com | IDT Ultramers or Gene Link long oligos | PTO and Phosphosphate available as custom modifications. PAGE purification strongly recommended for long oligos. |
| MinElute PCR purification kit | Qiagen: http://www.qiagen.com | 28004 | Minimum elution PCR purifications kits are preferred. |
| QIAPrep Spin Mini Prep kit | Qiagen: http://www.qiagen.com | 27104 | Silica column or similar matrix kits are preferred. |
| Restriction enzymes | NEB: https://www.neb.com | DpnI: R0176L | See NEB website for a list of RE. |
References
- Dovey, O. M., Foster, C. T., Cowley, S. M. Histone deacetylase 1 (HDAC1), but not HDAC2, controls embryonic stem cell differentiation. Proc. Natl. Acad. Sci. USA. 107, 8242-8247 (2010).
- Harvey, M., et al. Spontaneous and carcinogen-induced tumorigenesis in p53-deficient mice. Nat. Genet. 5, 225-229 (1993).
- Waterhouse, P., et al. Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4. Science. 270, 985-988 (1995).
- Thomas, K. R., Capecchi, M. R. Site-directed mutagenesis by gene targeting in mouse embryo-derived stem cells. Cell. 51, 503-512 (1987).
- Hasty, P., Rivera-Pérez, J., Bradley, A. The length of homology required for gene targeting in embryonic stem cells. Mol. Cell. Biol. 11, 5586-5591 (1991).
- Smithies, O., Gregg, R. G., Boggs, S. S., Koralewski, M. A., Kucherlapati, R. S. Insertion of DNA sequences into the human chromosomal beta-globin locus by homologous recombination. Nature. 317, 230-234 (1985).
- Hirata, R., Chamberlain, J., Dong, R., Russell, D. W. Targeted transgene insertion into human chromosomes by adeno-associated virus vectors. Nat. Biotechnol. 20, 735-738 (2002).
- Szostak, J. W., Orr-Weaver, T. L., Rothstein, R. J., Stahl, F. W. The double-strand-break repair model for recombination. Cell. 33, 25-35 (1983).
- Bradley, A., Evans, M., Kaufman, M. H., Robertson, E. Formation of germ-line chimaeras from embryo-derived teratocarcinoma cell lines. Nature. 309, 255-256 (1984).
- Fu, J., Teucher, M., Anastassiadis, K., Skarnes, W., Stewart, A. F. A recombineering pipeline to make conditional targeting constructs. Methods Enzymol. Soriano, P. M., Wassarman, P. M. 477, Academic Press. 125-144 (2010).
- Zhang, Y., Buchholz, F., Muyrers, J., Stewart, A. A new logic for DNA engineering using recombination in Escherichia coli. Nat. Genet. 20, 123-128 (1998).
- Copeland, N., Jenkins, N., Court, D. Recombineering: a powerful new tool for mouse functional genomics. Nat. Rev. Genet. 2, 769-779 (2001).
- Muyrers, J., Zhang, Y., Testa, G., Stewart, A. Rapid modification of bacterial artificial chromosomes by ET-recombination. Nucleic Acids Res. 27, 1555-1557 (1999).
- Yu, D., et al. An efficient recombination system for chromosome engineering in Escherichia coli. Proc. Natl. Acad. Sci. USA. 97, 5978-5983 (2000).
- Sharan, S. K., Thomason, L. C., Kuznetsov, S. G., Court, D. L. Recombineering: a homologous recombination-based method of genetic engineering. Nature Protoc. 4, 206-223 (2009).
- Wang, J., et al. An improved recombineering approach by adding RecA to λ red recombination. Mol. Biotechnol. 32, 43-53 (2006).
- Datta, S., Costantino, N., Court, D. L. A set of recombineering plasmids for gram-negative bacteria. Gene. 379, 109-115 (2006).
- Fu, J., et al. Full-length RecE enhances linear-linear homologous recombination and facilitates direct cloning for bioprospecting. Nat. Biotechnol. 30, 440-446 (2012).
- Muyrers, J., Zhang, Y., Buchholz, F., Stewart, A. RecE/RecT and Redalpha/Redbeta initiate double-stranded break repair by specifically interacting with their respective partners. Genes Develop. 14, 1971-1982 (2000).
- Maresca, M., et al. Single-stranded heteroduplex intermediates in lambda Red homologous recombination. BMC Mol. Biol. 11, 54(2010).
- Mosberg, J. A., Lajoie, M. J., Church, G. M. Lambda Red recombineering in Escherichia coli occurs through a fully single-stranded intermediate. Genetics. 186, 791-799 (2010).
- Liu, P., Jenkins, N. A., Copeland, N. G. A highly efficient recombineering-based method for generating conditional knockout mutations. Genome Res. 13, 476-484 (2003).
- Chan, W., et al. A recombineering based approach for high-throughput conditional knockout targeting vector construction. Nucleic Acids Res. 35, e64(2007).
- Zhang, Y., Muyrers, J. P. P., Testa, G., Stewart, A. F. DNA cloning by homologous recombination in Escherichia coli. Nat. Biotechnol. 18, 1314-1317 (2000).
- Lee, E. C., et al. A highly efficient Escherichia coli-based chromosome engineering system adapted for recombinogenic targeting and subcloning of BAC DNA. Genomics. 73, 56-65 (2001).
- Skarnes, W. C., et al. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Valenzuela, D. M., et al. High-throughput engineering of the mouse genome coupled with high-resolution expression analysis. Nat. Biotechnol. 21, 652-659 (2003).
- Bantscheff, M., et al. Chemoproteomics profiling of HDAC inhibitors reveals selective targeting of HDAC complexes. Nat. Biotechnol. 29, 255-265 (2011).
- Mulryan, K., et al. Reduced vas deferens contraction and male infertility in mice lacking P2X1 receptors. Nature. 403, 86-89 (2000).
- Subramanian, K., Rutvisuttinunt, W., Scott, W., Myers, R. The enzymatic basis of processivity in lambda exonuclease. Nucleic Acids Res. 31, 1585-1596 (2003).
- Antoch, M. P., et al. Functional identification of the mouse circadian Clock gene by transgenic BAC rescue. Cell. 89, 655-667 (1997).
- Rostovskaya, M., et al. Transposon-mediated BAC transgenesis in human ES cells. Nucleic Acids Res. 40, e150(2012).
- Giraldo, P., Montoliu, L. Size matters: use of YACs, BACs and PACs in transgenic animals. Transgenic Res. 10, 83-103 (2001).
- Hill, F., et al. BAC trimming: minimizing clone overlaps. Genomics. 64, 111-113 (2000).
- Warming, S., Costantino, N., Court, D. L., Jenkins, N. A., Copeland, N. G. Simple and highly efficient BAC recombineering using galK selection. Nucleic Acids Res. 33, e36(2005).
- Cong, L., et al. Multiplex Genome Engineering Using CRISPR/Cas Systems. Science. 339, 819-823 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved