Method Article
Subklonierung Plus-Insertion (SPI) - A Novel Recombineering Verfahren zur schnellen Bau der Gene Targeting Vektoren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Gene targeting methodologies can be used to generate transgenic mice with knockout, knock-in and tagged alleles. Here, we describe an improved method of recombineering in E. coli, that we term ‘subcloning plus insertion’, which can be used to generate custom gene targeting vectors rapidly.
Zusammenfassung
Gene targeting refers to the precise modification of a genetic locus using homologous recombination. The generation of novel cell lines and transgenic mouse models using this method necessitates the construction of a ‘targeting’ vector, which contains homologous DNA sequences to the target gene, and has for many years been a limiting step in the process. Vector construction can be performed in vivo in Escherichia coli cells using homologous recombination mediated by phage recombinases using a technique termed recombineering. Recombineering is the preferred technique to subclone the long homology sequences (>4kb) and various targeting elements including selection markers that are required to mediate efficient allelic exchange between a targeting vector and its cognate genomic locus. Typical recombineering protocols follow an iterative scheme of step-wise integration of the targeting elements and require intermediate purification and transformation steps. Here, we present a novel recombineering methodology of vector assembly using a multiplex approach. Plasmid gap repair is performed by the simultaneous capture of genomic sequence from mouse Bacterial Artificial Chromosome libraries and the insertion of dual bacterial and mammalian selection markers. This subcloning plus insertion method is highly efficient and yields a majority of correct recombinants. We present data for the construction of different types of conditional gene knockout, or knock-in, vectors and BAC reporter vectors that have been constructed using this method. SPI vector construction greatly extends the repertoire of the recombineering toolbox and provides a simple, rapid and cost-effective method of constructing these highly complex vectors.
Einleitung
Die Entwicklung von Gen-Targeting-Technologien, hat den Bau von Zelllinien und Maus-Modellen ermöglicht, verschiedene biologische Systeme 1-3 zu untersuchen. Ein Schlüssel der ersten Stufe in der Modifikation einer genomischen Sequenz ist die Gestaltung und Konstruktion eines Gen-Targeting-Vektor 4. Targeting-Vektoren sind Plasmidkonstrukte, die das Allel von Interesse, die die gewünschten Modifikationen (n) durch einen Selektionsmarker (beispielsweise Neomycin) flankiert tragen und langen genomischen Regionen für effiziente homologe Rekombination in Säugerzellen 5 erforderlich. Präzise Genveränderung durch Einbringen des Targeting-Vektors in embryonale Stammzellen (ES-Zellen) 6 oder somatischen Zellen 7, dadurch gelöst, dass eine homologe Rekombination zwischen identischen Abschnitte der DNA-Sequenz auf dem Zielvektor und den genomischen Locus resultiert in der Übertragung von der beabsichtigten Modifikation um das Genom durch Genkonversion 8. Solche modified ES-Zellen können in der Maus Blastozysten injiziert werden, um Nachkommen (Chimären) herstellen, die dann übertragen können diese modifizierten Allele über die Keimbahn 9. Ein alternativer Weg, um transgene Mäuse zu erzeugen beinhaltet die Mikroinjektion eines Genexpressionsvektor in einzelligen Maus Zygoten, die der zufälligen Integration des Vektors in das Genom der Maus 10 führt. Traditionelle Methoden der Vektorkonstruktion wurden auf herkömmliche verlassen 'cut and paste' Klonen Verwendung von Restriktionsenzymen und DNA-Ligasen, um die verschiedenen Selektionsmarker und genomische Fragmente in einen Vektor-Rückgrat zu klonen. Jedoch ist eine inhärente Begrenzungsfaktor herkömmlicher Klonen die Positionierung und die Wahl der Restriktionsstellen, vor allem bei längeren DNA-Sequenzen. Dies erfordert häufig mehrere Subklonierungsschritte und führt auch fremde DNA-Sequenzen in den Vektor, die oft zu einer geringeren Effizienz des Gen-Targeting.
Recombineering (rekombinogenen gerineering) ist ein DNA-Engineering-Technologie, die diese Einschränkungen überwunden durch die Verwendung der homologen Rekombination (HR) durch Phagen Rekombination Proteine in E. vermittelte coli-Zellen 11,12. Da jede Region eine homologe Sequenz kann als Substrat Rekombination dienen, werden die Beschränkungen der Verfügbarkeit von Restriktionsstellen entfernt wurde. Große DNA-Sequenzen können nahtlos direkt in vivo modifiziert werden, so auch ihre strukturelle Integrität bewahren 13. Recombineering ist sehr effizient mit kurzen Homologien (50 bp) 14 und damit Homologiearme (HA) können bequem in synthetische Oligo-Sequenzen integriert werden. In einem typischen Experiment Rekombinationstechnologie, einem Oligo oder einem Doppelstrang-DNA (dsDNA) Fragment, HA in Rekombinationstechnologie kompetente E. elektroporiert coli-Zellen, welche die Ziel entweder auf dem Chromosom oder auf einem Plasmid 15 angeordnet. Die Rekombination Potential wird durch induzierbare Expression des Red rec tragenenombination Proteine der Phagen 16,17 bzw. die RecET Proteine der rac Prophagen 18. Die Rot / RecE Exonuklease wandelt lineare dsDNA zu einer Einzelstrang-DNA (ssDNA) Zwischen, die dann von ihrem Partner, Rot / RecT, eine einzelsträngige Glühen Protein (SSAP) 19 gebunden. Das Tempern eines langen ssDNA oder eine kurze Oligo an seinen komplementären Zielsequenz auf der Folgestrang der Replikationsgabel und führt zum Einbau der Sequenz an der Targetstelle. Verzögerungsstrang ssDNA Rekombination ist die Grundlage für die hohe Effizienz der Rekombination und können durch die "Beta" Rekombinationsmodell 20,21 beschrieben.
Ein typischer Workflow Rekombination zum Aufbau einer Gen-Targeting-Vektor umfasst eine der beiden folgenden Strecken. Ein Weg beinhaltet Subklonieren der gewünschten genomischen Region von einem Maus-BAC-Klons in ein Plasmid, gefolgt von dem sequentiellen Einführen LoxP Rekombinationsstelle, einen Selektionsmarker 22 etc. oder die alternative Route beinhaltet gezielt den BAC genomischen Locus mit den verschiedenen Zielvektorelemente durch mehrere Runden von Rekombination 10,23 und Subklonierung des modifizierten Locus in ein Plasmid durch Lücke Reparatur Klonen 24,25. Variationen zu diesem Thema wurden in verschiedenen High-Throughput-Rekombination Rohrleitungen im Rahmen der großen Maus Produktionsprogramme 26,27 verwendet. Diese Verfahren umfassen jedoch komplizierte und langwierige Stufen erfordern die Verwendung von speziellen Vektoren und E. coli-Stämmen (zB Cre-exprimierenden Zellen) und nutzen die eine oder mehrere Zwischenschritte der Vektor DNA Aufreinigung und Rücktransformation (Tabelle 1). Subklonierung und Einfügen (SPI) ist eine neue Technik, die Beta-Rekombination Rekombination und Reparatur Lücke Klonierung in einem einzigen Prozess (Abbildung 1) verbindet. SPI Vektor Montage ist einfach, schnell und flexibel und bietet deutliche Verbesserung gegenüber Standard recombiEngineering nähert (Tabelle 1). Hier zeigen wir, wie einfach und Nutzen des Einsatzes von SPI für verschiedene Vektorkonstruktion Anwendungen mit besonderem Schwerpunkt auf den Aufbau Nicht-Standard-und herausfordernde Vektor-Designs. Testfälle enthalten den Bau eines fluoreszierenden Reporter Knockin Vektor, eine doppelte Fotos mit Namensproteinexpression Knockin Vektor, ein BAC fluoreszierenden Reportervektor und eine Knockout-Vektor. Verschiedentlich die Forderung, einen Zelloberflächenrezeptor zu lokalisieren, zu reinigen, eine Kernproteinkomplex Diese untersucht oder bedingt abzutragen die Expression eines Gens.
Protokoll
1. Gene Targeting Design-
- Bestellen Sie eine entsprechende BAC-Klon für den genomischen Region von Interesse. Damit dies isogen zu der Art von ES-Zellen zu modifizieren zB werden RPCI-23 und-24 RPCI BAC-Klone zur Gen-Targeting mit C57BL / 6-ES-Zellen.
- Bewerben konventionellen Gen-Targeting-Kriterien bei der Gestaltung des Targeting-Vektors. Wichtige Parameter sind, ob die Änderung erforderlich ist konstitutiv oder bedingte zu sein, die Definition kritischer Exons (CE) zum Löschen in einem Gen-Knockout-Strategie und den Abstand und die Anordnung der Intron-Kassetten.
Hinweis: Jeder von ihnen ist im Detail an anderer Stelle 10 diskutiert. - Wählen genomischen Regionen jeweils von 5-6 kb flankieren das Ziel Modifikationsstelle.
HINWEIS: Die Größe des subklonierten Einsatz ist daher typischerweise 10-12 kb, obwohl die obere Grenze kann so hoch wie 80 kb mit einer niedrigen Kopien Subklonierung Plasmid p15A dergleichen sein, pBR322 usw. und bis zu 200 kb einer BACVektor.
2. Multiplex Recombineering Oligos
- Design-Oligos zur Plasmidrückgrat (Subklonierung Plasmid) und den selektierbaren Marker (Insertionskassette). Entwerfen jedes Oligos, daß er 180 bp HA flankierenden genomischen Zielstelle und 20 bp der spezifischen Anfangssequenz des Einschubkassette oder Subklonieren Plasmid (Figur 2) enthält.
HINWEIS: Homologiearme sollten keine sich wiederholenden Elemente enthalten, werden Vorhandensein von repetitiven Elementen in falscher Ausrichtung und Subklonierung führen. Repetitive Elemente können mit Web-basierte Tools wie die '' Wiederholen Masker '' erkannt werden. - Umfassen eine einzigartige Restriktionsenzym (RE) vor Ort auf eine der Vektor Oligos, die Gen-Targeting-Vektor für die ES-Zell-Targeting (Abbildung 2) zu linearisieren.
- Überprüfen Oligo Parameter unter Verwendung eines Oligo Analyzer Programm. Achten Sie darauf, Sekundärstrukturen in der Primerregion zu vermeidens.
- Kürzere HA (50 bp) der Einschubkassette wird toleriert und führt zu geringeren Anzahl von Rekombinanten jedoch sicherzustellen, dass die Subklonierung Plasmid HA immer mehr (180 bp).
- Bestimmen Sie die Ausrichtung der genomischen DNA-Inserts des jeweiligen BAC-Klon mit Web-basierte Tools wie '' cloneDB ''. Stellen Sie die Richtung der Replikation von Oris, indem Sie die Karte von der BAC Plasmidrückgrat im BAC-Bibliothek Konstruktion.
HINWEIS: Oris ist in der Regel gegenüber dem Transkriptionsrichtung des Chloramphenicol (Chl) Marker für alle gängigen BAC-Plasmide. - Hinzufügen zwei terminalen Phosphorothioat (PTO) Bindungen an das 5'-Ende des Oligos, die entgegengesetzt zu der Richtung der Replikation auf dem BAC-Klon ist. Hinzufügen eines 5'-Phosphat Modifikation der Rückwärts Oligo (Abbildung 2).
HINWEIS: Die asymmetrische phosphorthioiertes PCR-Kassette auf Red Verdauung erzeugt ss-DNA-Zwischenprodukt, das die Hauptverzögerungsstrang kannder Replikationsgabel.
HINWEIS: Maximal Multiplex Rekombinationsfrequenz mit den Folgestrangs geschützt Kassetten beobachtet. Führende Strang geschützt oder Dual geschützt Kassetten können gleichwertige Rekombination Effizienz irgend loci nicht zu produzieren. - Bestellen Oligos mit PAGE oder HPLC-Reinigung.
3. BAC Klon Transformation mit pSC101 BADgbaA Recombineering Plasmid.
- Um die E. machen coli-Stamm mit dem BAC Rekombination beherrschen, verwandeln es mit der pSC101 BADgbaA Plasmid, das die Red Gene 16.
HINWEIS: Die pSC101 BADgbaA Plasmid enthält die Rot-RecA-Gene unter der Kontrolle des Arabinose-induzierbaren araC-P BAD-Promotor, ein Tetracyclin-Selektionsmarker und dem temperaturempfindlichen pSC101-Replikon.- Erstechen eine sterile Pipettenspitze in der BAC-Agar-Kultur und impfen 5,0 ml LB-Medium (LB), pH 8,0, 12,556; g ml -1 Chl. Wachsen bei 37 ° C für 5 Stunden unter Schütteln bei 200 rpm.
- Kühlen Sie 10% (v / v) Glycerin-Lösung, Mikrozentrifugenröhrchen und Elektroporationsküvetten auf Eis. Kühlen eines gekühlten große Zentrifuge und Mikro bis 4 ° C.
- Bestimmen Sie die optische Dichte (OD) der Kultur mit einem Spektralphotometer und Messung der Extinktion bei 600 nm. Bereiten elektro Zellen (wie unten beschrieben), wenn ein OD 600 Lesung von 0,3 bis 0,8 erreicht wird.
- Spin down Zellen in einem 50 ml Zentrifugenröhrchen in einer großen Zentrifuge bei 1.216 × g für 5 min bei 4 ° C.
- Wash-Zellen mit 1 ml gekühltem 10% Glycerin und Spin-down-Zellen bei 17.949 × g für 20 sec bei 4 ° C. Führen Sie den Waschschritt insgesamt 3 mal.
- Resuspendieren der Zellen in einem Gesamtvolumen von 50 ul 10% Glycerin und fügen 10-200 ng der Plasmid pSC101 BADgbaA Rekombinationstechnologie. Besorgen Sie sich eine Einzelzellsuspension durch Pipettierennach oben und unten mehrere Male und dann übertragen Sie die Zellen in ein vorgekühltes 1 mm Lücke Elektroporationsküvette.
- Elektroporation der Zellen mit einem Wert von 1,8 kV, 25 & mgr; F und 200 Ω.
HINWEIS: Überprüfen Sie die richtigen Einstellungen für jede Marke von Elektroporator. Eine Zeitkonstante der Elektroporation unter 4 zeigt die Anwesenheit von Salz und anderen Verunreinigungen. - Der Zellen sofort erholen in 1 ml LB und Übertragen der Zellen in ein 50 ml Zentrifugenröhrchen.
- Wachsen die BAC GBAA Kultur bei 30 ° C für 2 Stunden unter Schütteln bei 200 Umdrehungen pro Minute.
HINWEIS: Die pSC101 BADgbaA Plasmid verloren, wenn die Zellen bei 37 ° C aufgrund der Inaktivierung des temperaturempfindlichen RepE Replikationsfaktor gezüchtet. Wachsen GBAA Zellen bei 30 ° C, um die Rekombination Funktionen aufrecht zu erhalten. - In 9 ml LB, die 12,5 & mgr; g ml -1 Chl und 4 ug ml -1 Tetracyclin (Tet) auf den wiederhergestellten BAC GBAA Kultur. Wachsen dieBAC GBAA Kultur O / N bei 30 ° C unter Schütteln bei 200 Umdrehungen pro Minute.
HINWEIS: Die Transformationseffizienz von Elektroporation der supercoiled Plasmid GBAA ausreichend hoch ist, um eine Sättigung Wachstums O / N in flüssigen Medien zu ermöglichen.
4. Vorbereitung der Insertion Kassetten und Subklonierung Plasmide
- HA in die Einschubkassette (n) und die Subklonierung Plasmid einzubauen, führen die Polymerase-Kettenreaktion (PCR) unter Verwendung der langen modifizierten Oligos, wie unten beschrieben.
- Optional: Plasmid Verschleppung in die Rekombination Reaktion zu vermeiden, verwenden Sie ein R6K Herkunft oder ähnlich engen Wirtsbereich Plasmidmatrize die Insertionskassette verstärken.
- Alternativ Arisierung der Plasmid-Vorlage mit einem RE-Digest (Tabelle 2). Wählen Sie ein RE, die außerhalb der PCR-Amplifikation Region schneidet und hitzeinaktiviertem. Hitze inaktiviert die RE wie vom Hersteller, Produzent empfohlenacturer.
- Einrichten der Polymerasekettenreaktion (PCR) unter Verwendung eines High-Fidelity DNA Polymerase hotstart Systems. Bereiten Sie ein PCR-Mastermix so detailliert (Tabelle 3). Führen Temperaturwechsel, wie dargestellt (Tabelle 3).
- Analyse der PCR-Produkte mittels Agarose-Gelelektrophorese. Last 1-5 ul jeder PCR auf ein 1% (w / v) Agarosegel, das 0,5 mg ml -1 Ethidiumbromid (EtBr).
HINWEIS: Die Anwesenheit von nicht-spezifischen Amplifikationsprodukte nicht in der Rekombinationstechnologie Reaktion stören. In einigen Fällen jedoch können Primer-Dimere Rekombinationstechnologie Effizienz verringern. - Reinige PCR-Produkte unter Verwendung eines PCR-Reinigungs-Kits.
- Optional: Entfernen Sie die Plasmidmatrize von PCRs durch Behandlung mit DpnI gefolgt von PCR-clean-up. Eluieren der DNA in einem minimalen Volumen von sterilem, deionisiertem Wasser (wie vom Hersteller empfohlen).
HINWEIS: Die Zugabe von DpnI zu PCR-Reaktionen führt zu einer verringerten Effizienz der Spaltung von th ungereinigteme methylierte Plasmid-DNA-Vorlage.
- Optional: Entfernen Sie die Plasmidmatrize von PCRs durch Behandlung mit DpnI gefolgt von PCR-clean-up. Eluieren der DNA in einem minimalen Volumen von sterilem, deionisiertem Wasser (wie vom Hersteller empfohlen).
- Quantifizierung PCR amplifizierte DNA durch Agarose-Gel-Analyse gegen einen bekannten Satz von DNA-Standards zB λ HindIII Verdau oder durch Verwendung eines ND-Spektrophotometer.
5. Subklonierung Plus-Insertion
- Verdünnen Sie die O / N BAC GBAA Kultur 50-fach durch Zugabe von 200 ul in 10 ml LB + Chl + Tet. Wachsen bei 30 ° C unter Schütteln bei 200 Upm für 1 h 50 min. Gehören Probe als negative Kontrolle verwendet werden.
- Kühlen aller Rekombinationstechnologie Materialien und Ausrüstung auf 4 ° C, wie in Schritt 3.1.2 beschrieben.
- Gießen LB Agar pH 8 Platten, die das korrekte Konzentration des geeigneten selektiven Antibiotikums (en), die die Auswahl des DNA-Fragments, das für die Auswahl der Subklonierungsvektor (Tabelle 4) sowie eingeführt wird ermöglicht.
HINWEIS: Einige Antibiotika sind pH-empfindlich. Verwenden LBAgar pH 8 in der Regel. - Eine 10% ige (w / v) Lösung von L-Arabinose. Filtersterilisieren durch einen 0,2 & mgr; m-Spritzenfilter.
HINWEIS: Arabinose induziert die Expression der Proteine von der Rekombination GBAA Plasmid. - Überprüfen Sie die OD der BAC GBAA Kultur mit einem Spektralphotometer. Sobald eine OD600 von 0,25-0,3 erreicht ist, induzieren die Rekombination Proteinen wie im folgenden Schritt beschrieben.
- Gib 200 ul der 10% Arabinose Lösung auf 10 ml der BAC Kultur bis zu einer Endkonzentration von Arabinose von 0,2% zu erreichen. Gehören nicht-induzierten Kultur (ohne Arabinose), die als negative Kontrolle verwendet werden.
- Übertragen Sie die BAK-Kultur zu einem 37 ° C Schüttelinkubator und induzieren Red Ausdruck für 45 min Schütteln bei 230 Umdrehungen pro Minute.
HINWEIS: Die Expression von Red Proteine ineffizient bei 30 ° C. - Spin down Zellen und wäscht mit 10% Glycerin 3-mal, wie in Schritt 3.1.5 beschrieben.
- Fügen 600-1,000 ng von jedem der Subklonierung Plasmid und die Insertion Kassette (n) zu der Rekombinationstechnologie Reaktion. Fügen Sie einen Vektor nur und Vektor plus Einzeleinsatz steuert, um die Rekombination Kompetenz und Integrität des Vektors und den Kassetten zu überprüfen.
- Besorgen Sie sich eine Einzelzellsuspension durch Auf- und Abpipettieren. Führen Elektroporation in Schritt 3.1.7 und anschließende Erholung in 1 ml LB bei 37 ° C für 1 Stunde für Multi-copy Plasmiden oder in 10 ml LB 3 h für BAC-Vektoren beschrieben, bei 37 ° C.
- Platte verschiedene Verdünnungen der Kultur gewonnen zB 90%, 10%, 1% auf die duale Selektions Agarplatten wachsen bei 37 ° C für 16 Stunden.
6. Analyse von Rekombinanten
- Optional: Wählen Sie 6 bis 12 Kolonien und durchzuführen, Kolonie-PCR mit einem HA flankierenden Primer und einen Einsatz spezifischer Primer. Fügen Sie die Subklonierung Plasmid und das Einsetzen cassette Plasmid sowie die Mutter BAC-Klon als negative Kontrollen.
- Führen Agarosegel-Analyse der Kolonie PCRs. Identifizieren positiver Klone durch die Anwesenheit von einem hellen Band an der erwarteten Größe.
HINWEIS: Der hohe Wirkungsgrad des SPI Klonens erzeugt meist richtig Rekombinanten.
- Führen Agarosegel-Analyse der Kolonie PCRs. Identifizieren positiver Klone durch die Anwesenheit von einem hellen Band an der erwarteten Größe.
- Wählen Kolonien in 5 ml LB pH 8, der die selektive Antibiotikum und wachsen O / N bei 37 ° C.
- Bereiten DNA-Minipreps Verwendung einer Säule Reinigungskits gemäß den Anweisungen des Herstellers.
- Bereiten BAC Miniprep DNA unter Verwendung von Standard Phenol-Chloroform-Isolation oder ein ähnliches Protokoll.
- Führen RE verdaut, auf dem Miniprep-DNA. Separate DNA durch Agarose-Gelelektrophorese. Analysieren RE Mustern, um die Klone, die die erwarteten Fragmente Größen der richtigen Zielvektor zu identifizieren. Wähle eine RE, die eindeutig diskriminiert zwischen dem Vektor fehlt Einlage (n) und dem Vektor, der die Einlage (n).
- Optional: Zellen, die frei von der BAC, die immer noch in der E. vorhanden sind erhalten coli nach Rekombination, verwenden Sie die Miniprep-Plasmid-DNA, um DH5alpha oder DH10B E. verwandeln coli-Zellen.
- Führen Sie die DNA-Sequenzierung über den HA und Insertionskassette zu Oligosynthese Fehler zu überprüfen.
Ergebnisse
Knockin Vektoren
Knockin Targeting-Vektoren sich aus der Notwendigkeit, eine neue Sequenz Funktion im Genom einschließlich einzelne Basenpaarsubstitution in einer Proteinkodierungsregion, die Fusion von einem fluoreszierenden Marker oder einem Affinitäts-Tag auf ein Protein oder die Integration einer Genexpressionskassette einzuführen. Um die Anwendung des SPI in Knockin Vektorkonstruktion Strategien zu testen, wurden zwei verschiedene Testfälle untersucht. Dnttip1 codiert die Desoxynukleotidyltransferase, Terminal, interacting protein 1 A (TDIF1), die zusammen mit Klasse-I-Histon-Deacetylase (HDAC) bilden eine mitotische Deacetylase-Komplex (Midac) 28. Um die Rolle von Dnttip1 Zellteilung zu untersuchen, wurde eine Tandem-Affinitätsmarkierungs Ansatz die TDIF1 interagierende Proteine zu isolieren. Frühere Versuche, einen Teil des Dnttip1 Gen subklonieren mit einem p15A Vektor, der lange Homologieregionen führte zu geringen Abstand Reparatureffizienz einnd häufige aberrante Rekombinationsprodukte (Daten nicht gezeigt). Damit ist der Bau einer Knockin Vektor am Dnttip1 Locus ein anspruchs Rekombination Übung. Eine SPI-Strategie wurde entwickelt, um eine 12 kb Abschnitt der Dnttip1 Gen überspannt den letzten Exon (Exon 13) in eine niedrige Kopien p15A Vektor subklonieren und gleichzeitig legen Sie eine Dual-Affinitätsmarker Selektionskassette in Exon 13 und ersetzt das Stop-Codon (3A ). Der 2X-FLAG-Calmodulin-Bindungsprotein (CBP) verbunden FRT-PGK-EM7-Neomycin (Neo) -BGhpA-FRT-Kassette (2,0 kb) wurde aus einer RE linearisierte Plasmid mit Dual PTO-modifizierte Oligos, die enthielt 120 bp HA flankierenden Dnttip1 amplifizierten Stop-Codon. A p15A zeo Dnttip1 Subklonierungsvektor (1,7 kb) wurde konstruiert, enthielt 200 bp Regionen homolog zu den Enden des Dnttip1 Sequenz subkloniert werden. Die Dnttip1 Subklonierung Plasmid linearisiert RE und PCR unter Verwendung von 20 bp modifizierten Oligosdass generiert eine führende Strang geschützt Vektor. Die PCR-Produkte wurden DpnI behandelt, gereinigt und in Recombineering zuständigen Dnttip1 BAC E. co-elektroporiert coli-Zellen als auch nicht-induzierten Kontrollzellen. Die SPI-Reaktionen wurden auf Zeocin (Zeo) und Kanamycin (Kan) Agarplatten (3B) enthält, plattiert. SPI produzierte korrekt geändert Dnttip1 knockin Vektor in allen der 12 Rekombinanten analysiert (Figur 3C). DNA-Sequenzierung bestätigte die Abwesenheit von Fehlern von Oligo-Synthese oder der PCR-Amplifikation resultiert.
Ein weiteres Beispiel für SPI ging es um die In-Frame Insertion einer verbesserten gelb fluoreszierendes Protein (eYFP) verbunden Selektionskassette am P2rx1 Gens. Die P2rx1 Gen kodiert ein G-Protein-gekoppelten Rezeptor, das als eine ATP-abhängigen Ionenkanals 29. Bindung an YFP-Fluoreszenz erlaubt die Verfolgung des P2X1-Rezeptors auf der Zelloberfläche in vaschiedenen funktionellen Tests. P2rx1 ist eine weitere schwierige Locus, der erhebliche Probleme mit herkömmlichen Rekombination Methoden vorgestellt wurde (Daten nicht gezeigt). Mit SPI ein 12 kb-Segment des P2rx1 Gen umfasst das Terminal Exon (Exon 12) wurde in einen p15A zeo Vektor subkloniert und mit der abgestimmten Insertion eines eYFP -LoxP flankiert Neo-Kassette ersetzt das Stoppcodon in Exon 12, das Konstrukt modifiziert P2rx1-eYFP Knockin Vektor (3D). In diesem Beispiel ist die Folgestrangs geschützt p15A Vektor (1,7 kb) enthielt 230 bp HA und die eYFP Kassette enthielt 50 bp HA und auch unmodifiziert. Die eYFP Insertionskassette (2,7 kb) wurde durch Spleißen überlappende PCR des eYFP Gen PCR aus pEYFP-C1 verstärkt und der LoxP- PGK-EM7-Neo-BGHpA-LoxP Kassette zusammengebaut ist, PCR aus pL452 (NCI, Frederick) amplifiziert . Die SPI-Reaktion erzeugte hunderte von Kolonien (Daten nicht gezeigt). RE Analyse von DNAMinipreps von 11 Klonen präpariert zeigte die Mehrheit enthielt die richtig montiert P2rx1-eYFP Knockin Vektor (3E). Zusätzliche Validierung durch DNA-Sequenzierung zeigte eine fehlerfreie Einführen des eYFP Kassette. Jedoch einige der Klone zeigten Profile der unmarkierte Spalt repariert und der markierten Spalt repariert Plasmide in der gleichen Zelle (Bahnen 6-9). Einige Proben enthielten auch falsch reparierten Spalt (Spur 2) oder mistargeted Plasmide (Bahnen 4 und 5). Der Ausfall gleichzeitige Subklonierung und Targeting teil SPI Rekombinanten zeigt die Grenzen von effizienten SPI Klonierung wenn große Kassetten (> 3 kb), die sich von den Beschränkungen Red Prozessivität langen DNA-Fragmente 30, oder bei Verwendung von kurzen HA auftreten. Tatsächlich Erhöhung der HA des eYFP Kassette 200 bp erhöht SPI Effizienz und die richtige Ausrichtung der Kassette (Daten nicht gezeigt). Gen-Targeting mit dem P2rx1 - eYFP Knockin Vektor in JM8.N4Maus-ES-Zellen (C57BL / 6-Stamm) erzeugt 6 positive Klone von 96, die den korrekt ausgerichtet P2rx1-eYFP Sequenz (3F) enthalten.
BAC Reporter Vektoren
Ein BAC-Klon des Zielgens enthält oft alle erforderlichen vor- und nachgelagerten regulatorische Elemente zB Enhancer, UTRs etc. sowie den endogenen Promotor, die Genexpression auf einem natürlichen Niveau 31 zu fahren. Ein BAC Reportervektor ist daher das bevorzugte Mittel, um die endogenen Expressionsmuster eines Gens 32 rekapitulieren. Jedoch stellt die Größe eines BAC-Plasmid (bis zu 200 kb) erhebliche praktische Probleme bei der Transfektion ein intaktes BAC in Zellen 33. Die Reduzierung der Größe des BAC genomisches Insert durch BAC Trimmen 34,35, unter Beibehaltung der notwendigen regulatorischen Elemente eines Gens, ermöglicht eine einfachere Handhabung der BAC und führt zu einer effizienteren transfectiauf. Aktuelle BAC-Engineering-Technologie beinhaltet mehrere Runden der Rekombination, um dieses Ziel zu erreichen 35. Um die Nützlichkeit der SPI in BAC Trimmen wurde ein pBeloBAC11 BAC-Vektor verwendet, um ein 30 kb-Genomsequenz, einschließlich der vollständigen Länge P2rx1 Gen aus dem 168 kb BAC P2rx1 zusammen mit der gleichzeitigen Insertion einer eYFP Kassette im P2rx1 Gen zu subklonieren nachweisen (Abb 4A). Die pBeloBAC11 zeo Vektorgerüst (6,5 kb) mit 180 bp PCR-HA wurde mit modifizierten Oligos, die ein Folgestrang geschützt Vektor erzeugt verstärkt. Das gleiche eYFP Neo-Kassette (3 kb), in der vorhergehenden P2rx1 knockin Vektorkonstruktion verwendet wird, wurde mittels PCR amplifiziert, wobei Folgestrang geschützte Oligos mit 180 bp HA und gezielte die P2rx1 Exon 12 Austausch des Stopp-Codons. Nach kombinierter Elektroporation des eYFP Kassette und dem pBeloBAC11 zeo Vektor in P2rx1 BAC Zellen expressing den GBAA Rekombinationstechnologie Proteine wurde die Kultur in 10 ml LB pH 8 für 3 h bei 37 ° C wiedergewonnen, die BAC-Plasmide zu trennen. Reines Rekombinanten wurden auf Zeo und Kan Agarplatten ausgewählt und bei einer Frequenz von 2 x 10 -6 beobachtet. Kolonie-PCR Genotypisierung Analyse ergab erfolgreiche BAC Trimmen in der 3 von 6 Klonen, die untersucht wurden (4B). Hohe Reichweite PCR-Amplifikation auf der eYFP Einführungsstelle bestätigt die richtige Kassette Einarbeitung in die drei positive Klone (4B). Die drei Klone fehlt die eYFP Einsatz waren auch falsch Lücke am 5 repariert-Ende, obwohl die Ursache für mistargeting der eYFP Kassette in diesen Klonen kann getrennt auf die korrekte Schließung der 5 sein "BAC Ende. Die drei eYFP positive BAC-Klone wurden weiter mit RE verdaut, analysiert und zeigten das erwartete Muster der richtig getrimmt eYFP rekombinanten BAC (4C </ Strong>). Sequenzanalyse zeigte Abwesenheit von Fehlern in der eYFP Kassette in nur 1 Klon aus den 3 Positive.
Bedingte Knockout (CKO) Vektoren
Bedingte Ablation der Genexpression ist ein wichtiges Instrument, um Entwicklungsprozesse zu untersuchen oder auf biologische Systeme zu einem bestimmten Zeitpunkt zu studieren. Ein bedingter Gen-Knockout-Strategie umfasst in der Regel die Platzierung LoxP Rekombinationsstellen rund um einen kritischen Exon (CE). Die Löschung eines CE auf Cre Expression oder Aktivierung erzeugt eine Rasterverschiebung und ein vorzeitiges Stoppcodon, was zu einer Verschlechterung der mRNA aufgrund von Nonsense-vermittelten Zerfall (NMD). Der Bau einer bedingten Gen-Targeting-Vektor ist eine komplexe Aufgabe, und umfasst mehrere Schritte der Subklonierung, Targeting und Transformation 22. SPI bietet einen bequemen Weg, um diesen Prozess zu vereinfachen. Als Testfall, eine bedingte Allel des Gens Zrsr2 errichtet wurdeVerwendung der SPI Methode (5A). Die Zrsr2 Gen kodiert für ein Spleißfaktor und eine einzelne Kopie auf dem X-Chromosom. Der Bedingungsstatus Gendeletion ist besonders wichtig, in diesem Fall, die Möglichkeit der Anpassung von Zellen an die mangelnde Zrsr2 während ES Zellenauswahl in einem konstitutiven Gendeletion Abzielungsstrategie steuern. SPI wurde durchgeführt, um eine 10 kb Teil des ZrSr2 Gen bei gleichzeitiger Aufnahme von zwei verschiedenen LoxP flankiert Selektionskassetten subklonieren. Die FRT-PGK-EM7-Neo-FRT-LoxP Kassette (2 kb) wurde PCR aus RE verstärkt verdaute pL451 mit Verzögerungsstrang geschützt Oligos, die enthalten sind 180 bp HA gezielt den ZrSr2 Intron 2. Eine zweite Kassette mit Rox-PGK-em7- Blasticidin (BSD) -Rox-LoxP (2 kb) wurde aus einem PCR R6K Plasmid verstärkt mit Folgestrang geschützt Oligos mit 180 bp HA identisch mit einem stromabwärts gelegenen Bereich in Intron 3 der beiden loxP-Stellen flankiert Exon 3, die CE, deren deletion beim bedingten Cre-Aktivierung führt zu einer Rasterverschiebung und führt ein vorzeitiges Stoppcodon. Die Zrsr2 Subklonierung Plasmid (1,6 kb) wurde aus einem PCR-RE linearisiert p15A zeo Plasmid mit Verzögerungsstrang geschützt Oligos mit 180 bp HA passend zu den Enden des 10 kb Zrsr2 Folge verstärkt. SPI-Reaktionen wurden durchgeführt wie zuvor beschrieben, und auf Zeo + Neo + Bsd Platten plattiert. Die ZrSr2 bedingten Targeting-Vektor wurde erfolgreich in den meisten der 12 untersuchten Rekombinanten (5B) zusammengebaut. Weitere DNA-Sequenzanalyse ergab ein richtiges Einsetzen sowohl des Selektionsmarker im ZrSr2 CKO Vektor.

Fig. 1 SPI Klonen. Übersicht über die SPI Klonprozess Kombinieren Kassetteneinschub- und Subklonierung in einem einzigen Schritt. (A) Die BAC-Klon ist tranmit dem pSC101 BADgbaA Plasmid sformed und bei 30 ° C gewachsen. (B) Nach Arabinoseinduktion die Red Proteine zu exprimieren, werden die asymmetrische geändert Insertionskassette und Subklonierung Plasmid in dem BAC-Klon eingeführt und sowohl mit dem Einsetzen und Subklonierung Marker, um die endgültige Vektor zu erzeugen ausgewählt. Bitte klicken Sie hier, um eine größere Version zu sehen diese Zahl.
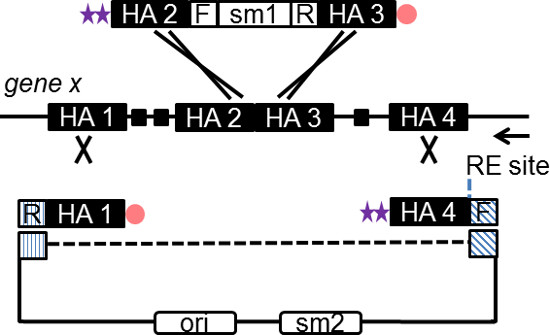
Figur 2: Schematische Darstellung der Konstruktion SPI Rekombinationstechnologie Oligos. Die Subklonierung Plasmid und Insertionskassette beide durch PCR unter Verwendung einer Kombination aus Klemme PTO und Phosphat-modifizierte Oligos. Das PCR-Fragment nach Red Verdauung in vivo produziert eine ssDNA Zwischenstufe, die zu der Folgestrang der Replikationsgabel lagert. Gene spezifische HA von 50-180 bp in jedem Oligo aufgenommen, wie dargestellt. Der Pfeil zeigt die Richtung der DNA-Replikation in einem Kandidatengen. Eine gestrichelte Linie stellt das Subklonieren Plasmidsequenz nicht in das PCR-Produkt eingebaut. RE-Stelle, Restriktionsenzymstelle des Linearisierung des endgültigen Vektors; F, vorne Sequenz (20 bp), spezifisch für die Subklonierung Plasmid oder Insertionskassette; R, umgekehrt komplementäre Sequenz (20 bp) der Plasmid oder Kassetten; sm, Selektionsmarker. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 3. SPI ermöglicht den Aufbau schwierig knockin Vektoren. (A) Schematische Darstellung des SPI Strategie der Konstruktion des Dnttip1 dual verwendet tagged Vektor. Arrow indiCates die Richtung der Replikation auf dem BAC-Klon. (B) Plating Ergebnisse der nicht-induzierten und induzierten Proben des Dnttip1 SPI-Experiment. (C) EcoRI-Spaltung von Dnttip1 SPI Klone. M, 1 kb Leiter (NEB); C, p15A Dnttip1 Lücke repariert Plasmid fehlt die Dual Tag-Kassette. Fragmentgrößen sind: Namensschilder, 9,2 + 4,4 + 2,2 kb; Kontrolle; 9,2 + 4,6 kb. (D) SPI basiert P2rx1-eYFP Knockin Vektorkonstruktion. (E) EcoRI-Spaltung von P2rx1-eYFP SPI Klone. M, 1 kb Leiter + (Invitrogen); C, p15A P2rx1 Lücke repariert Plasmid fehlt die eYFP Kassette. Fragmentgrößen sind: Namensschilder, 8,3 + 4,4 + 3,1 + 0,03 kb; Kontrolle; 8,3 + 3,1 + 1,8 + 0,03 kb (F) Southern-Blot-Analyse der P2rx1 -. EYFP Gen-Targeting in ES-Zell JM8.N4 Zellen. Top-Panel, Southern-Blot mit dem 3'-Ende-Sonde mit PshAI verdauen. Dargestellt ist die Screening-Ergebnis von 5 Klone. Bodenplatte, auslöschen südlichen Verwendungdie 5'-Ende-Sonde und SpeI Verdau der aus der 3 identifizierten Positive-Ende-Screening. PshAI RE-Stelle; S, SpeI RE Website. Eine gestrichelte Linie stellt das Ende des Vektors HA. Black Box bezeichnet südlichen Sonde. Erwarteten Restriktionsfragmenten sind, PshAI: WT, 8,9 kb; eYFP-neo, 11.5 kb; SpeI:. WT, 6,9 kb; eYFP-neo, 7,6 kb Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
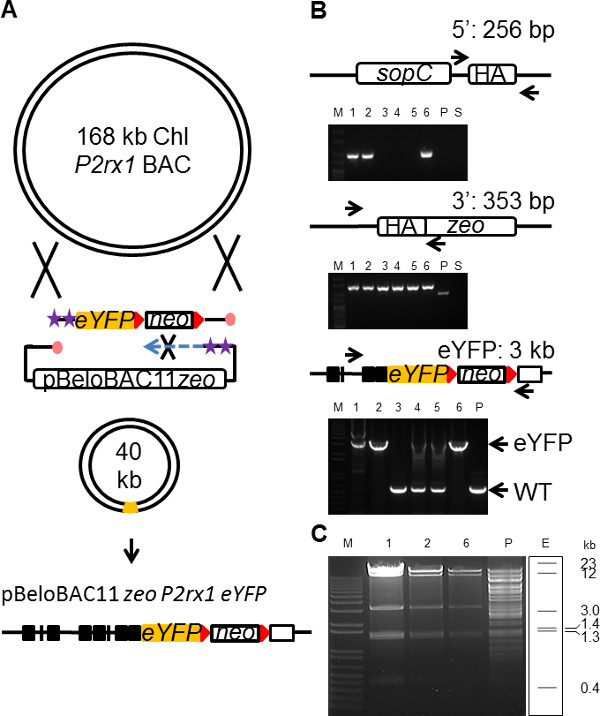
Abbildung 4. Vereinfachte BAC Trimmen mit SPI. (A) Schematische Darstellung des Konzepts BAC Trimmen mit SPI. Zeichen ist in 1 beschrieben. (B) PCR-Amplifikation über den 5 'und 3'-Enden des subklonierten Einsatz und über die P2rx1-eYFP insertion Ort. Die Screening-Strategie ist für jede Art der PCR gezeigt. M (oben), Hyperladder 25 bp, (Bodenplatten), 1 KB +; P, P2rx1 BAC; . S, pBeloBAC11 zeo Subklonierung Plasmid (C) der drei HindIII eYFP positive SPI BAC-Klone aus (B) zu verdauen; E, erwartet HindIII Restriktionsmuster des beschnittenen eYFP BAC. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
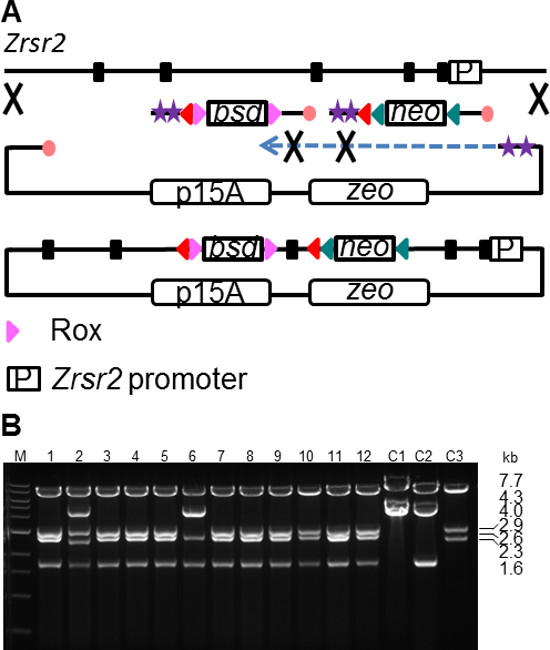
Abbildung 5. Bedingtes Knockout Vektor Generation mit SPI Klonen. (A) Schematische Darstellung der gleichzeitigen Einbau von zwei verschiedenen LoxP flankiert Selektionskassetten während Subklonierung des Zrsr2 Allel. Zeichen ist in 1 beschrieben. (B) </ Strong>, EcoRI verdaut, der Zrsr2 SPI Klone. L, 1 kb Leiter (NEB); C1, p15A ZrSr2 Lücke repariert Plasmid, C2, p15A ZrSr2 Lücke repariert Plasmid, das das neo-Einsatz; C3, p15A ZrSr2 Lücke repariert Plasmid, das die bsd Einsatz. Fragmentgrößen sind: cko, 7,7 + 2,9 + 2,6 + 1,6 kb; C1, 7,7 + 4,0 kb; C2, 7,7 + 4,3 + 1,6 kb; C3, 7,7 + 2,9 + 2,3 kb. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
| Anzahl der Schritte | Konventionelle Rekombination Pipeline ein | Multiplex Rekombination b |
| Schritt 1 | Transformation von Rekombination Plasmid in BAC-Host | Transformation von Rekombination Plasmid in BAC-Host. Herstellung der Targeting-Kassetten und Subklonierung Vektoren. |
| Schritt2 | Einsetzen des R1 / R2 Gateway-Kassette | Multiplex Lücke Reparatur Klonen |
| Schritt 3 | Einfügen von floxed Kan Kassette | O / N-Kultur aus einzelnen Kolonien |
| Schritt 4 | Gap Reparatur in R3 / R4 Plasmid | Plasmidpräparation und Verifizierung |
| Schritt 5 | Umwandlung in Cre + E. coli | |
| Schritt 6 | Plasmidpräparation und Verifizierung | |
| Schritt 7 | O / N Dreiwege-Gateway Reaktions | |
| Schritt 8 | Transformation des Drei-Wege-Gateway-Reaktion in DH10B E. coli-Zellen | |
| Schritt 9 | Übernachtkultur von Einzelkolonien | |
| Schritt 10 | Plasmidpräparation und Sequenzüberprüfung | |
| b Durchschnittliche Zeit von 4 Tagen überprüft Klon | ||
Tabelle 1: Vergleich von konventionellen Rekombination mit SPI in den Bau von Knockout Vektoren.
| RE Buffer | 5 & mgr; |
| DNA | 1 ug Plasmid oder gereinigten PCR-Produkte |
| RE | 1 ul (mehr als 5 Geräten) |
| TE | bis zu 50 & mgr; |
| Bei 37 ° C für mindestens 1 Std. Erwärmen inacitvate nach den Anweisungen des Herstellers | |
Tabelle 2: RE verdauen.
| PCR-Materialien | Endkonzentration |
| PCR-Puffer | 1x |
| dNTP | 200 nM |
| MgSO 4 | 1,5 mM |
| Betain | 1,3 M |
| DMSO | 1% |
| Forward-Primer | 200 nM |
| Reverse-Primer | 200 nM |
| DNA-Polymerase | 1 U |
| Schablone | 10 ng des Mehrfachkopien-Plasmiden oder 2,5 & mgr; l Miniprep-DNA für die Genotypisierung PCRs |
| Wasser | bis zu 50 & mgr; a |
| a Zur Standard 50 ul PCR-Reaktion mit Mehrfachkopie-Plasmide. Hohe Reichweite Genotypisierung PCRs wurden in 25 & mgr; l PCR-Reaktionen einstellen. | |
| PCR-Bedingungen | |
| 95 ° C | 2 min |
| 92 ° C | 10 Sek |
| 55 ° C | 30 Sekunden |
| 72 ° C | 30 Sekunden |
| 30 Zyklen b | |
| b Zyklus kann nicht bis 35 für BAC PCR Genotypisierung erweitert werden | |
Tabelle 3: PCR-Set-up Bedingungen.
| Antibiotika | Konzentration ein (ug ml -1) |
| Ampicllin | 50 |
| Blasticidin b | 40 |
| Chloramphenicol | 12,5 |
| Gentamicin | 2 |
| Hygromycin c | 30 |
| Kanamycin b | 15 |
| Tetracycline | 4 |
| Trimethoprim c | 10 |
| Zeocin | 5 |
| eine Empfehlung für den Einsatz mit BACs und Mehrfachkopie-Plasmide, wenn in Kombination mit Multiplex-Rekombination verwendet | |
| b Blasticidin (35 & mgr; g ml -1) und Kanamycin (6 & mgr; g ml -1), wenn sie zusammen in Kombination verwendet | |
| c Hygromycin und Trimethoprim sind nicht für die Auswahl mit Einzelkopie BACs empfohlen. | |
Tabelle 4. Empfohlene Antibiotikakonzentrationen für den Einsatz in SPI Experimente.
Diskussion
Der Bau der ES-Zelllinien und Maus-Modellen ist historisch beteiligten Gene Targeting unter Verwendung von Plasmid-Konstrukte, die die modifizierte Allel 4 enthalten. Jedoch ist die Konstruktion dieser Komplex das Gen-Targeting-Vektoren hat sich als eine erhebliche Engpass bei der rechtzeitigen Herstellung derartiger Modelle. Die Entwicklung der Rekombination auf der Basis der Konstruktion des Vektors Strategien hat verbesserte Vektor-Design und effizienter Vektor Montage erlaubt. Dennoch aktuellen Rekombination Protokolle beinhalten noch mehrere Schritte erfordern Zwischen Plasmidreinigung und verschiedene Bakterienstämme. Subklonierung und Einfügen bietet einen neuartigen Ansatz zur Konstruktion des Vektors, die in einem Elektroporation Ereignis in der Wohn BAC Wirtsstamm durchgeführt werden können. Die Nützlichkeit der SPI in Gen-Targeting wurde hier eine Vielzahl von Vektor-Konstruktionsanwendungen getestet. In allen hier betrachteten Fällen erwiesen SPI effizient zu sein und die richtige rekombinante Plasmid wurde hergestellt.In der Mehrzahl der Fälle wurden die mehrere unterschiedliche Kassetten richtig im Targeting-Vektor inseriert. Große DNA-Kassetten und Vektoren wurden leicht in dem SPI-Protokoll aufgenommen und zeigte die Flexibilität dieses Systems.
SPI beruht auf der Verwendung langer Homologiesequenzen und Phosphorothioat (PTO) Schutz der linearen DNA-Kassetten. PTO Modifikation verleiht Schutz gegen Exonukleasen zu der linearen DNA 20,21 und die lange HA erhöht Rekombinationseffizienz zu Multiplexing ermöglichen. Synthese von längeren Oligo-Sequenzen erhöht jedoch die Wahrscheinlichkeit des Ansammelns Fehler insbesondere Deletionen. Mutationen im Oligo kann besonders nachteilig sein, wenn sie zu decken Protein kodierenden Regionen. DNA-Sequenzierung über den HA und die das gesamte Länge des eingelegten Kassette ist empfehlenswert, um Klone mit allen Sequenzänderungen zu eliminieren. Verwendung eines High-Fidelity-DNA-Polymerase-System wird auch vorgeschlagen, um die Einführung eines zu vermeideny PCR-Fehler. Die Länge und Zusammensetzung der HA des Subklonierung Plasmid kritischer ist relativ zu der Einschubkassette (Daten nicht gezeigt). Für besonders empfindliche Anwendungen wie Bau von Knockin-Vektoren, in denen alle Mutationen in Exon Regionen werden nicht toleriert, kann der HA des Insertionskassette gekürzt werden (50 bis 120 bp) Probleme mit langen Oligos assoziiert zu vermeiden. Insertionskassette können unmodifiziert oder dual phosphorthioiertes (wenn die anhand der Richtung der Replikation nicht verfügbar ist) gelassen werden. Aber Multiplexen in diesen Fällen immer noch erfordert lange geschützt HA Subklonierung Plasmide. Eine Einschränkung dieser besonderen Strategie ist die Senkung der Multiplexing Effizienz, die möglicherweise Auswirkungen kann SPI Klonen an verschiedenen Loci.
Die Länge der Insertionskassette und dem Subklonieren Plasmid ist ein weiterer wichtiger Parameter bei der SPI Klonen. Größere DNA-Moleküle zu elektroporieren weniger wirksam, und die Wirkung ist kumulativ, da die Wiederquirement alle Kassetten in der gleichen Zelle einzuführen (Daten nicht gezeigt). Multiplexing ist am effizientesten mit kleineren Einschubkassetten. DNA-Fragmente größer als 3 kb stellen auch eine Grenze für Red vermittelte ssDNA Verarbeitung, die effizienteste bis zu 3 kb 30 ist. Eingefügt Kassetten mehr als 3 kb sind Dual reseziert und weniger effizient rekombinieren über eine Beta-unabhängigen Weg 20. Daher wird Screening von Kolonien ausreichen, um die korrekte Klon identifiziert in diesen Fällen wichtig. Eine längere Dauer der Rekombination nach der Elektroporation erhöht auch die Chancen für eine Erholung der richtige Klon in schwierigen SPI Übungen. Bis zu vier kleine Kassetten (<1,5 kb) können gleichzeitig mit dem SPI-Prozess eingeführt werden, wenn die Multiplexeffizienz mit jedem zusätzlichen Kassette verringert (Daten nicht gezeigt). Jedoch spiegelt dies das Ergebnis einer optimalen SPI Experiment und sinnvoll, die Grenzwerte des Multiplexens beachten, wenn viele große Kassetten ist.
Die Entwicklung von Genom-Editing-Tools wie Cluster regelmäßig beabstandeten kurzen palindromischen Repeats (CRISPR) -cas9 Endonuklease-System hat die Schaffung neuer Genom-Modifikationen aktiviert werden und hat zu einer effizienteren Genomtechnik 36 geführt. Jedoch haben diese neueren Technologien Gen-Targeting-Vektoren ergänzt, anstatt sie verdrängt. Es ist vorgesehen, dass die CRISPR-cas System könnte Antibiotika-Selektion zu ersetzen und zu verfeinern die Multiplex-Rekombination Protokoll.
Offenlegungen
T.R.R is the inventor of a British patent application on multiplex recombineering technology.
Danksagungen
T.R.R conceived the project, designed and performed experiments and prepared the manuscript. E.J.K and S.E.M performed experiments. All authors contributed intellectually to the final manuscript. This work was funded by a University of Leicester Innovation Fellowship to SEM and by a UK Medical Research Council (MRC) Senior Research Fellowship to S.M.C (MR/J009202/1). DNA sequencing was performed by Protein and Nucleic Acid Laboratories (PNACL), Centre for Core Biotechnology Services, University of Leicester. We wish to thank A. Francis Stewart for providing the Rox and Dre plasmids. pL451 and pL452 plasmids were obtained from National Cancer Institute (NCI), Frederick, USA.
Materialien
| Name | Company | Catalog Number | Comments |
| Antibiotics except Zeocin | Sigma: http://www.sigmaaldrich.com | Ampicillin, A9518-5G; Chloramphenicol , C1919-5G; Blasticidin, 15205-25MG; Gentamicin, G1264-50MG; Hygromycin, H3274-50MG; Kanamycin,: K1876-1G; Tetracycline hydrochloride, T7660-5G; Trimethoprim, 92131-1G | |
| Zeocin | Invivogen: | ant-zn-1 | Zeocin is also available from Life technologies/Fisher |
| C57BL/6 BAC clones | CHORI: https://bacpac.chori.org/ | RPCI-23 or RPCI-24 BAC libraries | 129/Sv BAC clones can be obtained from Invivogen or Life technologies/Fisher |
| KOD hotstart DNA polymerase system | Millipore: https://www.merckmillipore.com | 71086-3 | |
| L-Arabinose | Sigma: http://www.sigmaaldrich.com | A3256-25G | |
| Long oligos | IDT: https://www.idtdna.com; Gene link: https://www.genelink.com | IDT Ultramers or Gene Link long oligos | PTO and Phosphosphate available as custom modifications. PAGE purification strongly recommended for long oligos. |
| MinElute PCR purification kit | Qiagen: http://www.qiagen.com | 28004 | Minimum elution PCR purifications kits are preferred. |
| QIAPrep Spin Mini Prep kit | Qiagen: http://www.qiagen.com | 27104 | Silica column or similar matrix kits are preferred. |
| Restriction enzymes | NEB: https://www.neb.com | DpnI: R0176L | See NEB website for a list of RE. |
Referenzen
- Dovey, O. M., Foster, C. T., Cowley, S. M. Histone deacetylase 1 (HDAC1), but not HDAC2, controls embryonic stem cell differentiation. Proc. Natl. Acad. Sci. USA. 107, 8242-8247 (2010).
- Harvey, M., et al. Spontaneous and carcinogen-induced tumorigenesis in p53-deficient mice. Nat. Genet. 5, 225-229 (1993).
- Waterhouse, P., et al. Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4. Science. 270, 985-988 (1995).
- Thomas, K. R., Capecchi, M. R. Site-directed mutagenesis by gene targeting in mouse embryo-derived stem cells. Cell. 51, 503-512 (1987).
- Hasty, P., Rivera-Pérez, J., Bradley, A. The length of homology required for gene targeting in embryonic stem cells. Mol. Cell. Biol. 11, 5586-5591 (1991).
- Smithies, O., Gregg, R. G., Boggs, S. S., Koralewski, M. A., Kucherlapati, R. S. Insertion of DNA sequences into the human chromosomal beta-globin locus by homologous recombination. Nature. 317, 230-234 (1985).
- Hirata, R., Chamberlain, J., Dong, R., Russell, D. W. Targeted transgene insertion into human chromosomes by adeno-associated virus vectors. Nat. Biotechnol. 20, 735-738 (2002).
- Szostak, J. W., Orr-Weaver, T. L., Rothstein, R. J., Stahl, F. W. The double-strand-break repair model for recombination. Cell. 33, 25-35 (1983).
- Bradley, A., Evans, M., Kaufman, M. H., Robertson, E. Formation of germ-line chimaeras from embryo-derived teratocarcinoma cell lines. Nature. 309, 255-256 (1984).
- Fu, J., Teucher, M., Anastassiadis, K., Skarnes, W., Stewart, A. F. A recombineering pipeline to make conditional targeting constructs. Methods Enzymol. Soriano, P. M., Wassarman, P. M. 477, Academic Press. 125-144 (2010).
- Zhang, Y., Buchholz, F., Muyrers, J., Stewart, A. A new logic for DNA engineering using recombination in Escherichia coli. Nat. Genet. 20, 123-128 (1998).
- Copeland, N., Jenkins, N., Court, D. Recombineering: a powerful new tool for mouse functional genomics. Nat. Rev. Genet. 2, 769-779 (2001).
- Muyrers, J., Zhang, Y., Testa, G., Stewart, A. Rapid modification of bacterial artificial chromosomes by ET-recombination. Nucleic Acids Res. 27, 1555-1557 (1999).
- Yu, D., et al. An efficient recombination system for chromosome engineering in Escherichia coli. Proc. Natl. Acad. Sci. USA. 97, 5978-5983 (2000).
- Sharan, S. K., Thomason, L. C., Kuznetsov, S. G., Court, D. L. Recombineering: a homologous recombination-based method of genetic engineering. Nature Protoc. 4, 206-223 (2009).
- Wang, J., et al. An improved recombineering approach by adding RecA to λ red recombination. Mol. Biotechnol. 32, 43-53 (2006).
- Datta, S., Costantino, N., Court, D. L. A set of recombineering plasmids for gram-negative bacteria. Gene. 379, 109-115 (2006).
- Fu, J., et al. Full-length RecE enhances linear-linear homologous recombination and facilitates direct cloning for bioprospecting. Nat. Biotechnol. 30, 440-446 (2012).
- Muyrers, J., Zhang, Y., Buchholz, F., Stewart, A. RecE/RecT and Redalpha/Redbeta initiate double-stranded break repair by specifically interacting with their respective partners. Genes Develop. 14, 1971-1982 (2000).
- Maresca, M., et al. Single-stranded heteroduplex intermediates in lambda Red homologous recombination. BMC Mol. Biol. 11, 54(2010).
- Mosberg, J. A., Lajoie, M. J., Church, G. M. Lambda Red recombineering in Escherichia coli occurs through a fully single-stranded intermediate. Genetics. 186, 791-799 (2010).
- Liu, P., Jenkins, N. A., Copeland, N. G. A highly efficient recombineering-based method for generating conditional knockout mutations. Genome Res. 13, 476-484 (2003).
- Chan, W., et al. A recombineering based approach for high-throughput conditional knockout targeting vector construction. Nucleic Acids Res. 35, e64(2007).
- Zhang, Y., Muyrers, J. P. P., Testa, G., Stewart, A. F. DNA cloning by homologous recombination in Escherichia coli. Nat. Biotechnol. 18, 1314-1317 (2000).
- Lee, E. C., et al. A highly efficient Escherichia coli-based chromosome engineering system adapted for recombinogenic targeting and subcloning of BAC DNA. Genomics. 73, 56-65 (2001).
- Skarnes, W. C., et al. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Valenzuela, D. M., et al. High-throughput engineering of the mouse genome coupled with high-resolution expression analysis. Nat. Biotechnol. 21, 652-659 (2003).
- Bantscheff, M., et al. Chemoproteomics profiling of HDAC inhibitors reveals selective targeting of HDAC complexes. Nat. Biotechnol. 29, 255-265 (2011).
- Mulryan, K., et al. Reduced vas deferens contraction and male infertility in mice lacking P2X1 receptors. Nature. 403, 86-89 (2000).
- Subramanian, K., Rutvisuttinunt, W., Scott, W., Myers, R. The enzymatic basis of processivity in lambda exonuclease. Nucleic Acids Res. 31, 1585-1596 (2003).
- Antoch, M. P., et al. Functional identification of the mouse circadian Clock gene by transgenic BAC rescue. Cell. 89, 655-667 (1997).
- Rostovskaya, M., et al. Transposon-mediated BAC transgenesis in human ES cells. Nucleic Acids Res. 40, e150(2012).
- Giraldo, P., Montoliu, L. Size matters: use of YACs, BACs and PACs in transgenic animals. Transgenic Res. 10, 83-103 (2001).
- Hill, F., et al. BAC trimming: minimizing clone overlaps. Genomics. 64, 111-113 (2000).
- Warming, S., Costantino, N., Court, D. L., Jenkins, N. A., Copeland, N. G. Simple and highly efficient BAC recombineering using galK selection. Nucleic Acids Res. 33, e36(2005).
- Cong, L., et al. Multiplex Genome Engineering Using CRISPR/Cas Systems. Science. 339, 819-823 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten