Distillation fractionnée
Source : Laboratoire de Dr. Nicholas Leadbeater — Université du Connecticut
La distillation est peut-être technique de laboratoire la plus courante utilisée par les chimistes pour l’épuration des liquides organiques. En combinaison avec différents points d’ébullition des composés se divisent en différents composants lorsque le mélange est soigneusement distillé. Les deux principaux types de distillation sont « simple distillation » et « distillation fractionnée », et les deux sont employés couramment dans les laboratoires de chimie organique.
Distillation simple est utilisée lorsque le liquide est b relativement pur (contenant des contaminants liquides de pas plus de 10 %), (b) a une composante non volatile comme un contaminant solide, ou (c) est mélangé avec un autre liquide dont le point d’ébullition qui diffère au moins 25 ° C. Distillation fractionnée est utilisée lorsque la séparation de mélanges de liquides dont les points d’ébullition sont plus semblables (séparés par moins de 25 ° C).
Cette vidéo détaille la distillation fractionnée d’un mélange des deux solvants organiques communs, cyclohexane et le toluène.
Pour séparer deux ou plusieurs liquides par distillation simple, ils sont d’abord chauffées dans une fiole. Le plus volatil liquide (le liquide dont le point d’ébullition inférieur) va s’évaporer en général tout d’abord, et la vapeur va passer dans une colonne de condensation, où il peut revenir dans un liquide (condensation) sur la fraîcheur murs de verre et puis versez dans un récipient de prélèvement (Figure 1).

La figure 1. Appareil de distillation simple.
Dans une distillation fractionnée, un mélange de liquides est bouilli et les vapeurs qui en résulte remontent un tube de verre appelé une « colonne de fractionnement » et séparent. La colonne de fractionnement est placée entre la fiole contenant le mélange et l’adaptateur « Y » et est généralement remplie de verre ou des perles en plastique, qui améliore la séparation entre les liquides être distillées. Distillation fractionnée conduit à une séparation plue que simple distillation car les perles de verre dans la colonne de fractionnement fournissent « plateaux théoriques » sur lequel les vapeurs peuvent se condenser, reevaporate et puis recondenser, essentiellement de la distillation du mélange maintes et maintes. Une assiette théorique est équivalente au cycle une vaporisation-condensation, ce qui équivaut à une distillation simple. Les liquides plus volatils seront déplace progressivement vers le haut de la colonne de fractionnement, tandis que les liquides bouillants inférieurs vont rester vers le bas, ce qui donne une meilleure séparation entre les liquides. La vapeur atteint finalement le condenseur, où il est refroidi et puis coule dans le récipient de collecte.
Une courbe de composition du point d’ébullition (Figure 2) peut être utilisée pour prédire le nombre de plateaux théoriques nécessaires pour obtenir une séparation désirée. Données de la courbe sont obtenues en prenant des mélanges de différentes composition, les chauffant au point d’ébullition, enregistrement de la température et analyse de la composition de la vapeur au-dessus de chaque mélange. La courbe inférieure représente la composition du liquide et la courbe supérieure représente la composition de la vapeur. Dans le cas de cette expérience, le mélange de départ était de cyclohexane de 50 % et 50 % de toluène. En commençant par l’axe des abscisses au point 50/50, dessin une ligne vers le haut la courbe liquide, puis une ligne horizontale droite au-dessus de la courbe de vapeur et de retour vers le bas pour l’axe des x, on peut constater qu’au cours de la distillation simple d’un 50 % cyclohexane : mélange à 50 % toluène, la première goutte de distillat serait composé d’environ 80 % de cyclohexane et 20 % de toluène.
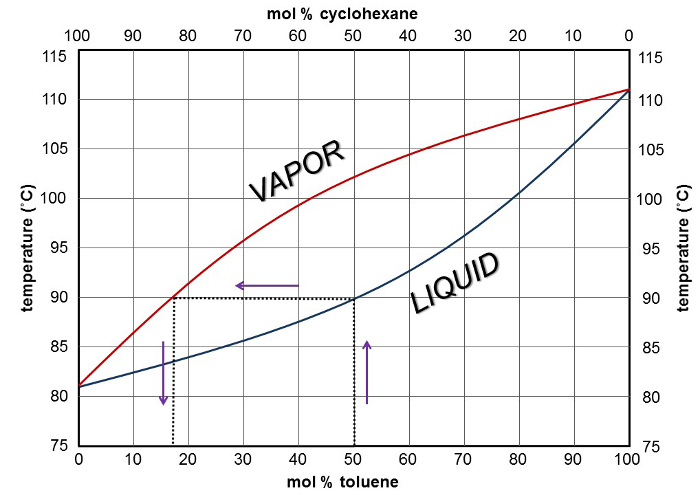
La figure 2. Courbe d’ébullition-composition pour le cyclohexane et le toluène montrant une distillation simple.
Distillation fractionnée est fondamentalement un certain nombre de distillations simples effectuées dans l’ordre, le nombre étant déterminé par le nombre de plateaux théoriques. Il est possible d’utiliser la courbe de composition du point d’ébullition pour déterminer le nombre de plateaux théoriques nécessaires pour obtenir un certain degré de séparation (Figure 3). À partir d’un mélange cyclohexane de 50 % et 50 % de toluène, une colonne de fractionnement avec une égale efficacité à deux plateaux théoriques se traduirait par distillat c’est 95 % cyclohexane pur. Une troisième plaque théorique se traduirait par le distillat qui est d’environ 99 % cyclohexane pur. Toutefois, en pratique, la situation n’est pas aussi simple. Tant que produit de la distillation et le mélange dans le ballon de distillation devient plus en plus enrichi dans le toluène — essentiellement, ce qui entraîne un nouveau mélange de départ qui est plus loin vers la droite sur la courbe de la composition liquide. Afin d’obtenir le cyclohexane pur, plateaux plus théoriques est nécessaires, mais l’efficacité de la colonne de fractionnement est fixe, et donc un point est atteint au cours de laquelle il ne peut plus fournir le degré requis de la séparation, résultant en distillat contenant des traces de contaminants plus de toluène.
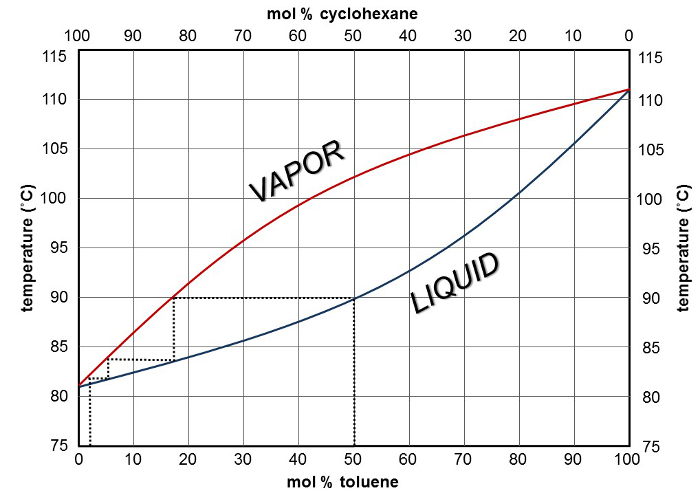
La figure 3. Courbe d’ébullition-composition pour le cyclohexane et le toluène montrant trois plateaux théoriques.
Une courbe de distillation, qui complote la température en fonction du volume de distillat, est illustrée à la Figure 4. Au départ, distillation se produit à environ 82 ° C, le point d’ébullition du cyclohexane. La température relativement stable montre que matériel presque pur est la distillation pendant cette période. Ensuite, la température s’élève et atteint un autre plateau environ 110 ° C, le point d’ébullition du toluène. Entre les deux plateaux, la température s’élève graduellement, pas instantanément. Rappelons que tant que produit de la distillation et le cyclohexane est supprimé, plateaux plus théoriques est nécessaires pour obtenir la pureté désirée. À un certain point la colonne de fractionnement est à son nombre maximal de plaques et permet de séparer le mélange, ce qui signifie qu’il y aura de distillat contenant des composants le cyclohexane et le toluène n’est plus efficacement. Une fois tous le cyclohexane a été distillé, toluène pur commence cependant, comme en témoigne le deuxième plateau de température de distillation. Pour obtenir la distillation optimale, le taux de distillation doit être constante et relativement lent.

La figure 4. Courbe de distillation fractionnée pour le cyclohexane et le toluène.
1. mise en place d’appareils de Distillation fractionnée
| Appareil de Distillation fractionnée | Quantité |
| Cornue dresse (supports de bague) | 2 |
| Cric de vis | 1 |
| Colliers de serrage | 4 |
| Pinces de Keck | 4 |
| Barre d’agitation magnétique | 1 |
| Colonne de fractionnement | 1 |
| Adaptateur « Y » | 1 |
| Thermomètre & thermomètre adaptateur | 1 |
| ballon à fond rond de 100 mL | 1 |
| Condenseur avec tubes d’entrée et de sortie d’eau | 1 |
| Adaptateur de collection | 1 |
| cylindres gradués de 25 mL | 3 |
| Chauffe-ballon | 1 |
| Remuer la plaque | 1 |
Le tableau 1. Composants d’appareils de distillation fractionnée.
Remarque : toute la verrerie, à l’exception des cylindres gradués, devrait avoir des joints rodés
- Rassembler tout le matériel nécessaire pour assembler l’appareil de distillation fractionnée (tableau 1) et placez-les dans une hotte aspirante.
- Placer le chauffe-ballon et remuer la plaque au pied du statif, assis au sommet d’un cric de vis.
- À l’aide de vérins, d’élever le chauffe-ballon jusqu'à une hauteur de 20 cm.
- Fixer une pince sur le statif. Fixer le ballon à fond rond pour le statif à l’aide de la pince afin que le ballon trouve snuggly dans le chauffe-ballon.
- Retirez le cric de vis et le chauffe-ballon, mettant de côté pour plus tard.
- Ajouter une barre d’agitation magnétique pour le ballon à fond rond.
- Ajoutez une colonne de fractionnement vers le haut du ballon à fond rond, fixant au statif avec une pince.
- Ajouter un adaptateur « Y » en haut de la colonne de fractionnement, fixez-la à la statif avec une pince et à la colonne de fractionnement avec un clip de Keck.
- Ajoutez une colonne de condensation au bras incliné vers le bas de l’adaptateur « Y », fixant avec un clip de Keck. Pour plus de stabilité, le condenseur peut être fixé avec un collier pour un deuxième statif.
- Raccordez le tuyau de la source d’eau pour le raccord inférieur sur le condenseur et raccordez le tube de retour de l’eau à la borne supérieure sur le condensateur. S’assurer que le tuyau est fixé au condenseur (pensez à l’aide de fil de cuivre pour tenir le tube en place).
- Connectez un adaptateur de collection à l’extrémité ouverte du condenseur et sécuriser la connexion avec un clip de Keck.
- Avoir trois cylindres jaugée de 25 mL disponibles pour la collecte du distillat.
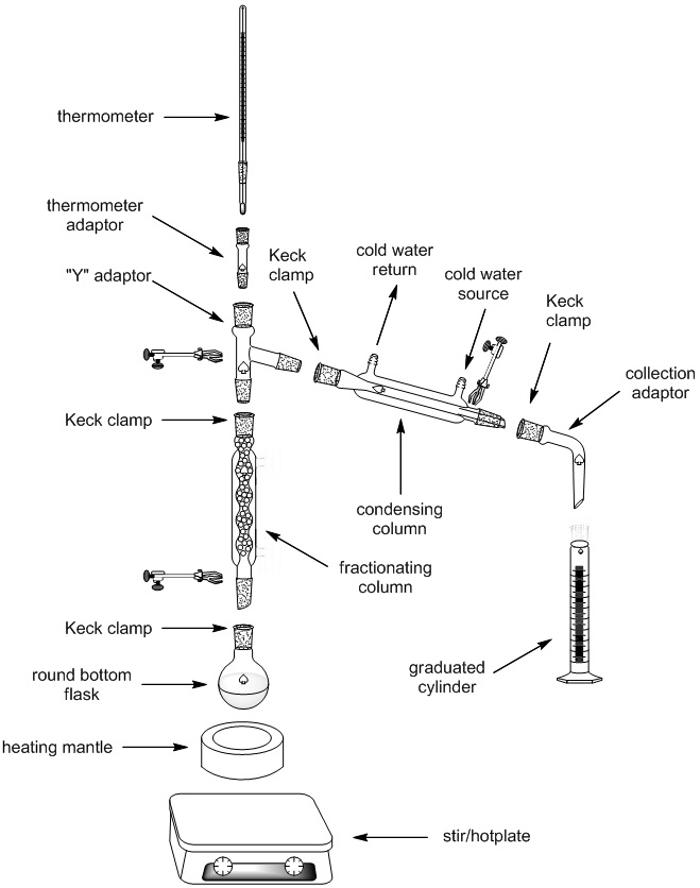
La figure 5. Appareil de distillation fractionnée.
2. préparation pour la Distillation
- Retirer le ballon de l’ensemble en l’abaissant jusqu'à la base du statif.
- Placez un entonnoir de tige dans la partie supérieure du ballon à fond rond et ajouter le liquide à distiller. Ne pas remplir le flacon plus qu’à moitié plein.
- Après avoir rempli le ballon, enlever l’entonnoir.
- Soulever le ballon une fois de plus et placer le ballon dans sa position d’origine sur le statif.
- À l’aide de l’adaptateur de thermomètre, placer le thermomètre dans l’orifice ouvert restant sur l’adaptateur « Y ». Le thermomètre doit être ajouté en dernier, tel qu’il est plus sensible à la casse.
- Placez le réservoir du thermomètre pour qu’il soit juste en dessous du bras latéral de l’adaptateur « Y ». Cela garantit une lecture précise de la température de la vapeur.
- Remplacer le chauffe-ballon et le cric de vis à leur position originale, snuggly enveloppant le ballon à fond rond.
- Placez une éprouvette graduée sous l’adaptateur condenseur, prête à recueillir le distillat.
3. effectuer la Distillation
- Augmentez progressivement la température de la chauffe-ballon jusqu'à ce que le liquide contenu dans le ballon à fond rond commence à bouillir.
- Dès ébullition est commencée, maintenez la température pendant 2 min.
- Remarque la bague de condensation augmente lentement vers le haut de la colonne de fractionnement. La hausse devrait être graduelle, qui assure une bonne séparation des composants mélange à travers les plateaux théoriques. Si l’anneau de condensat s’arrête en hausse, augmenter légèrement la température. Il devrait prendre au moins 5 min pour l’anneau atteindre le sommet de la colonne.
- Une fois que les premières gouttes de liquide commencent à tomber en bas du condenseur, la température doit rester presque constante. Enregistrement de la température comme chacun 2 mL de distillat s’accumule dans l’éprouvette graduée.
- Ajuster la chaleur en conséquence pour tenir compte de 1-2 gouttes/s du condenseur dans l’éprouvette graduée.
- Chaque fois que l’éprouvette graduée s’élève à 4 mL, le remplacer rapidement par un vide.
- Versez le distillat dans un flacon propre, étiqueté pour plus de sécurité.
- Si la distillation se produit très lentement, envelopper la colonne avec le papier d’aluminium ou de la laine de verre pour le protéger des courants d’air froids.
- Quand la température commence à baisser significativement, presque tous le cyclohexane a été distillé. Augmenter la température jusqu'à ce que le toluène commence à bouillir et Distiller. Encore une fois, noter la température comme recueille chaque 2 mL de distillat.
- Avant que tout le contenu de la fiole s’évapore, cesser de chauffer le ballon. Il est important de veiller à ce que le ballon ne devienne pas sec, qui pourrait amener à craquer.
- Retirer le chauffe-ballon en abaissant le cric de vis à la base du socle cornue
- Analyser le contenu du flacon de distillat pour confirmer la pureté à l’aide d’une technique choisie, telle que la RMN du 1H.
Par Distillation fractionnée d’un mélange Cyclohexane-toluène
La pureté du distillat peut être évaluée par un certain nombre de techniques. Un des meilleurs est la spectroscopie RMN. Le spectre 1H-RMN du mélange initial avant la distillation est illustré à la Figure 6. Signaux pour le toluène et le cyclohexane sont clairement visibles. 1 Spectres HNMR du cyclohexane pur et des distillats de toluène pur sont présentés dans les Figures 7 et 8, respectivement. Aucun contaminant de l’autre composant n’est visibles dans chaque cas, montrant l’efficacité de la distillation.
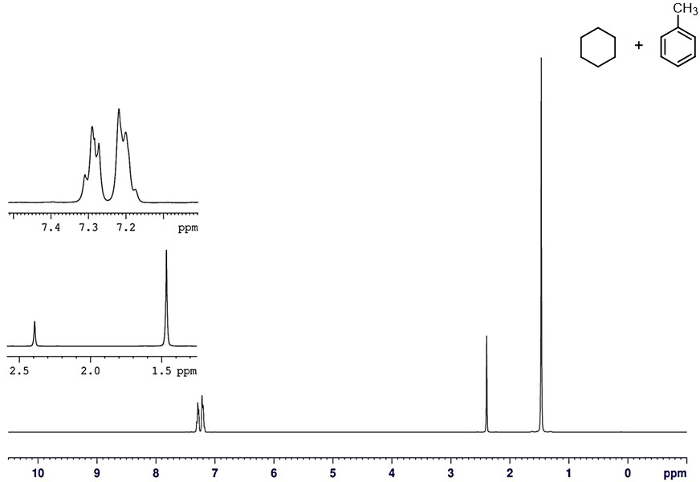
La figure 6. 1 H-RMN d’un mélange de cyclohexane et toluène avant distillation.

La figure 7. 1 H-RMN du distillat pur cyclohexane.
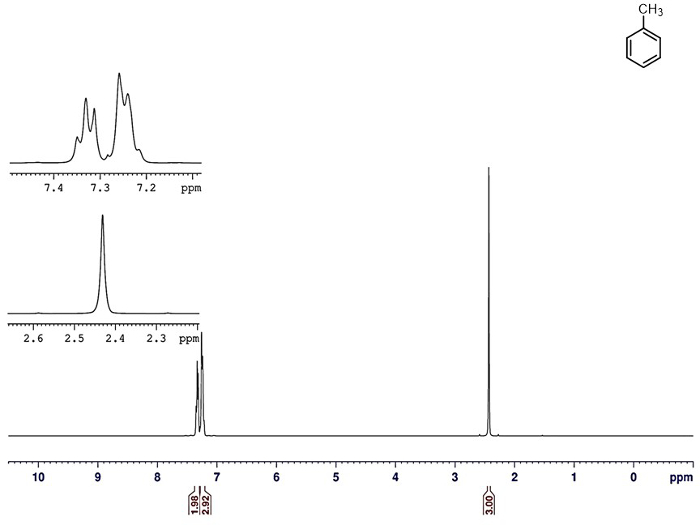
La figure 8. 1 H-RMN du distillat toluène pur.
Distillation représente environ 95 % de tous les procédés de séparation industrielle actuelle. La principale différence entre distillations effectuées à l’échelle laboratoire et ceux réalisés industriellement est que les premiers sont généralement exécutés d’une manière avec, alors que ces derniers fonctionnent souvent en continu. Distillation continue, le mélange de départ, vapeurs et distillat sont maintenus à une composition constante en soigneusement reconstituer le matériel fixe et en supprimant des fractions de vapeur et de liquide dans le système. Le plus largement utilisé l’application industrielle de la continuité, par distillation fractionnée est dans les raffineries de pétrole et des installations de traitement du gaz naturel. À une température inférieure à 36 ° C, gaz naturel sépare du pétrole. Autres substances, comme l’éther de pétrole et de naphta, séparent avant que le pétrole n’atteigne la gamme 69 à 74 ° C, à quel point l’essence se sépare.
Distillation trouve également des applications dans l’industrie alimentaire. Il est utilisé pour produire une grande variété de boissons alcoolisées, par exemple, le whisky, le rhum et le brandy. Lorsque les matériaux fruits et végétaux fermentent, une solution diluée d’éthanol est produite. Le matériel fermenté de distillation purifie et concentre à l’éthanol. Une variété d’autres composants, tels que les esters parfumés et autres types d’alcool, sont également collectées au cours du processus de distillation, qui tient compte de la saveur unique de l’esprit fini.
Passer à...
Vidéos de cette collection:

Now Playing
Distillation fractionnée
Organic Chemistry
332.8K Vues

Introduction à la catalyse
Organic Chemistry
34.1K Vues

Montage d'un chauffage à reflux
Organic Chemistry
166.3K Vues

Réaliser des réactions en dessous de la température ambiante
Organic Chemistry
70.3K Vues

Transfert de solvants via une rampe à vide (ligne Schlenk)
Organic Chemistry
41.5K Vues

Dégazage des liquides par la technique "cycle geler-pomper-dégeler"
Organic Chemistry
55.9K Vues

Préparation de réactifs anhydres et équipement
Organic Chemistry
79.1K Vues

Purification des composés par recristallisation
Organic Chemistry
705.3K Vues

Séparation des mélanges par précipitation
Organic Chemistry
157.2K Vues

Extraction solide-liquide
Organic Chemistry
237.1K Vues

Utilisation d'un évaporateur rotatif (ou Rotovap) pour éliminer un solvant
Organic Chemistry
212.3K Vues

Préparation de cristaux pour analyse par diffraction des rayons X
Organic Chemistry
32.3K Vues

Performing 1D Thin Layer Chromatography
Organic Chemistry
288.4K Vues

Chromatographie sur colonne
Organic Chemistry
358.4K Vues

Spectroscopie à résonance magnétique nucléaire (RMN)
Organic Chemistry
246.7K Vues