Voltammétrie cyclique
Vue d'ensemble
Source : Laboratoire du Dr Kayla Green — Texas Christian University
Une expérience de voltampérométrie cyclique (CV) implique l’analyse d’un éventail de tensions potentielles pendant la mesure actuelles. Dans l’expérience de CV, le potentiel d’une électrode immergée, stationnaire est scanné d’un potentiel départ prédéterminé jusqu'à une valeur finale (appelée la commutation possible) puis l’analyse inverse est obtenu. Cela donne un balayage « cyclique » potentiels et le courant contre la courbe de potentiel provenant des données s’appelle un voltamogramme cyclique. Le premier volet est appelé le « scan vers l’avant » et la vague de retour est appelée le « balayage inverse ». Les potentielles extrêmes sont appelées la « fenêtre de scan ». L’ampleur de la réduction et l’oxydation des courants et la forme de la voltampérogrammes sont fortement tributaires de la concentration de l’analyte, le taux de balayage et des conditions expérimentales. En faisant varier ces facteurs, voltamétrie cyclique peut donner des informations relatives à la stabilité de l’état d’oxydation de métaux de transition dans la forme complexée, la réversibilité des réactions de transfert d’électrons et des informations concernant la réactivité. Cette vidéo vous expliquera les réglages de base pour une expérience de voltampérométrie cyclique, y compris la préparation de l’analyte et de mettre en place la cellule électrochimique. Une expérience de voltampérométrie cyclique simple sera présentée.
Principles
Dans une expérience de voltampérométrie cyclique du potentiel appliqué entre l’électrode de référence et l’électrode de travail augmente de façon linéaire avec le temps (vitesse de balayage (V/s)). En même temps, le courant est mesuré entre le travail et l’électrode de comptoir (ou auxiliaire) ayant pour résultat les données qui sont tracées dans le courant (i) vs potentiel (E). Réduction et oxydation des événements sont observés et assignés dans les parcelles qui en résulte. Réduction des événements se produisent en analyte de tensions potentielles spécifiques où la réaction M+ n + e– → M+ n-1 (M = métallique) est énergétiquement favorable (dite potentiel de réduction) et mesuré en augmentant les valeurs actuelles. Le courant augmentera à mesure que le potentiel de tension atteint le potentiel de réduction de l’analyte, mais tombe alors que le taux maximal de transfert de masse a été atteinte. Le courant ne descend qu’à atteindre l’équilibre à une valeur constante. Les réactions d’oxydation (M+ n → M+ n + 1 + e–) peut également être observée comme une diminution des valeurs actuelles à des potentiels qui énergiquement favorisent la perte d’electron(s).
Les voltampérogrammes qui en résultent sont ensuite analysées et le potentiel (E,p) et les données actuelles (j’aip) pour la réduction et de manifestations d’oxydation dans des conditions expérimentales chaque installation sont notées. Ces renseignements peuvent être utilisés pour évaluer le caractère réversible de réduction couplée et événements de l’oxydation. Comme indiqué plus haut potentiels de pointe (Epa et Epc) et des courants de pointe (j’aipc et j’aipa) sont des paramètres fondamentaux utilisés pour caractériser un événement ou un couple redox. Au cours d’un processus d’oxydo-réduction réversible, les formes oxydées et réduites d’un composé sont en équilibre à la surface de l’électrode. L’équation de Nernst décrit la relation entre le potentiel et le rapport d’équilibre, ([R] / [O])x = 0.
 (1)
(1)
Où, 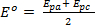 s’appelle le potentiel formel de la réaction et prend en compte les coefficients d’activité et d’autres facteurs expérimentaux.
s’appelle le potentiel formel de la réaction et prend en compte les coefficients d’activité et d’autres facteurs expérimentaux.
Plus précisément, le courant de crête d’une réaction réversible est donné par :
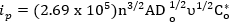 (2)
(2)
où, jep est le sommet le courant en ampères, n est le nombre d’électrons impliqués, A est la zone de l’électrode en cm2, Do est la constante de diffusion (cm2/s), v est la vitesse de balayage (V/s) et Co* est la concentration en vrac (moles/cm3). La constante de diffusion peut être mesurée à l’aide de plus vastes expériences détaillées ailleurs et n’est pas l’objet de cette vidéo1. Toutefois, les lignes directrices plus basiques peuvent servir pour l’évaluation de la réversibilité du système1. Critères d’un système totalement réversible1:
 à diverses analyse taux n = nombre d’électrons
à diverses analyse taux n = nombre d’électrons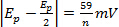 à diverses scan tarifs
à diverses scan tarifs- | j’aipa/j’aipc| = scan de 1 à divers tarifs
- Ep est indépendante de v v = vitesse de balayage
- aux potentiels au-delà Ep, j’ai-2
 t
t
Les tests de diagnostic simples permettant de définir un système totalement irréversible à 25 ° C sont :
- Aucun Pic inverse (il s’agit d’irréversibilité chimique, mais pas nécessairement à l’irréversibilité de transfert électronique)
- Epc se déplace
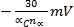 pour chaque décennie augmentent dans v (irréversibilité électrochimique)
pour chaque décennie augmentent dans v (irréversibilité électrochimique) 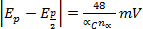
Enfin, des tests de diagnostic permettant de définir un système quasi réversible sont :


- Epc décale négativement avec l’augmentation de v
La position de la réduction et/ou les événements d’oxydation permet d’en déduire des informations sur la nature électronique des complexes de métaux de transition et les effets sur des ligands donneurs. Par exemple, le Fe+ 3 / + 2 potentiel de réduction de dérivés du ferrocène est très sensible à l’environnement électronique fournie par l’ensemble de ligand cyclopentadiényle (Cp). (Retire) Cp substituants électro-donneurs augmenter la densité (diminution) de l’électron sur le centre de fer et décaler le potentiel redox des valeurs négatives (positif) par rapport au Fc.
Dans le présent protocole ferrocène serviront à titre d’exemple. Conditions expérimentales comme solvant, le choix de l’électrolyte et l’aire de répartition potentielle étudie (fenêtres de balayage) sont largement dictées par la solubilité de l’analyte et des conditions expérimentales. Les utilisateurs sont encouragés à consulter les textes pertinents tels que Bard et Faulkner1 pour en savoir plus.
Procédure
1. préparation de la Solution d’électrolyte
- Préparer une solution mère d’électrolyte (10 mL), composée de 0,1 M [Bu4N] [BF4] CH3CN.
- Placer la solution d’électrolyte dans le flacon électrochimique, ajouter un petit et placer le capuchon sur le flacon, comme illustré à la Figure 1.
- Vérifier que la tête de l’azote est dans la solution d’électrolyte. Remuer et dégazer la solution d’électrolyte avec un léger courant de gaz de2 sec N (~ 10 min) pour éliminer l’oxygène moléculaire redox actif.
- Au cours de l’étape 1.3, insérez avec précaution l’électrode de travail (par exemple le carbone vitreux), compteur (Pt) et des électrodes de référence (Ag/AgNO3) dans le haut de cellule de téflon. Connectez les fils de support de cellule à l’électrode appropriée.

La figure 1. Programme d’installation d’une cellule électrochimique.
2. obtenir une analyse en arrière-plan
- Définir les conditions expérimentales relatives au solvant. L’acétonitrile, la fenêtre de scan est généralement +2,000 mV –-2 000 mV.
- Exécuter et enregistrer les voltampérogrammes de la solution d’électrolyte à une gamme de vitesses de balayage (p. ex. 20 mV/s, 100 mV/s ou 300 mV/s).
- Vérifier l’analyse qui en résulte pour s’assurer qu’il n’y a pas d’impuretés dans la solution d’électrolyte ou restantes en oxygène. Un système propre n’aura aucun événement d’oxydo-réduction. Si la configuration est contaminée, les électrodes et la verrerie devront être nettoyés et la solution d’électrolyte refait à l’aide de composants propres.
3. préparation de la Solution d’Analyte
- Combiner l’analyte (~ 2-5 mM, concentration finale) d’intérêt avec la solution d’électrolyte préparée ci-dessus.
- Vérifier que la tête de l’azote est dans la solution d’électrolyte. Remuer et dégazer la solution d’analyte/électrolyte avec un léger courant de gaz de2 sec N (~ 10 min) pour éliminer l’oxygène moléculaire redox actif.
4. cyclique voltammétrie d’Analyte
- Effectuer plusieurs expériences voltamogramme cycliques à des taux de balayage de 20 mV à 1 000 mV (en fonction des capacités de support de cellule). Commencer chaque balayage utilisant le circuit ouvert calculé potentiel.
- Méthodiquement varier le sens de balayage [(+ to –) et (-au +)] et fenêtres de balayage afin d’isoler les événements d’oxydo-réduction d’intérêt. Le voltamogramme devrait toujours commencer de zéro courant (circuit ouvert). Ferrocène (Fc) subit une réaction d’oxydation à ferrocénium (Fc+).
- De nombreux groupes normaliser les données pour le couple redox Fc/Fc+ . Dans cet exercice, ~ 2 mg de Fc sont ajoutés à la solution d’analyte et étape 4.2 est répété pour des fins de référencement. En analyse de données, tous les spectres sont normalisées au couple Fc/Fc+ la valeur 0,00 V. Un tableau des potentiels de réduction normalisée est disponible2.
5. nettoyage des électrodes et la cellule électrochimique
- Soigneusement desserrer et enlever chaque électrode de la cellule électrochimique.
- Rincez l’électrode de référence avec l’acétonitrile et essuyer avec un Kimwipe. Stocker dans la solution de stockage référence électrode.
- Nettoyer doucement l’électrode de travail et compteur conformément aux directives des fabricants (par ex. BASi : http://www.basinc.com/mans/pguide.pdf) pour éliminer les produits de réaction d’oxydo-réduction qui s’accumulent au cours de certaines expériences.
Résultats
Une analyse de CV du ferrocène à 300 mV/s dans l’acétonitrile a été réalisée et le voltamogramme correspondant est illustré à la Figure 2.

La ΔE peut être dérivé des données dans la Figure 2 , basé sur la différence entre Epa et Epc.
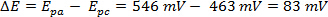
Les voltampérogrammes cycliques superposées à la Figure 3 représentent consécutives d’expériences réalisées sur le même système à balayage différents tarifs. Comme indiqué en plus haut, un tracé linéaire de j’aip vs v1/2 (en médaillon sur la Figure 3) montre que la réaction est diffusion contrôlée.
La position de l’événement E1/2 ou redox (Epa ou Epc) peut servir à déterminer les effets que le ligand a sur le centre métallique active de redox fournissant la réaction électrochimique. La figure 4 montre une série de congénères axée sur le ferrocène avec des substitutions de variables sur l’anneau de Cp. Comme illustré à la Figure 5, l’halogénure électroattracteurs se traduit par la valeur de1/2 Ede ce complexe à être déplacés vers des potentiels plus positifs parce que la forme oxydée est déstabilisée par le ligand électroattracteurs. L’électron donnant des groupes méthyles du composé C résultat en E1/2 pour passer à des potentiels plus négatifs que les espèces oxydées sont stabilisé.

Figure 2. Une analyse de CV du ferrocène à 150 mV/s dans l’acétonitrile. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3. Un composé contenant du cobalt qui donne lieu à l’événement une réduction. L’encart montre une corrélation linéaire entre jep et v1/2. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4. Une série de composés à base de ferrocène. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
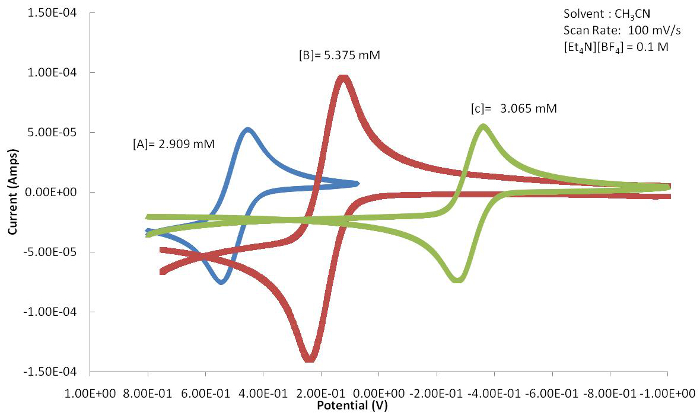
Figure 5. Les voltampérogrammes cycliques qui en résultent de A-C (Figure 4) montrent un changement marqué dans E1/2 en raison des effets de ligand électronique attachés au centre métallique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
References
- Bard, A. J., Faulkner, L. A. Electrochemical methods: Fundamentals and Applications. 2nd ed. New York: Wiley; 833 p. (2001).
- Geiger, W. E., Connelly, N. G. Chemical Redox Agents for Organometallic Chemistry. Chem Rev. 96 (2), 877-910, (1996).
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Voltammétrie cyclique
Analytical Chemistry
125.6K Vues

Préparation des échantillons pour analyse
Analytical Chemistry
84.9K Vues

Étalon interne
Analytical Chemistry
205.0K Vues

Méthode de l'addition standard
Analytical Chemistry
320.4K Vues

Courbes d'étalonnage
Analytical Chemistry
798.0K Vues

Spectroscopie ultraviolet-visible (UV-Vis)
Analytical Chemistry
624.6K Vues

La spectroscopie Raman pour l'analyse chimique
Analytical Chemistry
51.3K Vues

Spectrométrie de fluorescence des rayons X
Analytical Chemistry
25.7K Vues

Chromatographie en phase gazeuse (CG) couplée à un détecteur à ionisation de flamme
Analytical Chemistry
282.6K Vues

La chromatographie en phase liquide à haute performance (CLHP)
Analytical Chemistry
385.3K Vues

Chromatographie par échange d'ions
Analytical Chemistry
264.8K Vues

Électrophorèse capillaire (EC)
Analytical Chemistry
94.2K Vues

Introduction à la spectrométrie de masse
Analytical Chemistry
112.5K Vues

Microscopie électronique à balayage (MEB)
Analytical Chemistry
87.3K Vues

Mesures électrochimiques d'un catalyseur sur support à l'aide d'un potentiostat / galvanostat
Analytical Chemistry
51.6K Vues