Chromatographie en phase gazeuse (CG) couplée à un détecteur à ionisation de flamme
Vue d'ensemble
Source : Laboratoire du Dr B. Jill Venton - University of Virginia
Chromatographie en phase gazeuse (GC) sert à séparer et à détecter les composés de faible poids moléculaire en phase gazeuse. L’échantillon est un gaz ou un liquide qui est vaporisé dans l’orifice d’injection. En général, les composés analysés sont moins de 1 000 Da, car il est difficile vaporiser les composés plus gros. GC est populaire pour la surveillance de l’environnement et des applications industrielles, car il est très fiable et peut être exécuté presque continuellement. GC est généralement utilisée dans les applications où les petites molécules volatiles sont détectés et avec des solutions non aqueuses. Chromatographie en phase liquide est plus populaire pour les mesures dans des échantillons aqueux et peut être utilisé pour l’étude des molécules plus grosses, parce que les molécules n’ont pas besoin de se vaporiser. GC est favorisée pour les molécules non polaires tandis que LC est plus fréquente pour la séparation des analytes polaires.
La phase mobile pour chromatographie en phase gazeuse est un gaz porteur, généralement hélium en raison de son faible poids moléculaire et d’être chimiquement inerte. Une pression est appliquée et la phase mobile déplace de l’analyte dans la colonne. La séparation se fait en utilisant une colonne enduite avec une phase stationnaire. Colonnes capillaires tubulaires ouverts sont les colonnes plus populaires et la phase stationnaire, enduite sur les parois du capillaire. Phases stationnaires sont souvent dérivés de polydiméthylsiloxane, avec 5 à 10 % des groupes fonctionnalisés pour affiner la séparation. Typique des groupes fonctionnels sont des groupes phényle, cyanopropyl ou trifluoropropyl. Colonnes capillaires sont généralement de 5 à 50 m de long. Des colonnes plus étroites ont une résolution plus élevée, mais nécessitent des pressions plus élevées. Colonne remplie peut également être utilisé où la phase stationnaire est adsorbée sur perles emballés dans la colonne. Colonne remplie est plus courtes, 1 à 5 m. capillaires tubulaires ouverts sont généralement préférés car ils permettent une efficacité accrue, des analyses plus rapides et ont des capacités supérieures.
Détection d’ionisation de flamme (FID) est un bon détecteur général pour les composés organiques en GC qui détecte la quantité de carbone dans un échantillon. Après la colonne, les échantillons sont brûlés dans une flamme d’hydrogène-air chaud. Les ions de carbone sont produites par la combustion. Alors que l’efficacité globale du processus est faible (seulement 1 sur 105 ions de carbone produisent un ion dans la flamme) le montant total des ions est directement proportionnel à la quantité de carbone dans l’échantillon. Électrodes sont utilisées pour mesurer le courant d’ions. FID est un détecteur destructrice, comme l’ensemble de l’échantillon est pyrolysé. FID n’est pas affectée par l’eau et de gaz non combustibles.
Principles
L’équilibre pour chromatographie en phase gazeuse est partitionnement et les composants de l’échantillon vont partitionner (c'est-à-dire distribuer) entre les deux phases : la phase stationnaire et la phase mobile. Les composés qui ont une plus grande affinité pour la phase stationnaire passent plus de temps dans la colonne éluer plus tard et ont un plus long temps de rétention (tR) que les échantillons qui ont une affinité plus élevée pour la phase mobile. Affinité pour la phase stationnaire est tirée principalement par les interactions intermoléculaires et la polarité de la phase stationnaire peut être choisie pour maximiser les interactions et donc la séparation. Pics idéales sont des distributions gaussiennes et symétrique, en raison du caractère aléatoire des interactions analyte avec la colonne. Caractéristiques du peak asymétrique, comme la pointe donnant ou équeutage, peuvent être due à une surcharge de la colonne, problèmes d’injection ou la présence d’adsorption des groupes fonctionnels tels que les acides carboxyliques.
Dans GC, la température est réglée pour modifier l’équilibre et donc les temps d’élution. Séparations en GC sont basées sur la volatilité parce que des substances de point d’ébullition plus élevés peuvent se condenser sur une colonne si la température est basse, donc ils ne sont pas éluées ou prennent un certain temps pour éluer. Isothermes séparations sont effectuées à une température ou dégradées séparations sont effectuées lorsque la température est inclinée lors de la séparation. Rampes de température permettent les deux composés de point bas et haut-point d’ébullition à séparer la séparation même.
L’affichage produit par GC est un chromatogramme qui donne le signal au fil du temps. Pics sont observés pour chacun des composés dans l’échantillon. Pour chaque sommet, une hauteur et une surface de pic peuvent être calculées. Aire du pic est généralement utilisé pour faire des courbes d’étalonnage et de calculer les concentrations des échantillons à inconnues. Le nombre de plateaux théoriques (N) est calculé à partir de chaque pic pour donner une mesure de l’efficacité de la colonne. Une équation pratique pour mesure N est N = 16(tR/W)2 oùR est le temps de rétention de l’analyte et W est la largeur du bas de la crête. N est utilisé pour comparer les séparations sur des colonnes différentes.
Le détecteur à ionisation de flamme est masse sensible. Ainsi, la quantité de signal est proportionnelle à la masse de carbone dans l’échantillon, pas le nombre de moles. Composés avec plus de carbone donnent des signaux plus. La combustion du carbone produit des ions qui sont détectées comme un courant. FID est un des plus sensibles détecteurs générales pour GC avec une limite de détection de l’ordre du picogramme. La réponse est linéaires sur sept ordres de grandeur, ce qui lui donne une large gamme de linéaire.
Procédure
1. initialisation de la GC
- Le gaz vecteur hélium et air et régler les manomètres sur l’instrument.
- Allumez le four à colonne à une température élevée (typiquement 250 ° C ou plus) à cuire dans la colonne. Ne pas dépasser la température maximale de la colonne. Cela supprimera tous les contaminants. Laissez-le cuire pendant au moins 30 min avant d’exécuter un échantillon.
2. faire un fichier de méthodes
- Dans le logiciel de contrôle de l’instrument, entrée toutes les valeurs souhaitées pour un fichier de méthodes. Tout d’abord, définir les paramètres de l’échantillonneur automatique. Définir le nombre de rinçages avant exécution, post-exécution rinçages et rince avec l’échantillon. Ces rinçages nettoyer la colonne entre les différents échantillons.
- La quantité injectée est généralement de 1 µL. Un coefficient de fractionnement est généralement définie car injecter tout d’un échantillon peut surcharger la colonne. Si le coefficient de fractionnement est 100 : 1, cela signifie que pour chaque 1 partie qui est injecté dans l’instrument 100 parties va perdre.
- Les phase mobile des paramètres d’entrée. Le débit est contrôlé par le jeu de pression. Des débits plus rapides conduisent à des séparations plus rapides, mais il y a moins de temps pour l’analyte et interagir avec la colonne.
- Entrer dans la programmation de température. Pour une course isotherme, réglez la température de la séparation et puis une fois pour la séparation. Pour une gradient d’élution, entrez la température de départ et indisponibilité, la température de finale et temps et la vitesse de la rampe en ° C/min. Un temps d’équilibrage est également défini qui permet à la colonne de cool dos vers le bas la température originale entre les exécutions.
- Entrez les paramètres du détecteur. Un taux d’échantillonnage et de la température détecteur sera inscrite. Le détecteur doit toujours être une température plus élevée que la température de la colonne afin qu’aucun analyte se condense sur le détecteur.
- Enregistrez le fichier de méthodes. Les paramètres peuvent doivent également être téléchargé alors qu’ils sont lus par le GC.
3. collecte de données de GC
- Allumez le gaz d’hydrogène et veillez à ce que le manomètre est correctement défini. Allumer la flamme de l’analyseur FID.
- Sur la grille de l’échantillonneur automatique, remplir le flacon de lavage avec le solvant de lavage, comme l’acétonitrile ou méthanol. Assurez-vous que le flacon de déchets est vide.
- Préparation des échantillons. Si il n’y a aucune chance de particules présentes dans l’échantillon, filtrer l’échantillon. Parce que les résidus de plastique peuvent parfois être vu avec GC, utilisation seul verre seringues et flacons pour préparer votre échantillon de verre.
- Remplir le flacon au moins la moitié d’échantillon ainsi la seringue de l’échantillonneur automatique est assurée pour ramasser de l’échantillon. Flacons pour échantillonneur automatique sont généralement 2 mL, mais si le volume de l’échantillon est limité, flacon plaquettes sont disponibles pour réduire le volume de l’échantillon nécessaire.
- Chargez l’exemple vial(s) dans le rack pour échantillonneur automatique. Garder une trace de quelle position chaque échantillon est dans.
- Avant la course, zéro à la référence de l’enregistreur sur le logiciel de l’ordinateur.
- Les fichiers peuvent être collectées comme un même essai ou utiliser une table de lots pour essais multiples. Veillez à spécifier le nombre correct de flacon pour l’échantillon. Cliquez sur le bouton « Démarrer » et en faire un fichier.
- Sont généralement analysé les données avec un logiciel. Les paramètres qui peuvent être mesurées incluent temps de rétention, hauteur de pic, surface de pic et nombre de plateaux théoriques.
4. résultats : GC analyse des échantillons de café
- Dans cet exemple, analyse de GC-FID a été réalisée pour la caféine et l’acide palmitique, deux composés présents dans le café. La caféine est moins polaire que l’acide palmitique, qui a une queue d’alcane à chaîne longue. Ainsi, la caféine est moins conservée et élue tout d’abord sur la colonne non polaire de 95 % diméthylpolysiloxane et 5 % phényl-ARYLÈNE (Figure 1).
- Partir du chromatogramme, on peuvent calculer la surface des pics. La surface des pics sont proportionnelles à la masse de carbone qui passe par le détecteur et ils peuvent être utilisés pour faire une courbe d’étalonnage de concentration de vs réponse instrument. Pour la Figure 1, la surface du pic est 27 315 pour la caféine et 18 852 pour l’acide palmitique.
- Une mesure de l’efficacité de la colonne est N, le nombre de plateaux théoriques. N peut être calculé à partir du chromatogramme pour chaque pic. Pour la Figure 1, N est de 283 000 pour la caféine et 261 000 pour l’acide palmitique.
- Figure 2 illustre l’effet de la température sur les séparations isothermes. Deux séparations sont recouvertes du même échantillon caféine et l’acide palmitique. Le premier est à 180 ° C et le second à 200 ° C. Les temps de rétention sont beaucoup plus petites pour l’exécuter une température plus élevée.
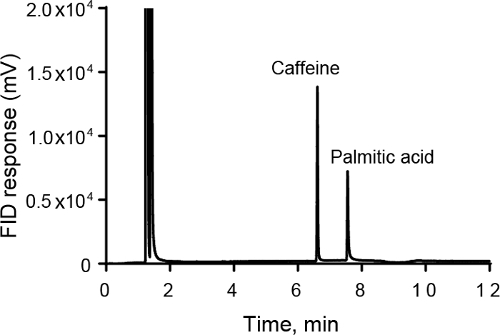
Figure 1. L’analyse des échantillons de la caféine et l’acide palmitique GC-FID. La caféine 5 mM standard élue tout d’abord, suivie de l’échantillon de l’acide palmitique 1 mM. La rampe de température était de 0,1 min à 150 ° C, suivie d’une rampe à 10 ° C/min à 220 ° C où la température est gardée pendant 5 min.

Figure 2. Analyse de GC-FID de courses isothermes d’un échantillon de café de torréfaction foncée. Une comparaison des GC-FID tourne à 180 ° C et 200 ° C pour un échantillon de café de torréfaction foncée. Les pics éluer beaucoup plus rapidement à une température de 200 ° C.
Applications et Résumé
GC est utilisé pour une variété d’applications industrielles. Par exemple, il est utilisé pour tester la pureté d’un produit chimique de synthèse. GC est également populaire dans des applications environnementales. GC est utilisé pour détecter les pesticides, les hydrocarbures aromatiques polycycliques et des phtalates. Plupart des applications de qualité air utilisent GC-FID pour surveiller les polluants de l’environnement. GC est également utilisé pour l’analyse, où les volatiles qui sont évaporation d’un liquide sont collectés et mesurées. Ceci est utile pour les industries cosmétiques et des aliments et des boissons. GC est utilisé pour les applications médico-légales ainsi, telles que la détection de drogues d’abus ou d’explosifs. En outre, le GC est utile dans l’industrie pétrolière pour la mesure des hydrocarbures. Les applications étendues rend GC 1 milliard de dollars par le marché mondial de l’année.
La figure 3 montre un exemple de comment GC puisse être utilisé dans l’industrie alimentaire. La figure 3 montre un chromatographe de vanille artificielle (noir) et la vraie vanille (rouge). GC peut être utilisé pour identifier l’échantillon réel, qui contient un gros pic de vanilline, mais ne contient-elle pas un second pic pour éthylvanilline.
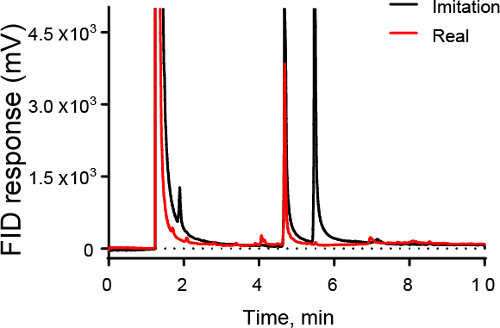
Figure 3. Chromatogramme de la GC-FID des échantillons vanille. Imitation et vraie vanille montrent des pointes grands à 4,7 min en raison de la vanilline, le composant de principe de la vanille. Toutefois, l’imitation vanille a aussi un pic important à 5,3 min, qui est due à l’éthylvanilline, un composé non présents en grandes quantités dans la vraie vanille.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Chromatographie en phase gazeuse (CG) couplée à un détecteur à ionisation de flamme
Analytical Chemistry
282.6K Vues

Préparation des échantillons pour analyse
Analytical Chemistry
84.9K Vues

Étalon interne
Analytical Chemistry
205.0K Vues

Méthode de l'addition standard
Analytical Chemistry
320.4K Vues

Courbes d'étalonnage
Analytical Chemistry
798.0K Vues

Spectroscopie ultraviolet-visible (UV-Vis)
Analytical Chemistry
624.6K Vues

La spectroscopie Raman pour l'analyse chimique
Analytical Chemistry
51.3K Vues

Spectrométrie de fluorescence des rayons X
Analytical Chemistry
25.7K Vues

La chromatographie en phase liquide à haute performance (CLHP)
Analytical Chemistry
385.3K Vues

Chromatographie par échange d'ions
Analytical Chemistry
264.8K Vues

Électrophorèse capillaire (EC)
Analytical Chemistry
94.2K Vues

Introduction à la spectrométrie de masse
Analytical Chemistry
112.5K Vues

Microscopie électronique à balayage (MEB)
Analytical Chemistry
87.3K Vues

Mesures électrochimiques d'un catalyseur sur support à l'aide d'un potentiostat / galvanostat
Analytical Chemistry
51.6K Vues

Voltammétrie cyclique
Analytical Chemistry
125.6K Vues