Imagerie des anévrismes de l'aorte abdominale par fluorescence dans le proche infrarouge
Vue d'ensemble
Source: Arvin H. Soepriatna1, Kelsey A. Bullens2, et Craig J. Goergen1
1 Fois Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
2 (en) Département de biochimie, Université de Purdue, Lafayette occidental, Indiana
L'imagerie par fluorescence proche infrarouge (NIRF) est une technique optique passionnante qui utilise des sondes fluorescentes pour visualiser des assemblages biomoléculaires complexes dans les tissus. L'imagerie NIRF présente de nombreux avantages par rapport aux méthodes d'imagerie conventionnelles pour l'imagerie non invasive des maladies. Contrairement à la tomographie calculée par émission de photons (SPECT) et à la tomographie par émission de positons (TEP), l'imagerie NIRF est rapide, à haut débit et n'implique pas de rayonnement ionisant. En outre, les développements récents dans l'ingénierie des sondes fluorescentes spécifiques à des cibles et activatables fournissent à NIRF une grande spécificité et sensibilité, ce qui en fait une modalité attrayante dans l'étude du cancer et des maladies cardiovasculaires. La procédure présentée est conçue pour démontrer les principes qui sous-tendent l'imagerie NIRF et la façon de mener des expériences in vivo et ex vivo chez de petits animaux afin d'étudier une variété de maladies. L'exemple spécifique montré ici emploie une sonde fluorescente activatable pour la matrice metalloproteinase-2 (MMP2) pour étudier son apprémonitable dans deux modèles différents de rongeurs des anévrismes aortiques abdominaux (AAA).
Principles
Comme son nom l'indique, l'imagerie NIRF utilise la lumière dans la première fenêtre proche infrarouge, allant de 650 nm à 900 nm, pour livrer des photons dans les tissus. L'énergie, E, d'un photon est caractérisée par l'équation 1, où h est la constante du Planck, c est la vitesse de la lumière dans un vide, et est la longueur d'onde de la lumière.

 (Équation 1)
(Équation 1)
Les molécules fluorescentes spécifiques à la cible appelées fluorophores sont généralement introduites dans l'animal par le génie génétique ou par injection de veines de queue avant l'imagerie. Ces fluorophores absorbent l'énergie du photon, qui soulève l'énergie des molécules de l'état du sol, S0, à l'état instable et excité S1'. En raison de l'instabilité de l'état S1', les molécules se détendre au niveau d'énergie vibratoire le plus bas dans cet état et libérer de l'énergie sous forme de chaleur. Les fluorophores, maintenant dans l'état détendu et excité S1, puis revenir à l'état de sol S0, émettant de la lumière à une longueur d'onde spécifique. La lumière émise, qui a une longueur d'onde plus longue en raison de la dissipation de l'énergie sous forme de chaleur, est ensuite capturée et enregistrée à l'aide d'un système d'imagerie par fluorescence. Le décalage fondamental entre les spectres d'absorption et d'émission est appelé le décalage Stokes et est important car il permet de différencier entre l'excitation et la lumière d'émission.
Procédure
La procédure suivante fournit les étapes détaillées nécessaires pour recueillir in vivo et ex vivo des images NIRF de petits animaux:
1. Configuration expérimentale
- Connectez une source de lumière de fibre optique au système d'imagerie de fluorescence à l'aide d'un guide de lumière à fibres optiques.
- Sélectionnez le filtre d'excitation approprié pour l'expérience. Le filtre d'excitation détermine la longueur d'onde de la lumière à livrer à l'échantillon et doit être choisi pour correspondre au spectre d'excitation du fluorophore introduit dans l'échantillon.
- Sélectionnez le filtre d'émission approprié. Le filtre d'émission bloque les composants spectrals indésirables, qui peuvent être attribués à l'autofluorescence, et devrait être choisi pour correspondre au spectre d'émission du fluorophore.
2. Préparation de l'échantillon
-
In Vivo
- Anesthésiez l'animal dans une chambre à induction à l'aide d'isoflurane à une concentration de 3-4% sur le cadran du débitmètre.
- Transférer l'animal sur un cône nasal fixé au stade d'imagerie et maintenir l'isoflurane à une concentration de 1 à 2 %. Une source de chaleur n'est pas nécessaire parce que les animaux ne sont généralement représentés que pendant une courte période de temps (à 5 min), et leur température corporelle ne diminue pas considérablement.
- Fixer les pattes de l'animal pour minimiser les artefacts de mouvement. Retirer les cheveux de la région d'intérêt en appliquant une crème dépilatoire.
- Appliquer la crème dépilatoire sur la plus petite surface nécessaire. Après 30 s, essuyez-le avec un tampon de gaze. Essuyez la zone une deuxième fois avec un tampon de gaze humidifié e-éthylique pour enlever complètement la crème dépilatoire.
- Appliquer un onduleur ophtalmique sur les yeux pour éviter le séchage des cornées.
- Injecter la sonde moléculaire fluorescente activatable dans l'animal. Pour cette application spécifique, des sondes activatoires MMP2 ont été injectées par voie intraveineuse dans la veine de la queue. À ce stade, la souris peut être image. Procéder à l'"Acquistion d'image" de ce protocole pour continuer. Surveillez l'animal pour la respiration régulière tout au long de la procédure brève.
-
Ex Vivo
- Après l'injection de la sonde fluorescente, euthanasiez l'animal d'une manière humaine selon les Lignes directrices 2013 de l'AVMA pour l'euthaniasie des animaux. Le surdosage de dioxyde de carbone (CO2) est une pratique courante pour euthanasier les petits animaux.
- Extraire chirurgicalement le tissu ou l'organe d'intérêt et enlever soigneusement l'excès de tissu adipeux avec des forceps.
- Rincer le tissu dans le phosphate tamponné salin pour enlever le sang résiduel et placer l'échantillon directement sur le stade d'imagerie.
3. Acquisition d'images
- Ouvrez le logiciel d'imagerie moléculaire et activez à la fois la source de lumière à fibres optiques et le système d'imagerie par fluorescence.
- Ouvrez la fenêtre d'acquisition et spécifiez le type d'exposition approprié à l'étude. Les expositions disponibles comprennent : L'exposition standard pour capturer une seule image, l'exposition time Lapse pour capturer une série d'images sur un intervalle de temps fixe, et l'exposition progressive pour capturer une séquence continue d'expositions à différents moments d'exposition.
- Sélectionnez UV-Transillumination comme source d'éclairage.
- En utilisant l'image prévisualisée comme référence, ajuster la mise au point de l'objectif, le champ de vision, et le f-stop / ouverture dans la chambre du système de capture pour optimiser la qualité de l'image échantillonnée. Ajuster le temps d'exposition et la position de l'échantillon.
- Fermez la fenêtre de prévisualisation et assurez-vous que tous les paramètres de la fenêtre d'acquisition correspondent aux paramètres de la caméra et du filtre.
- Cliquez sur 'Expose' pour acquérir et enregistrer l'image.
- Le logiciel d'imagerie moléculaire standard fournit généralement une variété d'outils d'analyse, de mesure et de correction d'image pour quantifier les signaux de fluorescence pour l'analyse d'image.
- À la fin de la séance d'imagerie, retirez l'échantillon/animal, éteignez le système et nettoyez l'étape d'imagerie pour minimiser les dommages au système.
Résultats
Les images REFR in vivo et ex vivo prises à partir de rongeurs atteints d'anévrismes aortiques abdominaux (AAA) sont présentées dans les figures 1-2. Une sonde fluorescente activatable a été injectée systématiquement par l'intermédiaire de la veine de queue pour visualiser l'activité de la matrice metalloproteinase-2 (MMP2). MMP2 est une enzyme elastolytique impliquée dans la dégradation de la matrice extracellulaire qui joue un rôle majeur dans l'initiation et la progression de l'AAA. Toutes les images ont été acquises à l'aide d'un filtre d'excitation de 625 nm, d'un filtre d'émission de 700 nm et d'un temps d'exposition de 60 secondes.
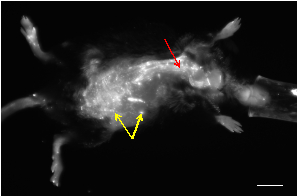
Figure 1: Image in vivo IN vivo de NIRF d'une souris e-déficiente d'apolipoprotein qui a développé un AAA suivant l'infusion de l'angiotensine-II. La plupart des petites taches montrant un signal élevé proviennent de l'autofluorescence de la peau (flèches jaunes). La vascularisation peut être visualisée sous forme de structures tubulaires avec des signaux de fluorescence élevés (flèche rouge). Barre à l'échelle: 1 cm.
La figure 2 montre une augmentation de l'activité MMP2 dans la région anévrismale de l'aorte abdominale, comme en témoigne l'augmentation observée de l'intensité du signal par rapport aux régions saines de l'aorte abdominale. Ce résultat est compatible avec des résultats dans la littérature qui montrent les niveaux élevés de MMP2 dans les AAA. Les sondes fluorescentes excédentaires ont été filtrées et accumulées dans les reins, ce qui a donné des signaux fluorescents lumineux.

Figure 2: Images NIRF de AAA de deux modèles animaux différents : (A) un AAA suprarénal en angiotensine II-infusé souris déficiente et (B) un AAA infraréréré dans le rat infusé avec l'élastase pancréatique porcine. Les flèches jaunes pointent vers les AAA. Barres d'échelle : 3 mm.
Applications et Résumé
L'imagerie NIRF s'appuie sur des sondes fluorescentes pour quantifier et visualiser les assemblages biomoléculaires dans les tissus. L'énergie du photon absorbée par la lumière proche infrarouge excite les molécules fluorescentes à un état d'énergie plus élevé, et la lumière émise avec une longueur d'onde plus caractéristique est capturée par un système d'imagerie par fluorescence. Ici, l'application de la formation image de NIRF pour étudier l'activité de MMP2 dans les anévrismes aortiques abdominaux a été démontrée in vivo et ex vivo. Contrairement à SPECT ou PET, qui sont considérés comme les normes d'or dans l'étude des processus métaboliques dans le corps non invasive, l'imagerie NIRF est une technique d'imagerie rapide et à haut débit qui n'implique pas de rayonnement ionisant. Une des limites de cette modalité est sa profondeur de pénétration relativement faible. Bien que cette limitation rende l'imagerie clinique des tissus profonds difficile, l'imagerie NIRF joue un rôle important en étudiant les tumeurs et les maladies cardiovasculaires chez les petits animaux.
Compte tenu de la sonde fluorescente appropriée, de nombreuses structures moléculaires peuvent être visualisées à l'aide des procédures d'imagerie NIRF présentées pour étudier à la fois l'initiation et la progression de la maladie chez les petits modèles animaux. Les applications ex vivo et in vivo spécifiques comprennent 1) l'évaluation de l'activité MMP dans la vascularisation des rongeurs, 2) la détection précoce des tumeurs dans différents types de cancers, et 3) l'évaluation de la pharmacocinétique des nanoparticules et de la biodistribution pour des applications thérapeutiques. En plus de l'activité accrue de MMP2 dans AAA, d'autres sondes fluorescentes de MMP ont été employées pour étudier la progression d'athérosclérose et pour caractériser la composition extracellulaire cardiaque de matrice suivant un infarctus myocarde. En outre, le vert d'indocyanine de fluorophore a été employé pour étudier la perfusion de tissu dans des modèles murins de l'ischémie postérieure. Pour en savoir plus sur l'application de l'imagerie NIRF sur la détection précoce du cancer, les colorants NIRF ciblant les tumeurs peuvent être utilisés pour évaluer les marges tumorales et aider aux procédures de résection. L'intégration des fluorophores dans les nanoparticules développées pour l'administration de médicaments permet aux scientifiques de développer des thérapies plus efficaces à base de nanoparticules pour une variété de maladies. Enfin, la capacité de localiser spatialement le signal fluorescent chez des animaux entiers ou des tissus intacts est un net avantage par rapport à d'autres essais enzymatiques conventionnels (zymographie de gel) et l'analyse des protéines (tache occidentale) qui exige que les animaux soient sacrifiés et que les tissus soient homogénéisés.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Imagerie des anévrismes de l'aorte abdominale par fluorescence dans le proche infrarouge
Biomedical Engineering
8.4K Vues

Imagerie d'échantillons biologiques par microscopie optique et confocale
Biomedical Engineering
36.3K Vues

Imagerie d'échantillons biologiques par MEB
Biomedical Engineering
24.1K Vues

Biodistribution des nanomédicaments : Application de la microscopie à balayage électronique
Biomedical Engineering
9.6K Vues

Imagerie par ultrasons à haute fréquence de l'aorte abdominale
Biomedical Engineering
14.8K Vues

Cartographie quantitative de la déformation d'un anévrisme de l'aorte abdominale
Biomedical Engineering
4.6K Vues

Tomographie photoacoustique pour l'imagerie du sang et des lipides dans l'aorte infrarénale
Biomedical Engineering
5.9K Vues

Imagerie par résonance magnétique cardiaque
Biomedical Engineering
15.0K Vues

Simulations numériques de la dynamique des fluides du flux sanguin lors d'un anévrisme cérébral
Biomedical Engineering
11.9K Vues

Techniques de mesure non invasive de la pression artérielle
Biomedical Engineering
12.1K Vues

Acquisition et analyse d'un signal ECG (électrocardiographie)
Biomedical Engineering
107.0K Vues

Résistance à la traction des biomatériaux résorbables
Biomedical Engineering
7.7K Vues

Imagerie Micro-CT de la moelle épinière d'une souris
Biomedical Engineering
8.3K Vues

Visualisation de la dégénérescence de l'articulation du genou après une blessure non invasive du LCA chez le rat
Biomedical Engineering
8.3K Vues

Imagerie combinée SPECT et CT pour visualiser la fonctionnalité cardiaque
Biomedical Engineering
11.2K Vues