Imagerie Micro-CT de la moelle épinière d'une souris
Vue d'ensemble
Source : Peiman Shahbeigi-Roodposhti et Sina Shahbazmohamadi, Département de génie biomédical, Université du Connecticut, Storrs, Connecticut
C'est un fait peu connu que la découverte et (par inadvertance) l'utilisation des rayons X a recueilli le premier prix Nobel de physique. La célèbre image aux rayons X de la main de la femme du Dr Ràntgen de 1895 qui a envoyé des ondes de choc à travers la communauté scientifique ressemble à la plupart des images 2D 2D de radiographie médicale moderne. Bien qu'il ne s'agit pas de la technologie la plus récente, l'imagerie par absorption des rayons X est un outil indispensable et se trouve dans les meilleurs laboratoires de R-D et d'université au monde, dans les hôpitaux, les aéroports, entre autres. On peut soutenir que les utilisations les plus avancées de l'imagerie par absorption des rayons X impliquent d'obtenir des informations comme celles trouvées dans une radiographie médicale 2D, mais réalisées en 3D grâce à une tomographie calculée (CT ou micro-CT). En prenant une série de projections de rayons X 2D, un logiciel avancé est capable de reconstruire des données pour former un volume 3D. Les informations 3D peuvent, et très probablement comprendra des informations de l'intérieur de l'objet sondé sans avoir à être coupé ouvert. Ici, une micro-CT scan sera obtenue, et les principaux facteurs ayant une incidence sur la qualité de l'image seront discutés.
Principles
Les rayons X peuvent être considérés comme des photons avec une plage d'énergie de 0,1 à 100 keV ou des ondes électromagnétiques avec des longueurs d'onde allant de 0,01 à 10 nm. Les rayons X peuvent être créés de plusieurs façons différentes, mais ici la discussion est limitée à l'imagerie continue de rayons X à faisceau de cônes. Ces rayons X sont créés par un phénomène connu sous le nom de "Bremsstrahlung", qui signifie "rayonnement de freinage" en allemand. Cela se produit lorsqu'une particule chargée subit une accélération [1]. Dans une source de rayons X, un électron chargé négativement est abattu dans un tube à vide et affecte un matériau cible (généralement tungstène, molybdène, cuivre ou autre métal) et, par sa décélération, émet des photons à l'échelle d'une radiographie. Un spectre continu de rayons X est généré parce que la décélération n'est ni uniforme ni instantanée, bien qu'il y ait des pointes dans la distribution centrées autour des énergies caractéristiques du matériau cible comme on le voit dans [2]. Il existe différentes courbes pour différentes énergies et matériaux cibles. Il s'agit d'une chose très importante à considérer lors de l'exécution d'un micro-CT scan et sera discuté dans une section ultérieure.
Un système de micro-CT typique comporte trois composants primaires, comme indiqué dans [3]. Les composants de base de ce système comprennent : a) source de rayons X, b) stade de rotation pour le montage de l'échantillon, et c) panneau plat ou objectif optique avec des détecteurs CCD. Les rayons X quittent la source et sont absorbés, transmis ou dispersés par l'échantillon avant d'arriver au détecteur. L'absorption est l'interaction prédominante mesurée en microCT, car différents matériaux dans le corps absorbent les rayons X différemment. Par exemple, les os contiennent beaucoup de calcium atomique, qui absorbe bien les rayons X. Ainsi, les os bloquent les rayons X d'atteindre le détecteur, et finissent par apparaître dans l'image comme une ombre. L'échantillon est ensuite tourné progressivement et le processus est répété jusqu'à ce que l'échantillon ait été photographié à 360 degrés ou, dans certains cas, à 180 degrés. La sortie de la tomographie est une série de projections 2D à différentes orientations qui peuvent être reconstruites en un volume 3D.
Micro-CT est une forme de microscopie, gagnant son nom de sa capacité à résoudre les fonctionnalités micro-échelle. La limitation de la résolution pour cette catégorie spécifique de micro-CT est régie par la taille de la tache source et la propagation de l'énergie, ainsi que par le type et l'efficacité du détecteur; pas par la longueur d'onde de la radiographie. La meilleure résolution possible pour cette catégorie de micro-CT est d'environ 500-700 nm en trois dimensions. Bien que, il est possible de détecter des caractéristiques d'un dixième ou centième de cette taille.
Le grossissement est effectué dans la plupart des systèmes de ToIAu moyen de grossissement géométrique. L'image dans [3] illustre l'idée de grossissement géométrique. Il est facilement imaginé comme un effet d'ombre. Plus une source lumineuse est proche d'un objet; plus l'ombre de l'objet s'affiche sur un mur ou un écran. De même, si ce mur ou cet écran devait s'éloigner de la source de lumière fixe et de l'échantillon, l'ombre de l'objet augmenterait en taille mais s'évanouirait. Optimiser la source de rayons X et les distances de travail du détecteur est une tâche très difficile et stimulante mentalement lorsque le signal suffisant, la haute résolution, et un temps d'analyse court sont souhaités. Comme pour tout, il y a des limites au grossissement géométrique, où l'idéalisation d'une source ponctuelle est détruite et les aberrations deviennent autoritaires.
L'un des nombreux défis en micro-CT est que la qualité visuelle du volume 3D sera quelque peu inconnue de l'enquêteur jusqu'à ce que l'analyse soit terminée et reconstruite. Bien que, avec assez d'expérience, un examen attentif de quelques projections 2D peut fournir suffisamment d'informations pour se sentir confiant au sujet d'une tomodensitome. Dans les sections suivantes, un ensemble d'exercices permettra de découvrir les effets de différents paramètres d'imagerie sur un ensemble de données et d'équiper un scientifique avec la compréhension nécessaire pour obtenir un volume 3D propre. Aux fins de la présente enquête, les échantillons biologiques seront sondés, bien que la procédure ne se limite pas à un type d'échantillon.
Montage d'un échantillon sonne comme une étape triviale, mais il est l'un des plus importants et négligés. Indépendamment de l'application, l'échantillon doit être monté de la manière la plus compacte possible. Compte tenu de l'image dans [3], imaginez si la gamme de positions de source et de détecteur était limitée parce que l'échantillon s'est coincé dans une direction et comment cela affecterait le grossissement géométrique. En plus de la distance de travail, le montage affecte considérablement le débit. Si l'échantillon était une articulation intacte du genou d'un rat, il serait logique de monter l'échantillon de sorte que le tibia et le fémur se tenaient debout. De cette façon, les rayons X passeraient à travers une courte distance et il y aurait suffisamment de signal au détecteur. La dernière chose à considérer lors du montage d'un échantillon est la stabilité. Le plus grand ennemi du micro-CT est le mouvement. Si l'ampleur du mouvement de l'échantillon s'approche de la résolution de l'analyse, il s'agira probablement de données inutiles. Le mouvement doit être limité par une adhérence sécurisée à une monture et avec un contrôle pour l'échantillonnage du changement de composition. Pour les échantillons biologiques, cela signifie s'assurer qu'il ne changera pas la morphologie par évaporation sur toute la longueur de l'analyse. Suspension dans le gel d'agarose ou d'emballage dans une fine couche de film de paraffine sont deux approches possibles pour éviter la déshydratation et le mouvement.
L'énergie des rayons X aura également un grand effet sur la qualité du volume 3D final. L'objectif est d'acquérir un signal suffisant au détecteur tout en ayant une atténuation suffisante de l'échantillon. L'atténuation des rayons X suit L'équation (1), où je suis le nombre final de comptes (intensité), I0 est le nombre initial de comptes, est le coefficient d'absorption de masse qui est unique à un matériau donné et l'énergie des rayons X (largement publié), est la densité du matériau, et x est la longueur du chemin de rayons X.
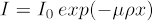 (1)
(1)
Idéalement, I/I0 (a.k.a. valeur de transmission) devrait être entre 5 - 95% pour toute l'orientation de l'échantillon, avec les meilleurs résultats à venir autour de la gamme moyenne. Pour vérifier cette valeur, prenez une image de l'échantillon, puis divisez les valeurs pixel de l'image par une image de l'air (c.-à-d. avec l'échantillon en dehors du champ de vision). Cette normalisation se trouve généralement dans les flux de travail des logiciels système. Ce n'est pas souvent que les échantillons biologiques exigent l'utilisation du filtrage des rayons X à la source, de sorte que ne sera pas couvert ici. En plus d'avoir une valeur de transmission idéale, le nombre idéal de dénombrements pour n'importe quelle partie de l'échantillon est de 5000 comptes. Pour garantir cela, le temps d'exposition par projection peut devoir être augmenté. Cela augmentera le temps d'analyse global. La figure 1 affiche des projections 2D propres.
Figure 1 : Images 2D de la moelle épinière de la souris normalisées contre l'air à 0 degrés (à gauche) et à 90 degrés (à droite).
Procédure
1. Montage d'un échantillon (Os)
- Pour examiner un réseau d'os, comme une colonne vertébrale, suspendez la structure dans un gel d'agarose et laissez guérir dans un tube en plastique à parois très minces (figure 2). La minceur du tube est très importante, affectant considérablement le débit du signal et la qualité globale de l'image. Cela affecte à son tour votre capacité à résoudre les fonctionnalités. La valeur de transmission du tube doit être aussi proche de 100% que possible.
- Montez le tube sur l'étage de l'échantillon avec du ruban adhésif ou en faisant un stand personnalisé, en fin de compte en s'assurant que l'échantillon est stationnaire et stable lorsque la scène tourne.

Figure 2 : Épine de souris suspendue dans le gel d'agarose à l'intérieur du tube en plastique à parois minces assis sur l'étape de l'échantillon du système de micro-CT.
2. Acquisition d'images
- Activez la source de rayons X à une énergie autour de la plage de 90 keV (90 kV et 10 W).
- Une fois que la source se réchauffe et s'installe sur l'énergie, acquérir une image à travers le logiciel du système.
- Vérifiez la valeur de transmission en normalisant l'image par rapport à une image d'air. Pour l'acquisition et l'application automatiques de référence, assurez-vous que l'échantillon peut se déplacer dans une direction donnée sans s'écraser.
- Si l'image a une transmission trop élevée, abaissez l'énergie progressivement jusqu'à ce que la valeur de transmission soit suffisante. Assurez-vous d'augmenter le temps d'exposition en conséquence afin que l'image ne semble pas bruyante et granuleuse. Si l'image a une transmission trop faible, augmentez l'énergie progressivement jusqu'à ce que la valeur de transmission soit suffisante.
- Commencez à déplacer la source de rayons X plus près de l'échantillon, tout en faisant très attention de ne pas les écraser. Rapprocher le plus possible de la source de l'échantillon est un pas dans la direction de maximiser le débit et d'obtenir la meilleure résolution possible.
- Dans ce cas, affiner le champ de vision de l'échantillon en déplaçant l'étape de l'échantillon avec ses actionneurs linéaires.
- Le logiciel affichera un paramètre connu sous le nom de taille de pixel qui est traité semblable à la résolution actuelle (bien qu'il soit en effet différent).
- Si le nombre est encore trop grand et que la source est très proche, le détecteur peut commencer à s'éloigner de l'échantillon.
- Si le nombre est trop petit, déplacez prudemment le détecteur plus près de l'échantillon.
- Essayez différents objectifs optiques et positions de détecteur ainsi, mais méfiez-vous de la complication que cela introduit lorsque vous essayez d'optimiser les paramètres d'analyse.
- Vérifiez toutes les orientations de l'échantillon pour vous assurer qu'il n'y a pas d'accidents pour trouver le meilleur temps d'exposition. Ceci est effectué en raison du changement de distance de travail, de la taille des pixels et de la position de l'échantillon.
- Faites pivoter lentement l'échantillon par incréments de 2 degrés tout en surveillant sa position par rapport à la source et au détecteur par l'intermédiaire de la caméra interne. Assurez-vous de déplacer la source et le détecteur en cas de collision.
- Trouvez la plus longue longueur de chemin de rayons X qui donne le plus faible nombre de nombres/valeurs de transmission et trouvez le temps d'exposition nécessaire pour sécuriser environ 5 000 comptes partout.
3. Soumission et reconstruction de tomographie
Le processus de reconstruction du point de vue de l'utilisateur n'est pas plus compliqué que n'importe laquelle des autres sélections de paramètres effectuées dans les étapes précédentes. Cependant, les frais de programmation et de calcul pour ce processus sont en fait assez importants. Les utilisateurs doivent viser à mieux comprendre ce qui se passe sous l'interface utilisateur logicielle lisse et comment les décisions ont un impact sur le produit final. De nombreux systèmes CT utilisent des algorithmes itératifs de reconstruction algébrique dans lesquels les projections 2D sont converties en une série d'équations linéaires décrivant les valeurs des pixels. D'autres systèmes utilisent des algorithmes de projection en arrière filtrés où Radon transforme les projections en sinogramme et sont ensuite passés par une série d'opérations d'intégration de ligne. Bien sûr, certains utilisent d'autres approches et même des méthodes hybrides. Au niveau le plus bas de participation à ces algorithmes, on sait que le nombre de projections et le déplacement total de rotation ont un impact sur le volume reconstruit final.
- Tout d'abord, décider s'il faut scanner plus de 180 ou 360 degrés en fonction du rapport d'aspect de l'échantillon. Si l'échantillon a un rapport d'aspect élevé de telle sorte que la longueur du chemin des rayons X est environ 4 fois ou plus plus longue à l'orientation à 90 degrés que l'orientation de 0 degrés qu'un balayage de 180 degrés serait un choix judicieux. (L'argument étant que l'information recueillie sur la courte longueur de chemin de rayons X n'est pas si différente d'un côté à l'autre. Si plus de projections peuvent être consacrées aux longues orientations de longueur de chemin de rayon X que l'ensemble de données bénéficiera. Le déplacement angulaire entre les projections sera plus faible et il y aura plus d'informations à partir de ces orientations délicates étant alimentés dans les algorithmes de reconstruction.) Si le rapport d'aspect n'est pas si élevé, utilisez des scans à 360 degrés.
- Ensuite, choisissez le nombre de projections et le déplacement angulaire total, qui dictera l'angle entre les projections. Plus cet angle est petit, moins l'interpolation sera effectuée et moins les informations sur les fonctionnalités seront tronquées. (Un équilibre doit être établi parce que plus de projections signifient un temps de balayage plus long, qui se corrèle à une fenêtre plus grande où les échantillons peuvent se déplacer, moins de temps pour scanner d'autres choses, et une durée de vie plus courte source. Une règle de base est d'avoir au moins 800 projections sur 360 degrés et de ne pas dépasser 3200 projections.
- Soumettez l'analyse.
- Après la totomographie terminée (généralement entre 4 - 16 heures), apporter la série 2D d'images dans le système (ou un certain open source) logiciel de reconstruction.
- Sélectionnez la correction optimale de décalage central. Le décalage de centre est un paramètre qui aligne les projets pour s'aligner (pensez à un jeu de cartes grossièrement mélangé qui doivent être collectés et alignés pour s'asseoir comme une pile soignée). Cette valeur se situe généralement entre -10 et 10 pixels.
- Sélectionnez le coefficient optimal de correction de durcissement du faisceau. La correction de durcissement des faisceaux est une suppression artificielle du contraste produit par le filtrage de l'échantillon. Si un échantillon est assez épais ou contient une gamme de matériaux légers et lourds, il aura un faux contraste basé sur l'atténuation des rayons X de faible énergie (soft). Cela devrait être appliqué de façon conservatrice. Une valeur moyenne se situe entre 0 et 0,5.
- Soumettre la reconstruction.
Résultats
Les images suivantes donnent un aperçu des résultats qui peuvent être obtenus à partir de l'utilisation de micro-CT avec la procédure indiquée ci-dessus. Des mesures qualitatives sur l'absorption variable peuvent être directement notées sur la base de ces images. Les données quantitatives telles que la porosité matérielle, la taille et la distribution des fonctionnalités, etc. nécessiteraient un traitement d'image supplémentaire dans un logiciel différent.
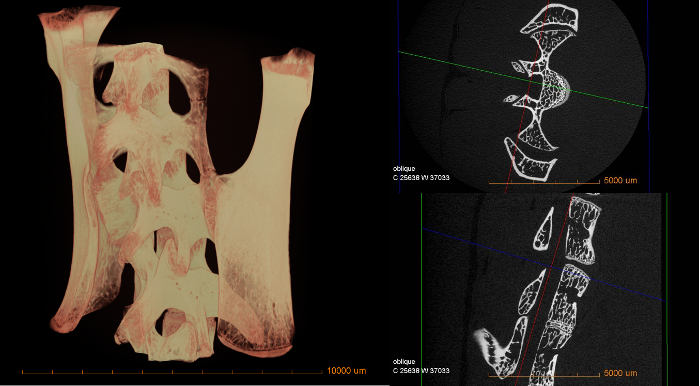
Figure 3 : Volume 3D de la moelle épinière de la souris (à gauche) et de deux tranches transversales numériques (à droite)
Applications et Résumé
Cette expérience a examiné les nombreux facteurs qui devraient être pris en considération lors de l'utilisation de micro-CT, en particulier pour un échantillon biologique. Ce projet a été conçu pour aider l'enquêteur à comprendre comment ses décisions auront une incidence sur les données que le micro-CT peut fournir. Comme nous l'avons démontré, il existe de nombreux paramètres dépendants et sensibles qui devraient être pris en considération, notamment : montage, énergie des rayons X, temps d'exposition, positionnement de la source et du détecteur, nombre de projections et déplacement angulaire total. Cet exercice se veut une introduction et ne fait qu'effleurer la surface de contrôle d'un ensemble de données CT.
Cette expérience s'est concentrée sur l'introduction au micro-CT en ce qui concerne l'imagerie d'un échantillon biologique, mais l'application de la tomographie aux rayons X 3D s'étend aux mondes de la microélectronique, de la géologie, de la fabrication additive, des revêtements, des piles à combustible, et bien plus encore. . Ces microscopes sont utilisés pour l'inspection, l'analyse des défaillances, la caractérisation, le contrôle de la qualité et même les essais non destructifs. Étant donné que les informations 3D réelles sont désormais accessibles de manière non destructive, les géométries extraites de CT peuvent être importées à des simulations où les objets peuvent être testés virtuellement.
References
- http://www.spectroscopyonline.com/tutorial-attenuation-X-rays-matter [cited 1 November 2017]
- http://hyperphysics.phy-astr.gsu.edu/hbase/quantum/xrayc.html [cited 1 November 2017]
- A.G. Rao, V.P. Deshmukh, L. L. Lavery, H. Bale, "3D investigation of the microstructural modification in hypereutetic aluminum silicon (Al-30Si) alloy." Microscopy and Analysis 2017 [cited 1 November 2017].
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Imagerie Micro-CT de la moelle épinière d'une souris
Biomedical Engineering
8.3K Vues

Imagerie d'échantillons biologiques par microscopie optique et confocale
Biomedical Engineering
36.2K Vues

Imagerie d'échantillons biologiques par MEB
Biomedical Engineering
24.0K Vues

Biodistribution des nanomédicaments : Application de la microscopie à balayage électronique
Biomedical Engineering
9.5K Vues

Imagerie par ultrasons à haute fréquence de l'aorte abdominale
Biomedical Engineering
14.8K Vues

Cartographie quantitative de la déformation d'un anévrisme de l'aorte abdominale
Biomedical Engineering
4.6K Vues

Tomographie photoacoustique pour l'imagerie du sang et des lipides dans l'aorte infrarénale
Biomedical Engineering
5.9K Vues

Imagerie par résonance magnétique cardiaque
Biomedical Engineering
15.0K Vues

Simulations numériques de la dynamique des fluides du flux sanguin lors d'un anévrisme cérébral
Biomedical Engineering
11.9K Vues

Imagerie des anévrismes de l'aorte abdominale par fluorescence dans le proche infrarouge
Biomedical Engineering
8.4K Vues

Techniques de mesure non invasive de la pression artérielle
Biomedical Engineering
12.1K Vues

Acquisition et analyse d'un signal ECG (électrocardiographie)
Biomedical Engineering
106.7K Vues

Résistance à la traction des biomatériaux résorbables
Biomedical Engineering
7.7K Vues

Visualisation de la dégénérescence de l'articulation du genou après une blessure non invasive du LCA chez le rat
Biomedical Engineering
8.3K Vues

Imagerie combinée SPECT et CT pour visualiser la fonctionnalité cardiaque
Biomedical Engineering
11.2K Vues