Autopsie et prélèvement des tissus
source : Kay Stewart, RVT, RLATG, CMAR ; Valerie A. Schroeder, RVT, RLATG. Université de Notre Dame, IN
nombreuses expérimentations animales dépendent de données finales collection moments qui sont recueillies à partir de la récolte et les essais d’organes et de tissus. L’utilisation de méthodes appropriées pour la collecte d’organes et de tissus peut influer sur la qualité des échantillons et l’analyse des données qui sont acquise pour les essais des tissus. La méthode d’euthanasie de l’animal peut également concerner la qualité des échantillons. Ce manuscrit donnera un aperçu de techniques d’autopsie appropriée pour les rats.
la méthode d’euthanasie plus couramment utilisés pour les souris et les rats est une surdose de dioxyde de carbone (CO 2). Selon l’American Veterinary Medical Association (AVMA), l’utilisation de CO 2 est acceptable avec des conditions qui réduisent au minimum l’aversion et la détresse. 1 les animaux restent dans leur cage maison, qui est placé dans une chambre. CO 2 est progressivement introduit dans la chambre à une vitesse de déplacement de 10 % à 30 % du volume chambre/min, ce qui provoque les animaux perdu conscience avant la perception de la douleur associée à activation des nocicepteurs par l’acide carbonique. Le flux est ensuite maintenu dans la chambre une fois un arrêt respiratoire a eu lieu pour s’assurer que l’animal est mort. Une surdose d’un inhalant anesthésie est également acceptable, en particulier pour les projets qui nécessitent l’utilisation du tissu pulmonaire, comme le CO 2 endommage le tissu pulmonaire. Exsanguination de l’animal peut également être nécessaire pour certaines expériences afin de réduire le volume de sang dans les tissus.
un enregistrement précis de toutes les conclusions est essentiel pendant une autopsie. Un formulaire doit être instauré qui enregistre un historique complet de l’animal, y compris l’identification des animaux, sexe, conditions de logement, date de naissance, date de décès, numéro de numéro/protocole d’étude et le nom de l’enquêteur de principe. Un examen interne brut est effectué comme les cavités du corps sont exposées pour révéler les organes internes. A noter une anomalie évidente. 2
autopsie et tissus de récolte doit être lancé immédiatement après l’euthanasie de l’animal, comme une fuite bactérienne du tractus intestinal peut confondre certains tests. Les organes internes doivent être observées à partir de la cavité abdominale et de passer à la cavité thoracique. Avant d’enlever les échantillons de tissus, il est important d’observer les organes in situ. 2 récolte organes et de tissus pour examen histologique exigent que les tissus sont bien préparés. Des échantillons de tissus pour histologie doivent être de 0,5 à 1 cm d’épaisseur pour permettre une pénétration suffisante de la solution de fixation. Fixation préserve les tissus biologiques, prévenir la carie, autolyse et putréfaction. Aussi, il s’arrête de réactions biochimiques en cours et peut-être augmenter la résistance mécanique ou la stabilité des tissus traités. L’objectif général de la fixation du tissu est de préserver les cellules et tissus des composants pour permettre la préparation des fines, coupes colorées. Sauf indication contraire, le fixateur le plus couramment utilisé est de 10 % de formol tamponné neutre. Prêt-à-utiliser 10 % formol tamponné neutre est commercialisé auprès des principaux fournisseurs. 3
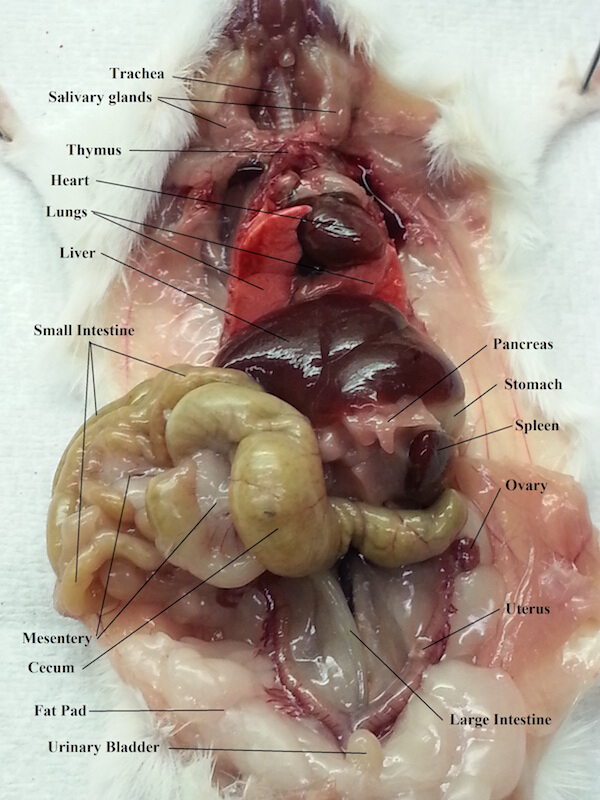
figure 1. Organes abdominaux et thoraciques d’un rat femelle.
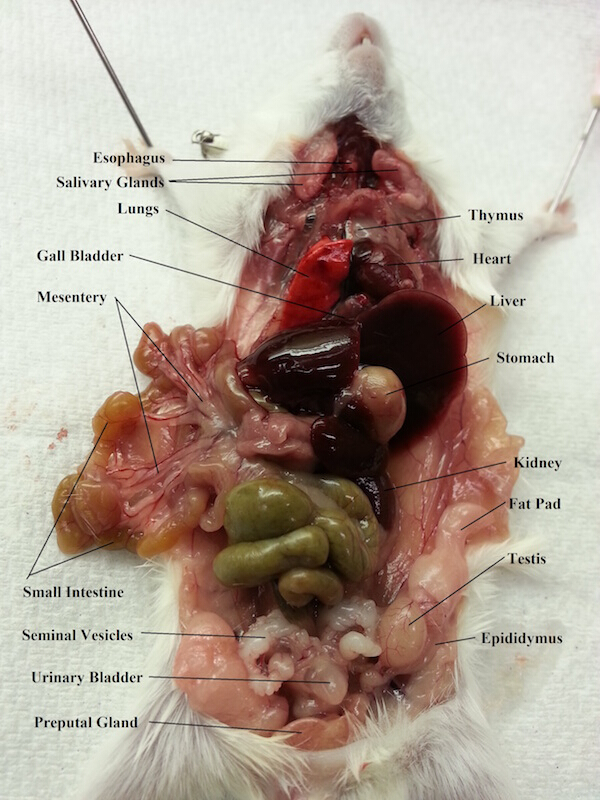
figure 2. Organes abdominaux et thoraciques d’un rat mâle.
1. examen extérieur
un brut examen externe du corps, qui comprend une inspection visuelle de l’organe de lésions et de masses, doit être exécuté dans l’étape initiale à une autopsie. Le pelage doit être examiné pour les zones de perte de cheveux. Les dents et les ongles sont évalués pour une croissance excessive ou d’usure. Convient de noter une coloration de la fourrure dans le bouche, les narines, les yeux, anal et ouvertures génitales. Tests de bande, grattage de la peau et fourrure examens devraient être effectuées pour détecter les parasites externes (voir procédure ci-dessous).
- Essai au ruban adhésif
- équipement requis pour un test de bande comprend les gants, une bande de ruban de cellophane clair, une lame de microscope de verre et ciseaux.
- Sont toujours porter des gants lors de manipulation de la bande, comme la colle soulèvera les huiles et les doigts, les cellules de la peau obscurcissant les conclusions ou créer une confusion lors de l’évaluation de la diapositive.
- Couper un morceau de ruban qui est légèrement plus étroite que la largeur et plus courte que la longueur de la lame de microscope.
- Enfoncez doucement le côté collant de la bande à l’anus et la région environnante et de supprimer rapidement les it.
- À l’aide de l’extrémité opposée de la cassette, appuyez dessus entre les omoplates et supprimer rapidement les it.
- Appliquer le ruban sur la lame de microscope.
- Le test de la bande est prêt pour l’examen microscopique. Œufs de parasites sont visibles à un grossissement de 4 X mais devraient ensuite être examinées à un grossissement de 10 X pour identifier correctement l’espèce.
- Il est important de ne pas toucher le côté adhésif du ruban. La bande va soulever les débris des mains gantées et rendre la lecture de la diapositive difficile.
- Raclage de la peau
- l’essai de raclage de la peau est effectué sur des zones d’alopécie, lésions cutanées ou excoriation.
- L’équipement requis pour le raclage de la peau est une lame de microscope de verre propre, huile minérale et d’une lame de métal spatule ou scalpel.
- Verser quelques gouttes d’huile minérale sur la lame de microscope.
- Pincer la peau dans un pli sur le bord de la lésion ou domaine d’intérêt.
- Placer une petite quantité d’huile minérale sur la peau.
- Placer le bord de la lame de la spatule ou le scalpel sur la peau et frottent contre la direction de la croissance des cheveux.
- Continuer à gratter jusqu'à ce qu’un peu de rougeur est visible sur la peau.
- Placer les cheveux et le tissu gratté de la surface de la peau dans l’huile sur la lame de microscope. Le cas échéant, diffuser le matériel afin qu’il soit distribué uniformément dans l’huile.
- La diapositive est maintenant prête à être examiné au microscope. Si vous le souhaitez, un lamelle couvre-objet peut être appliqué à la goutte d’huile sur la lame. Examiner la lame à 4 X et un grossissement de 10 X.
- Examen pelt
- l’examen de la peau est le dernier examen externe effectué ; cependant, il est fait après l’examen interne est terminé.
- L’animal est placé dans un verre ou de plastique Pétri après que tous les échantillons d’organes internes ont été collectés.
- Le plat est placé dans un réfrigérateur pendant 15 minutes.
- Après 15 minutes, le plat est placé sous un microscope à dissection et la peau est examinée pour les parasites externes. La plupart des acariens fourrure se déplacera vers les extrémités des poils et on observe facilement.
2. Examen brut intérieur de la cavité abdominale
- exciser la peau
- une petite incision est faite juste en avant du bassin chez les femelles et surtout le prépuce chez les hommes.
- La coupe de la peau s’étend à la Chin.
- Par dissection par clivage est utilisé pour détacher la peau de l’aponévrose et le muscle.
- Coupes transversales sont faites avant les membres postérieurs et postérieur aux membres avant. Il faut ne pas de rompre les vaisseaux sanguins dans la région axillaire.
- Utilisation dissection par clivage pour exposer la zone cervicale et thoracique. Redoublez de prudence devrait être exercé pour eviter une rupture de la jugulaire et carotide vaisseaux du cou.
- Glandes mammaires
- chez les femelles, examiner le tissu mammaire à chercher des masses, décoloration ou anomalies.
- Les femelles allaitantes ou enceintes passera volume de tissu mammaire, et lait peut-être être présent.
- Tissu mammaire se trouve de la partie supérieure du sternum à la manubrium à l’ouverture génitale sur la face ventrale et s’étend latéralement sur les deux côtés presque toucher sur la surface dorsale sur les hanches et les épaules.
- L’excision des glandes mammaires nécessite agrippant le bord de la glande avec une pince pouce et par dissection pour desserrer des pièces jointes à la peau. Une fois que la glande a été séparée de la peau, ciseaux iris peut être utilisé pour couper toutes les pièces jointes restantes avant de mettre le gland dans une solution de fixation.
- Glandes sous-cutanées
- glandes préputiales sont jumelés et situés juste en avant du prépuce chez le rat mâle. Elles apparaissent en grands et sont d’un gris de couleur jaunâtre avec un aspect spumeux. Glandes salivaires
- Submandibular sont jumelés, situé à la mandibule et s’étendent le long de l’encolure au sternum manubrium. Ils ont un revêtement dur et sont fermement adhérés aux muscles.
- Retrait de ces glandes nécessite une dissection émoussée et Redoublez de prudence lorsque vous travaillez dans la région cervicale pour éviter une rupture des vaisseaux sanguins. Par dissection par clivage est une technique de dissection anatomique dans les tissus sont séparés et les structures sous-jacentes exposés sans couper.
- Pour une dissection émoussée, les ciseaux sont utilisés pour répandre les tissus apart, plutôt que de les couper dehors. Les embouts fermés sont poussés dans les tissus et ensuite ouvert pour fractionner le tissu le long des plans naturels. Ce processus nécessite patience et une touche délicate, comme l’étirement du tissu peut causer des dommages aux organes adjacents et les vaisseaux sanguins.
- Les glandes, une fois libérés des muscles sous-jacents, sont levées et les pièces jointes résiduels sont rompus.
- Les glandes exigent au moins une coupe pour permettre la pénétration de la fixateur.
- Graisse sous-cutanée est évaluée pour la quantité et de dépôts. Un animal obèse peut avoir une grande quantité de graisse avec la peau épaissie. Les animaux qui sont déshydratés aura réduit l’élasticité de la peau, et il se sentira plus mince.
- Muscle
- observer les muscles abdominaux, intercostaux et exposés du cou et des membres. Notez tout épaississement anormal, masses ou décoloration.
- Si le muscle est nécessaire pour l’analyse, sélectionner et couper l’échantillon avant de prendre les organes abdominaux pour réduire la contamination sanguine.
- Ouverture de la cavité du corps
- une petite coupe transversale en fait la plus caudale point du muscle abdominal exposé.
- Lifting du muscle loin des organes, découper le long de la linea alba à la xiphoïde.
- Couper les muscles abdominaux de la ligne médiane latéralement, juste au-dessus des membres postérieurs sur les deux côtés.
- Couper le muscle abdominal le long de la courbe des côtes des deux côtés.
- Graisse abdominale
- évaluer la quantité et l’accumulation de graisse corporelle. Un animal sain aura coussinets adipeux abdominales et certaines matières grasses le long de la surface dorsale de la cavité abdominale. Un animal trop mince, ou un très jeune animal, n’aura pas une quantité appréciable de graisse qui entoure les reins.
- Observer la couleur de la graisse corporelle et noter toutes les anomalies.
3. Organes abdominaux
- foie
- normalement, la couleur du foie doit être un rouge foncé. Les marges doivent être lisse et ont un bord croquant. Un foie anormaux auront une bordure épaisse et peut avoir des encoches ou bords festonnés.
- Il faut lors de manipulation du foie, telle qu’elle est un tissu mou. Toute perturbation de l’intégrité de l’orgue se traduira dans le sang une fuite dans la cavité du corps et de masquer les organes.
- Doucement reflètent le foie loin du diaphragme et faire une coupe à travers les vaisseaux sanguins antérieur du foie.
- Reflètent le foie vers le diaphragme et saisir le nœud fibreux qui relie tous les lobes du foie au centre. Soulevez le foie tout en coupant toutes les pièces jointes à l’intestin et l’estomac.
- Enlever le foie en une seule pièce et tache de sang excédentaire de la surface de l’organe. Il peut être placé dans un bain de solution saline, ou rincé dans une solution saline stérile, avant le découpage en sections plus minces pour permettre la pénétration des solutions fixateur.
- Vésicule biliaire
- la vésicule biliaire est un petit sac transparent qui apparaît souvent en jaune due à l’accumulation de bile. Il est présent chez la souris, mais pas chez les rats.
- De la vésicule biliaire est située entre les lobes plus haut de la page du foie le long de la ligne médiane. Il est généralement relié à la membrane par un frein mince qui peut accidentellement être déchiré, causant de la vésicule biliaire à se rompre.
- La vésicule biliaire peut être enlevée avec le foie et séparée par la suite à l’examen.
- Rate
- la rate est rouge foncé et situé le long de la courbure inférieure de l’estomac. Il doit être régulier dans la forme, avec une surface légèrement mate.
- Il est généralement plus grande chez les mâles que les femelles. Animaux avec les parasitoses internes, les infections bactériennes ou maladies du sang peut-être ont agrandi spleens.
- Comme les filtres rate endommagé des globules rouges de la circulation, il est rempli de sang. Lors du retrait de la rate, éviter toute perforation à l’orgue.
- Pour l’enlever, la rate est levée et les pièces jointes couper entre l’estomac et la rate.
- Tractus intestinal
- post mortem évolue rapidement et comprennent l’accumulation de sang dans les tissus, ce qui entraîne l’apparition d’ecchymoses et le gonflement des intestins avec gaz, souvent produites par la prolifération bactérienne. Le tractus intestinal est soigneusement inspecté après il a été éliminé de l’organisme.
- Estomac
- l’estomac se trouve à l’extrémité distale de le œsophage. Il semble être deux tons, différencier les parties musculaires et glandulaires.
- L’estomac doit être évaluée pour la présence de nourriture par la convivialité. Les rongeurs mangent généralement constamment en raison d’un métabolisme élevé. Un estomac vide est à noter qu’il peut être révélateur de la maladie.
- Ne pas couper l’estomac, comme le contenu finira par contaminer les organes de la cavité abdominale.
- Pour retirer le tractus intestinal, le œsophage de l’estomac est sectionné juste en avant de l’estomac. Si l’estomac doit être placé dans un conteneur commun de fixateur, un morceau de suture peut être attaché autour de le œsophage pour éviter toute fuite du contenu de l’estomac avant découpe.
- Intestin grêle
- l’intestin grêle est composé de trois parties : le duodénum, le jéjunum et l’iléon. Il ne contiendra pas de boulettes fécales.
- Le duodénum est une section plus courte du sphincter de l’estomac postérieure au début du jéjunum. Le canal cholédoque pénètre dans l’intestin grêle dans le duodénum et le tissu pancréatique est plus fermement attaché à cette partie de l’intestin grêle.
- Le jéjunum est la partie centrale de l’intestin grêle.
- Peyer ' s Patches-composée de tissu lymphoïde dans petit ovale patches-sont présents sur la surface nonmesenteric du jéjunum et iléon chez le rat. 3 Ceux-ci font partie du système immunitaire et peut être utiles dans le diagnostic des troubles du système immunitaire.
- L’iléon est la partie distale de l’intestin grêle et est la plus longue partie, se terminant à caecum.
- Caecum
- du caecum est une couleur verdâtre et très doux.
- Il est situé à la jonction du petit et du gros intestin.
- Fermentation se produit dans le caecum, donc la ponction de l’orgue se traduira par une odeur nauséabonde et la contamination des organes par des bactéries.
- Gros intestin
- le gros intestin commence au caecum et se poursuit à l’anus. Il est facilement identifiable, comme les boulettes fécales peuvent être visualisées dans la lumière de l’intestin.
- Il ne faut pas des zones d’hémorragie ou de décoloration immédiatement après euthanasie.
- Mésentère
- les petits et les grands intestins sont ancrés au corps par le mésentère, une membrane contenant les vaisseaux sanguins, matières grasses et les ganglions lymphatiques.
- Il convient de rechercher des ganglions lymphatiques et les masses avant d’ôter le tractus intestinal.
- Pancréas
- le pancréas est un organe diffus situé au-dessous de l’estomac et entre les premiers plis du duodénum. C’est un bronzage lumineux de couleur grise et composé de plusieurs petits lobes avec des bords irréguliers.
- Il n’est pas possible d’enlever le pancréas en un seul morceau.
- Si le tissu pancréatique doit être récolté, il doit être effectuée avant l’enlèvement du tractus intestinal.
- Tissu identifié comme pancréatique doit être soigneusement taquiné loin le tissu mésentérique entourant it.
- Enlever le tractus intestinal
- tractus intestinal est supprimé comme une seule pièce, commençant par l’estomac et s’étendant jusqu'à l’anus.
- Une coupe faite dans le gros intestin, juste en avant de l’anus. Le tractus intestinal entière peut être attaches de levé et tout membraneuses rompus. Le tractus intestinal peut alors être retiré le mésentère coupé en sections et fixe.
- Lorsque vous placez les sections de l’intestin dans les pots contenant les autres organes, il est impératif que les extrémités soit lié pour prévenir la contamination des tissus avec des bactéries intestinales. Tract
- la lumière de l’intestin peut être exposé en réduisant sa longueur à l’aide de ciseaux petit et pointu. L’intérieur peut être rincé après avoir exposé le lumen.
- Certaines études mAY exigent qu’une partie de l’intestin être enlevée et vidée plutôt que couper. En obtenant une aiguille émoussée à une extrémité du tissu excisé, une solution saline ou fixateur peut être forcée dans l’intestin pour vider le contenu.
- Rein
- les reins sont des organes pairs situés contre les muscles du dos. Le rein droit est plus élevé que la gauche. Les reins chez les animaux plus âgés peuvent être entourés par des dépôts de graisse, ce qui les rend difficiles à visualiser.
- C’est environ la taille et la couleur d’un haricot noir ainsi que sa surface doit être lisse.
- Immédiatement antérieur du rein est la glande surrénale, apparaissant comme un nodule de petit, rose clair.
- Pour enlever le rein, l’isoler à l’aide d’une pince et couper entre le rein et l’uretère.
- Les reins ont une capsule externe difficile qui peut être décollée de mieux visualiser les surfaces. Couper un rein en deux le long de l’axe le plus long et l’autre rein transversalement. Remarque tout grit dans le rein pourrait indiquer la présence de cristaux ou de dépôts minéraux.
- Système reproducteur femelle
- l’utérus est une structure en forme de Y. Le corps de l’utérus est court avec des cornes appariés à gauche et à droite. Les cornes se terminent aux trompes de Fallope et les ovaires. Chez une patiente non gravides, les cornes seront rose pâle et mince. Chez un animal enceinte, les cornes apparaîtront plus sombres et sont prononcées les vaisseaux sanguins en cours d’exécution adjacentes aux cornes utérines. À mesure que progresse de gestation, les cornes utérines aura un " collier de perles " apparence. Les embryons en développement créera une zone pâle dans la corne et qu’ils développent, l’utérus s’étire et le tissu va devenir plus mince, permettant la visualisation.
- Les ovaires sera situé juste en dessous des reins. Ils auront une surface rugueuse due à des stades différents de la maturation des follicules. Ovaires kystiques aura des vésicules remplies de liquide. Ce liquide peut varier de paille coloré aux sanguineous.
- Pour enlever les ovaires, coupés les pièces jointes artériels vers l’avant et la trompe de Fallope vers l’arrière. Si vous le souhaitez, les ovaires peuvent être souscrite attachés à l’utérus.
- D’enlever l’utérus, il doit être saisi délicatement et traction appliquée pour pouvoir couper au-dessous du col de l’utérus. Après la coupe, soulever le corps et les cornes de l’utérus, brisant toutes les pièces jointes dans la cavité coelomique.
- Système reproducteur masculin
- les vésicules séminales sont blanches, ram ' s en forme de corne, jumelé à des structures situées vers l’avant de la vessie et fixée sur la ligne médiane à la glande prostatique. La taille varie, mais ils peuvent être aussi grands que le caecum.
- La glande prostatique est située autour de la vessie à la base. Ce tissu est généralement un bronzage léger. Chez les animaux plus âgés, il peut présenter une hyperplasie. Les animaux plus âgés en général ont plus graisse corporelle qui peut compliquer la visualisation de la prostate.
- Testicules sont jumelés et situés dans le sac scrotal. La surface doit être lisse et fine vascularisation évidente sur la surface. Souris et les rats n’ont pas un anneau inguinal ou le sphincter, ce qui permet à l’animal de retirer les testicules dans la cavité abdominale. Pour visualiser ces, saisir les coussinets adipeux abdominales situés dans le bas ventre et les tirer vers l’avant. Cela va tirer les testicules du scrotum pour permettre l’examen. L’épididyme est le long de la marge inférieure du testicule et s’effile vers le haut. Le canal déférent est fixé à l’extrémité de l’épididyme et nous ramène à la prostate.
- Enlèvement des testicules peut être accompli en coupant l’attachement au scrotum et en sectionnant le canal déférent.
- Suppression de la prostate et les vésicules séminales nécessite un saisissant la base de la vessie et de levage, tout en coupant les pièces jointes sous la prostate.
4. Cavité thoracique
poumons- les poumons sont normalement une couleur rose vif et spongieux de texture avec une surface lisse. Cependant, l’euthanasie en CO 2 peut causer des hémorragies pulmonaires, résultant en des taches rouges foncés qui peuvent couvrir la surface du poumon entier.
- Heart
- coeur est rouge foncé avec quatre chambres. Les ventricules sont musclés et fermes au toucher. Les oreillettes sont de couleur rouge plus foncée et s’asseoir au sommet des ventricules. Ils sont beaucoup moins musclés et apparaissent flasques.
- Le péricarde est une membrane mince et translucide qui entoure le cœur.
- Thymus
- le thymus est situé vers l’avant pour le coeur et s’assoit sur la trachée. Il doit être lisse en texture.
- Chez les jeunes animaux, il semble que tan avec une texture grasse.
- Les animaux plus âgés auront l’infiltration du tissu adipeux dans le thymus, agrandissant et en donnant le thymus une couleur blanche.
- Trachée
- la trachée s’étend de l’épiglotte à la bifurcation des bronches. C’est un tube cartilagineux côtelée souple.
- , Il devrait être clair et pas n’importe quel liquide fluide ou spumeux dans la lumière. Euthanasie en CO 2 peut causer des fluides (serosanguinous et/ou moussants) accumulation dans les poumons et la trachée en raison de l’hémorragie.
- Oesophage
- le œsophage s’étend de la cavité buccale à l’estomac. C’est un tube très mince qui se trouve directement derrière la trachée et le cœur, puis passe à travers le diaphragme à l’estomac.
- Le œsophage est difficile à enlever, car il se déchire facilement même si le tissu est extensible. Suppression de le œsophage se faite plus facilement en disséquant il loin de la trachée après l’ablation du cœur et des poumons.
- Enlever les organes thoraciques
- le coeur et les poumons sont plus faciles à enlever ensemble.
- Placer la pince perpendiculairement à la trachée et saisir la trachée fermement, juste au-dessus du thymus.
- à l’aide des ciseaux, faire une coupe perpendiculaire à la trachée juste en avant de la pince. Cette réduction devrait rompre la trachée et le œsophage.
- Sans desserrer l’emprise sur la trachée, soulevez la trachée direction caudale, et découper toutes les pièces jointes des poumons à la surface de la colonne vertébrale dans la cage thoracique.
- Le œsophage peut doivent être coupés pour être capable de soulever le cœur et poumons gratuitement la cavité thoracique.
- Après que le cœur est éliminé de l’organisme, il peut rincer avec du sérum physiologique pour enlever les résidus de sang et de caillots, ou il peut être rempli avec le fixateur par l’intermédiaire de l’aorte.
- Une fois les poumons est excisés, ils sont gonflés avec fixateur. Une ligature est placée lâchement autour de la trachée. Une aiguille reliée à une seringue contenant le fixateur de choix est enfilée dans la lumière de la trachée. La ligature est resserrée autour de l’aiguille, et le fixateur est injecté jusqu'à ce que les poumons sont gonflés. Lors du retrait de l’aiguille, la ligature est serrée pour éviter les fuites.
- Cavité buccale
- langue
- la langue des rongeurs est lisse.
- Examiner la surface des lésions, y compris le dessous.
- La langue est rarement récoltée à l’exception des enquêtes spécialisées telles que les études de cancer de la bouche.
- Pour supprimer la langue, couper à travers les surfaces buccales de chaque côté de la cavité buccale à l’articulation mandibulaire-temporelle.
- Disloquer la mâchoire inférieure et reflètent le maxillaire pour révéler l’épiglotte et la base de la langue.
- Avec des pinces afin d’étendre la langue, couper les fixations sous direction caudale à la base de la langue.
- Entretien traction, couper horizontalement à la base de la langue à fREE de la cavité buccale.
- Dents
- denture Rat se compose de trois molaires et une incisive dans chaque quadrant qui est séparée par un diastème édenté. Ils sont couverts par émail que sur la face labiale ; sur la surface intérieure de la dent est dentine.
- Rat dents sont normalement de couleur jaune/orange. Cette couleur est le plus prononcée sur l’émail incisive et est due à la présence d’un pigment contenant du fer. La couleur commence à environ 21 jours après la naissance et s’aggrave avec l’âge.
- Examiner les dents pour la prolifération ou malocclusion.
- langue
5. Tête
yeux- les yeux devraient être égaux en taille et claire d’exsudat. La conjonctive doit être lisse.
- Pour enlever les yeux, faire pression sur la peau qui entoure le œil vers l’arrière et vers le bas pour dépasser le œil de l’orbite. À l’aide d’une pince embout incurvé, isoler le globe et couper les pièces jointes tenant dans la douille.
- Oreilles
- observer les oreilles pour l’identification. Demande de certains enquêteurs étiquettes aux oreilles soient incluses dans les échantillons d’organes pour confirmation d’identité animale.
- Les conduits auditifs sont examinés des lésions, des masses, ou exsudat.
- Nez
- on observe le nez liquide ou exsudat.
- Les narines doivent être claire et symétriques.
l’étape finale dans de nombreux projets de recherche est l’autopsie des animaux expérimentaux. Une observation détaillée des structures externes et internes, suivie de la collection de tissus pour analyse complémentaire fournit une grande quantité de données de recherche. Les techniques appropriées pour l’élimination de tissu et préservation avec les solutions de fixateur appropriées sont essentiels pour la bonne interprétation des résultats.
- Leary, S., Underwood, W., Anthony, R., Cartner, S., Corey, D., Grandin, T., et al. 2013. AVMA guidelines for the euthanasia of animals: 2013 edition.
- Parkinson, C.M., O'Brien, A., Albers, T.M., Simon, M.A., Clifford, C.B. and Pritchett-Corning, K.R. 2011. Diagnostic Necropsy and Selected Tissue and Sample Collection in Rats and Mice. 54. e2966. 1-7.
- Fiette, L. and Slaoui, M. 2011. Necropsy and Sampling Procedures in Rodents. Drug Safety Evaluation: Methods and Protocols, 39-67.
- Youngson, R.M. 2005. Collins dictionary of Medicine fourth edition.
Passer à...
Vidéos de cette collection:

Now Playing
Autopsie et prélèvement des tissus
Lab Animal Research
57.8K Vues

Techniques de manipulation et de contention des rongeurs
Lab Animal Research
173.2K Vues

Soins de base
Lab Animal Research
27.6K Vues

Principes fondamentaux de l'élevage et du sevrage
Lab Animal Research
35.5K Vues

Techniques d'identification des rongeurs I
Lab Animal Research
54.4K Vues

Techniques d'identification des rongeurs II
Lab Animal Research
25.5K Vues

Administration d'agents expérimentaux I
Lab Animal Research
99.9K Vues

Administration d'agents expérimentaux II
Lab Animal Research
34.6K Vues

Administration d'agents expérimentaux III
Lab Animal Research
31.2K Vues

Administration d'agents expérimentaux IV
Lab Animal Research
51.2K Vues

Prélèvement d'échantillons de sang I
Lab Animal Research
170.7K Vues

Prélèvement d'échantillons de sang II
Lab Animal Research
72.7K Vues

Induction et maintien de l’anesthésie
Lab Animal Research
50.0K Vues

Recommandations pour la chirurgie des rongeurs
Lab Animal Research
22.3K Vues

Prélèvement de tissus en conditions stériles
Lab Animal Research
34.7K Vues