Method Article
Test de l’acétylcholine suivie d’une adénosine pour le diagnostic invasif des troubles vasomoteurs coronariens
Dans cet article
Résumé
Les troubles de vasomotion coronarienne représentent des causes fonctionnelles fréquentes d’angine de poitrine chez les patients atteints de coronaires non obstruées. Le mécanisme sous-jacent de l’angine de poitrine (endotype) chez ces patients peut être déterminé par une procédure diagnostique invasive complète basée sur des tests de provocation à l’acétylcholine suivis d’une évaluation dérivée de Doppler de la réserve de flux coronaire et de la résistance microvasculaire.
Résumé
Plus de 50% des patients présentant des signes et symptômes d’ischémie myocardique subissant une angiographie coronaire ont des artères coronaires non obstruées. Les troubles coronariens vasomoteurs (altération de la vasodilatation et/ou augmentation de la vasoconstriction/spasme) représentent des causes fonctionnelles importantes pour une telle présentation clinique. Bien que la vasodilatation altérée puisse être évaluée avec des techniques non invasives telles que la tomographie par émission de positrons ou l’imagerie par résonance magnétique cardiaque, il n’existe actuellement aucune technique non invasive fiable pour le diagnostic des spasmes coronariens. Ainsi, des procédures diagnostiques invasives (IDP) ont été développées pour le diagnostic des troubles coronariens vasomoteurs, y compris les tests spasmodiques ainsi que l’évaluation de la vasodilatation coronaire. L’identification du type de trouble sous-jacent (appelé endotype) permet d’initier des traitements pharmacologiques ciblés. Bien qu’une telle approche soit recommandée par les lignes directrices actuelles de la Société européenne de cardiologie pour la prise en charge des syndromes coronariens chroniques basées sur l’étude CorMicA, la comparabilité des résultats ainsi que les essais multicentriques sont actuellement entravés par des différences majeures dans les protocoles institutionnels pour les tests fonctionnels coronariens. Cet article décrit un protocole IDP complet comprenant des tests de provocation intracoronarienne à l’acétylcholine pour le diagnostic des spasmes épicardiques / microvasculaires, suivis d’une évaluation par fil Doppler de la réserve de flux coronaire (CFR) et de la résistance microvasculaire hyperémique (HMR) à la recherche d’une déficience vasodilatatoire coronarienne.
Introduction
Au cours des dernières années, la cardiologie interventionnelle a fait des progrès substantiels dans divers domaines. Cela comprend non seulement le traitement interventionnel des valves cardiaques par remplacement transcathéter de la valve aortique et la réparation bord à bord de la valve mitrale et tricuspide, mais aussi les interventions coronaires 1,2,3,4,5,6. Parmi ces derniers, on trouve des progrès dans les techniques de traitement des occlusions totales chroniques ainsi que des lésions calcifiées par rotation et thérapie par ondes de choc. En plus de ces procédures coronaires interventionnelles plutôt structurelles, des procédures diagnostiques invasives (PDI) ont maintenant été établies à la recherche de troubles coronariens fonctionnels (spasmes coronariens et dysfonctionnement microvasculaire)7. Ces derniers comprennent un groupe hétérogène d’affections fréquentes, mais non exclusivement, chez les patients souffrant d’angine de poitrine et d’artères coronaires non obstruées. Les principaux mécanismes sous-jacents à ces troubles vasomoteurs sont une vasodilatation coronaire altérée, une vasoconstriction / spasme accrue ainsi qu’une résistance microvasculaire coronaire accrue. Cette dernière est souvent due à une maladie microvasculaire obstructive8. Sur le plan anatomique, des troubles vasomoteurs coronariens peuvent survenir dans les artères épicardiques, la microcirculation coronaire ou les deux. Le groupe d’étude international sur les troubles coronariens vasomoteurs (COVADIS) a publié des définitions pour le diagnostic de ces troubles 9,10 et des lignes directrices récentes de la Société européenne de cardiologie (ESC) sur la prise en charge des patients atteints du syndrome coronarien chronique ont formulé des recommandations pour une évaluation adéquate des patients en fonction de l’état clinique 11 . De plus, des publications récentes ont délimité les différents endotypes qui peuvent être dérivés d’un IDP12,13. Une telle approche présente un avantage pour chaque patient, car des études randomisées ont montré une meilleure qualité de vie chez les patients subissant une PDI suivie d’un traitement médical stratifié en fonction du résultat du test par rapport aux soins habituels prodigués par le médecin généraliste14. Actuellement, il y a un débat sur le protocole le plus approprié pour tester de tels troubles vasomoteurs. Le but de cet article est de décrire un protocole où les tests de provocation à l’acétylcholine (ACh) à la recherche de spasmes coronaires sont suivis d’une évaluation par fil Doppler de la réserve de flux coronaire (CFR) et de la résistance microvasculaire hyperémique (HMR) à l’aide d’adénosine (Figure 1).
Protocole
Le test intracoronaire ACh a été approuvé par le comité d’éthique local et le protocole suit les directives de notre institution pour la recherche humaine. Un précédent article de JoVE couvrait un protocole montrant la préparation des solutions d’ACh ainsi que la préparation des seringues pour l’injection intracoronaire d’ACh15.
1. Préparation des solutions d’ACh et préparation des seringues pour injection intracoronaire d’ACh
- Veuillez vous référer à un article JoVE publié précédemment15.
2. Préparation de la solution d’adénosine pour injection intracoronaire
- Prendre 1 ampoule de 6 mg d’adénosine (avec 2 mL de solvant) dans une seringue (ce qui correspond à une dose de 3 mg/mL).
- Ajouter les 6 mg d’adénosine à 100 mL de solution de chlorure de sodium à 0,9 % et mélanger délicatement.
- Remplir une seringue de 10 mL avec 3,5 mL de solution d’adénosine (environ 200 μg d’adénosine).
- Effectuez la dernière étape 3 fois pour la préparation de 3 injections.
3. Angiographie coronarienne diagnostique
- Selon la voie d’accès artérielle, injecter une anesthésie locale à proximité de l’artère fémorale droite (habituellement 15 ml de mépivacaïne) ou à proximité de l’artère radiale droite (habituellement 2 ml de mépivacaïne).
- Pour confirmer le succès de l’anesthésie locale, piquez la peau anesthésiée avec l’aiguille et demandez au patient si la douleur est toujours présente.
- Percez l’artère selon la technique Seldinger et insérez la gaine (généralement 5F). Si possible, omettre la prophylaxie par spasme radial chez les patients subissant une PDI planifiée. Effectuer une angiographie coronaire dans des conditions stériles.
- Introduisez le cathéter de diagnostic sur un fil à pointe en J à travers la gaine de l’artère radiale jusqu’à l’aorte ascendante et avancez-le jusqu’à la racine aortique.
- Donnez 5000 UI d’héparine.
- Engager le cathéter diagnostique dans l’ostium de l’artère coronaire droite (ARC) et par la suite de l’artère coronaire gauche (ACL). Injecter 2 mL de contraste pour confirmer le positionnement correct du cathéter.
- Effectuer une coronarographie dans différentes vues en utilisant des injections manuelles d’environ 10 mL d’agent de contraste sous fluoroscopie pour visualiser les artères coronaires.
NOTE: Habituellement, LAO 40° et RAO 35° sont utilisés pour le RCA et LAO 45°/ CRAN 25°, RAO 30°/ CRAN 30° et RAO 20°/ CAUD 30° sont utilisés pour l’ACV.
4. Préparatifs pour le PDI
- Comme condition préalable à l’IDP, exclure toute sténose épicardique de >50% à l’évaluation visuelle.
REMARQUE: L’artère par défaut pour l’IDP est l’ACV car elle permet l’examen des deux vaisseaux (artère descendante antérieure gauche (LAD) et artère circonflexe gauche (LCX)) en même temps. - Placez un cathéter de guidage adapté à l’ACL dans le cathéter principal gauche (cela peut être 5F ou 6F, le choix du cathéter dépend de l’anatomie du patient).
- Donnez encore 5000 UI d’héparine.
- Faites avancer le fil de débit/pression Doppler avec précaution à travers le cathéter de guidage dans l’artère principale gauche.
- Après le rinçage pour éviter tout contraste dans le cathéter, étalonnez le fil de débit/pression Doppler avec le capteur de réserve de débit fractionnaire (FFR) (localisé à côté de la pointe ou décalé de 1,5 cm selon le type de fil) dans le principal gauche (appuyez sur Norme sur le logiciel du système informatique).
- Placez la pointe du fil dans la partie médiane proximale du vaisseau (généralement LAD). Effectuer une fluoroscopie pour enregistrer la position du fil.
- Évaluez et optimisez la qualité du signal Doppler et ECG, si nécessaire.
REMARQUE: Cela peut être fait en tournant ou en tirant le fil afin d’optimiser la position du fil. Il est également possible d’affiner le signal Doppler dans les paramètres du système (par exemple, traçage et mise à l’échelle optimaux des signaux ECG et Doppler, réglage du filtre mural, etc.). - Une fois qu’un bon signal est obtenu, appuyez sur Enregistrer pour enregistrer les signaux sur le système. Le patient est maintenant prêt pour le PDI.
5. Réalisation de la PDI
- Injecter 6 mL de la concentration d’ACh la plus faible (0,36 μg/mL) dans l’ACV (~ 2 μg d’ACh) en 20 s. Rincer avec 3-4 mL de solution saline. Effectuez une surveillance continue de l’ECG à 12 dérivations et demandez au patient des symptômes angineux reconnaissables (par exemple, douleur thoracique, dyspnée). Observez les courbes du signal Doppler et enregistrez la vitesse maximale moyenne (APV) pendant l’injection d’ACh.
- Effectuer une coronarographie de l’ACL après injection d’ACh par injection manuelle d’environ 10 mL d’agent de contraste à travers le cathéter. Après chaque dose d’ACh, enregistrer et imprimer l’ECG à 12 dérivations. Demandez au patient des symptômes angineux reconnaissables. Faites une pause de 1 minute entre chaque dose.
REMARQUE: Habituellement, une projection RAO 20 ° / CAUD 30 ° est la meilleure projection pour les tests ACh. - Injecter 6 mL de la concentration moyenne d’ACh (3,6 μg/mL) dans l’ACV (~ 20 μg d’ACh). Injecter dans les 20 secondes avec une surveillance continue de l’ECG à 12 dérivations et des symptômes du patient. Rincer avec 3-4 mL de solution saline. Observez les courbes Doppler-signal et enregistrez l’APV pendant l’injection d’ACh. Effectuer une angiographie coronaire de l’ACL après l’injection de 6 mL d’ACh comme mentionné ci-dessus.
- Injecter 5,5 mL de la concentration élevée d’ACh (18 μg/mL) dans l’ACL (~ 100 μg d’ACh). Injecter dans les 20 s avec une surveillance continue de l’ECG et des symptômes du patient. Rincer avec 3-4 mL de solution saline. Observez les courbes Doppler-signal et enregistrez l’APV pendant l’injection d’ACh. Répéter l’angiographie coronaire de l’ACL comme décrit ci-dessus.
REMARQUE: Chez la plupart des patients présentant des spasmes coronariens, une reproduction des symptômes, des modifications de l’ECG ou une vasoconstriction épicardique se développent à cette dose. Si une bradycardie survient pendant l’injection d’ACh, cela peut être résolu en ralentissant la vitesse de l’injection manuelle d’ACh. Une injection plus lente sur une période de 3 min par rapport à l’injection de 20 s est également réalisable. - Si aucun spasme épicardique (c.-à-d. > vasoconstriction à 90 %) ne se produit à la dose de 100 μg, continuez avec la dose de 200 μg d’ACh (11 mL de la concentration élevée d’ACh (18 μg/mL). Injecter dans les 20 s avec une surveillance continue de l’ECG et des symptômes du patient. Rincer avec 3-4 mL de solution saline. Observez les courbes Doppler-signal et enregistrez l’APV pendant l’injection d’ACh. Répéter l’angiographie coronaire de l’ACL.
REMARQUE: Ralentissez la vitesse de l’injection manuelle d’ACh si une bradycardie se produit comme mentionné ci-dessus. - Injecter 200 μg de nitroglycérine dans l’ACL à la fin du test ACh ou en cas de symptômes graves (angor ou dyspnée sévères), de décalages ECG ischémiques ou de spasmes épicardiques. Effectuer une angiographie coronaire de l’ACL après environ une minute pour documenter la réversion du spasme.
- Une fois que l’APV revient à la ligne de base et que l’ECG ainsi que les symptômes du patient se sont normalisés, passez à l’étape suivante (c.-à-d. CFR, évaluation HMR).
- Appuyez sur Base pour capturer les valeurs de base de l’APV ainsi que la pression distale () et aortique (Pa).
- Injecter rapidement un bolus de 3,5 mL de la solution d’adénosine dans l’ACV (~ 200 μg d’adénosine) suivi d’un bref rinçage de solution saline (10 mL). Appuyez sur le bouton de recherche de pic 3 battements cardiaques après l’injection pour lancer la recherche de pic (APV maximal et minimal) afin d’éviter les influences de bouffées vasomotrices. Le système calcule et affiche les valeurs pour FFR, CFR et HMR.
REMARQUE: L’injection intracoronaire d’adénosine est bien tolérée par les patients avec seulement peu d’effets secondaires tels que des palpitations. - Répétez les étapes précédentes (5.8 et 5.9) jusqu’à ce que 2 mesures concordantes aient été effectuées avec succès. Calculer la moyenne FFR/CFR/HMR à partir des valeurs des mesures.
- Tirez le fil de débit/pression Doppler dans la conduite principale gauche pour vérifier la dérive de pression. En cas de dérive de pression importante, recalibrez le capteur de pression du fil (étape 4.5) et répétez la mesure CFR/HMR.
- Retirez le fil de débit/pression Doppler et prenez une image finale de l’ACV pour documenter qu’aucune blessure au vaisseau n’est survenue.
Résultats
Selon les critères diagnostiques suggérés par COVADIS9, l’angine vasospastique peut être diagnostiquée si les critères suivants s’appliquent lors du test de provocation ACh : modifications transitoires de l’ECG indiquant une ischémie, reproduction des symptômes angineux habituels du patient et vasoconstriction > 90% d’un vaisseau épicardique confirmée lors de l’angiographie coronaire (Figure 2).
Un spasme de la microvascularisation coronaire peut être diagnostiqué si les symptômes du patient et les altérations ischémiques de l’ECG surviennent lors du test de provocation en l’absence de vasospasme épicardique10 (Figure 3).
Une vasodilatation microvasculaire altérée peut être diagnostiquée en interprétant les mesures CFR et HMR après les injections d’adénosine. Selon les valeurs seuils appliquées, un CFR réduit est défini comme < 2,012,13 ou ≤ 2,516, respectivement (figure 4). Pour l’HMR, les données sur les valeurs seuils optimales sont rares, mais une résistance microvasculaire accrue est actuellement définie comme un HMR > 1,917 ou > 2,47 (figure 5).

Figure 1 : Organigramme de la procédure diagnostique invasive. Après exclusion de toute sténose épicardique lors de l’angiographie diagnostique, le potentiel vasoconstricteur des artères coronaires est testé par injection intracoronaire de doses incrémentielles d’ACh. Après le test de provocation spasmodique, une évaluation de la vasodilatation par injection intracoronaire d’adénosine est effectuée, suivie d’une mesure du CFR et de l’HMR. Veuillez cliquer ici pour voir une version agrandie de cette figure.
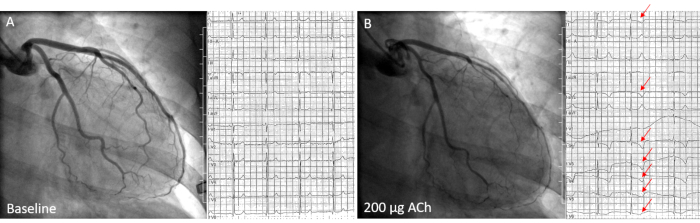
Figure 2 : Patiente de 58 ans présentant un spasme épicardique diffus pendant le test de provocation ACh. A) Mesure de base avant injection d’ACh ne montrant ni sténose ni modifications ischémiques de l’ECG. B) Spasme épicardique diffus du LAD après injection intracoronaire de 200 μg ACh dans la conduite principale gauche, accompagné d’une inversion en T dans la LAVa en plomb et d’une dépression ST descendante dans les dérivations I et V2-V 6 (flèches rouges) pendant la reproduction des symptômes du patient. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Patiente de 61 ans présentant un spasme microvasculaire lors d’un test de provocation ACh. A) Mesure de base avant injection d’ACh ne montrant ni sténose ni modifications de l’ECG ischémique. B) Vasoconstriction mineure des vaisseaux épicardiques après injection intracoronaire de 100 μg ACh dans la conduite principale gauche. La patiente a présenté ses symptômes habituels, accompagnés d’une dépression du segment ST dans les dérivations II, V4-V 6 (flèches rouges). Veuillez cliquer ici pour voir une version agrandie de cette figure.
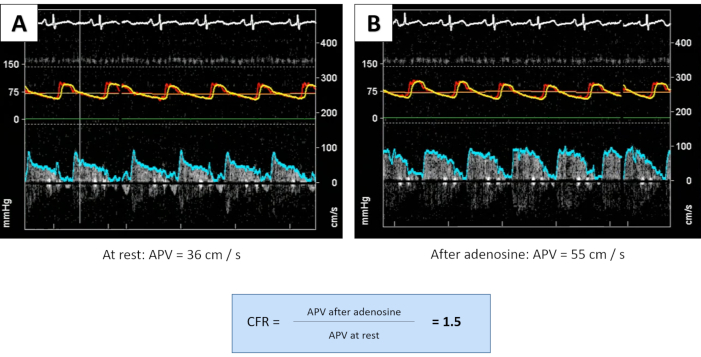
Figure 4 : Évaluation de la vasodilatation par mesure du CFR. Après injection d’adénosine, l’APV a augmenté insuffisamment de 36 cm/s au repos (A) d’environ 50 % à 55 cm/s (B), conduisant à un taux de létalité pathologique de 1,5. Mesures à effectuer jusqu’à l’obtention de deux lectures concordantes (mesures supplémentaires non indiquées); Le CFR équivaut à la moyenne des mesures. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Évaluation de la vasodilatation par mesure de l’HMR. Pour le calcul de l’HMR, la vitesse maximale moyenne (APV) et la pression artérielle coronaire distale (P d) sont mesurées après injection d’adénosine, ce qui conduit à un HMR pathologique de 2,3. Mesures à effectuer jusqu’à l’obtention de deux lectures concordantes (mesures supplémentaires non indiquées); HMR équivaut à la moyenne des mesures. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La prise en charge des patients souffrant d’angine de poitrine et d’artères coronaires non obstruées est souvent exigeante et parfois frustrante. Une étape importante du bilan de ces patients est que le ou les mécanismes physiopathologiques sous-jacents aux symptômes du patient sont correctement étudiés. C’est un défi car souvent, non seulement un mécanisme est responsable et diverses étiologies, y compris cardiaques et non cardiaques, coronaires et non coronaires, doivent être prises en compte.
Souvent, les patients souffrant de douleurs thoraciques d’origine inconnue sont programmés pour une coronarographie diagnostique invasive à la recherche d’une maladie coronarienne épicardique sténosante. Plusieurs études ont montré que malgré des symptômes probants et des tests de stress non invasifs anormaux, ces patients ont des artères coronaires non obstruées dans plus de 50% des cas12,18. Bien qu’il soit exact que le rendement des patients présentant des sténoses épicardiques pertinentes doit être amélioré, il ne faut pas négliger que les troubles coronariens fonctionnels peuvent être responsables d’une telle présentation clinique. Nous et d’autres avons montré que la vasodilatation coronaire altérée et / ou les spasmes coronariens peuvent représenter plus de 60% de ces cas12,18. L’établissement d’un diagnostic chez ces patients souvent instables représente une étape importante dans la prise en charge des patients. Ainsi, il est important de profiter de l’occasion de l’angiographie coronarienne diagnostique pour d’autres tests. Bien que cela puisse prolonger le temps de laboratoire du cathéter d’environ 30 minutes, l’établissement d’un diagnostic peut empêcher les patients de revenir pour une angiographie diagnostique répétée à l’avenir et permettre l’initiation de traitements pharmacologiques ciblés.
Dans ce contexte, plusieurs protocoles pour un PDI ont été élaborés au cours des dernières années. Cela implique l’évaluation de la vasoconstriction / spasme ainsi que de la vasodilatation et de la résistance microvasculaire. Certains centres ont ajouté des évaluations supplémentaires à leur protocole, y compris des mesures des concentrations de lactate dans des échantillons de sang des sinus coronaires pendant les tests ACh (à la recherche de spasmes microvasculaires)19,20 ou la réalisation d’une nouvelle provocation de l’ACh après la documentation du spasme et l’injection de nitroglycérine pour évaluer l’effet protecteur de la nitroglycérine. Ces derniers aspects seront couverts dans d’autres contributions de cette collection de méthodes JoVE.
Lorsque l’on discute des étapes critiques du protocole présenté ici, le premier aspect est l’effet vasodilatateur de la nitroglycérine. Comme la coronarographie est souvent effectuée par l’artère radiale, certains médicaments sont habituellement administrés pour prévenir les spasmes de l’artère radiale (par exemple, nitroglycérine / vérapamil). Cela peut avoir un impact sur les tests vasomoteurs ultérieurs, car des études ont montré que la nitroglycérine peut avoir un effet sur le tonus épicardique jusqu’à 15-20 minutes21. Cependant, une étude comparant les effets de toute prophylaxie par spasme de l’artère radiale sur le test ACh n’a pas été publiée jusqu’à présent. Dans ce contexte, il est également discutable de savoir quand effectuer des tests ACh (c’est-à-dire avant ou après les tests FFR/CFR/HMR). Si le test ACh est effectué après le test FFR/CFR/HMR, les effets vasodilatateurs de la nitroglycérine peuvent encore être présents et influencer les résultats du test ACh14. C’est pourquoi il est recommandé d’effectuer un test ACh avant le test FFR/CFR/HMR. Cependant, il n’y a pas encore eu de comparaison directe de ces deux protocoles.
Une autre étape critique du protocole est l’utilisation et le positionnement du fil de flux/pression Doppler. Pour éviter toute complication intravasculaire, le fil doit être placé avec prudence et idéalement dans la partie médiane proximale du vaisseau. Pour une application chez les patients présentant des sténoses intermédiaires, en particulier dans la partie distale du vaisseau, la pose avec un microcathéter peut être conseillée. Bien que le fil de débit/pression Doppler présente l’avantage qu’un signal Doppler direct peut être entendu et vu à l’écran, l’obtention d’un bon signal peut parfois être difficile. Une combinaison de rotation et de traction du fil ainsi qu’un réglage fin avec la télécommande (par exemple, réglage du facteur d’échelle, détection de courbe et filtre mural) résout le problème dans la plupart des cas.
Une limitation importante de la méthode réside dans le fait que seule l’ACV est testée avec ce protocole. La raison pour laquelle l’ACV est testée comme artère par défaut est que deux vaisseaux peuvent être contestés en même temps. Néanmoins, dans les rares cas où le PCI ne révèle aucune anomalie dans l’ACV, l’ACR doit être évaluée. Une autre limite est que l’évaluation de la résistance microvasculaire est une approche plutôt nouvelle et, par conséquent, les valeurs seuils optimales chez les patients ayant des artères coronaires non obstruées sont encore un sujet de débat. Selon la méthode utilisée, soit l’indice de résistance microvasculaire (IMR; méthode de thermodilution) soit l’HMR (technique Doppler) est fourni. Les valeurs seuils actuellement utilisées pour le diagnostic de la dysfonction microvasculaire sont > 25 pour l’IMR22 et > 1,917 ou > 2,47 pour l’HMR.
L’IDP tel que présenté dans cet article représente l’une des formes les plus complètes de test vasomoteur coronarien. Un avantage majeur par rapport aux protocoles de test non invasifs réside dans le fait que les protocoles non invasifs ne sont généralement pas en mesure d’évaluer les spasmes coronariens. Bien que cela ait été suggéré comme réalisable dans une publication récente de Korea23 , il y a encore beaucoup de scepticisme quant à la sécurité des patients, car les spasmes multivaisseaux pendant les tests non invasifs d’ergonovine peuvent ne pas être contrôlés de manière adéquate. On peut s’attendre à ce que les futurs essais cliniques randomisés continuent de démontrer l’utilité du PCI en conjonction avec un traitement médical stratifié. De plus, l’IDP représente la plate-forme idéale pour l’évaluation de nouveaux agents pharmacologiques pour le traitement des différents endotypes de troubles vasomoteurs coronariens.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas de conflit d’intérêts.
Remerciements
Ce projet a été soutenu par la Fondation Berthold-Leibinger, Ditzingen, Allemagne.
matériels
| Name | Company | Catalog Number | Comments |
| Cannula 0,95 x 50 mm (arterial punction) | BBraun | 4206096 | |
| Cannula 23 G 0,6 x 25 mm (local anesthesia) | BBraun | 4670025S-01 | |
| Coronary angiography suite (AXIOM Artis MP eco) | Siemens | n/a | |
| Contrast agent Imeron 350 with a 10 mL syringe for contrast injection | Bracco Imaging | 30699.04.00 | |
| Diagnostic catheter (various manufacturers) | e.g. Medtronic | DXT5JR40 | |
| Glidesheath Slender 6 Fr | Terumo | RM*RS6J10PQ | |
| Heparin 5,000 IU (25,000 IU / 5 mL) | BBraun | 1708.00.00 | |
| Mepivacaine 10 mg/mL | PUREN Pharma | 11356266 | |
| Sodium chloride solution 0.9 % (1 x 100 mL) | BBraun | 32000950 | |
| Syringe 2 mL (1x) (local anesthesia) | BBraun | 4606027V | |
| Syringe 10 mL (1x) (Heparin) | BBraun | 4606108V | |
| Acetylcholine chloride (vial of 20 mg acetylcholine chloride powder and 1 ampoule of 2 mL diluent) | Bausch & Lomb | NDC 240208-539-20 | |
| Cannula 20 G 70 mm (2x) | BBraun | 4665791 | |
| Glyceryle Trinitrate 1 mg/mL (5 mL) | Pohl-Boskamp | 07242798 | |
| Sodium chloride solution 0.9 % (3 x 100 mL) | BBraun | 32000950 | |
| Syringe 2 mL (1x) | BBraun | 4606027V | |
| Syringe 5 mL (5x) | BBraun | 4606051V | |
| Syringe 10 mL (1x) | BBraun | 4606108V | |
| Syringe 50 mL (3x) | BBraun | 4187903 | |
| Adenosine 6 mg/2 mL | Sanofi-Aventis | 30124.00.00 | |
| ComboMap Pressure/Flow System | Volcano | Model No. 6800 (Powers Up) | |
| Pressure/Flow Guide Wire | Volcano | 9515 | |
| Sodium chloride solution 0.9 % (1 x 100 mL) | BBraun | 32000950 | |
| Syringe 10 mL (3x) | BBraun | 4606108V |
Références
- Burneikaitė, G., et al. Cardiac shock-wave therapy in the treatment of coronary artery disease: systematic review and meta-analysis. Cardiovascular Ultrasound. 15 (1), 11 (2017).
- Tajti, P., et al. Update in the Percutaneous Management of Coronary Chronic Total Occlusions. JACC. Cardiovascular Interventions. 11 (7), 615-625 (2018).
- Sharma, S. K., et al. North American Expert Review of Rotational Atherectomy. Circulation. Cardiovascular Interventions. 12 (5), 007448 (2019).
- Nickenig, G., et al. Transcatheter edge-to-edge repair for reduction of tricuspid regurgitation: 6-month outcomes of the TRILUMINATE single-arm study. The Lancet. 394 (10213), 2002-2011 (2019).
- Vakil, K., et al. Safety and efficacy of the MitraClip system for severe mitral regurgitation: a systematic review. Catheterization and Cardiovascular Interventions. 84 (1), 129-136 (2014).
- Cahill, T. J., et al. Transcatheter aortic valve implantation: current status and future perspectives. European heart journal. 39 (28), 2625-2634 (2018).
- Ford, T. J., et al. Assessment of Vascular Dysfunction in Patients Without Obstructive Coronary Artery Disease: Why, How, and When. JACC. Cardiovascular interventions. 13 (16), 1847-1864 (2020).
- Sechtem, U., et al. Coronary microvascular dysfunction in stable ischaemic heart disease (non-obstructive coronary artery disease and obstructive coronary artery disease). Cardiovascular Research. 116 (4), 771-786 (2020).
- Beltrame, J. F., et al. International standardization of diagnostic criteria for vasospastic angina. European Heart Journal. 38 (33), 2565-2568 (2017).
- Ong, P., et al. International standardization of diagnostic criteria for microvascular angina. International journal of cardiology. 250, 16-20 (2018).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Ford, T. J., et al. Ischemia and No Obstructive Coronary Artery Disease: Prevalence and Correlates of Coronary Vasomotion Disorders. Circulation. Cardiovascular Interventions. 12 (12), 008126 (2019).
- Suda, A., et al. Coronary Functional Abnormalities in Patients With Angina and Nonobstructive Coronary Artery Disease. Journal of the American College of Cardiology. 74 (19), 2350-2360 (2019).
- Ford, T. J., et al. Stratified Medical Therapy Using Invasive Coronary Function Testing in Angina: The CorMicA Trial. Journal of the American College of Cardiology. 72 (23), 2841-2855 (2018).
- Ong, P., Athanasiadis, A., Sechtem, U. Intracoronary Acetylcholine Provocation Testing for Assessment of Coronary Vasomotor Disorders. Journal of Visualized Experiments. (114), (2016).
- Sara, J. D., et al. Prevalence of Coronary Microvascular Dysfunction Among Patients With Chest Pain and Nonobstructive Coronary Artery Disease. JACC. Cardiovascular Interventions. 8 (11), 1445-1453 (2015).
- Kunadian, V., et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. European Heart Journal. 41 (37), 3504-3520 (2020).
- Ong, P., et al. High prevalence of a pathological response to acetylcholine testing in patients with stable angina pectoris and unobstructed coronary arteries. The ACOVA Study (Abnormal COronary VAsomotion in patients with stable angina and unobstructed coronary arteries. Journal of the American College of Cardiology. 59 (7), 655-662 (2012).
- Mohri, M., et al. Angina pectoris caused by coronary microvascular spasm. The Lancet. 351 (9110), 1165-1169 (1998).
- Sun, H., et al. Coronary microvascular spasm causes myocardial ischemia in patients with vasospastic angina. Journal of the American College of Cardiology. 39 (5), 847-851 (2002).
- Waxman, S., Moreno, R., Rowe, K. A., Verrier, R. L. Persistent primary coronary dilation induced by transatrial delivery of nitroglycerin into the pericardial space: a novel approach for local cardiac drug delivery. Journal of the American College of Cardiology. 33 (7), 2073-2077 (1999).
- Fearon, W. F., Kobayashi, Y. Invasive Assessment of the Coronary Microvasculature: The Index of Microcirculatory Resistance. Circulation. Cardiovascular Interventions. 10 (12), (2017).
- Om, S. Y., et al. Diagnostic and Prognostic Value of Ergonovine Echocardiography for Noninvasive Diagnosis of Coronary Vasospasm. JACC. Cardiovascular Imaging. 13 (9), 1875-1887 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon