Method Article
In Vitro Croissance des follicules Preantral souris sous microgravité simulée
Dans cet article
Résumé
Une technique très prometteuse pour générer des tissus construit sans aide d’une matrice est aux cellules en culture dans un état de microgravité simulée. À l’aide d’un système rotatif de culture, nous avons examiné la croissance folliculaire ovarienne et la maturation des ovocytes en termes de survie du follicule, morphologie, croissance et fonction d’ovocytes dans les conditions de microgravité simulée.
Résumé
14 les tissus ovariens de souris âgées de jours et des follicules preantral isolés de souris du même âge ont été incubés dans un système de culture de microgravité simulée. Quantitativement, nous avons évalué la survie du follicule, follicule mesurée et diamètres de l’ovocyte et examiné l’ultrastructure des ovocytes issus du système. Nous avons observé une diminution follicule survie, diminution de l’expression des expressions de la prolifération cellulaire antigène nucléaire et facteur de différenciation de croissance 9, comme indicateurs pour le développement des cellules de la granulosa et des ovocytes, respectivement et ultrastructural ovocyte anomalies dans les conditions de microgravité simulée. Le dispositif expérimental de microgravité simulée doit être optimisé pour offrir un modèle pour l’étude des mécanismes impliqués dans l’ovocyte/follicule in vitro le développement.
Introduction
In vitro le développement ovarien folliculaire et la maturation des ovocytes ont été obtenus selon les méthodes traditionnelles de culture 2 dimensions, telles que sur la surface des boîtes de Pétri et trois matrice (3D) dimensions, telles que l’alginate et hydrogel1 ,2,3. Un système de culture 3D efficacement maintenu follicules dans une structure tissulaire et gardé les profils d’expression génique semblables comme en vivo4 follicules et produit ovocytes méiose compétentes5,6. Systèmes de culture 3D peuvent être obtenues en un État exempt de matrice, par exemple, pendaison drop suspension et roulement de navires. Le navire de mur tournant (RWV) développé par la National Aeronautics and Space Administration (NASA) génère une microgravité simulée (s-µg) pour les cellules cultivées à l’intérieur du bâtiment7. Cette microgravité simulée condition fournit un système de culture unique de la prolifération cellulaire et la différenciation en raison de l’absence de sédimentation par convection. Il a été démontré que microgravité simulée favorisé la formation de vaisseaux endothéliale de cellules endothéliales8,9, tissu thyroïdien assemblage à partir de cellules thyroïdiennes10et chondrogenèse adipeux-dérivée cellules souches mésenchymateuses dans RWV dispositifs11. Cependant, d’autres études ont montré que microgravité simulée induit l’apoptose dans les cellules gastriques et simulé de B lymphoblastes12,13,14, suggérant les effets de la microgravité sur les lésions cellulaires peut être la cellule dépendant du type. Microgravité simulée pourrait aussi provoquer des changements au niveau ultrastructural, tel que rapporté dans l’organisation de la broche perturbés et induit blebbing cytoplasmique en ovocytes15. Les conditions de microgravité simulée optimisée et les mécanismes qui induisent des lésions des tissus cellulaires ou génie sous le système nécessitent enquête. Des expériences in vitro d’ovocytes/follicules ovariens à l’aide de dispositifs RWV de plus en plus peuvent fournir des informations précieuses sur expressions génétiques ovocyte et ultrastructures des organites de l’ovocyte. Dans cette étude, les tissus ovariens contenant des follicules preantral et isolés des follicules preantral a été utilisé pour étudier les effets de la microgravité simuléesur la maturation du follicule développement et ovocyte.
Dans cette étude, les tissus ovariens contenant des follicules preantral et isolés des follicules preantral ont été utilisés pour étudier les effets de la microgravité simulée sur développement et oocyte maturation du follicule. Dans notre étude, le RWV, un dispositif de microgravité simulée, tourne autour d’un axe horizontal à l’intérieur d’une étuve à2 CO 5 %, fournissant un état de microgravité simulée avec oxygénation efficace et très basse tension de cisaillement. Nous avons analysé l’expression de gène d’antigène nucléaire de prolifération cellulaire (PCNA) et facteur de différenciation de croissance 9 (GDF-9) comme indicateurs pour le développement des cellules de la granulosa et des ovocytes, respectivement. Nous avons démontré que les expressions PCNA et GDF-9 ont été supprimées dans les cellules de la granulosa et des ovocytes, respectivement, lorsqu’il est cultivé dans le dispositif RWV, et nous a montré le retrait des microvillosités des ovocytes de la zone pellucide dans les follicules cultivées dans le s-µ g condition, qui était similaire à celle de GDF-9-deficient souris follicules16.
Protocole
Approbation éthique pour cette étude proviennent de l’Animal recherche éthique Comité du Wen Zhou Medical College.
1. préparation des milieux de Culture et d’Alginate Hydrogel
- Préparer le tissu ovarien et manipulation de follicule moyen moyen moyen L-15 avec 10 % sérum de veau fœtal, 100 UI/mL de pénicilline et 100 µg/mL de streptomycine. Conserver à 4 ° C pendant deux semaines.
- Préparer le tissu ovarien et milieu de culture de follicule consistant en un milieu essentiel alpha-minimal [α-MEM] additionné de sérum de veau fœtal [BF], 5 % 1 % insuline-sélénium-transferrine, 10 mUI/ml rFSH, 100 UI/mL de pénicilline et 100 µg/mL de streptomycine. Conserver à 4 ° C pendant deux semaines.
- Préparez l’alginate hydrogel utilisant la solution de l’alginate de sodium de 0,8 % (p/v) dans du PBS stérile, puis déposez 10 µL de cette solution dans la solution d’encapsulation (140 mM NaCl 50 mM CaCl2) pour créer des billes d’alginate.
Remarque : La taille de billes d’alginate était environ 3 mm de diamètre.
2. isolement du follicule et l’Encapsulation de souris
- 14 jours ICR des souris femelles de réforme par dislocation cervicale, enlever les ovaires aseptiquement, à l’aide de ciseaux et pinces et mettre des ovaires dans 2 mL de milieu de manutention.
- Couper les ovaires en deux à l’aide d’un scalpel. Le tissu ovarien demi taille était environ 1 mm d’épaisseur pour la culture dans le milieu de culture.
- Manuellement les isoler des follicules des ovaires à l’aide d’aiguilles de 26 1/2-GUE sous un stéréomicroscope de X 2-4 et recueillir les follicules sélectionnés pour la culture dans le milieu de culture.
NOTE : Critères de sélection pour le follicule : 1) follicules étaient ronds avec des ovocytes au milieu et 2 ou 3 couches de cellules de la granulosa entourant les ovocytes, 2) follicules ont une membrane basale intacte, accompagnée de quelques cellules de la thèque, et 3) follicule comptait 90-100 µm de diamètre - Créer des billes d’alginate selon l’étape 1.3. Laver les follicules avec la solution de l’alginate et pipette puis un follicule unique au milieu de chaque bille d’alginate pour s’assurer que chaque perle contient un seul follicule sous un stéréomicroscope. Après le rinçage dans le milieu de culture, la culture l’alginate perles dans 150 µL de milieu de culture dans un 35 × 10 culture mm plat ou un dispositif RWV.
3. tissu ovarien ou follicule Culture sous microgravité simulée
- Utiliser un dispositif RWV pour générer la microgravité simulée. Remplir le récipient avec du pétrole léger (environ 10 mL), mettre 150 µL de milieu de culture dans une goutte dans l’huile, puis transférer un morceau de tissu ovarien ou des billes d’alginate trois follicules encapsulé dans les gouttelettes moyennes. Fermer le bouchon du port bateau et fixer le navire sur la base rotative de l’appareil.
- Dans contrôle groupes, placer des billes d’alginate contenant des follicules ou tissu ovarien dans 150 µL de milieu de culture dans une gouttelette recouvert d’huile de paraffine légères dans 35 × Pétri de 10 mm.
- Incuber le Pétri et dispositif RWV dans un incubateur à 37 ° C à humidifié avec 5 % de CO2 dans l’air.
- Pour changer de milieu de culture en dispositif RWV : Versez l’huile et le milieu du navire dans un 150 × 20 mm boîte de Petri, transférer les perles de tissus ou d’alginate ovariennes dans une boîte de Petri avec milieu de culture. Rétablir le système de culture de navire par étape 3.1.
4. décapsulation et récupération du follicule
- Après 4 jours de culture, verser l’huile et le milieu du navire dans un 150 × 20 mm boîte de Petri. Ramasser des billes d’alginate et décapsule des follicules des billes d’alginate en incubant en manutention additionné de 10 lyase d’alginate de U/mL pendant 30 min à 37 ° C.
- Recueillir des follicules et puis lavez-les à manutention milieu sous un stéréomicroscope.
5. tissu ovarien et évaluation de follicule
- Analyse de viabilité de cellules
- Laver les follicules décapsulés trois fois dans du PBS-D et puis les incuber dans 150 µL des réactifs combinés analyse de viabilité de cellules (2 µM calcéine AM et 4 µM EthD-1) à température ambiante pendant 45 min.
- Transfert des follicules pour une lame de microscope propre avec 10 µL D-PBS, recouvrir d’un lamelle couvre-objet et puis sceller avec du vernis à ongle transparent.
- Comte vert et des globules rouges dans les diapositives sous un microscope confocal fluorescence (400 X).
Remarque : Dans ce test de viabilité, cellules vertes sont des cellules vivantes, et les globules rouges sont les cellules mortes. Follicules avec moins de 10 % des cellules rouges (morts) sont considérés comme des follicules ont survécu.
- L’hématoxyline et éosine (H & E) la coloration des tissus ovariens et follicule
- Difficulté des ovaires frais souris âgés de 14 jours et follicules preantral isolés de souris âgées de 14 jours dans une solution de Bouin sous forme d’échantillons de jour 0. Fixer le tissu ovarien cultivé après 2 jours ou 4 jours de culture et follicules individuels à l’intérieur des billes d’alginate après 4 jours culture comme échantillons expérimentaux.
- Incorporer tous les échantillons à la paraffine, section en série à 5 µm d’épaisseur et puis tache avec H & E selon les instructions du fabricant.
- Comptage du follicule et la mesure du diamètre
- Dans les sections de tissu ovarien colorées avec H & E, compter tous les follicules et les follicules preantral sains au sein de la zone de section de tissu au microscope (grossissement 400 X). Calculer la densité de follicules en divisant le nombre de follicules preantral par le nombre total des follicules.
Remarque : les follicules preantral sains sont ceux qui ont au moins deux couches de cellules de la granulosa. - Diamètre de follicule et ovocyte mesure des follicules jour 0 et 4 jour cultivé des follicules.
- Dans les sections de tissu ovarien colorées avec H & E, compter tous les follicules et les follicules preantral sains au sein de la zone de section de tissu au microscope (grossissement 400 X). Calculer la densité de follicules en divisant le nombre de follicules preantral par le nombre total des follicules.
- Immunohistochimie
- Fixer le tissu ovarien dans 4 % paraformaldéhyde, incorporer à la paraffine, section à 5 µm-épaisseur et monter des coupes de tissus sur des lames. Déparaffinage les sections, réhydrater et eux en tampon citrate pendant 15 min. bloc incuber la peroxydase endogène en peroxyde d’hydrogène 3 % et démasquent l’antigène dans les 5 % de sérum de chèvre puis incuber avec des anticorps primaires à température ambiante pendant 3 h.
- Laver dans du PBS pendant 3 min, puis incuber les lames avec la peroxydase de raifort (HRP) dilué au 1 : 500-conjugué chèvre anti-lapin IgG (H + L) pendant 1 h à température ambiante.
Remarque : Les anticorps primaires utilisés dans l’étude étaient des anticorps de lapin anti-GDF-9 (dilution 1/500) et des anticorps de lapin anti-PCNA (dilution 1 : 200).
- Laver dans du PBS pendant 3 min, puis incuber les lames avec la peroxydase de raifort (HRP) dilué au 1 : 500-conjugué chèvre anti-lapin IgG (H + L) pendant 1 h à température ambiante.
- Incuber les lames de section ovarienne avec 3, 3'-Diaminobenzidine [DAB] pour détecter l’activité peroxydasique et Mont sur lames de verre avec support de montage aqueux.
- Observer les diapositives section ovaire au microscope au grossissement de X 400.
- Fixer le tissu ovarien dans 4 % paraformaldéhyde, incorporer à la paraffine, section à 5 µm-épaisseur et monter des coupes de tissus sur des lames. Déparaffinage les sections, réhydrater et eux en tampon citrate pendant 15 min. bloc incuber la peroxydase endogène en peroxyde d’hydrogène 3 % et démasquent l’antigène dans les 5 % de sérum de chèvre puis incuber avec des anticorps primaires à température ambiante pendant 3 h.
- Microscopie électronique à transmission [TEM]
- Difficulté des follicules au glutaraldéhyde à 2,5 % pendant 3 h à température ambiante, puis fixer à 1 % le tétroxyde d’osmium pendant 1 h à 37 ° C.
6. analyse statistique
- Présenter toutes les données au format moyenne ± SEM. Déterminer que les différences entre les groupes en analyse de variance (ANOVA) suivie de Tukey test de comparaison multiple. Le seuil α pour signification de résultat de test a été fixé à p < 0,05.
Résultats
Figure 1 a montre un RWV avec de l’huile à l’intérieur du navire. Une gouttelette de 150 µL de milieu contenant un morceau de tissu ovarien ou des billes d’alginate trois follicules encapsulé a été mises dans l’huile. Les gouttelettes moyennes a été maintenue dans un état de vitesse terminale en raison de la traînée fluide sur les gouttelettes dans l’huile rotative au taux de 25 rotations par minute, ce qui produit un état de microgravité simulée (s-µg). Dans une expérience de contrôle, les tissus ovariens ou follicules prédosées furent cultivées dans une gouttelette de 150 µL de milieu recouvert d’huile minérale dans 35 × 10 mm plats (Figure 1 b), qui a généré un 1 - condition deg .
Afin d’étudier les effets de la microgravité simulée sur preantral follicule développement in vitro, nous avons cultivé le tissu ovarien 14 jours souris sous 1 -g (expérience de contrôle) ou des conditions s-µg. Nous avons compté le nombre de follicules sains dans les H & E coupes dans deux conditions coloré après 0, 2 et 4 jours de culture (Figure 2). Nous avons constaté que la survie du follicule dans le tissu ovarien traité dans la s-µg condition était sensiblement inférieure à celui sous la 1 -g condition au jour 2 et 4 de culture (p < 0,05, ANOVA). En outre, nous avons ne constaté qu’aucun PCNA positive des signaux ont été détectées dans les tissus ovariens sous la condition deg s-µ (Figure 3). Dans la culture des follicules preantral isolés, encapsulé dans des billes d’alginate, nous a révélé que sensiblement plus de follicules a survécu sous 1 -g condition (76,8 % ± 5,3 %, n = 227) que s-µg condition (54,4 % ± 6,7 %, n = 249) jour 4 de la culture . En outre, taille de l’ovocyte n’eu aucune augmentation significative après 4 jours de culture, bien le follicule taille a augmenté considérablement dans les deux conditions de gravité (Figure 4). Toutefois, les follicules avec moins de 10 % des cellules mortes de la granulosa (Figure 5) étaient significativement plus faibles sous le 1 -g condition (81,5 ± 5 %, n = 10) que sous condition de s-µg (90 ± 8 %, n = 10) (p < 0,05).
Afin d’étudier les effets de la microgravité simulée sur la fonctionnalité de l’ovocyte, nous avons examiné l’expression du marqueur spécifique ovocyte GDF-9. Nous avons démontré que l’expression GDF-9 a été remarquablement diminuées dans le tissu ovarien s-µg condition (Figure 6). En outre, nous avons démontré fréquentes anomalies ultrastructurales des organites d’ovocytes dans les follicules encapsulés au jour 4, de la culture à condition s-µg (Figure 7).

Figure 1 : Le programme d’installation de s -µg et 1-g des conditions de culture. (A) s-µg a été créé par la rotation navire mur et garder les sujets de culture dans un état de constante chute libre au sein de l’huile mobile. (B) 1 A -g condition a été créée par mise en culture de tissu ovarien ou des follicules à la surface d’une boîte de Pétri recouvert d’huile minérale. La flèche indique une goutte de médium. Echelle = 1 cm. Ce chiffre a été modifié par Zhang et al. 17 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
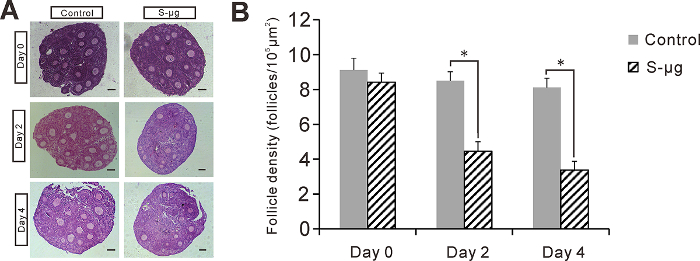
Figure 2 : Effets de s-µg sur la culture de tissus ovarien. (A) des Sections de tissu ovarien cultivées sous 1 -g ou s-µg conditions pour 0, 2 et 4 jours. Echelle = 50 µm. (B) follicule densité dans les sections de tissu ovarien. Erreur bar représente 1 SEM, * : p < 0,05. Ce chiffre a été modifié par Zhang et al. 17 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Immunohistochimie de PCNA. Expression de la protéine PCNA a été étudiée dans les cellules de la granulosa dans le tissu ovarien cultivées sous 1 -g ou s-µg conditions pour 0, 2 et 4 jours. Echelle = 50 µm. Ce chiffre a été modifié par Zhang et al. 17 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Des effets sur la culture des follicules preantral encapsulés dans des billes d’alginate de s-µg . (A) la morphologie des follicules preantral cultivées sous 1 -g ou s-µg conditions pendant 0 jours et 4 jours. Echelle = 50 follicule ovocyte diamètre de µm. (B) et (C) ont été comparés entre 1 g et s-µg conditions. Erreur bar représente 1 SEM, * : p < 0,05. Ce chiffre a été modifié par Zhang et al. 17 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Analyse de viabilité de cellules. Images représentatives ont été prises au microscope au grossissement de X 400. Le test utilise calcéine AM pour visualiser des cellules vivantes colorées en vert et EthD-1 pour visualiser les noyaux des cellules mortes colorées en rouge. (A) : un follicule avec granulosa direct de ~ 100 % (vert). (B) : un follicule avec les cellules de la granulosa direct (vert), ainsi que plus de 10 % de cellules mortes (rouge). Echelle = 50 µm.Ce chiffre a été modifié par Zhang et al. 17 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
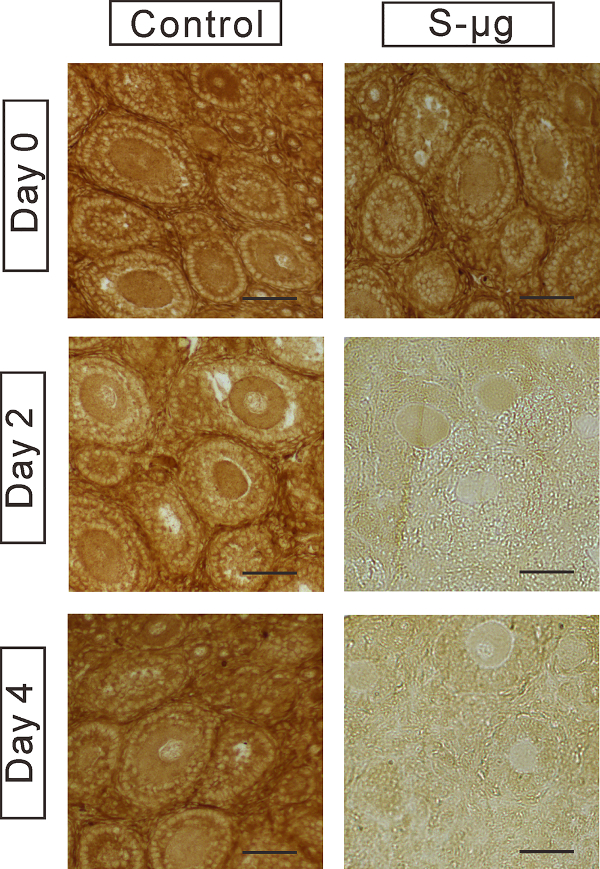
Figure 6 : Immunohistochimie de GDF-9. Expression de la protéine GDF-9 a été étudiée chez les ovocytes dans le tissu ovarien cultivées sous 1 -g ou s-µg conditions pour 0, 2 et 4 jours. Echelle = 50 µm. Ce chiffre a été modifié par Zhang et al. 17 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
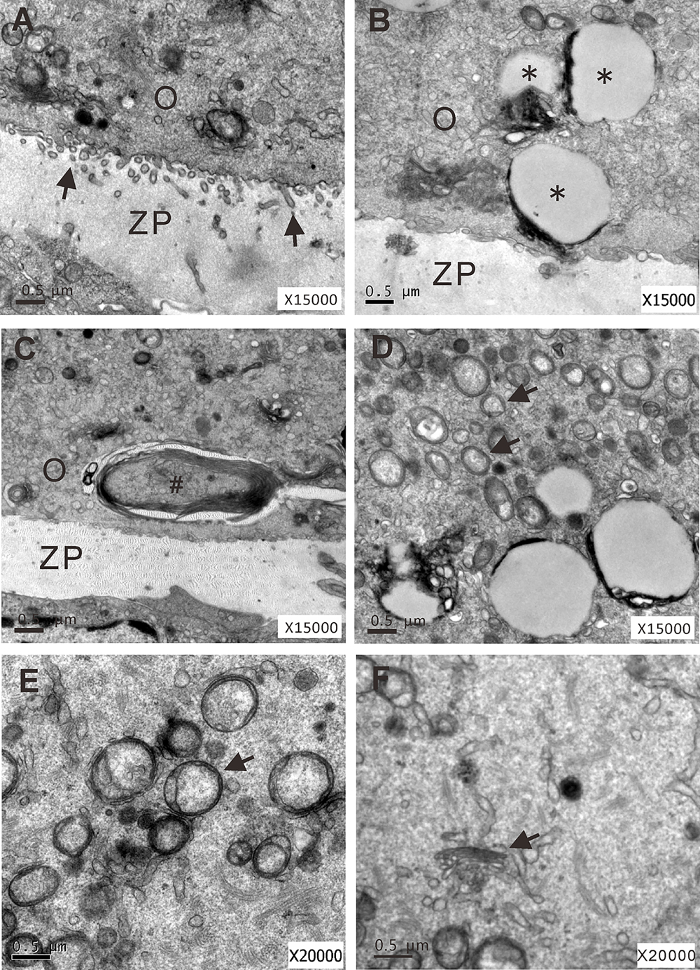
Figure 7 : Analyse ultrastructurale des follicules preantral isolées cultivées sous 1 - g ou s-µ g des conditions au jour 4, de la culture. (A) un ovocyte de microvillosités (flèches) qui s’étend dans la zone pellucide (1 -g condition). (B.-f.) Ovocytes avec grandes vacuoles (*), corps multilamellaires (#), des gouttelettes lipidiques (flèches), vacuolisées mitochondries dépourvues de crêtes (flèche) et disperser l’appareil de Golgi (flèche), respectivement (s-µg condition). O: ovocyte ; ZP : zone pellucide. Ce chiffre a été modifié par Zhang et al. 17 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Les étapes essentielles pour la culture réussie des follicules preantral sont : 1) sélectionnant correctement les follicules preantral selon les critères de sélection qui ont été décrites dans le protocole texte 2.1) ; 2) préformage toutes les procédures dans une condition sceptique et maintenir une culture stérile ; et 3) correctement mise en place le système de culture RWV.
La sauvegarde de la cohérence des observations expérimentales dans les expériences répétées consiste à utiliser des matériaux similaires ou identiques. Les critères de sélection des follicules preantral souris a révélé que les follicules étaient 1) ovocytes sains au stade de ventilation (GVBD) de la vésicule germinative entourée d’une mince zone pellucide ; 2) 2-3 couches de cellules de la granulosa entourées d’une membrane basale ; et 3) certaines cellules thécales attaché à la membrane basale. Ainsi, les follicules sélectionnés avaient non seulement tous les trois compartiments fonctionnels d’un follicule ovarien pour soutenir la croissance des ovocytes, mais aussi une identification morphologique similaire avec un diamètre de 90 à 100 µm.
Il s’agit de la première tentative d’augmenter les follicules preantral souris de la manière de la 3D, culture sous la microgravité simulée. Plusieurs systèmes de culture ont été développés pour les follicules preantral souris. Les ovocytes obtenus à partir du follicule cultivé sur une surface plane des boîtes de Pétri, la culture dite de 2D, pourraient être fécondés et produit une descendance direct. Par ailleurs, cultures 3D, telles que les cultures de follicules dans des billes d’alginate, maintiennent une structure de tissu semblable à ce que le corps produit en pourcentage élevé ovocytes méiose compétente. Toutefois, le processus de développement des follicules ovariens/ovocytes dans un champ de gravité zéro est inconnu. RWV, un dispositif qui attire une attention considérable en génie tissulaire, peut générer un environnement de microgravité simulée et fournissent un environnement idéal pour étudier les effets de la microgravité simulée sur la croissance du follicule ovarien/ovocytes in vitro.
Il est important de mettre en place l’appareil RWV correctement pour la culture cellulaire. Les bulles d’air dans le récipient doivent être enlevés. La méthode pour enlever les bulles d’air, si générés dans l’enceinte, est la suivante : placez deux seringues de 0,5 ml d’huile dans chacun des ports deux seringues. Ouvrez les valves contrôlant les ports de la seringue. Manoeuvrer des bulles d’air sous l’orifice de la seringue. Tirez sur les bulles dans la seringue tout en injectant environ le même volume de médias par le biais de l’autre port de la seringue. Après que toutes les bulles sont enlevés, fermer les robinets, enlever les seringues et replacer les couvercles de port de seringue. Il est également essentiel pour savoir la vitesse de rotation correcte, ce qui empêche les cellules de décantation via une rotation constante. Optimisation de la vitesse de rotation est déterminée par le poids spécifique des cellules, la densité du fluide et la viscosité.
Les profils d’expression PCNA, GDF-9, qui ressemblaient à celles de GDF-9-deficient souris follicules16, a révélé que microgravité simulée a eu des effets néfastes sur le développement des cellules de la granulosa et des ovocytes. Le navire d’un appareil RWV filé autour d’un axe horizontal à l’intérieur d’une étuve 5 % de CO2 , permettant la pénétration d’oxygène et de dioxyde de carbone à travers une membrane dans le dos, fournissant l’oxygénation efficace et très basse tension de cisaillement, qui avait peu de chances d’être le cause du traumatisme du follicule/ovocyte. Optimisation du montage expérimental et des analyses supplémentaires sont nécessaires pour étudier le mécanisme des effets préjudiciables.
D’autres études sont nécessaires pour étudier le potentiel de développement des ovocytes in vitro provenant du système de culture RWV. In vitro la maturation des ovocytes au stade de la MII est actuellement menée. La validation finale de ce système de culture est examinée par la capacité de fécondation des ovocytes récupérées.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrentes.
Remerciements
Les auteurs aimeraient remercier Yilong Wang et Yanlin Zhao pour leur aide à maintenir les animaux, Chan Zhang pour son aide dans la préparation des échantillons histologiques et Dr Songtao He pour la lecture critique de ce manuscrit. Ce travail a été soutenu par la Fondation sciences naturelles de la Province du Zhejiang (numéro de licence : LY13C120002).
matériels
| Name | Company | Catalog Number | Comments |
| ICR mice | SLRC Laoratory | 14-day-old female mice | |
| L-15 medium | Sigma | L1518 | With L-glutamine, liquid, sterile-filtered, suitable for cell culture |
| fetal bovine serum | Gibco | 10100147 | Origin: Australia |
| Penicillin V potassium | Sigma | 1504503 | United States Pharmacopeia (USP) Reference Standard (USP) |
| Streptomycin sesquisulfate hydrate | Sigma | 46754 | Analytical standard |
| Universal Click Pen Needles | Penfine | 12×1/2" 0.33×12 mm | |
| Alginate | Sigma | W201502 | |
| alpha-minimal essential medium | Sigma | M0894 | Alpha Modification, with L-glutamine, without ribonucleosides, deoxyribonucleosides and sodium bicarbonate, powder, suitable for cell culture |
| Insulin-selenium-transferrin | Invitrogen | 51500056 | Liquid, sterile-filtered, BioReagent, suitable for cell culture |
| GONAL-F | Merck Serono | Recombinant follitropin alfa for injection | |
| Disposable high-aspect-ratio rotating vessel | Synthecon | 10 mL | |
| Culture oil | Vitrolife | Sterile light paraffin oil | |
| Alginate Lyase | Sigma | A1603 | powder, >10,000 units/g solid |
| 26 1/2-guage needle | Becton Dickinson | ||
| 35×10mm dish | Becton Dickinson | ||
| Viability/Cytotoxicity assay Kit | Invitrogen | L3224 | |
| Bouin’s solution | Sigma | HT10132 | |
| Horseradish peroxidase (HRP)-conjugated goat anti-rabbit IgG (H+L) | Jackson Immuno-Research Laboratories | 111-035-003 | |
| 3,3N-Diaminobenzidine Tertrahydrochloride | Beyotime | P0203 | |
| Aqueous mounting medium | Dako | C0563 | |
| Rabbit anti-GDF-9 antibody | Beijing Biosynthesis Biotechnology | BS-175R | |
| Rabbit anti-PCNA antibody | Proteintech | 24036-1-AP | |
| Methylene blue | Sigma | M9140 | |
| Transmission electron microscope | Hitachi | H-7500 |
Références
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biol Reprod. 41, 268-276 (1989).
- O'Brien, M. J., Pendola, J. K., Eppig, J. J. A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol Reprod. 68, 1682-1686 (2003).
- Liu, J., Van der Elst, J., Van den Broecke, R., Dhont, M. Live offspring by in vitro fertilization of oocytes from cryopreserved primordial mouse follicles after sequential in vivo transplantation and in vitro maturation. Biology of Reproduction. 64, 171-178 (2001).
- Parrish, E. M., Siletz, A., Xu, M., Woodruff, T. K., Shea, L. D. Gene expression in mouse ovarian follicle development in vivo versus an ex vivo alginate culture system. Reproduction. 142, 309-318 (2011).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12, 2739-2746 (2006).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75, 916-923 (2006).
- Grimm, D., et al. Growing tissues in real and simulated microgravity: new methods for tissue engineering. Tissue engineering. Part B, Reviews. 20, 555-566 (2014).
- Grimm, D., et al. Different responsiveness of endothelial cells to vascular endothelial growth factor and basic fibroblast growth factor added to culture media under gravity and simulated microgravity. Tissue engineering Part A. 16, 1559-1573 (2010).
- Grimm, D., et al. A delayed type of three-dimensional growth of human endothelial cells under simulated weightlessness. Tissue engineering. Part A. 15, 2267-2275 (2009).
- Pietsch, J., et al. Interaction of proteins identified in human thyroid cells. International journal of molecular sciences. 14, 1164-1178 (2013).
- Yu, B., et al. Simulated microgravity using a rotary cell culture system promotes chondrogenesis of human adipose-derived mesenchymal stem cells via the p38 MAPK pathway. Biochem Biophys Res Commun. 414, 412-418 (2011).
- Maier, J. A., Cialdai, F., Monici, M., Morbidelli, L. The impact of microgravity and hypergravity on endothelial cells. Biomed Res Int. 2015, 434803(2015).
- Zhu, M., Jin, X. W., Wu, B. Y., Nie, J. L., Li, Y. H. Effects of simulated weightlessness on cellular morphology and biological characteristics of cell lines SGC-7901 and HFE-145. Genet Mol Res. 13, 6060-6069 (2014).
- Dang, B., et al. Simulated microgravity increases heavy ion radiation-induced apoptosis in human B lymphoblasts. Life Sci. 97, 123-128 (2014).
- Wu, C., et al. Simulated microgravity compromises mouse oocyte maturation by disrupting meiotic spindle organization and inducing cytoplasmic blebbing. PLoS One. 6, e22214(2011).
- Dong, J., et al. Growth differentiation factor-9 is required during early ovarian folliculogenesis. Nature. 383, 531-535 (1996).
- Zhang, S., et al. Simulated Microgravity Using a Rotary Culture System Compromises the In Vitro Development of Mouse Preantral Follicles. PLoS One. 11, e0151062(2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon