Method Article
In Vitro Crecimiento de los folículos Preantral ratón bajo microgravedad simulada
En este artículo
Resumen
Una técnica muy prometedora para generar tejido construye sin utilizar la matriz es a células en cultivo en condiciones de microgravedad simulada. Usando un sistema de cultivo rotatorio, examinamos crecimiento del folículo ovárico y la maduración de ovocitos en términos de supervivencia del folículo, morfología, crecimiento y función de ovocitos bajo la condición de microgravedad simulada.
Resumen
14 tejido ovárico día ratón y preantral folículos aislados de ratones de la misma edad fueron incubados en un sistema de cultivo de microgravedad simulada. Cuantitativa evaluaron la supervivencia folicular, folículo mide y diámetros de ovocitos y examinó la ultraestructura de los ovocitos producidos a partir del sistema. Se observó supervivencia disminuida del folículo, downregulation de las expresiones de la proliferación celular antígeno nuclear y factor de diferenciación de crecimiento 9, como indicadores para el desarrollo de células de la granulosa y de oocitos, respectivamente y ultraestructurales de ovocitos anormalidades con la condición de microgravedad simulada. La configuración experimental de microgravedad simulada debe optimizarse para proporcionar un modelo para la investigación de los mecanismos implicados en el desarrollo del ovocito/folicular en vitro .
Introducción
In vitro el desarrollo de folículo ovárico y la maduración de ovocitos se han logrado con métodos tradicionales de la cultura 2-dimensional, como en la superficie de placas de Petri y de tres dimensiones (3D) matriz como alginato e hidrogel1 ,2,3. Un sistema de cultivo 3D efectivamente mantiene los folículos en una estructura de tejido mantiene los perfiles de expresión génica similar como en vivo4 folículos y produce ovocitos competentes meiotically5,6. Sistemas de cultivo 3D también pueden establecerse en un estado libre de matriz, por ejemplo, colgante gota suspensión y balanceo de los buques. El buque de pared giratorio (RWV) desarrollado por la National Aeronautics and Space Administration (NASA) genera una microgravedad simulada (s-μg) para las células cultivadas dentro de la nave7. Este microgravedad simulada condición proporciona un sistema de cultura única de proliferación y diferenciación celular debido a la falta de sedimentación para la convección. Se ha demostrado que microgravedad simulada promueve formación de vasos endotelial de las células endoteliales8,9, montaje de tiroides células10y condrogénesis de adiposo deriva del tejido de la tiroides células madre mesenquimales en RWV dispositivos11. Sin embargo, otros estudios han demostrado que la microgravedad simulada indujo apoptosis en las células gástricas y simulado de B linfoblastos12,13,14, sugiriendo los efectos de la microgravedad en el daño celular puede ser la célula depende del tipo. Microgravedad simulada también puede causar cambios en el nivel ultraestructural, como se informó en la organización del huso perturbado e inducida por blebbing citoplásmico en ovocitos15. Las condiciones de microgravedad simulada optimizado y los mecanismos que inducen lesiones en tejido celular o Ingeniería bajo el sistema requieren una investigación adicional. In vitro los experimentos de crecimiento de los folículos ováricos/ovocitos utilizando dispositivos RWV pueden proporcionar información valiosa sobre expresiones del gene de ovocitos y ultraestructuras de organelos de ovocitos. En este estudio, el tejido ovárico que contiene los folículos preantral y aislados folículos preantral se utilizó para investigar los efectos de la microgravedad simuladasobre maduración desarrollo y ovocitos del folículo.
En este estudio, el tejido ovárico que contiene los folículos preantral y aislados folículos preantral fueron utilizados para investigar los efectos de la microgravedad simulada en maduración desarrollo y ovocitos de los folículos. En nuestro estudio, el RWV, un dispositivo de microgravedad simulada, gira alrededor de un eje horizontal dentro de una incubadora de 5% CO2 , proporcionando un estado de microgravedad simulada con oxigenación eficiente y muy baja tensión de esquileo. Hemos analizado las expresiones del gene del antígeno nuclear de proliferación celular (PCNA) y factor de crecimiento diferenciación 9 (GDF-9) como indicadores para el desarrollo de células de la granulosa y de oocitos, respectivamente. Hemos demostrado que PCNA y GDF-9 expresiones fueron suprimidas en las células de la granulosa y los ovocitos, respectivamente, cuando se cultivan en el dispositivo RWV, y mostramos la retirada de las microvellosidades del ovocito de la zona pelúcida en los folículos cultivados bajo el μ s g condición, que era similar a la de GDF-9-deficientes de los folículos de ratón16.
Protocolo
Aprobación ética para este estudio se obtuvo de la Animal investigación ética Comité de Wen Zhou Facultad de medicina.
1. preparación de medios de cultivo y alginato hidrogel
- Preparar el tejido ovárico y manipulación del folículo medio usando L-15 medio con 10% suero fetal bovino, penicilina 100 UI/mL y 100 de μg/mL estreptomicina. Almacenar a 4 ° C durante dos semanas.
- Preparación de tejido ovárico y folículo medio de cultivo que consiste en un medio esencial mínimo alfa [α-MEM] suplementado con 5% de suero bovino fetal [SBF], 1% insulina-selenio-transferrina 10 rFSH mUI/ml, 100 UI/mL de penicilina y estreptomicina 100 μg/mL. Almacenar a 4 ° C durante dos semanas.
- Preparar el alginato hidrogel con solución de alginato de sodio 0.8% (p/v) en PBS estéril, luego coloque 10 μl de esta solución en la solución de la encapsulación (140 mM NaCl 50 mM CaCl2) para crear perlas de alginato.
Nota: El tamaño de grano de alginato fue unos 3 mm de diámetro.
2. aislamiento del folículo y encapsulación del ratón
- Sacrificar ratones hembra de 14 días de edad ICR por dislocación cervical, ovarios quitar asépticamente usando tijeras y pinzas y los ovarios en 2 mL de medio de manipulación.
- Corte los ovarios a la mitad con un bisturí. El tejido ovárico tamaño medio fue de 1 mm de espesor para la cultura en el medio de cultivo.
- Manualmente aislar los folículos de los ovarios con agujas calibre 26 1/2 bajo un estereomicroscopio de X 2-4 y recoger los folículos seleccionados para la cultura en el medio de cultivo.
Nota: Criterios de selección folículo: 1) folículos eran redondos con los ovocitos en el medio y 2-3 capas de células de la granulosa que rodean los ovocitos, 2) folículos tenían una membrana basal intacta con algunas células de la teca y tamaño del folículo 3) 90-100 μm de diámetro - Crear perlas de alginato por paso 1.3. Lave los folículos con solución de alginato y luego pipetear un solo folículo en el centro de cada grano de alginato para asegurarse de que cada grano contiene un folículo único bajo un estereomicroscopio. Después de aclarar en medio de cultivo, cultura el alginato granos en 150 μL de medio de cultivo en un 35 × 10 mm cultura plato o un dispositivo RWV.
3. tejido ovárico o folículo cultura bajo microgravedad simulada
- Usar un dispositivo RWV para generar microgravedad simulada. Llene el recipiente con aceite de parafina luz (~ 10 mL), colocar 150 μL de medio de cultivo en una gota en el aceite, luego transferir una pieza de tejido ovárico o tres gránulos de alginato con folículos encapsulados a la gota mediana. Cerrar el tapón del recipiente y arreglar la nave en la base giratoria del aparato.
- En el control de grupos, colocar perlas de alginato conteniendo folículos o tejido ovárico en 150 μL de medio de cultivo en una gota de cubiertas con aceite de parafina luz de 35 × 10 platos de cultura mm.
- Incubar los platos de la cultura y dispositivo RWV en un incubador humedecido a 37 ° C con 5% CO2 en aire.
- Para cambiar de medio de cultivo en dispositivo RWV: Vierta el aceite y el medio de la nave en un 150 × 20 mm cultura, transferir las cuentas tejido o alginato de ovario a una placa de cultivo con medio de cultivo. Volver a establecer el sistema de cultivo del buque por el paso 3.1.
4. desencapsulación y recuperación del folículo
- Después de 4 días de cultivo, vierta el aceite y el medio de la nave en un 150 × 20 mm cultura. Recoger perlas de alginato y desencapsulan los folículos de los gránulos de alginato por incubar en el manejo de medio suplementado con 10 liasa de alginato U/mL durante 30 min a 37 ° C.
- Recoger los folículos y luego lavarlos en el manejo de medio bajo un estereomicroscopio.
5. evaluación del folículo y tejido ovárico
- Análisis de viabilidad de la célula
- Lavar los folículos decapsulated tres veces en D-PBS y entonces les Incube en 150 μL de los reactivos de ensayo de viabilidad celular combinados (calceína AM de 2 μm y 4 μm EthD-1) a temperatura ambiente durante 45 minutos.
- Transferencia de los folículos a un portaobjetos limpio con 10 μl D-PBS, cubrir con un cubreobjetos y luego sellar con esmalte de uñas claro.
- Cuenta verde y rojo las células en el portaobjetos en un microscopio de fluorescencia confocal (400 X).
Nota: En este análisis de viabilidad, verdes células son células vivas, y glóbulos rojos son células muertas. Folículos con menos de 10% eritrocitos (muertos) son considerados como folículos sobrevividos.
- Hematoxilina y eosina (H & E) tinción de tejido ovárico y folículos
- Arreglo dulce ratón de 14 días de edad los ovarios y folículos preantral aislados de ratones de 14 días de edad en solución de Bouin como muestras del día 0. Fijar el tejido ovárico cultivado después de 2 días o 4 días de la cultura y los folículos individuales dentro de los gránulos de alginato después de 4 días la cultura como muestras experimentales.
- Incrustar todas las muestras en parafina, sección en serie a 5 μm de grosor y luego la mancha con H & E acuerdo con las instrucciones del fabricante.
- Folículo de conteo y medición de diámetro
- En el tejido ovárico secciones teñidas con H & E, contar todos los folículos y los folículos preantral saludables dentro del área de la sección de tejido bajo un microscopio (magnificación 400 X). Calcular la densidad de folículos dividiendo el número de folículos preantral por el número total de folículos.
Nota: los folículos sanos preantral son aquellos con al menos dos capas de células de la granulosa. - Medir el diámetro del folículo y el ovocito de los folículos de día 0 y día 4 cultiva folículos.
- En el tejido ovárico secciones teñidas con H & E, contar todos los folículos y los folículos preantral saludables dentro del área de la sección de tejido bajo un microscopio (magnificación 400 X). Calcular la densidad de folículos dividiendo el número de folículos preantral por el número total de folículos.
- Immunohistochemistry
- Fijar el tejido ovárico en paraformaldehído al 4%, incrustar en parafina, sección de 5 μm de grosor y montar las secciones de tejido en las diapositivas. Dewax las secciones, rehidratar, incubar en tampón de citrato para bloque de 15 minutos la peroxidasa endógena en peróxido de hidrógeno 3%, desenmascarar antígenos en 5% de suero de cabra y luego incubar con anticuerpos primarios a temperatura ambiente durante 3 horas.
- Lavado en PBS durante 3 minutos, luego incubar los portaobjetos con 1: 500 diluido con peroxidasa de rábano (HRP)-conjugado anti-conejo de cabra IgG (H+L) por 1 h a temperatura ambiente.
Nota: Los anticuerpos primarios utilizados en el estudio eran anticuerpos anti-GDF-9 (dilución 1: 500) y anticuerpos anti-PCNA (dilución 1: 200).
- Lavado en PBS durante 3 minutos, luego incubar los portaobjetos con 1: 500 diluido con peroxidasa de rábano (HRP)-conjugado anti-conejo de cabra IgG (H+L) por 1 h a temperatura ambiente.
- Incube los portaobjetos sección ovárica con 3, 3'-diaminobenzidina [DAB] para detectar la actividad de la peroxidasa y montaje en portaobjetos de vidrio con medio de montaje acuoso.
- Observar diapositivas de la sección ovárica bajo un microscopio a 400 aumentos.
- Fijar el tejido ovárico en paraformaldehído al 4%, incrustar en parafina, sección de 5 μm de grosor y montar las secciones de tejido en las diapositivas. Dewax las secciones, rehidratar, incubar en tampón de citrato para bloque de 15 minutos la peroxidasa endógena en peróxido de hidrógeno 3%, desenmascarar antígenos en 5% de suero de cabra y luego incubar con anticuerpos primarios a temperatura ambiente durante 3 horas.
- Microscopía electrónica de transmisión [TEM]
- Fijar los folículos en glutaraldehído al 2.5% durante 3 horas a temperatura ambiente y después fijar en tetraóxido de osmio 1% durante 1 h a 37 ° C.
6. estadístico análisis
- Presentar todos los datos en formato de media ± SEM. Determinar que las diferencias entre grupos por análisis unidireccional de varianza (ANOVA) seguido de Tukey, prueba de comparación múltiple. El umbral α para el significado de resultado de prueba fue fijado en p < 0.05.
Resultados
Figura 1A muestra un RWV con aceite dentro de la nave. Una gota de 150 μL de medio conteniendo una pieza de tejido ovárico o tres gránulos de alginato con folículos encapsulados se puso en el aceite. La gota mediana se mantuvo en un estado de velocidad terminal debido a la fricción fluida en las gotitas de aceite rota a velocidad de 25 revoluciones por minuto, lo que genera una condición de microgravedad simulada (s-μg). En un experimento de control, tejido ovárico o encapsulados folículos fueron cultivados en una gota de 150 μL de medio cubiertas con aceite mineral en 35 × 10 mm platos (figura 1B), que generan 1g condición.
Para estudiar los efectos de la microgravedad simulada en el desarrollo del folículo preantral en vitro, cultiva el tejido ovárico de 14 días de edad del ratón bajo 1 -g (experimento de control) o s-μg condiciones. Contamos el número de folículos sanos en la H & E manchado secciones en dos condiciones después de 0, 2 y 4 días de cultivo (figura 2). Se encontró que la supervivencia del folículo en tejido ovárico en la condición de s μg fue significativamente más baja que el bajo 1 -g condición en día 2 y 4 de cultivo (p < 0.05, ANOVA). Por otra parte, no encontramos que PCNA positiva señales fueron detectadas en el tejido ovárico bajo la condición deg μ s (figura 3). En la cultura de aislados folículos preantral encapsulada en gránulos de alginato, reveló que significativamente más folículos sobrevivieron bajo 1 -g condición (76,8% ± 5,3%, n = 227) que s μg condición (54.4% ± 6.7%, n = 249) el día 4 de cultivo . Además, tamaño de ovocitos no tuvo ningún aumento significativo después de 4 días de cultivo, aunque el folículo tamaño aumentó significativamente en ambas condiciones de gravedad (figura 4). Sin embargo, los folículos con células de granulosa muertos de menos de 10% (figura 5) fueron significativamente inferiores en el 1 -g condición (81,5 ± 5%, n = 10) que s μg condiciones (90 ± 8%, n = 10) (p < 0.05).
Para investigar los efectos de la microgravedad simulada en la funcionalidad de ovocitos, examinamos la expresión del marcador específico de ovocitos GDF-9. Hemos demostrado que GDF-9 expresión era notable regula en el tejido ovárico s μg condiciones (figura 6). Además, hemos demostrado frecuentes anormalidades ultraestructurales de organelos de ovocitos en los folículos encapsulados en el día 4 de cultura bajo la condición deg s μ (figura 7).

Figura 1 : Configuración de s -μg y 1-g condiciones de la cultura. (A) s μg fue creada por la rotación buque de pared y mantener los temas de cultura en un estado de constante caída libre en el aceite moviendo. (B) A 1 -g condición fue creado por cultivo de tejido ovárico o folículos en la superficie de una placa de Petri cubierta con aceite mineral. La flecha indica una gota del medio. Barra de escala = 1 cm. Esta figura ha sido modificada de Zhang et al. 17 haga clic aquí para ver una versión más grande de esta figura.
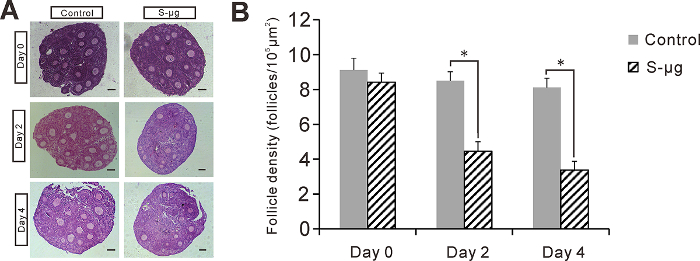
Figura 2 : Efectos de la s-μg en la cultura de tejido ovárica. (A) las secciones de tejido ovárico cultivadas bajo 1 -g o s μg condiciones de 0, 2 y 4 días. Barra de escala = 50 μm. (B) densidad del folículo en las secciones de tejido ovárico. Error de la barra representa 1 SEM, *: p < 0.05. Esta figura ha sido modificada de Zhang et al. 17 haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Inmunohistoquímica de PCNA. Expresión de la proteína PCNA fue examinada en las células de la granulosa en el tejido ovárico cultivadas bajo 1 -g o s μg condiciones de 0, 2 y 4 días. Barra de escala = 50 μm. Esta figura ha sido modificada de Zhang et al. 17 haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Efectos de la s μg en la cultura de los folículos preantral encapsuladas en gránulos de alginato. (A) morfología de preantral folículos cultivados bajo 1 -g o s μg condiciones de 0 días y 4 días. Barra de escala = 50 μm. (B) diámetro del ovocito y (C) diámetro de folículo se compararon entre 1 g y s μg . Error de la barra representa 1 SEM, *: p < 0.05. Esta figura ha sido modificada de Zhang et al. 17 haga clic aquí para ver una versión más grande de esta figura.

Figura 5 : Ensayo de viabilidad celular. Se tomaron imágenes representativas bajo un microscopio a 400 aumentos. El ensayo utiliza calceína AM para visualizar células vivas teñidas en verde y EthD-1 para visualizar los núcleos de las células muertas teñidas en rojo. (A): un folículo con células de la granulosa vivo ~ 100% (verde). (B): un folículo con células de la granulosa vivo (verde), así como más de 10% de células muertas (rojo). Barra de escala = 50 μm.Esta figura ha sido modificada de Zhang et al. 17 haga clic aquí para ver una versión más grande de esta figura.
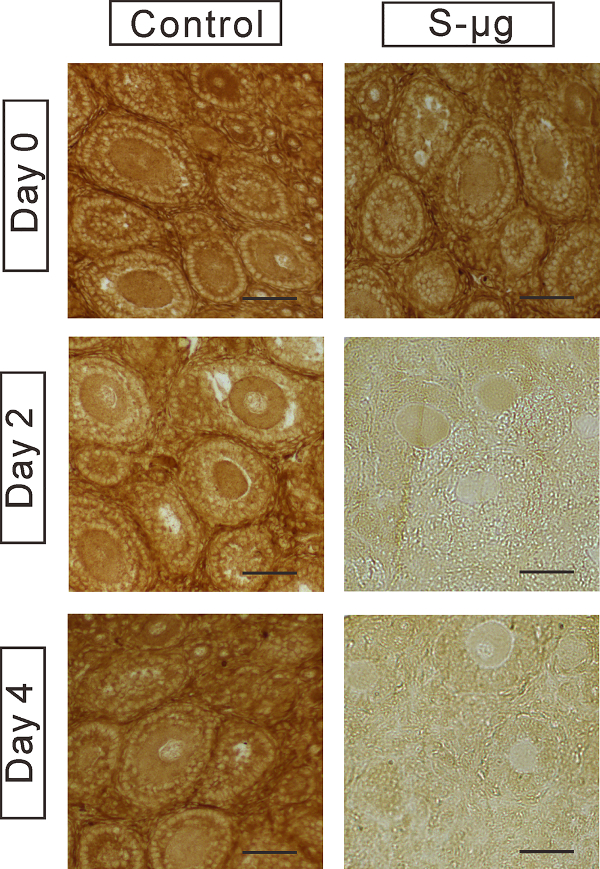
Figura 6 : Immunohistochemistry del GDF-9. Expresión de la proteína GDF-9 fue examinada en los ovocitos en el tejido ovárico cultivadas bajo 1 -g o s μg condiciones de 0, 2 y 4 días. Barra de escala = 50 μm. Esta figura ha sido modificada de Zhang et al. 17 haga clic aquí para ver una versión más grande de esta figura.
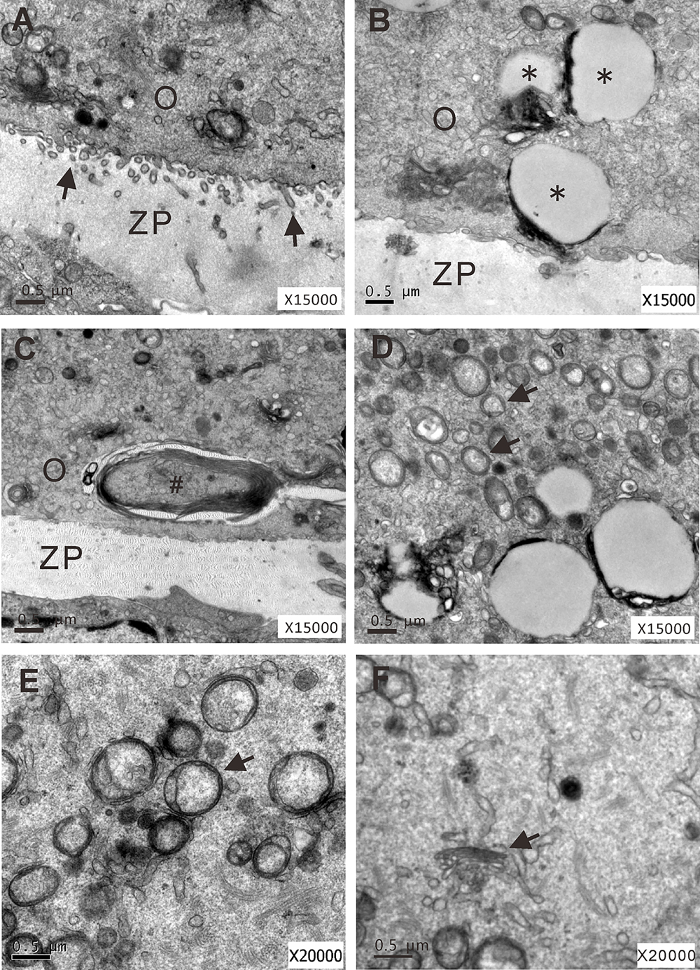
Figura 7 : Análisis ultraestructural de aislados folículos preantral cultivadas bajo 1 - g o μ s g condiciones en el día 4 de cultura. (A) un ovocito con microvellosidades (flechas) que se extiende en la zona pelúcida (1 -g condición). (B-F) Ovocitos con grandes vacuolas (*), cuerpos multilamellar (#), gotitas de lípidos (flechas), vacuolated las mitocondrias falta cristae (flecha) y la dispersión de aparato de Golgi (flecha), respectivamente (s-μg condición). O: ovocito; ZP: zona pelúcida. Esta figura ha sido modificada de Zhang et al. 17 haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los pasos críticos para el cultivo exitoso de folículos preantral son: 1) seleccionar correctamente los folículos preantral según los criterios de selección que se describen en el protocolo de texto 2.1); 2) todos los procedimientos en una condición escéptica de la preforma y el mantenimiento de una cultura estéril; y 3) configurar correctamente el sistema de cultivo RWV.
La salvaguardia de la consistencia de las observaciones experimentales en los experimentos de replicación es utilizar materiales similares o idénticos. Los criterios para la selección de folículos preantral ratón revelaron que los folículos tenían 1) ovocitos sanos en la etapa de descomposición (GVBD) vesícula germinal rodeada por una delgada zona pelúcida; 2) 2-3 capas de células de la granulosa encerradas por una membrana basal; y 3) algunas células tecal unida a la membrana basal. Así, los folículos seleccionados no sólo todos tenían tres compartimentos funcionales de un folículo ovárico para apoyar el crecimiento del ovocito, sino también una identificación morfológica similar con un diámetro de 90-100 μm.
Este es el primer intento de crecer los folículos preantral ratón en la forma de cultivo bajo la microgravedad simulada en 3D. Se han desarrollado varios sistemas de cultivo para preantral folículos de ratón. Ovocitos de folículos cultivados en una superficie plana de Petri, la llamada cultura 2D, podrían ser fertilizados y producen descendencia viva. Por otra parte, las culturas 3D, como las culturas de los folículos en gránulos de alginato, mantienen una estructura de tejido similar a lo que el cuerpo produce en alto porcentaje de ovocitos meiotically competente. Sin embargo, se desconoce el proceso de desarrollo de los folículos ováricos/ovocitos en un campo de gravedad cero. RWV, un dispositivo que está atrayendo considerable atención en ingeniería de tejidos, puede generar un ambiente de microgravedad simulada y proporcionan un entorno ideal para investigar los efectos de la microgravedad simulada sobre el crecimiento del folículo ovárico/ovocitos en vitro.
Es importante establecer el aparato RWV correctamente para el cultivo celular. Deben eliminarse las burbujas de aire en el recipiente. El método para quitar burbujas de aire, si genera en el vaso, es como sigue: Coloque dos jeringas con 0.5 mL de aceite en cada uno de los puertos de dos jeringas. Abra las válvulas de control de los puertos de la jeringa. Maniobre las burbujas de aire debajo del puerto de la jeringa. Tire las burbujas en la jeringa durante aproximadamente el mismo volumen de medios a través de otro puerto de la jeringuilla de inyección. Después se eliminan todas las burbujas, cierre las válvulas, retire las jeringas y reemplazar las tapas de puerto de la jeringa. También es importante averiguar la velocidad de rotación correcta, lo que impide que las células colocar mediante una rotación constante. Optimización de la velocidad de rotación se determina por el peso específico de las células, la densidad del fluido y la viscosidad.
Los perfiles de expresión de PCNA y GDF-9, que eran similares a las de los folículos de ratón GDF-9-deficiente16, revelaron esa microgravedad simulada tenía efectos perjudiciales sobre el desarrollo de células de la granulosa y de oocitos. El recipiente del aparato RWV hecha girar alrededor de un eje horizontal dentro de una incubadora 5% CO2 , permitiendo permeabilidad de oxígeno y dióxido de carbono a través de una membrana en la parte trasera, proporcionando oxigenación eficiente y muy baja tensión de esquileo, que era poco probable que sea la causa de la lesión del folículo/ovocitos. Optimización del montaje experimental y otros análisis son necesarios para investigar el mecanismo de los efectos perjudiciales.
Se necesitan estudios adicionales para investigar el potencial del desarrollo de los ovocitos en vitro derivado del sistema de cultura RWV. Maduración in vitro de ovocitos a etapa MII actualmente lleva a cabo. La validación final de este sistema de cultivo se examinarán por la capacidad de fertilización de los ovocitos obtenidos.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
Los autores desean agradecer a Yilong Wang y Yanlin Zhao por su ayuda en el mantenimiento de los animales, Chan Zhang para su asistencia en la preparación de las muestras histológicas y Dr. Songtao He para la lectura crítica de este manuscrito. Este trabajo fue financiado por la Fundación de Ciencias naturales de la provincia de Zhejiang (número: LY13C120002).
Materiales
| Name | Company | Catalog Number | Comments |
| ICR mice | SLRC Laoratory | 14-day-old female mice | |
| L-15 medium | Sigma | L1518 | With L-glutamine, liquid, sterile-filtered, suitable for cell culture |
| fetal bovine serum | Gibco | 10100147 | Origin: Australia |
| Penicillin V potassium | Sigma | 1504503 | United States Pharmacopeia (USP) Reference Standard (USP) |
| Streptomycin sesquisulfate hydrate | Sigma | 46754 | Analytical standard |
| Universal Click Pen Needles | Penfine | 12×1/2" 0.33×12 mm | |
| Alginate | Sigma | W201502 | |
| alpha-minimal essential medium | Sigma | M0894 | Alpha Modification, with L-glutamine, without ribonucleosides, deoxyribonucleosides and sodium bicarbonate, powder, suitable for cell culture |
| Insulin-selenium-transferrin | Invitrogen | 51500056 | Liquid, sterile-filtered, BioReagent, suitable for cell culture |
| GONAL-F | Merck Serono | Recombinant follitropin alfa for injection | |
| Disposable high-aspect-ratio rotating vessel | Synthecon | 10 mL | |
| Culture oil | Vitrolife | Sterile light paraffin oil | |
| Alginate Lyase | Sigma | A1603 | powder, >10,000 units/g solid |
| 26 1/2-guage needle | Becton Dickinson | ||
| 35×10mm dish | Becton Dickinson | ||
| Viability/Cytotoxicity assay Kit | Invitrogen | L3224 | |
| Bouin’s solution | Sigma | HT10132 | |
| Horseradish peroxidase (HRP)-conjugated goat anti-rabbit IgG (H+L) | Jackson Immuno-Research Laboratories | 111-035-003 | |
| 3,3N-Diaminobenzidine Tertrahydrochloride | Beyotime | P0203 | |
| Aqueous mounting medium | Dako | C0563 | |
| Rabbit anti-GDF-9 antibody | Beijing Biosynthesis Biotechnology | BS-175R | |
| Rabbit anti-PCNA antibody | Proteintech | 24036-1-AP | |
| Methylene blue | Sigma | M9140 | |
| Transmission electron microscope | Hitachi | H-7500 |
Referencias
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biol Reprod. 41, 268-276 (1989).
- O'Brien, M. J., Pendola, J. K., Eppig, J. J. A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol Reprod. 68, 1682-1686 (2003).
- Liu, J., Van der Elst, J., Van den Broecke, R., Dhont, M. Live offspring by in vitro fertilization of oocytes from cryopreserved primordial mouse follicles after sequential in vivo transplantation and in vitro maturation. Biology of Reproduction. 64, 171-178 (2001).
- Parrish, E. M., Siletz, A., Xu, M., Woodruff, T. K., Shea, L. D. Gene expression in mouse ovarian follicle development in vivo versus an ex vivo alginate culture system. Reproduction. 142, 309-318 (2011).
- Xu, M., Kreeger, P. K., Shea, L. D., Woodruff, T. K. Tissue-engineered follicles produce live, fertile offspring. Tissue Eng. 12, 2739-2746 (2006).
- Xu, M., West, E., Shea, L. D., Woodruff, T. K. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod. 75, 916-923 (2006).
- Grimm, D., et al. Growing tissues in real and simulated microgravity: new methods for tissue engineering. Tissue engineering. Part B, Reviews. 20, 555-566 (2014).
- Grimm, D., et al. Different responsiveness of endothelial cells to vascular endothelial growth factor and basic fibroblast growth factor added to culture media under gravity and simulated microgravity. Tissue engineering Part A. 16, 1559-1573 (2010).
- Grimm, D., et al. A delayed type of three-dimensional growth of human endothelial cells under simulated weightlessness. Tissue engineering. Part A. 15, 2267-2275 (2009).
- Pietsch, J., et al. Interaction of proteins identified in human thyroid cells. International journal of molecular sciences. 14, 1164-1178 (2013).
- Yu, B., et al. Simulated microgravity using a rotary cell culture system promotes chondrogenesis of human adipose-derived mesenchymal stem cells via the p38 MAPK pathway. Biochem Biophys Res Commun. 414, 412-418 (2011).
- Maier, J. A., Cialdai, F., Monici, M., Morbidelli, L. The impact of microgravity and hypergravity on endothelial cells. Biomed Res Int. 2015, 434803(2015).
- Zhu, M., Jin, X. W., Wu, B. Y., Nie, J. L., Li, Y. H. Effects of simulated weightlessness on cellular morphology and biological characteristics of cell lines SGC-7901 and HFE-145. Genet Mol Res. 13, 6060-6069 (2014).
- Dang, B., et al. Simulated microgravity increases heavy ion radiation-induced apoptosis in human B lymphoblasts. Life Sci. 97, 123-128 (2014).
- Wu, C., et al. Simulated microgravity compromises mouse oocyte maturation by disrupting meiotic spindle organization and inducing cytoplasmic blebbing. PLoS One. 6, e22214(2011).
- Dong, J., et al. Growth differentiation factor-9 is required during early ovarian folliculogenesis. Nature. 383, 531-535 (1996).
- Zhang, S., et al. Simulated Microgravity Using a Rotary Culture System Compromises the In Vitro Development of Mouse Preantral Follicles. PLoS One. 11, e0151062(2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados