Method Article
Quantification de l'expression protéique et co-localisation utilisant multiplexé Immuno-histochimie Coloration et multispectrale Imaging
Dans cet article
Résumé
Immunohistochemistry is a powerful lab technique for evaluating protein localization and expression within tissues. Current semi-automated methods for quantitation introduce subjectivity and often create irreproducible results. Herein, we describe methods for multiplexed immunohistochemistry and objective quantitation of protein expression and co-localization using multispectral imaging.
Résumé
Immunohistochemistry is a commonly used clinical and research lab detection technique for investigating protein expression and localization within tissues. Many semi-quantitative systems have been developed for scoring expression using immunohistochemistry, but inherent subjectivity limits reproducibility and accuracy of results. Furthermore, the investigation of spatially overlapping biomarkers such as nuclear transcription factors is difficult with current immunohistochemistry techniques. We have developed and optimized a system for simultaneous investigation of multiple proteins using high throughput methods of multiplexed immunohistochemistry and multispectral imaging. Multiplexed immunohistochemistry is performed by sequential application of primary antibodies with secondary antibodies conjugated to horseradish peroxidase or alkaline phosphatase. Different chromogens are used to detect each protein of interest. Stained slides are loaded into an automated slide scanner and a protocol is created for automated image acquisition. A spectral library is created by staining a set of slides with a single chromogen on each. A subset of representative stained images are imported into multispectral imaging software and an algorithm for distinguishing tissue type is created by defining tissue compartments on images. Subcellular compartments are segmented by using hematoxylin counterstain and adjusting the intrinsic algorithm. Thresholding is applied to determine positivity and protein co-localization. The final algorithm is then applied to the entire set of tissues. Resulting data allows the user to evaluate protein expression based on tissue type (ex. epithelia vs. stroma) and subcellular compartment (nucleus vs. cytoplasm vs. plasma membrane). Co-localization analysis allows for investigation of double-positive, double-negative, and single-positive cell types. Combining multispectral imaging with multiplexed immunohistochemistry and automated image acquisition is an objective, high-throughput method for investigation of biomarkers within tissues.
Introduction
Immunohistochimie (IHC) est une technique de laboratoire standard pour la détection de la protéine dans le tissu, et IHC est encore largement utilisé dans la recherche et la pathologie de diagnostic. L'évaluation de la coloration IHC est souvent semi-quantitative, l'introduction d'un biais potentiel dans l'interprétation des résultats. De nombreuses approches semi-quantitatives ont été développés qui incorporent à la fois l' intensité de la coloration et de la portée de coloration dans le diagnostic final de 1-4. D' autres systèmes comprennent l' intensité de notation et localisation subcellulaire afin de mieux localiser l' expression 5. Incorporation des scores moyens de téléspectateurs multiples est souvent utilisé afin de minimiser les effets de polarisation unique spectateur 6. En dépit de ces efforts, la subjectivité dans l' analyse reste encore, en particulier lors de l' évaluation de la mesure de la coloration 7. Protocole de normalisation et de la subjectivité de l'entrée en minimisant humaine est primordiale pour créer des résultats précis et reproductibles IHC.
content "> Il existe d' autres options que IHC pour déterminer l' expression des protéines dans les tissus. Dans le cadre de la recherche, l' immunohistochimie a traditionnellement été considérée comme un moyen d'examiner la localisation des protéines 8, tandis que d' autres techniques telles que immunoblotting sont considérés comme l' étalon - or pour étudier l' expression des protéines . tissu Détermination ou une expression spécifique de compartiment cellulaire est difficile sans incorporer des techniques avancées telles que le fractionnement cellulaire ou microdissection laser 9,10. L'utilisation d'anticorps fluorescents sur des lames de tissus offre un compromis raisonnable, mais fond autofluorescence en raison de NADPH, lipofushines, réticulaire fibres, le collagène, l' élastine et peuvent rendre difficile une quantification précise 11.Plates - formes de pathologie de calcul automatiques sont une voie prometteuse pour plus quantification objective de la pathologie coloration 12-15. La combinaison de l'imagerie multispectrale avec des microréseaux de tissusfacilite l'analyse à haut débit de l'expression des protéines dans les grandes tailles d'échantillon. Avec ces techniques, l' analyse des protéines co-localisation, l' hétérogénéité de coloration, et des tissus et la localisation subcellulaire est possible tout en réduisant sensiblement les préjugés et le temps nécessaire à l' analyse inhérents, tout en retournant les données d'une manière continue plutôt que le format catégorique 16. Par conséquent, le but de cette étude était de démontrer l'utilité de la méthodologie et pour effectuer des immunohistochimie multiplexé avec l'analyse, en utilisant un logiciel d'imagerie multispectrale.
Ce protocole est écrit pour le manuel, la coloration immunohistochimique multiplex d'une seule lame de coupe de tissu avec quatre anticorps monoclonaux optimisés. Comme expérience représentative, anti-lapin nucléaire récepteur alpha des œstrogènes (ERa) et du récepteur d'androgène (AR) sont multiplexés avec liée à la membrane anti-souris et CD147 lié à la membrane anti-souris de la E-cadhérine. Tout anticorps de choix peut être Substituted pour les anticorps énumérés ici, mais chaque combinaison d'anticorps nécessite une optimisation séparée. Prétraitement pour tous les anticorps doivent être identiques. Les anticorps AR et CD147 doivent être optimisés individuellement, puis comme un cocktail. Chaque anticorps est détecté en utilisant un système de polymère exempte de biotine et l'un des 4 chromogènes uniques.
Protocole
NOTE: Le protocole décrit ici coloration et analyse d'un microréseau tissulaire (TMA), décrit précédemment 12,17,18. La section TMA 4 um d'épaisseur a été obtenu à partir d'un bloc de paraffine à l'aide d'un microtome standard.
NOTE: Une bibliothèque spectrale pour les 4 chromogènes et de contraste devrait être créé pour l'image de quantification. Pour ce faire, le protocole optimisé pour chaque anticorps individuel doit être exécuté avec un anticorps par diapositive, moins la contre-coloration finale. Un cinquième lame doit être colorée avec l'hématoxyline pour générer les 5 images nécessaires pour créer la bibliothèque spectrale.
1. Multiplex immunohistochimie
- diapositives Faire cuire dans un four à 60 ° C pendant 20 min. L'utilisation d'une hotte chimique, immerger diapositive dans 100% de xylène. Répétez l'opération pour 2 changements de xylène. Immergez diapositive dans 100% d'éthanol pendant 5 min. Répéter l'opération avec frais 100% d'éthanol.
- Immergez diapositive dans 95% d'éthanol pendant 3 min. Répéter l'opération avec frais95% d'éthanol. Immergez diapositive dans 70% d'éthanol pendant 3 min. Immergez glisser dans l'eau distillée pendant 3 min. Répéter l'opération avec de l'eau distillée fraîche. Tap coulissant verticalement pour évacuer l'eau de la diapositive. Appliquer 200 ul de peroxydase endogène bloqueur prête à l'emploi pendant 5 min.
- Égoutter peroxydase bloqueur de la diapositive et plongez dans 45 ml de tampon d'extraction prêt à l'emploi (pH inférieur à 7,0). Placer le récipient à glissière dans une cocotte-minute et démarrer le programme mis à 124 ° C pendant 4 min. Laisser autocuiseur refroidir pendant 20 min. avant l'ouverture.
- Retirer le contenant de tampon de récupération et laisser refroidir 10 min supplémentaires. Rincez coulissant dans l'eau distillée pendant 10 minutes. Vider l'eau de la diapositive et de délimiter soigneusement le tissu sur la lame avec un stylo barrière hydrophobe.
- Ajouter 200 pi de tampon phosphate salin slide (PBS) .Transfert à un récipient plat avec couvercle (chambre d'incubation) contenant de la gaze humide.
- Préparer 1 litre de 1 x solution saline tamponnée au Tris avec du Tween-20 (TBST) en diluant 50 ml de 20x tampon Tris salin contenant 1% de Tween-20 et 950 ml d'eau distillée.
- Égoutter PBS de la diapositive et appliquer 200 pi de 1x TBST. Incuber pendant 2 min. Égoutter TBST de la diapositive et revenir diapositive à la chambre d'incubation. Appliquer 200 pi de bloc de protéines universel prêt à l'emploi, à proximité chambre et incuber pendant 7 min.
- Égoutter bloc de protéines et de revenir diapositive à la chambre d'incubation. Diluer l'anticorps anti ERa 1: 400 en y ajoutant 0,6 ul d'anticorps à 239,4 ul de diluant d'anticorps. Appliquer 200 pi d'anticorps dilué à glisser et à proximité chambre.
- Incuber diapositive à la température ambiante pendant 2 heures. Égoutter anticorps à partir de lame et rincer avec TBST suivi par immersion pendant 5 min dans TBST.
- Égoutter TBST de la diapositive et revenir diapositive à la chambre d'incubation. Appliquer 200 pi de chèvre polymère anti-lapin peroxydase de raifort à utiliser prêt et à proximité chambre. Incuber pendant 30 min. à température ambiante. diapo Rincer à l'TBST et lieu coulissant dans le récipient de TBST pendant 5 min.
- Préparer brun peroxydase de raifort-3,3'-diaminobenzidine (DAB HRP) chromogène par l'addition de 8 pl de chromogène DAB pour le tampon de substrat DAB 250 ul et bien mélanger.
- Égoutter TBST de la diapositive, retour diapositive à la chambre d'incubation et d'appliquer 200 pi de brun chromogène HRP-DAB pendant 6 min. Rincer soigneusement la lame avec de l'eau distillée et le lieu coulissant dans un récipient d'eau distillée.
- Mélanger la solution dénaturante en combinant 50 ul du premier réactif d'élution avec 150 ul du second réactif tampon. Vider l'eau hors de la diapositive et appliquer une solution dénaturant diluée à la diapositive pendant 3 min. à température ambiante. Décanter et rincer réactif dénaturant avec TBST. Immergez diapositive dans TBST pendant 5 min.
- Préparer AR / CD147 cocktail d'anticorps par dilution de 4,2 ul d'anticorps anti-AR et 2,8 ul d'anticorps anti-CD147 avec 203 ul de diluant d'anticorps. Égoutter TBST de la diapositive, revenir diapositive à la chambre d'incubation et d'appliquer 200 pi de AR / CD147 cocktail à la diapositive. Fermer la chambre et incuber pendant 1 heure à température ambiante. diapo Rincer à l'TBST et plonger dans TBST pendant 5 min.
- Égoutter TBST, retour diapositive à la chambre d'incubation et d'appliquer 200 pi d'anti-lapin de polymère de la phosphatase alcaline de chèvre prête à l'emploi. Fermer la chambre et glissez incuber pendant 30 min. à température ambiante. diapo Rincer à l'TBST et plonger dans TBST pendant 5 min.
- Préparer rouge phosphatase alcaline chromogène en ajoutant 3,2 ul de chromogène rouge à 250 pi de tampon chromogène rouge et bien mélanger.
- Égoutter TBST de la diapositive et revenir diapositive à la chambre d'incubation. Appliquer 200 pi de dilution alcaline phosphatase rouge chromogène à la diapositive, à proximité chambre et incuber pendant 7 min.
- Égoutter chromogène et bien rincer la lame avec de l'eau distillée. Placer les lames dans un récipient d'eau distillée pendant 5 min. Vider l'eau de la diapositive, rincer à l'TBST et revenir à la chambre d'incubation. Appliquer 200 pi de chèvre polymère anti-souris-HRP à la diapositive et closchambre e. Incuber pendant 30 min. à température ambiante.
- Égoutter polymère de la lame et rincer avec du TBST. Placer la lame dans TBST pendant 5 min. Préparer 200 pi de pourpre chromogène HRP lié en ajoutant 3,2 ul du réactif de stabilisation à 250 pi du tampon et bien mélanger. Ajouter 3,2 pi de chromogène pourpre et bien mélanger, puis 3,2 ul du réactif de peroxyde d'hydrogène et bien mélanger.
- Égoutter TBST hors diapositive et appliquer 200 pl de chromogène pourpre prêt à lame et incuber pendant 7 min. à température ambiante. diapo Rincer à l'eau distillée toboggan et placer dans un récipient d'eau distillée pendant 5 min.
- Mélanger la solution dénaturante par mélange de 50 ul du premier réactif d'élution avec 150 ul du second réactif tampon. Vider l'eau hors de la diapositive et appliquer une solution dénaturant diluée à la diapositive pendant 3 min. à température ambiante.
- Rincer réactif dénaturant off avec TBST. Placer la lame dans le récipient de TBST pendant 5 min. Diluer anti- E-cadhérine anticorpsà 1: 200 en y ajoutant 1,1 ul d'anticorps à 218,9 pi du diluant d'anticorps. Égoutter le TBST de la diapositive, retour diapositive à la chambre d'incubation et d'appliquer 200 pi de E-cadhérine à la diapositive. Fermer la chambre et incuber 30 min. à température ambiante.
- diapo Rincer à l'TBST et lieu coulissant dans le récipient de TBST pendant 5 min. Égoutter le TBST de la diapositive, revenir diapositive à la chambre d'incubation et d'appliquer polymère HRP anti-souris 200 pi de chèvre. Incuber à température ambiante pendant 30 min. diapo Rincer à l'TBST et lieu coulissant dans le récipient de TBST pendant 5 min.
- Préparer noir HRP lié chromogène en ajoutant 8 pi de chromogène à 250 pi de tampon. Appliquer 200 pi chromogène à glisser et développer pendant 2 min. Rincer soigneusement diapo avec de l'eau distillée et plongez dans un récipient d'eau distillée.
- Diluer hématoxyline en ajoutant 40 ul hématoxyline à 200 ul d'eau distillée. Vider l'eau de la diapositive et appliquer 200 pi de hématoxyline diluée à glisser pendant 30 secondes. slide Rinsel'eau du robinet à fond en cours d'exécution pendant 2 min., puis rincer à l'eau distillée pendant 30 secondes. Placer la lame dans un four à 60 ° C pendant 15-30 min.
- Immergez diapositive fraîchement préparé 100% de xylène pendant 30 secondes, essuyer l'excès de xylène off et ajouter une goutte de milieu de montage permanent. Coverslip avec un n ° 1,5 lamelle.
Acquisition et analyse 2. Automated image
- Chargez lames colorées sur un scanner de diapositives automatique. Basé sur le diamètre, la séparation, et le nombre de noyaux TMA, de créer un protocole de balayage automatisé selon le manuel d'instructions du fabricant.
- Ouvrez le logiciel d'imagerie multispectrale pour construire une bibliothèque spectrale de lames de contrôle colorées avec des chromogènes individuels et le toboggan hématoxyline tachée. Ouvrez un cube image acquise à partir d'une lame de contrôle et sélectionnez quatre à cinq zones colorées positivement pour définir optiquement que chromogène. Répéter l'opération avec l'image des cubes d'autres lames de contrôle jusqu'à ce qu'une bibliothèque representi spectrale complèteng tous chromogènes est créé, puis enregistrez la bibliothèque spectrale.
- Commencer un nouveau projet dans le logiciel d'imagerie multispectrale. Sélectionnez "multispectrale (.im3)" pour l'option de format d'image et "Brightfield" pour le format de l'échantillon. Tout d'abord, configurer le projet en choisissant les options désirées: "Tissue Segment", "Trouver Caractéristiques", "phénotypage", "Score" et "Exporter". À ce stade, la résolution d'image peut être modifiée afin d'accélérer le temps d'analyse, si désiré.
Segmentation 3. Tissue
- Importez la bibliothèque spectrale précédemment créé et sélectionnez tous les chromogènes à inclure dans l'analyse.
- Ouvrir l'image cubes pour être inclus dans l'ensemble en sélectionnant l'option "Open Cube d'image" données d'entraînement. Pour garantir la précision de la formation, sélectionner au moins 18% du nombre total d'images à analyser. Choisissez des images qui représentent tous les états pathologiques pour augmenter la précision de la segmentation. Cette portion d'images is appelé l'ensemble des images de formation.
- Blanc images de l'équilibre dans la formation prévue en sélectionnant l'outil de compte-gouttes et le choix d'une zone dans une image qui est blanc.
- Sélectionnez le bouton "Advance" pour passer à la segmentation des tissus. Utilisez le panneau "Tissue Catégories" pour choisir les types de tissus à analyser (ie «tissu» et «non-tissu»). Pour de plus précise la localisation tissulaire de la protéine, plusieurs catégories de tissus peuvent être utilisés ( par exemple ". Épithéliums", "stroma" et "non-tissu»).
- Commencez à créer l'algorithme et la définition des catégories de tissus en dessinant autour de groupes de cellules à l'intérieur des images de formation. Lorsque vous avez terminé avec une catégorie de tissu, répéter pour d'autres catégories de tissus. Assurez-vous de choisir des groupes de cellules dans les images qui sont caractéristiques de ce type de catégorie de tissus.
- Répétez ce processus pour toutes les images au sein de l'ensemble des images de formation.
- Sélectionner les composants (chromogènes) à inclure dans training pour le "tissu Segmenter". Lorsque vous effectuez l'analyse des images de fond clair immunohistochimie, tous les composants sont normalement inclus dans la formation. Inclure les images de coloration négative abondantes dans la formation prévue pour éviter les biais lors de cette étape.
- Choisissez une "Pattern Scale" approprié pour la formation du segmenteur de tissus. Sous un grossissement de 20x, une grande échelle de modèle est généralement approprié. Lorsque vous travaillez avec des tissus avec une architecture fine sous un grossissement plus élevé, une échelle de modèle plus petit est plus approprié.
- Sélectionnez le bouton "Train Tissue Segmenter" pour commencer à former le segmenteur de tissus. Observer une précision boîte de pop-up affichant reflétant la proportion de pixels au sein des régions de formation qui sont correctement classés.
REMARQUE: Le logiciel tente continuellement d'améliorer la précision de l'algorithme jusqu'à l'arrêt manuel. Nous avons déjà démontré que la formation sur 18% des images résultats dans 97% de précision de formation 12. - Après le segmenteur de tissu est formé, choisissez une résolution de segment approprié. la résolution du segment correspond à temps requis pour les images du segment, avec une résolution grossière nécessitant moins de temps et une résolution fine nécessitant plus de temps.
- Segment l'ensemble du jeu de la formation d'images en cliquant sur "Segment Images". Laisser le logiciel suffisamment de temps pour appliquer l'algorithme à toutes les images de formation. Une fois terminé, examiner la formation prévue pour trouver tous les tissus mal classés avec l'algorithme de formation actuel.
- Pour affiner le processus de segmentation des tissus, ajouter, modifier ou supprimer des régions de formation de tissus. Utilisez l'option "bords de finition" si les pixels s'étendent sur les bords d'une catégorie de tissu dans un autre. Si de petits groupes de pixels sont mal classés, ajuster le seuil de la taille du segment minimum.
- Lorsque les modifications sont terminées, sélectionnez "Segment Images", ce sera re-former le segmenteur de tissu pour créer un nouvel algorithme pour la segmentation des tissus. L'algorithme précédentest automatiquement enregistré et peut être retourné si nécessaire.
- Quand à l'aise avec les résultats de l'algorithme de segmentation de tissu, avancer à la segmentation de la cellule en sélectionnant le bouton "Avancé".
4. Cellule Segmentation
- Choisissez les compartiments subcellulaires à inclure dans la segmentation des cellules. Assurez-vous que "Nuclei" est déjà sélectionné pour choisir "cytoplasme" ou "membrane".
NOTE: "Membrane" segmentation ne doit être choisi lors d'un marqueur spécifique de la protéine de la membrane a été inclus dans IHC, tels que E-cadhérine. - Dans l'onglet "Nuclei", il y a plusieurs options. Commencez par choisir les réglages appropriés pour la segmentation nucléaire (voir étape 4.3). Choisissez si les catégories individuelles ou tous les tissus seront inclus dans la segmentation.
- Sélectionnez une approche de segmentation nucléaire
- Sélectionnez le contre-coloration "Pixel-Based (Seuil)" approche pour une méthode simplifiée pour obtenir une bonnerésultats sans connaître beaucoup sur les paramètres de traitement d'image.
NOTE: Cela rend souvent un bon premier choix. Lors du choix d'une approche, "Pixel-Based (Seuil)» est plus approprié quand il y a une contre-coloration nucléaire fiable, tandis que «Objet-Based" doit être utilisé s'il y a un manque de contre-coloration nucléaire cohérente. - Sélectionnez le "Pixel-Based (Seuil)" approche quand il y a une contre-coloration nucléaire fiable.
NOTE: Cette approche est purement à base de pixels. Cette approche peut également être utilisée pour d'autres besoins d'analyse d'images qui peuvent être remplies avec un simple seuil, comme la détection de tous les pixels dans une catégorie de tissu qui tache positive pour une tache IHC. - Sélectionnez l'approche de l'objet à base si le nucléaire de contraste ne fournit pas une coloration uniforme et spécifique des objets nucléaires, et les approches morphométriques-plus avancées sont nécessaires pour détecter les noyaux.
- Sélectionnez "Composants pour la segmentation nucléaire", "Nucloreille Taille "et" Clean-up "si l'utilisateur souhaite définir davantage les paramètres de segmentation des noyaux.
- Sélectionnez le contre-coloration "Pixel-Based (Seuil)" approche pour une méthode simplifiée pour obtenir une bonnerésultats sans connaître beaucoup sur les paramètres de traitement d'image.
- Sélectionnez les paramètres de forme cytoplasme
- Sélectionnez le bouton "Advance" pour passer à la segmentation cytoplasme.
NOTE: Il existe plusieurs options dans le cytoplasme segmentation à choisir. L'option appelée «distance intérieure au noyau" est à base de pixels. Elle reflète la distance entre l'extérieur du noyau et l'intérieur du cytoplasme. L'augmentation de cette valeur diminue la probabilité que le signal nucléaire traverse dans le compartiment de cytoplasme. - Sélectionnez ensuite, «distance extérieure au noyau".
NOTE: Ceci est également basé sur les pixels. La distance extérieure au noyau reflète la distance entre l'extérieur du noyau et l'extérieur de la cellule. Cette valeur peut être grande ou assez petit pour inclure ou exclure des signaux de la membrane si on le souhaite. - Next select, "taille minimale".
NOTE: La taille minimale, pixel base, reflète la taille de l'échantillon de cytoplasme minimum pour être inclus dans l'analyse. Si la taille du cytoplasme est plus petite dans une cellule particulière telle que lorsque les cellules sont serrées ensemble, cette segmentation cytoplasme est exclu de l'analyse. - Sélectionnez l'option suivante, "Component" avec "primaire", "secondaire", et sélectionnez "tertiaire" comme des options secondaires.
NOTE: Ici on peut choisir un marqueur cytoplasmique spécifique. Semblable à la segmentation nucléaire, si un marqueur spécifique IHC cytoplasmique a été utilisé, ce composant peut être utilisé pour définir le cytoplasme en trouvant une valeur de seuil minimum. Ceci aide à définir le cytoplasme mais pas nécessaire pour une précision acceptable. - Le passage à la dernière des trois options à onglets est "Membrane". Ici, l'utilisateur définit le compartiment à membrane avec un marqueur protéique. Choisissez "primaire", "secondaire", et / ou «tertiaire» pour chaque marqueur spécifique de la membrane utilisée. Réglez "pleine échelle OD "pour trouver un seuil minimum ou un point positif pour chaque marqueur sur les membranes cellulaires.
- Poursuivant sous l'onglet "Membrane" et sélectionnez l'option "Taille maximale de cellule".
NOTE: Ceci est la distance à la valeur de la membrane, en pixels, qui spécifie la taille maximale des cellules. Une valeur de 12 est normalement approprié pour les images prises à un grossissement de 20x. - Après avoir sélectionné toutes les options, sélectionnez "Segment image" ou "Segment All". Appliquer les paramètres pour les images et les observer «individuellement» ou en mode «Galerie».
REMARQUE: Réglez les paramètres et les seuils si nécessaire, et re-segment jusqu'à satisfait des résultats de segmentation des cellules dans l'ensemble des images de formation.
- Sélectionnez le bouton "Advance" pour passer à la segmentation cytoplasme.
5. phénotypage de cellules
REMARQUE: précise la cellule de segmentation est nécessaire afin d'obtenir le phénotypage cellulaire précise, et la fonction de phénotypage est trainable.
- Utilisez la fonction "Ajouter &# 34; bouton pour ajouter phénotypes à la liste des "phénotypes". Les utilisateurs peuvent sélectionner une couleur pour le phénotype.
- Cliquez sur "Modifier phénotypes" pour attribuer un phénotype à une cellule. Cliquez sur une cellule particulière pour faire apparaître un menu déroulant, permettant à l'utilisateur de choisir le phénotype et de passer ensuite. Identifier au moins cinq (5) cellules dans chaque phénotype afin de procéder. 25 Le choix d'une ou plusieurs cellules de chaque phénotype est nécessaire pour obtenir des résultats optimaux.
6. La notation IHC et co-localisation
- Choisissez "Advance" pour passer à la "Score IHC ou IF" étape. Choisissez une "Catégorie de tissu" de marquer.
NOTE: Une seule catégorie de tissu peut être marqué au cours d'une analyse particulière, mais si les résultats de la notation dans une autre catégorie de tissus sont souhaités, l'analyse peut être répétée plus tard avec des paramètres différents. - Choisissez un type désiré "Scoring".
NOTE: Positivity crée deux bacs (positifs et négatifs) pour un composant d'intérêt, Tout en double positivité est utilisé pour l'analyse de co-localisation. D'autres options incluent 4-bin, 10-bin, et 50-bin analyses pour un marqueur de choix. - Choisissez la cellule "Compartiment" pour être utilisé dans la notation analyse.
- Semblable à trouver un seuil minimal pour la composante nucléaire primaire, sélectionnez "Voir les données des composants" et déplacez le curseur sur les images de formation pour trouver des seuils minimaux de densité optique appropriés de coloration pour les cellules positives pour le composant (s) d'intérêt.
- Si les cellules intensément colorées sont à exclure, abaisser le seuil maximum à un niveau approprié. Sinon, utilisez le bouton automatique pour choisir un maximum de seuil pour l'analyse.
- Choisissez la formation d'images pour marquer dans le but de valider les valeurs de seuillage.
NOTE: Le pourcentage de cellules dans un bac particulier sera retourné et peut être comparé par inspection visuelle ou le comptage manuel. Une fois terminé, sélectionnez "Advance" pour passer à l'étape "Exporter".
7. L'application de l'algorithme et Batch Analysis
- Testez l'algorithme créé par la segmentation des tissus, la segmentation de la cellule, et les valeurs de notation en exportant les données pour l'ensemble de la formation. Suivez les invites pour créer un nouveau dossier pour le répertoire d'exportation. Sélectionnez les images et les tables à créer et inclus dans l'analyse. Effectuer l'analyse en sélectionnant "Exporter pour tous».
- Les tableaux sont exportés dans des fichiers texte séparés par des tabulations et peuvent être ouverts dans la plupart des programmes d'analyse de données.
- Lorsque l'analyse est terminée, afficher les données de segmentation de la cellule et de notation pour les images à la fois haute et basse coloration pour évaluer la précision des réglages.
- Lorsque vous êtes satisfait des paramètres, appliquer l'algorithme créé à partir de l'ensemble de formation d'images à l'ensemble des images par le biais d'analyses de lots. Cliquez sur l'onglet "Analyse par lots» et un algorithme sera copié à partir du projet actif.
- Choisissez un nouveau répertoire d'exportation et sélectionner les images et les tables doivent être inclus dans l'analyse. Sous l'option fichiers d'entrée, sélectionnez "Ajouter des images" et choisissez toutes les images à inclure dans l'analyse par lots.
- Effectuer l'analyse en sélectionnant l'option "Exécuter". Comme pour l'analyse de l'ensemble de la formation, cette étape nécessitera une quantité de temps variable, en fonction des paramètres particuliers et le nombre d'images incluses dans l'analyse.
- Une fois terminé, passer à l'onglet «Revue / Fusionner". Le répertoire de lot par défaut dans le répertoire d'exportation de l'analyse des lots et peuvent être modifiés si on le souhaite. Sélectionnez "Inclure tous" et sélectionnez "Fusionner" pour créer des feuilles de données avec des données de synthèse pour l'analyse.
8. Analyse des données Exporté
- Ouvrez les tables exportées dans le logiciel d'analyse de données et de supprimer ou masquer des colonnes de données qui ne sont pas pertinents à l'analyse, tels que les valeurs minimales et maximales pour chaque composant. Les données primaires utilisées dans l'analyse est dans la moyenne densité optique cOLONNE pour chaque composant.
- Critique exporté des cartes de segmentation et des images brutes afin de déterminer quels échantillons ou noyaux TMA doivent être exclus de l'analyse. Les valeurs de pourcentage de tissus aident à déterminer si un échantillon doit être inclus ou non, avec une coupure arbitraire de <5% utilisée le plus souvent pour les critères d'exclusion.
- Supprimer les données ou les lignes contenant des échantillons non pertinents à exclure de l'analyse des données.
- Utiliser les données de quantification des protéines pour étudier les changements dans l' état de la maladie ou la relation avec les caractéristiques clinico-pathologiques de la maladie 12,18-21.
Résultats
Sur la figure 1, la formation est effectuée sur des tissus de la prostate à des images de segments dans l' épithélium et du stroma des parties, ainsi que le compartiment non tissulaire. En utilisant le marqueur membranaire E-cadhérine épithéliale, la segmentation des cellules a été réalisée pour séparer le noyau, cytoplasme, et les parties de membrane, illustré à la figure 2.
Dans une expérience, nous avons utilisé multiplexé IHC pour étudier l'expression et la localisation de l' AR, ERa, E-cadhérine, et CD147, comme représenté sur la figure 3. En utilisant ces techniques, nous sommes en mesure d'identifier les cellules positives pour l' expression nucléaire à la fois l' ERa et AR (figure 3B - 3C) malgré chevauchement des signaux colorimétriques, comme indiqué par des flèches vertes dans la figure 3A. Nous avons trouvé des différences marquées dans la proportion de cellules stromales positives doubles dans les différents états de prmaladie ostate (Figure 3D). Nous avons quantifié l' expression spécifique de la membrane cellulaire de CD147 en utilisant E-cadhérine comme une protéine marqueur (flèches rouges dans la figure 3A), et nous avons été le premier groupe à étudier l' expression de CD147 spécifique de la membrane dans les tissus de la prostate. Nous avons constaté une diminution significative de l'expression CD147 en association avec la progression du cancer de la prostate (Figure 3E) et avons trouvé une association importante avec le pronostic post-chirurgicale 19.
Il y a des cas où la conception de l'expérience pauvre peut conduire à la segmentation des tissus inexacts. Sur la figure 4, l'algorithme appliqué à un ensemble de tissus n'a pas exactement épithélial de segment et les compartiments de stroma (figure 4C). Dans cette expérience, l'actine du muscle lisse α (α-SMA) a été utilisé pour marquer le compartiment stromal. Parce que α-SMA et le muscle lisse est diminuée ou perdues dans certaines tumeurs (Figure 4A), l'algorithme créé par la segmentation des tissus (figure 4B) a été incapable de faire la différence avec précision entre épithéliales et stromales compartiments de seules données morphométriques. Il faut prendre soin lors du choix des marqueurs protéiques pour les compartiments de tissus ou de cellules.

Figure 1: Segmentation du tissu en utilisant multispectrale Software Imaging. Un microréseau de tissu de la prostate a été coloré par immunohistochimie multiplexé pour le récepteur des androgènes (AR), récepteurs d'œstrogènes alpha (ERa), E-cadhérine et CD147. Un ensemble d'images de formation ont été importées dans un logiciel d'imagerie multispectrale représentant des types de tissus et états pathologiques de l'ensemble des images (A). catégories de tissus ont été créés notamment stroma (vert), épithéliums (rouge), et non le tissu (bleu), et les catégories ont été définies par le dessin manuellement sur le dessusde formation d' images (B). Après avoir dessiné sur les images de formation, un algorithme de segmentation du tissu a été créé et appliqué à l'ensemble des images (C) de formation. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2: Cellule Segmentation en nucléaire, cytoplasmique et membrane Compartments. Le compartiment nucléaire a été défini pour la segmentation cellulaire en fixant un seuil minimal pour hématoxyline contre - coloration (A). Le cytoplasme est défini par rapport au noyau en utilisant des algorithmes prédéfinis dans le logiciel (B). E-cadhérine a été utilisé comme marqueur membranaire et un seuil minimum moyenne OD a été appliqué pour définir le compartiment à membrane (C). Tout Cette techniqueows quantification simultanée de l' expression des protéines dans tous les compartiments intracellulaires (D). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
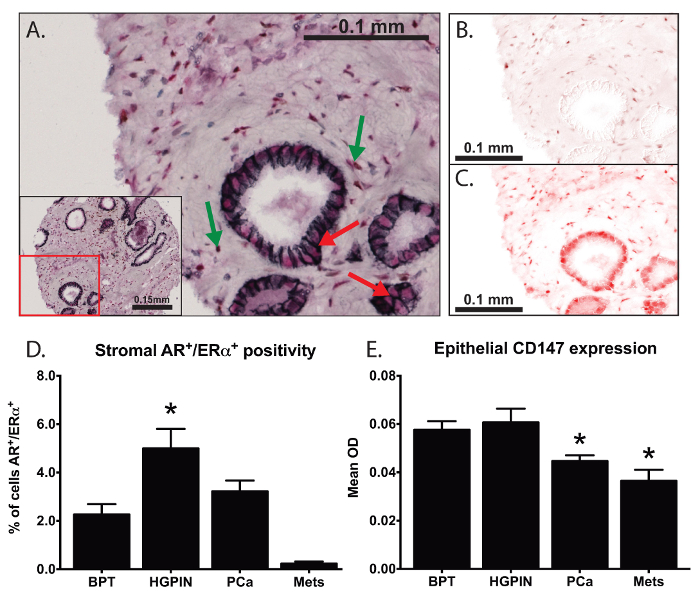
Figure 3: Analyse de la co-localisation et de la membrane spécifique de l' expression des protéines. Multiplexée IHC a été utilisé pour étudier l'expression et la localisation du récepteur des androgènes (AR), récepteurs d'œstrogènes alpha (ERa), E-cadhérine et CD147 (A). DAB (chromogène brun) a été utilisé pour marquer AR (B) et un chromogène rouge utilisé pour marquer ERa (C). Nous avons été en mesure d'identifier des biomarqueurs spatialement chevauchantes (flèches vertes en A) et de quantifier (D) la proportion de cellules avec co-localisation nucléaire de ERa et ARà l'intérieur de la prostate stroma. À l'aide de la E-cadhérine (chromogène noire) pour définir la membrane plasmique (flèches rouges A), nous avons mesuré l' expression spécifique de la membrane de CD147 dans les tissus de la prostate (E) 19. Une-analyse de variance (ANOVA) a été utilisée pour l' analyse statistique, les barres d'erreur reflète l' erreur standard de la moyenne, et les astérisques représentent p <0,05. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
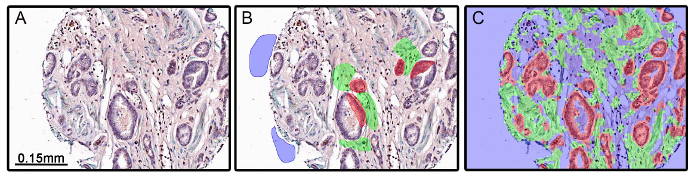
Figure 4: Segmentation insuffisante des tissus résultant de la conception expérimentale. les tissus de la prostate bénins et malins ont été colorées pour l'actine α-muscle lisse (α-SMA; chromogène vert), le récepteur des androgenes (chromogène rouge) et le récepteur d'androgène variante 7 (chromogène DAB). a-SMA a été utilisé commeun marqueur de stroma et est diminuée dans certaines tumeurs, y compris de la prostate (A). Lorsque la formation a été réalisée (B) et l'algorithme de segmentation de tissu a été appliqué, le stroma et les compartiments épithéliales étaient insuffisamment segmenté en raison de l'absence d'α-SMA coloration (C). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
L'utilisation d' une immunohistochimie traditionnelle pour l' évaluation de l' expression des protéines est limitée par des méthodes subjectives, semi-quantitative de l' analyse 22,23. plates-formes de Advance ont été créés pour l'analyse à haut débit de l'expression des biomarqueurs et de la localisation. segmentation détaillée des deux tissus et compartiments subcellulaires permet aux utilisateurs d'étudier l'expression des biomarqueurs, la localisation et la co-localisation avec d'autres marqueurs d'intérêt. Dans des études précédentes, nous avons démontré l'utilité de l' IHC et de l' imagerie multispectrale, en particulier lorsqu'ils sont utilisés pour étudier les protéines localisées au même compartiment cellulaire 18,20,21. Lorsqu'il est combiné avec micropuces de tissu 24, ces techniques permettent une quantification plus rapide et plus objective de l' expression de la protéine que ne le permet l' analyse manuelle par un pathologiste.
Un problème avec l'utilisation de l'immunohistochimie pour la protéine est la quantification reproductibilité des résultats en raison de la subjecnature tive de l'analyse et des différences inhérentes à la technique et des réactifs. Un avantage significatif de l'utilisation des plates-formes telles que l'imagerie multispectrale pour mesurer l'expression des protéines est la reproductibilité des résultats. Les données provenant des plates - formes de pathologie informatisés corrèlent très à l' analyse manuelle par un pathologiste en retournant des données dans un format continu et en réduisant considérablement le temps de travail, en particulier lorsque l'on travaille avec un grand échantillon de tailles 12,16,25. Des études ont montré une concordance globale élevée dans les résultats entre les différentes plates - formes multispectrales 14. De plus, nous avons précédemment montré que les résultats de la coloration sont hautement reproductibles , même lorsqu'il existe une variabilité dans le nombre de protéines a étudié 12. L'utilisation de plates-formes de pathologie automatisées pour les colorations et l'analyse ne sera pas éliminer tous les écarts dans les résultats, tels que ceux découlant des anticorps créés vers des épitopes différents, mais ces plates-formes ne réduire considérablement le biais et irreproductibilité souvent associée à l'immunohistochimie.
Il y a des mesures particulières dans le protocole qui sont essentiels pour le retour des résultats précis et reproductibles. conception expérimentale appropriée à travers la sélection de protéines à inclure dans les tissus ou les marqueurs subcellulaires est important pour la segmentation précise. Lorsque vous effectuez une analyse de la positivité, la sélection d'un seuil plus bas pour une coloration positive a un effet important sur les résultats finaux. Alors que le choix d'un seuil pour "on / off" des protéines telles que des facteurs de transcription nucléaires est assez simple, trouver un seuil de protéines plus hétérogène exprimées est difficile. Cela devrait idéalement être réalisée en collaboration avec un pathologiste génito conseil certifié ou un score en moyenne sur plusieurs observateurs pour trouver le seuil idéal pour l'analyse.
Il est important de reconnaître certaines limites de versions actuelles de cette technologie. Lorsque décollage du compartiment cytoplasmique, trois approches peuvent être utilisées: (1) la coloration avec un marqueur spécifique cytoplasme, (2) la coloration avec un marqueur spécifique de la membrane et en utilisant le noyau à la membrane à distance de marqueur comme cytoplasme, et (3) à l'aide une méthode de dessin pour définir manuellement les limites du cytoplasme par rapport au noyau. D'après notre expérience, en utilisant un marqueur spécifique de la membrane est la technique la plus précise. L'approche manuelle de dessin est normalement précis si les noyaux sont situés au centre ou si le biomarqueur d'intérêt est uniformément répartie dans tout le cytoplasme. définir avec précision le cytoplasme des cellules stromales comme les fibroblastes et les cellules musculaires lisses reste difficile et doit être pris en considération lors de la conception d'une expérience.
Une autre limitation de la technologie est la dépendance à l'égard de la segmentation des noyaux cellulaires. Si le plan de coupe exclut le noyau d'une cellule particulière, cette cellule ne sera pas inclus dans l'analyse. Si il n'y a pascytoplasme visible entre les noyaux ou des amas de noyaux adjacents, ceux-ci sont souvent reconnu comme l'un gros morceau nucléaire, plutôt que de noyaux distincts. D'une manière générale, l'hématoxyline de contraste est normalement suffisante pour la segmentation nucléaire acceptable, et la manipulation des paramètres logiciels tels que seuil maximum pour la taille noyau peut résoudre la plupart des problèmes avec la segmentation nucléaire.
Une dernière limite de plates-formes de pathologie automatisées est la segmentation fiable des tissus résultant de la conception expérimentale pauvres. L'importance de choisir des biomarqueurs de tissus et de cellules appropriées pour répondre à la question de l'intérêt ne peut être surestimée. Comme nous l'avons démontré dans nos résultats représentatifs, un marqueur épithélial ou stromal qui change de manière significative l'expression entre les états pathologiques peut poser des problèmes lors de la création d'un algorithme pour la segmentation des tissus. Il est intéressant de noter qu'il existe d'autres options si difficile analyses de ce type se posent. Par exemple, imag individuellees peuvent être analysées en tirant manuellement tous les compartiments de tissu, plutôt que par l'application d'un algorithme à partir d'un ensemble d'images d'entraînement. Ceci offre l'avantage de la segmentation qui est parfaitement conforme à ce que l'utilisateur désire, mais il introduit aussi la subjectivité et peut augmenter considérablement le temps nécessaire pour terminer une analyse. conception expérimentale appropriée est la meilleure façon d'accélérer l'analyse et de maximiser la précision du tissu et de la segmentation des cellules.
Cette technologie et le protocole ont de nombreuses applications futures. De nombreux biomarqueurs pour des états pathologiques particuliers ont été identifiés, mais pas validée. analyse objective à haut débit avec des plates-formes multispectrales facilite la validation de ces biomarqueurs. En outre, l'évaluation de l'expression et de co-localisation de multiples protéines peuvent fournir des indications sur les voies de signalisation mal compris. Sans aucun doute, ce qui réduit la subjectivité inhérente à l'analyse des staini immunohistochimiqueng est utile pour la compréhension de l'expression et la localisation d'une large gamme de marqueurs protéiques.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun intérêt financier concurrents.
Remerciements
Les auteurs remercient l'Université du Wisconsin Initiatives de recherche translationnelle dans le laboratoire de pathologie, en partie soutenu par le Département UW de pathologie et de médecine de laboratoire et UWCCC subvention P30 CA014520, pour l'utilisation de ses installations et ses services.
matériels
| Name | Company | Catalog Number | Comments |
| Xylene | Fisher Chemical | X3F1GAL | NFPA rating: Health – 2, Fire – 3 , Reactivity – 0 |
| Ethyl Alcohol-200 proof | Fisher Scientific | 4355223 | NFPA rating: Health – 0, Fire – 3 , Reactivity – 0 |
| Tris Base | Fisher Scientific | BP152-500 | NFPA rating: Health – 2, Fire – 0 , Reactivity – 0 |
| Tris Hydroxymethyl aminomethane HCl | Fisher Scientific | BP153-1 | NFPA rating: Health – 2, Fire – 0 , Reactivity – 0 |
| Tween 20 | Chem-Impex | 1512 | NFPA rating: Health – 0, Fire – 1 , Reactivity – 0 |
| Phosphate-buffered saline | Fisher Scientific | BP2944-100 | NFPA rating: Health – 1, Fire – 0 , Reactivity – 0 |
| Peroxidazed | Biocare Medical | PX968 | Avoid contact with skin and eyes. May cause skin irritation and eye damage. |
| Estrogen Receptor alpha | Thermo Fisher Scientific-Labvision | RM9101 | Not classified as hazardous |
| Androgen Receptor | SCBT | sc-816 | Not classified as hazardous |
| CD147 | Biodesign | P87535M | Not classified as hazardous |
| E-cadherin | Dako | M3612 | Not classified as hazardous |
| Renoir Red Andibody Diluent | Biocare Medical | PD904 | It is specially designed to work with Tris-based antibodies |
| DeCloaking Chamber | Biocare Medical | Model DC2002 | Take normal precautions for using a pressure cooker |
| Barrier pen-Immuno Edge | Vector Labs | H-4000 | |
| Denaturing Kit-Elution step | Biocare Medical | DNS001H | Not classified as hazardous |
| Mach 2 Goat anti-Rabbit HRP Polymer | Biocare Medical | RHRP520 | Not classified as hazardous |
| Mach 2 Goat anti-Rabbit AP Polymer | Biocare Medical | RALP525 | Not classified as hazardous |
| Mach 2 Goat anti-Mouse HRP Polymer | Biocare Medical | M3M530 | Not classified as hazardous |
| Betazoid DAB Chromogen Kit | Biocare Medical | BDB2004 | 1. DAB is known to be a suspected carcinogen. 2. Do not expose DAB components to strong light or direct sunlight. 3. Wear appropriate personal protective equipment and clothing. 4. DAB may cause sensitization of skin. Avoid contact with skin and eyes. 5. Observe all federal, state and local environmental regarding disposal |
| Warp Red Chromogen Kit | Biocare Medical | WR806 | Corrosive. Acid that may cause skin irritation or eye damage. |
| Vina Green Chromogen Kit | Biocare Medical | BRR807 | Harmful if swallowed |
| Bajoran Purple Chromogen Kit | Biocare Medical | BJP807 | Flammable liquid. Keep away from heat, flames and sparks. Harmful by ingestion or absorption. Avoid contact with skin or eyes, and avoid inhalation. |
| Cat Hematoxylin | Biocare Medical | CATHE | Purple solution with a mild acetic acid (vinegar) scent. May be irritating to skin or eyes. Avoid contact with skin and eyes. Avoid ingestion. |
| XYL Mounting Media | Richard Allen | 8312-4 | NFPA rating: Health – 2, Fire – 3 , Reactivity – 0 |
| 1.5 Coverslips | Fisher Brand | 22266858 | Sharp edges |
| Incubation (Humidity)Chamber | obsolete | obsolete | Multiple vendors available |
| Convection Oven | Stabil- Therm | C-4008-Q | |
| Background Punisher Blocking Reagent | Biocare Medical | BP974 | This product is not classified as hazardous. |
| inForm software | PerkinElmer | CLS135781 | Primary multispectral imaging software used in manuscript |
| Nuance software | PerkinElmer | Nuance EX | Software used for making spectral libraries within manuscript |
| Vectra microscope and slide scanner | PerkinElmer | VECTRA | Automated slide scanner and microscope for obtaining IM3 image cubes |
Références
- Valdman, A., et al. Expression of redox pathway enzymes in human prostatic tissue. Anal Quant Cytol Histol. 31 (6), 367-374 (2009).
- Rimm, D. L., Camp, R. L., Charette, L. A., Olsen, D. A., Provost, E. Amplification of tissue by construction of tissue microarrays. Exp Mol Pathol. 70 (3), 255-264 (2001).
- Jonmarker, S., et al. Expression of PDX-1 in prostate cancer, prostatic intraepithelial neoplasia and benign prostatic tissue. APMIS. 116 (6), 491-498 (2008).
- McCarty, K. S., Miller, L. S., Cox, E. B., Konrath, J., McCarty, K. S. Sr Estrogen receptor analyses. Correlation of biochemical and immunohistochemical methods using monoclonal antireceptor antibodies. Arch Pathol Lab Med. 109 (8), 716-721 (1985).
- Volante, M., et al. Somatostatin receptor type 2A immunohistochemistry in neuroendocrine tumors: a proposal of scoring system correlated with somatostatin receptor scintigraphy. Mod Pathol. 20 (11), 1172-1182 (2007).
- Muris, J. J., et al. Immunohistochemical profiling of caspase signaling pathways predicts clinical response to chemotherapy in primary nodal diffuse large B-cell lymphomas. Blood. 105 (7), 2916-2923 (2005).
- Jaraj, S. J., et al. Intra- and interobserver reproducibility of interpretation of immunohistochemical stains of prostate cancer. Virchows Arch. 455 (4), 375-381 (2009).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. J Histochem Cytochem. 14 (12), 929-931 (1966).
- Peters, T. J. Investigation of tissue organelles by a combination of analytical subcellular fractionation and enzymic microanalysis: a new approach to pathology. J Clin Pathol. 34 (1), 1-12 (1981).
- Emmert-Buck, M. R., et al. Laser Capture Microdissection. Science. 274 (5289), 998-1001 (1996).
- Waters, J. C. Accuracy and precision in quantitative fluorescence microscopy. J Cell Biol. 185 (7), 1135-1148 (2009).
- Huang, W., Hennrick, K., Drew, S. A colorful future of quantitative pathology: validation of Vectra technology using chromogenic multiplexed immunohistochemistry and prostate tissue microarrays. Hum Pathol. 44 (1), 29-38 (2013).
- Rimm, D. L. C-Path: A Watson-Like Visit to the Pathology Lab. Science Translational Medicine. 3 (108), (2011).
- Fiore, C., et al. Utility of multispectral imaging in automated quantitative scoring of immunohistochemistry. J Clin Pathol. 65 (6), 496-502 (2012).
- Stack, E. C., Wang, C., Roman, K. A., Hoyt, C. C. Multiplexed immunohistochemistry, imaging, and quantitation: A review, with an assessment of Tyramide signal amplification, multispectral imaging and multiplex analysis. Methods. 70 (1), 46-58 (2014).
- Rizzardi, A. E., et al. Quantitative comparison of immunohistochemical staining measured by digital image analysis versus pathologist visual scoring. Diagn Pathol. 7, 42(2012).
- Bauman, T. M., et al. Characterization of fibrillar collagens and extracellular matrix of glandular benign prostatic hyperplasia nodules. PLoS One. 9 (10), e109102(2014).
- Bauman, T. M., et al. Beta-catenin is elevated in human benign prostatic hyperplasia specimens compared to histologically normal prostate tissue. Am J Clin Exp Urol. 2 (4), 313-322 (2014).
- Bauman, T. M., Ewald, J. A., Huang, W., Ricke, W. A. CD147 expression predicts biochemical recurrence after prostatectomy independent of histologic and pathologic features. BMC Cancer. 15 (1), 549(2015).
- Bauman, T. M., et al. Finasteride treatment alters tissue specific androgen receptor expression in prostate tissues. Prostate. 74 (9), 923-932 (2014).
- Nicholson, T. M., Sehgal, P. D., Drew, S. A., Huang, W., Ricke, W. A. Sex steroid receptor expression and localization in benign prostatic hyperplasia varies with tissue compartment. Differentiation. 85 (4-5), 140-149 (2013).
- Taylor, C. R., Levenson, R. M. Quantification of immunohistochemistry--issues concerning methods, utility and semiquantitative assessment II. Histopathology. 49 (4), 411-424 (2006).
- Matos, L. L., Trufelli, D. C., de Matos, M. G., da Silva Pinhal, M. A. Immunohistochemistry as an important tool in biomarkers detection and clinical practice. Biomark Insights. 5, 9-20 (2010).
- Kononen, J., et al. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med. 4 (7), 844-847 (1998).
- Ong, C. W., et al. Computer-assisted pathological immunohistochemistry scoring is more time-effective than conventional scoring, but provides no analytical advantage. Histopathology. 56 (4), 523-529 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon