Method Article
الكميات التعبير البروتين والتعاون التعريب عن طريق تعدد المناعية النسيجية تلطيخ والمتعددة الأطياف التصوير
In This Article
Summary
Immunohistochemistry is a powerful lab technique for evaluating protein localization and expression within tissues. Current semi-automated methods for quantitation introduce subjectivity and often create irreproducible results. Herein, we describe methods for multiplexed immunohistochemistry and objective quantitation of protein expression and co-localization using multispectral imaging.
Abstract
Immunohistochemistry is a commonly used clinical and research lab detection technique for investigating protein expression and localization within tissues. Many semi-quantitative systems have been developed for scoring expression using immunohistochemistry, but inherent subjectivity limits reproducibility and accuracy of results. Furthermore, the investigation of spatially overlapping biomarkers such as nuclear transcription factors is difficult with current immunohistochemistry techniques. We have developed and optimized a system for simultaneous investigation of multiple proteins using high throughput methods of multiplexed immunohistochemistry and multispectral imaging. Multiplexed immunohistochemistry is performed by sequential application of primary antibodies with secondary antibodies conjugated to horseradish peroxidase or alkaline phosphatase. Different chromogens are used to detect each protein of interest. Stained slides are loaded into an automated slide scanner and a protocol is created for automated image acquisition. A spectral library is created by staining a set of slides with a single chromogen on each. A subset of representative stained images are imported into multispectral imaging software and an algorithm for distinguishing tissue type is created by defining tissue compartments on images. Subcellular compartments are segmented by using hematoxylin counterstain and adjusting the intrinsic algorithm. Thresholding is applied to determine positivity and protein co-localization. The final algorithm is then applied to the entire set of tissues. Resulting data allows the user to evaluate protein expression based on tissue type (ex. epithelia vs. stroma) and subcellular compartment (nucleus vs. cytoplasm vs. plasma membrane). Co-localization analysis allows for investigation of double-positive, double-negative, and single-positive cell types. Combining multispectral imaging with multiplexed immunohistochemistry and automated image acquisition is an objective, high-throughput method for investigation of biomarkers within tissues.
Introduction
المناعية (IHC) هي تقنية المختبرات القياسية للكشف عن البروتين داخل الأنسجة، وانها لا تزال تستخدم على نطاق واسع IHC في كل من البحث والتشخيص المرضي. تقييم IHC تلطيخ غالبا ما يكون نصف الكمية، وإدخال التحيز المحتمل في تفسير النتائج. وقد وضعت العديد من المناهج شبه الكمية التي تتضمن كلا من شدة تلطيخ ومدى تلطيخ إلى التشخيص النهائي 1-4. وتشمل الأنظمة الأخرى كثافة يحرز والمكان التحت خلوية من أجل توطين التعبير 5 أفضل. وغالبا ما تستخدم إدماج متوسط درجات من المشاهدين متعددة من أجل تقليل آثار المشاهد واحد التحيز 6. وعلى الرغم من هذه الجهود، الذاتية في التحليل لا يزال، وخاصة عند تقييم مدى تلطيخ 7. توحيد البروتوكول والتقليل الذاتية من مدخلات الإنسان هو الهدف الأسمى لخلق دقيقة، النتائج IHC استنساخه.
محتوى "> وهناك خيارات أخرى إلى جانب IHC لتحديد تعبير البروتين داخل الأنسجة. وفي إعداد البحوث، وقد جرت العادة على النظر المناعية كوسيلة لفحص البروتين توطين 8، في حين ينظر إلى تقنيات أخرى مثل immunoblotting كما معيار الذهب للتحقيق في التعبير البروتين . تحديد الأنسجة أو الخلايا التعبير عن مقصورة محددة صعبة دون دمج تقنيات متقدمة مثل تجزئة الخلية أو القبض على الليزر تسليخ مجهري 9،10. استخدام الأجسام المضادة الفلورسنت على شرائح الأنسجة يقدم حلا وسطا معقولا، ولكن خلفية تألق ذاتي بسبب NADPH، lipofuscins، شبكي ألياف الكولاجين، والإيلاستين يمكن أن تجعل الكميات الدقيقة من الصعب 11.الآلية منصات علم الأمراض الحسابية هي اتجاها واعدا لمزيد من الكميات الموضوعية للأمراض تلطيخ 12-15. الجمع بين التصوير متعدد الأطياف مع ميكروأرس الأنسجةيسهل تحليل الإنتاجية العالية من البروتين التعبير في أحجام عينة كبيرة. مع هذه التقنيات، وتحليل البروتين شارك في الترجمة، وعدم التجانس تلطيخ، والأنسجة وتوطين التحت خلوية ممكن مع تخفيض جوهري في كل من التحيزات الكامنة والوقت اللازم للتحليل، بينما كان عائدا البيانات في مستمرة بدلا من الشكل القاطع 16. ولذلك، كان الغرض من هذه الدراسة هو إثبات فائدة من ومنهجية لأداء المناعية المضاعفة مع التحليل، وذلك باستخدام برامج التصوير متعدد الأطياف.
كتب هذا البروتوكول اليدوي، وتلطيخ المناعى تعدد الإرسال من قسم الأنسجة شريحة واحدة مع أربعة أجسام مضادة وحيدة النسيلة الأمثل. كتجربة نموذجية، والمضاعفة النووي المضادة للأرنب ألفا مستقبلات هرمون الاستروجين (ERα) ومستقبلات الاندروجين (AR) مع anti-الماوس CD147 بغشاء وبغشاء لمكافحة فأر E-كادهيرين. يمكن substitut أي الأجسام المضادة في الاختيارإد عن الأجسام المضادة المدرجة هنا، ولكن كل مجموعة من الأجسام المضادة يتطلب تحسين منفصل. يجب أن تكون المعالجة المسبقة لجميع الأجسام المضادة متطابقة. يجب أن يكون الأمثل الأجسام المضادة AR وCD147 على حدة وبعد ذلك حفل كوكتيل. تم الكشف عن كل الأجسام المضادة باستخدام نظام البوليمر خالية من البيوتين واحدة من 4 المكوره فريدة من نوعها.
Protocol
ملاحظة: بروتوكول يصف هنا تلطيخ وتحليل ميكروأري الأنسجة (TMA)، التي سبق وصفها 12،17،18. تم الحصول على قسم TMA سميكة 4 ميكرون من كتلة البارافين باستخدام مشراح القياسية.
ملاحظة: مكتبة الطيفية لل4 المكوره ومباين ينبغي إنشاء لالكميات الصورة. من أجل القيام بذلك، يجب تشغيل بروتوكول الأمثل لكل الأجسام المضادة الأفراد مع الأجسام المضادة واحدة لكل شريحة، ناقص مباين النهائي. يجب أن تكون ملطخة شريحة الخامسة مع الهيماتوكسيلين لتوليد 5 الصور اللازمة لإنشاء مكتبة الطيفية.
1. المتعددة المناعية
- شرائح خبز في الفرن 60 درجة مئوية لمدة 20 دقيقة. استخدام غطاء الدخان الكيميائية، وتزج الشرائح في 100٪ زيلين. كرر لمدة 2 تغييرات الزيلين. تزج الشرائح في الإيثانول بنسبة 100٪ لمدة 5 دقائق. مع تكرار الطازجة 100٪ من الإيثانول.
- تزج الشرائح في الايثانول 95٪ لمدة 3 دقائق. كرر مع الطازجة95٪ من الإيثانول. تزج الشرائح في الايثانول 70٪ لمدة 3 دقائق. تزج الشرائح في الماء المقطر لمدة 3 دقائق. كرر مع الماء المقطر النقي. شريحة الحنفية عموديا لاستنزاف المياه من الشريحة. تطبيق 200 ميكرولتر من الجاهزة للاستخدام مانع البيروكسيداز الذاتية لمدة 5 دقائق.
- استنزاف البيروكسيديز مانع من الشريحة وتزج في 45 مل العازلة استرجاع جاهزة للاستخدام (الرقم الهيدروجيني أقل من 7.0). مكان حاوية الشرائح في طنجرة الضغط والبدء في برنامج لتعيين 124 درجة مئوية لمدة 4 دقائق. السماح طنجرة الضغط لتبرد لمدة 20 دقيقة. قبل الافتتاح.
- إزالة الحاويات العازلة استرجاع والسماح لتبرد إضافي 10 دقيقة. شطف الشرائح في الماء المقطر لمدة 10 دقيقة. استنزاف المياه من شريحة وترسيم بعناية الأنسجة على الشريحة باستخدام قلم حاجز مسعور.
- إضافة 200 ميكرولتر من الفوسفات مخزنة المالحة (PBS) .Transfer الشرائح إلى وعاء مسطح مع غطاء (غرفة الحضانة) التي تحتوي على شاش رطبة.
- إعداد 1 لتر من 1X المالحة تريس مخزنة مع توين-20 (TBST) عن طريق تمييع 50 ملتر من 20x وتريس مخزنة المالحة التي تحتوي على 1٪ توين 20 و 950 مل من الماء المقطر.
- استنزاف برنامج تلفزيوني من الشرائح وتطبيق 200 ميكرولتر من 1X TBST. احتضان 2 دقيقة. استنزاف TBST من الانزلاق والعودة الانزلاق الى غرفة الحضانة. تطبيق 200 ميكرولتر من كتلة البروتين العالمي جاهزة للاستخدام، وغرفة وثيقة واحتضان لمدة 7 دقائق.
- استنزاف كتلة البروتين والعودة الانزلاق الى غرفة الحضانة. تمييع مكافحة ERα الضد 1: 400 بإضافة 0.6 ميكرولتر من الأجسام المضادة إلى 239.4 ميكرولتر من مخفف الأجسام المضادة. تطبيق 200 ميكرولتر من الأجسام المضادة المخفف لشريحة وغرفة قريبة.
- احتضان الشرائح في درجة حرارة الغرفة لمدة 2 ساعة. استنزاف الضد من الشرائح وشطف مع TBST تليها الغمر لمدة 5 دقائق في TBST.
- استنزاف TBST من الانزلاق والعودة الانزلاق الى غرفة الحضانة. تطبيق 200 ميكرولتر من الجاهزة للاستخدام الماعز المضادة للأرنب الفجل البيروكسيديز البوليمر وغرفة قريبة. احتضان لمدة 30 دقيقة. بدرجة حرارة الغرفة. شريحة شطف مع TBST ومكان الشريحة في حاوية من TBST لمدة 5 دقائق.
- إعداد البني الفجل البيروكسيديز-3،3'-diaminobenzidine (HRP-DAB) مولد اللون عن طريق إضافة 8 ميكرولتر من DAB مولد اللون إلى 250 ميكرولتر عازلة DAB الركيزة ويمزج جيدا.
- استنزاف TBST من الشريحة، شريحة العودة إلى غرفة الحضانة وتطبيق 200 ميكرولتر من بني مولد اللون HRP-DAB لمدة 6 دقائق. شطف جيدا الشريحة مع الماء المقطر ومكان الشريحة في وعاء من الماء المقطر.
- مزيج الحل تغيير طبيعة من خلال الجمع بين 50 ميكرولتر من كاشف شطف الأول مع 150 ميكرولتر من كاشف عازلة الثاني. استنزاف المياه قبالة الشريحة وتطبيق الحل تغيير طبيعة المخفف إلى الشريحة لمدة 3 دقائق. بدرجة حرارة الغرفة. صب وشطف تغيير طبيعة كاشف مع TBST. تزج الشرائح في TBST لمدة 5 دقائق.
- إعداد AR / CD147 الأجسام المضادة كوكتيل من خلال تمييع 4.2 ميكرولتر من الأجسام المضادة لمكافحة AR و 2.8 ميكرولتر من مكافحة CD147 الأجسام المضادة مع 203 ميكرولتر من مخفف الأجسام المضادة. استنزاف TBST من الشريحة، والعودة الانزلاق الى غرفة الحضانة وتطبيق 200 ميكرولتر من AR / CD147 جocktail إلى الشريحة. إغلاق الغرفة واحتضان لمدة 1 ساعة في درجة حرارة الغرفة. شريحة شطف مع TBST وتزج في TBST لمدة 5 دقائق.
- استنزاف TBST، والانزلاق العودة إلى غرفة الحضانة وتطبيق 200 ميكرولتر من الجاهزة للاستخدام الماعز المضادة للأرنب الفوسفاتيز القلوية البوليمر. إغلاق الغرفة والشرائح احتضان لمدة 30 دقيقة. بدرجة حرارة الغرفة. شريحة شطف مع TBST وتزج في TBST لمدة 5 دقائق.
- إعداد الفوسفاتيز القلوية الأحمر مولد اللون بإضافة 3.2 ميكرولتر من مولد اللون الأحمر إلى 250 ميكرولتر عازلة مولد اللون الأحمر وتخلط جيدا.
- استنزاف TBST من الانزلاق والعودة الانزلاق الى غرفة الحضانة. تطبيق 200 ميكرولتر من المخفف قلوي أحمر الفوسفاتيز مولد اللون إلى الشريحة، وغرفة وثيقة واحتضان لمدة 7 دقائق.
- استنزاف مولد اللون ويشطف جيدا الشرائح مع الماء المقطر. ضع الشريحة في وعاء من الماء المقطر لمدة 5 دقائق. استنزاف المياه من الانزلاق، وشطف مع TBST والعودة إلى غرفة الحضانة. تطبيق 200 ميكرولتر الماعز المضادة للماوس HRP البوليمر إلى الشريحة وكلوسالبريد الغرفة. احتضان لمدة 30 دقيقة. بدرجة حرارة الغرفة.
- استنزاف البوليمر من الشرائح وشطف مع TBST. الشرائح مكان في TBST لمدة 5 دقائق. إعداد 200 ميكرولتر من الأرجواني مولد اللون المرتبطة HRP بإضافة 3.2 ميكرولتر من كاشف الاستقرار إلى 250 ميكرولتر من المخزن المؤقت وتخلط جيدا. إضافة 3.2 ميكرولتر من مولد اللون الأرجواني وتخلط جيدا، ثم 3.2 ميكرولتر من كاشف بيروكسيد الهيدروجين وتخلط جيدا.
- استنزاف TBST من الشرائح وتطبيق 200 ميكرولتر من مولد اللون الأرجواني استعداد لشريحة واحتضان لمدة 7 دقائق. بدرجة حرارة الغرفة. شريحة شطف مع المقطر المياه الشرائح وضعها في وعاء من الماء المقطر لمدة 5 دقائق.
- مزيج الحل تغيير طبيعة عن طريق خلط 50 ميكرولتر من كاشف شطف الأول مع 150 ميكرولتر من كاشف عازلة الثاني. استنزاف المياه قبالة الشريحة وتطبيق الحل تغيير طبيعة المخفف إلى الشريحة لمدة 3 دقائق. بدرجة حرارة الغرفة.
- شطف تغيير طبيعة كاشف قبالة مع TBST. ضع الشريحة في حاوية من TBST لمدة 5 دقائق. تمييع مكافحة E-كادهيرين الضدإلى 1: 200 بإضافة 1.1 ميكرولتر الضد إلى 218.9 ميكرولتر مخفف الأجسام المضادة. استنزاف TBST من الشريحة، شريحة العودة إلى غرفة الحضانة وتطبيق 200 ميكرولتر من E-كادهيرين إلى الشريحة. إغلاق الغرفة واحتضان مدة 30 دقيقة. بدرجة حرارة الغرفة.
- شريحة شطف مع TBST ومكان الشريحة في حاوية من TBST لمدة 5 دقائق. استنزاف TBST من الشرائح، والعودة الانزلاق الى غرفة الحضانة وتطبيق 200 ميكرولتر الماعز المضادة للماوس HRP البوليمر. يحضن في درجة حرارة الغرفة لمدة 30 دقيقة. شريحة شطف مع TBST ومكان الشريحة في حاوية من TBST لمدة 5 دقائق.
- إعداد الأسود HRP المرتبطة مولد اللون عن طريق إضافة 8 ميكرولتر من مولد اللون إلى 250 العازلة ميكرولتر. تطبيق 200 ميكرولتر مولد اللون إلى الشريحة وتطوير لمدة 2 دقيقة. شطف جيدا الشرائح مع الماء المقطر وتزج في وعاء من الماء المقطر.
- تمييع الهيماتوكسيلين بإضافة 40 ميكرولتر الهيماتوكسيلين إلى 200 ميكرولتر الماء المقطر. استنزاف المياه من الشرائح وتطبيق 200 ميكرولتر من الهيماتوكسيلين المخفف إلى الشريحة لمدة 30 ثانية. شريحة شطفتشغيل بدقة ماء الصنبور لمدة 2 دقيقة، ثم يشطف في الماء المقطر لمدة 30 ثانية. الشرائح مكان في C الفرن 60 درجة لمدة 15-30 دقيقة.
- تزج الشرائح في الطازجة 100٪ الزيلين لمدة 30 ثانية، ومسح زيلين الزائد وإضافة قطرة واحدة من وسائل الاعلام المتزايدة دائمة. ساترة مع رقم 1.5 ساترة.
2. الآلي الحصول على الصور وتحليل
- تحميل الشرائح ملطخة على ماسح الشرائح الآلية. واستنادا إلى قطر، والانفصال، وعدد من النوى TMA، إنشاء بروتوكول المسح الآلي وفقا دليل تعليمات الشركة المصنعة.
- فتح برامج التصوير متعدد الأطياف لبناء مكتبة طيفية من الشرائح السيطرة ملطخة المكوره الفردية والهيماتوكسيلين ملطخة الشرائح. فتح مكعب صورة تم الحصول عليها من شريحة التحكم واختر 4:56 المناطق الملون بشكل إيجابي في تحديد بصريا أن مولد اللون. كرر مع مكعبات صورة من الشرائح التحكم الأخرى حتى استكمال representi مكتبة الطيفينانوغرام جميع المكوره تم إنشاؤه، ثم قم بحفظ مكتبة الطيفية.
- بدء مشروع جديد ضمن برنامج التصوير متعدد الأطياف. حدد "المتعددة الأطياف (.im3)" لخيار تنسيق الصور و"Brightfield" لتنسيق العينة. أولا، تكوين المشروع عن طريق اختيار الخيارات المطلوبة: "نسيج القطاع"، "البحث الميزات"، "Phenotyping"، "نقاط" و "تصدير". في هذه المرحلة، يمكن تغيير دقة وضوح الصورة للإسراع وقت التحليل إذا رغبت في ذلك.
3. الأنسجة الإنقسام
- استيراد مكتبة الطيفية التي تم إنشاؤها مسبقا وحدد كل المكوره ليتم تضمينها في التحليل.
- مكعبات صورة مفتوحة ليتم تضمينها في بيانات التدريب التي وضعتها تحديد الخيار "فتح صورة مكعب". لضمان دقة التدريب واختيار لا يقل عن 18٪ من إجمالي عدد الصور التي سيتم تحليلها. اختيار الصور التي تمثل جميع الحالات المرضية لزيادة دقة تجزئة. هذا جزء من الصور طدعا الصورة مجموعة التدريب من الصور.
- صور توازن اللون الأبيض في التدريب التي وضعتها اختيار أداة قطارة العين واختيار منطقة في صورة واحدة وهذا هو الأبيض.
- اختر زر "تقدم" للانتقال إلى تجزئة الأنسجة. استخدام "الأنسجة فئات" لوحة لاختيار أنواع الأنسجة ليتم تحليلها (أي "النسيج" و "غير الأنسجة"). لمزيد من الدقة توطين الأنسجة البروتين، وفئات النسيج متعددة يمكن استخدامها (أي. "ظهائر"، "سدى"، و "غير الأنسجة").
- البدء في إنشاء خوارزمية وتحديد فئات الأنسجة عن طريق الرسم حول مجموعات من الخلايا داخل الصور التدريب. عند الانتهاء من فئة الأنسجة واحدة، كرر لفئات الأنسجة الأخرى. تأكد من اختيار مجموعة من الخلايا داخل الصور التي هي سمة من هذا النوع فئة الأنسجة.
- كرر هذه العملية لجميع الصور ضمن مجموعة التدريب من الصور.
- حدد المكونات (المكوره) ليتم تضمينها في ترينينغ ل "نسيج مقتطع". عند إجراء تحليل الصور brightfield المناعية، وعادة بإدراج جميع المكونات في التدريب. تشمل وفرة الصور تلطيخ السلبية في التدريب ووضع لتجنب التحيز خلال هذه الخطوة.
- اختر "مقياس نمط" المناسب لتدريب مقتطع الأنسجة. تحت 20X التكبير، وعلى نطاق واسع نمط غير المناسب عادة. عند العمل مع الأنسجة مع الهندسة المعمارية الجميلة تحت أعلى التكبير، وعلى نطاق أصغر النمط هو أكثر ملاءمة.
- حدد "قطار نسيج مقتطع" الزر لبدء تدريب مقتطع الأنسجة. لاحظ دقة مربع المنبثقة التي تظهر يعكس نسبة بكسل داخل المناطق التدريب التي تصنف بشكل صحيح.
ملاحظة: البرنامج يحاول باستمرار لتحسين دقة الخوارزمية حتى توقف يدويا. لقد أثبتنا سابقا أن التدريب على 18٪ من النتائج الصور في 97٪ من الدقة تدريب 12. - بعد يتم تدريب مقتطع الأنسجة، واختيار القرار المناسب شريحة. يتوافق قرار شريحة إلى الوقت اللازم لصور الجزء، مع قرار الخشنة التي تتطلب وقتا أقل وقرار الغرامة التي تتطلب المزيد من الوقت.
- جزء من مجموعة تدريب كامل من الصور عن طريق النقر على "صور الشريحة". السماح لبرنامج الوقت الكافي لتطبيق الخوارزمية لجميع الصور التدريب. عند الانتهاء من مراجعة تدريب مجموعة من العثور على أي أنسجة المصنفة بشكل خاطئ مع خوارزمية التدريب الحالية.
- لضبط عملية تجزئة النسيج، إضافة، تحرير، أو إزالة مناطق التدريب الأنسجة. استخدام الخيار "حواف تقليم" إذا بكسل تمتد على حواف الفئة نسيج واحد إلى آخر. إذا أساء تصنيف مجموعات صغيرة من بكسل، ضبط عتبة على الحد الأدنى لحجم القطاع.
- عندما يتم الانتهاء من التعديلات، حدد "تقسيم الصور"، وهذا سوف إعادة تدريب مقتطع الأنسجة لإنشاء خوارزمية جديدة لتقسيم الأنسجة. الخوارزمية السابقةهو حفظها تلقائيا ويمكن إعادتها إلى إذا لزم الأمر.
- عندما ثقة مع نتائج خوارزمية تجزئة الأنسجة، وتقدم إلى تجزئة الخلية عن طريق اختيار زر "تقدم".
الإنقسام 4. خلية
- اختيار المقصورات التحت خلوية ليتم تضمينها في تقسيم الخلية. تأكد من أن "النواة" محدد مسبقا لاختيار "السيتوبلازم" أو "غشاء".
ملاحظة: يجب فقط أن يتم اختيار "غشاء" تجزئة عندما أدرج بروتين علامة غشاء محددة في IHC، مثل E-كادهيرين. - ضمن علامة التبويب "نوى"، وهناك العديد من الخيارات. تبدأ باختيار الإعدادات المناسبة للتجزئة النووية (راجع الخطوة 4.3). اختيار ما إذا كان سيتم إدراج فئات الأنسجة الفردية أو كل في تجزئة.
- حدد نهجا لتقسيم النووية
- حدد مباين "القائم بكسل (عتبة)" نهج لطريقة مبسطة للحصول على الخيرالنتائج دون معرفة الكثير عن إعدادات معالجة الصور.
ملاحظة: هذا غالبا ما يجعل الخيار الأول جيد. عند اختيار هذا النهج "القائم بكسل (عتبة)" هو أكثر ملاءمة عندما يكون هناك موثوقة النووية مكافحة وصمة عار، في حين أن "وجوه وبناء" يجب أن تستخدم إذا كان هناك نقص في مباين النووية ثابت. - حدد "بكسل القائم (عتبة)" نهج عندما يكون هناك مباين النووية يمكن الاعتماد عليها.
ملاحظة: هذا النهج القائم على بكسل بحتة. ويمكن أيضا أن هذا النهج أن تستخدم لتحليل الاحتياجات الصورة الأخرى التي يمكن أن تكون راضية عن عتبة بسيطة، مثل الكشف عن بكسل ضمن فئة الأنسجة التي تلطخ إيجابية لوصمة عار IHC. - اختيار النهج القائم على كائن إذا لم مباين النووية توفر تلطيخ ثابت ومحدد من الأجسام النووية، وهناك حاجة إلى نهج أكثر تقدما القائم على القياس الشكلي للكشف نوى.
- حدد "مكونات لتقسيم النووية"، "Nuclالأذن الحجم "، و" تنظيف "إذا كان المستخدم يرغب في زيادة تحديد إعدادات تجزئة النوى.
- حدد مباين "القائم بكسل (عتبة)" نهج لطريقة مبسطة للحصول على الخيرالنتائج دون معرفة الكثير عن إعدادات معالجة الصور.
- تحديد المعلمات شكل السيتوبلازم
- حدد زر "تقدم" للانتقال إلى تقسيم السيتوبلازم.
ملاحظة: هناك العديد من الخيارات ضمن تقسيم السيتوبلازم للاختيار من بينها. الخيار يسمى "المسافة الداخلية لنواة" هو بكسل القائم. وهو يعبر عن المسافة بين خارج النواة وداخل السيتوبلازم. زيادة هذه القيمة يقلل من احتمال أن إشارة النووية تجتاز في حجرة السيتوبلازم. - اختر التالي، "المسافة الخارجي لنواة".
ملاحظة: هذا هو أيضا بكسل القائم. المسافة الخارجي لنواة تعكس المسافة بين السطح الخارجي للنواة وخارج الخلية. يمكن تعيين هذه القيمة كبيرة أو صغيرة بما يكفي لتضمين أو استثناء إشارات غشاء إذا رغبت في ذلك. - المقبل حدد "الحد الأدنى لحجم".
ملاحظة: الحد الأدنى للحجم، عنصورةل مقرها، يعكس الحد الأدنى لحجم العينة السيتوبلازم ليتم تضمينها في التحليل. إذا كان حجم السيتوبلازم هو أصغر في خلية معينة مثل عندما يتم الخلايا معبأة بإحكام معا، يتم استبعاد هذا تقسيم السيتوبلازم من التحليل. - حدد الخيار التالي، "مكون" مع "الابتدائية"، "الثانوية"، وحدد "التعليم العالي" كخيارات ثانوية.
ملاحظة: وهنا يمكن للمرء أن يختار علامة السيتوبلازم محددة. على غرار تجزئة النووية، إذا تم استخدام علامة IHC هيولية محددة، وهذا العنصر يمكن أن تستخدم لتحديد السيتوبلازم من خلال إيجاد قيمة عتبة الحد الأدنى. وهذا يساعد في تحديد السيتوبلازم ولكن ليس من الضروري للتأكد من دقتها مقبولة. - الانتقال إلى آخر الخيارات كلفه هو "غشاء". هنا، يمكن للمستخدم يحدد مقصورة غشاء مع علامة البروتين. اختيار "الابتدائية"، "الثانوية"، و / أو "التعليم العالي" لكل علامة محددة غشاء المستخدمة. ضبط "كامل مقياس يادال "للعثور على حد أدنى أو إيجابية لكل علامة على أغشية الخلايا.
- استمرار تحت علامة التبويب "غشاء" وحدد الخيار "الحد الأقصى لحجم الخلية".
ملاحظة: هذه هي المسافة إلى قيمة الغشاء، بالبكسل، والذي يحدد الحد الأقصى لحجم الخلايا. قيمة 12 مناسبة عادة للصور التي اتخذت في 20X التكبير. - بعد اختيار جميع الخيارات، حدد "تقسيم صورة" أو "الجزء جميع". تطبيق الإعدادات على الصور ومشاهدتها "فردي" أو في وضع "معرض".
ملاحظة: ضبط الإعدادات وعتبات إذا لزم الأمر، وإعادة شريحة حتى راض عن نتائج خلية التجزئة في مجموعة التدريب من الصور.
- حدد زر "تقدم" للانتقال إلى تقسيم السيتوبلازم.
5. Phenotyping من الخلايا
مطلوب دقيقة تجزئة الخلية من أجل الحصول على دقة phenotyping الخلية، وميزة phenotyping هو للتدريب: ملاحظة.
- استخدام "إضافة و# 34؛ زر لإضافة الظواهر إلى قائمة "الظواهر". يمكن للمستخدمين اختيار لون للالنمط الظاهري.
- انقر على "تحرير الظواهر" لتعيين النمط الظاهري للخلية. انقر على خلية معينة لإظهار القائمة المنسدلة، مما يسمح للمستخدم أن يختار النمط الظاهري ومن ثم المضي قدما. تحديد لا يقل عن خمسة (5) خلايا في كل النمط الظاهري من أجل المضي قدما. اختيار 25 أو أكثر من الخلايا من كل النمط الظاهري هو مطلوب لتحقيق أفضل النتائج.
6. يحرز IHC والتعاون التعريب
- اختيار "تقدم" للانتقال إلى "نتيجة IHC أو إذا" خطوة. اختيار "تصنيف الأنسجة" ليسجل.
ملاحظة: الفئة نسيج واحد فقط يمكن أن سجل خلال تحليل معين، ولكن إذا تم النتائج المرجوة التهديف في فئة أنسجة أخرى، فإن التحليل يمكن أن يتكرر في وقت لاحق مع إعدادات مختلفة. - اختيار المرجوة "يحرز" نوع.
ملاحظة: الإيجابية يخلق اثنين من صناديق (الإيجابية والسلبية) للمكون من الفائدة، بينما يستخدم الإيجابية مزدوجة لتحليل شارك في التعريب. وتشمل الخيارات الأخرى 4-بن، 10 بن، و50 بن تحليلات علامة الاختيار. - اختيار الخلية "مقصورة" لاستخدامها في يحرز التحليل.
- مماثلة لإيجاد حد أدنى للمكون النووي الرئيسي، حدد "عرض بيانات مكون" وتحرك المؤشر فوق الصور تدريبية لتجد المناسبة الكثافة البصرية العتبات الدنيا من تلطيخ للخلايا إيجابية للمكون (ق) من الفائدة.
- إذا كانت الخلايا الملون بشكل مكثف هي أن تكون مستبعدة، وانخفاض الحد الأقصى عتبة إلى مستوى مناسب. خلاف ذلك، استخدم زر السيارات لاختيار أقصى حد للتحليل.
- اختيار تدريب الصور ليسجل من أجل التحقق من صحة قيم العتبة.
ملاحظة: سيتم إرجاع النسبة المئوية للخلايا داخل بن معين، ويمكن مقارنتها عن طريق التفتيش البصري أو العد والفرز اليدوي. مرة واحدة كاملة، حدد "المسبق" للشروع في خطوة "تصدير".
- اختبار الخوارزمية التي تم إنشاؤها من خلال تقسيم الأنسجة، وتجزئة الخلية، والقيم التهديف عن طريق تصدير البيانات لمجموعة التدريب. اتبع المطالبات لإنشاء مجلد جديد للدليل التصدير. حدد الصور والجداول المراد إنشاؤها وتدرج في التحليل. إجراء تحليل عن طريق اختيار "تصدير للجميع".
- ويتم تصدير الجداول في ملفات نصية مفصول ويمكن فتحها في معظم برامج تحليل البيانات.
- عندما التحليل الكامل، عرض البيانات تجزئة الخلية والتهديف للصور مع كل من تلطيخ ارتفاع وانخفاض لتقييم دقة الإعدادات.
- عندما راض عن إعدادات، وتطبيق الخوارزمية التي تم إنشاؤها من مجموعة التدريب من الصور لمجموعة كاملة من الصور من خلال تحليل دفعة واحدة. انقر فوق علامة التبويب "تحليل دفعة" وسيتم نسخ الخوارزمية فتح من المشروع النشط.
- اختيار دليل تصدير جديد وحدد الصور التي وطبلوفاق هي التي ينبغي إدراجها في التحليل. تحت خيار ملفات الإدخال، حدد "إضافة الصور" واختيار جميع الصور ليتم تضمينها في التحليل دفعة واحدة.
- إجراء تحليل عن طريق تحديد خيار "تشغيل". كما هو الحال مع تحليل مجموعة التدريب، وهذه الخطوة تتطلب كميات متفاوتة من الوقت، اعتمادا على إعدادات معينة وعدد من الصور المدرجة في التحليل.
- عند الانتهاء، تقدم إلى "مراجعة / دمج" علامة التبويب. يمكن تغيير الإعدادات الافتراضية دليل دفعة إلى دليل التصدير من التحليل دفعة وإذا رغبت في ذلك. حدد "تشمل جميع" وحدد "دمج" لإنشاء أوراق البيانات مع بيانات موجزة لتحليلها.
8. تحليل البيانات المصدرة
- فتح الجداول التي تم تصديرها في برنامج تحليل البيانات وإزالة أو إخفاء أعمدة البيانات التي لا تمت بصلة للتحليل، مثل الحد الأدنى والحد الأقصى للقيم لكل مكون. البيانات الأولية المستخدمة في التحليل في متوسط البصرية كثافة جolumn لكل عنصر.
- مراجعة تصدير خرائط التقسيم والصور الخام لتحديد أي عينات أو النوى TMA هي لاستبعادها من التحليل. الأنسجة القيم نسبة تساعد في تحديد ما إذا كان ينبغي شمل عينة أو لا، مع قطع التعسفي من <5٪ المستخدمة في معظم الأحيان لمعايير الاستبعاد.
- إزالة البيانات أو الصفوف التي تحتوي على عينات لا علاقة لها أن تستبعد من تحليل البيانات.
- استخدام البيانات البروتين الكمي للتحقيق تغييرات في الحالة المرضية أو العلاقة مع الخصائص اكلينيكية المرضية للمرض 12،18-21.
النتائج
في الشكل 1، يتم تنفيذ التدريب على أنسجة البروستاتا إلى صور شريحة في الظهارية وانسجة أجزاء، جنبا إلى جنب مع مقصورة غير الأنسجة. باستخدام الظهارية غشاء علامة E-كادهيرين، تم إجراء تقسيم الخلية إلى فصل النواة، السيتوبلازم، وأجزاء الغشاء، كما هو موضح في الشكل (2).
في تجربة واحدة، كنا المضاعفة IHC للتحقيق في التعبير وتوطين AR، ERα، كادهيرين E، وCD147، كما هو مبين في الشكل (3). وباستخدام هذه التقنيات، ونحن قادرون على تحديد الخلايا إيجابية للتعبير النووي لكل من ERα و AR (الشكل 3B - 3C) على الرغم من تداخل الإشارات اللونية، كما هو موضح مع السهام الخضراء في الشكل 3A. لقد وجدنا اختلافات ملحوظة في نسبة مزدوجة خلايا انسجة إيجابية في ولايات مختلفة من العلاقات العامةمرض ostate (الشكل 3D). نحن كميا غشاء الخلية محددة تعبير عن CD147 باستخدام كادهيرين E كما البروتين علامة (السهام الحمراء في الشكل 3A)، وكنا أول مجموعة للتحقيق في غشاء التعبير CD147 محددة في أنسجة البروستاتا. لقد وجدنا انخفاضا كبيرا في التعبير CD147 بالتعاون مع سرطان البروستاتا التقدم (الشكل 3E) وجدت جمعية الهامة مع التشخيص بعد الجراحة 19.
هناك حالات حيث سوء تصميم تجربة يمكن أن يؤدي إلى تقسيم الأنسجة غير دقيقة. في الشكل (4)، الخوارزمية تطبيقها على مجموعة من الأنسجة لم بدقة شريحة الظهارية ومقصورات اللحمية (الشكل 4C). في هذه التجربة، واستخدمت-α السلس الأكتين العضلات (α-SMA) بمناسبة المقصورة اللحمية. لأن α-SMA والعضلات الملساء وانخفض أو فقدت في بعض الأورام (فيقوإعادة 4A)، وكانت الخوارزمية التي تم إنشاؤها من خلال تجزئة النسيج (الشكل 4B) غير قادرة على التمييز بدقة بين الظهارية وانسجة المقصورات من البيانات المظهرية وحدها. ينبغي توخي الحذر عند اختيار علامات البروتين للنسيج أو خلية المقصورات.

الشكل 1: الأنسجة الإنقسام عن طريق المتعددة الأطياف التصوير البرمجيات. كانت ملطخة وميكروأري أنسجة البروستاتا باستخدام المناعية المضاعفة لمستقبلات الاندروجين (AR)، هرمون الاستروجين مستقبلات ألفا (ERα)، E-كادهيرين، وCD147. تم استيراد مجموعة من الصور التدريب في برامج التصوير متعدد الأطياف تمثل أنواع الأنسجة والحالات المرضية من مجموعة كاملة من الصور (A). تم إنشاء فئات الأنسجة بما في ذلك سدى (الأخضر)، ظهائر (الحمراء)، وغير الأنسجة (الأزرق)، وكانت فئات محددة من خلال رسم يدويا على رأسالتدريب الصور (B). بعد تعادله على الصور التدريب، تم إنشاء خوارزمية لتجزئة النسيج وتطبيقها على مجموعة التدريب من الصور (C). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تقسيم الخلية إلى النووية، حشوية، وغشاء المقصورات. تم تعريف مقصورة النووية للتجزئة الخلية عن طريق وضع حد أدنى للcounterstaining الهيماتوكسيلين (A). تم تعريف السيتوبلازم فيما يتعلق باستخدام نواة محددة مسبقا الخوارزميات ضمن برنامج (B). وقد استخدم E-كادهيرين كعلامة غشاء والحد الأدنى يعني تم تطبيق عتبة OD لتحديد مقصورة غشاء (C). هذه التقنية فقطالدودة الحلزونية الكميات في وقت واحد من التعبير البروتين في جميع المقصورات التحت خلوية (D). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
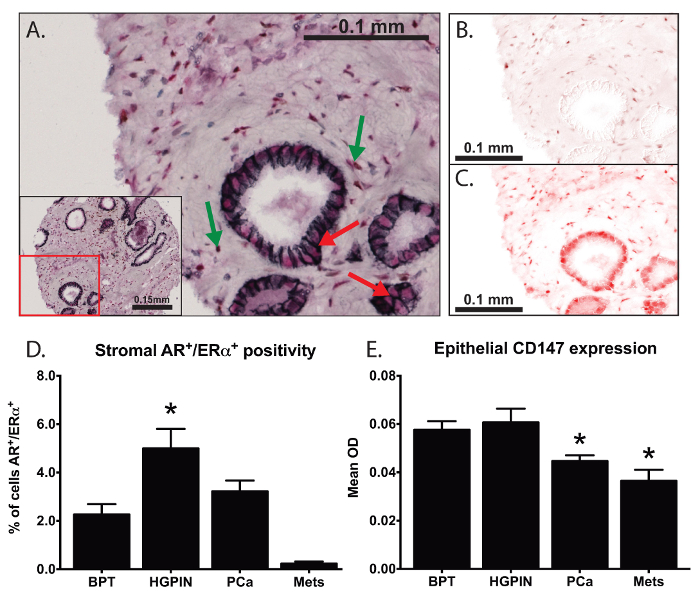
الشكل 3: تحليل المشارك التعريب وغشاء محدد البروتين التعبير. وقد استخدم تعدد IHC للتحقيق في التعبير وتوطين مستقبلات الاندروجين (AR)، هرمون الاستروجين مستقبلات ألفا (ERα)، E-كادهيرين، وCD147 (A). وقد استخدم DAB (مولد اللون البني) بمناسبة AR (ب) ومولد اللون الأحمر الذي يستخدم في تحديد ERα (C). كنا قادرين على تحديد المؤشرات الحيوية متداخلة مكانيا (الأسهم الخضراء في A) وقياس (D) نسبة الخلايا مع النووي شارك في توطين ERα وARضمن سدى البروستاتا. باستخدام كادهيرين E (مولد اللون الأسود) لتحديد غشاء البلازما (السهام الحمراء في A)، ونحن كميا التعبير غشاء محددة من CD147 داخل أنسجة البروستاتا (E) 19. في اتجاه واحد تم استخدام تحليل التباين (ANOVA) للتحليل الإحصائي، وتعكس أشرطة الخطأ خطأ المعياري للمتوسط، والنجمة تمثل ف <0.05. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
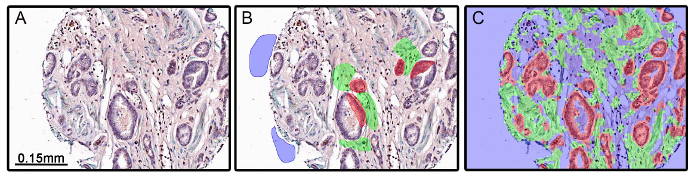
الشكل 4: عدم كفاية تقسيم الأنسجة الناتجة من تصميم التجارب. كانت ملطخة أنسجة البروستاتا الحميدة والخبيثة لل-α السلس الأكتين العضلات (α-SMA، مولد اللون الأخضر)، مستقبلات الاندروجين (مولد اللون الأحمر)، ومستقبلات الاندروجين البديل 7 (DAB مولد اللون). ألفا-SMA كان يستخدموانخفضت علامة سدى، وفي بعض الأورام، بما في ذلك البروستات (A). عندما تم إجراء التدريب (B) وتم تطبيق خوارزمية تجزئة النسيج، كانت اللحمية ومقصورات الظهارية مجزأة غير كاف نظرا لعدم وجود α-SMA تلطيخ (C). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
استخدام المناعية التقليدية لتقييم التعبير البروتين محدودة، وأساليب ذاتية شبه الكمية للتحليل 22،23. وقد تم إنشاء منصات مسبقا لتحليل الإنتاجية العالية التعبير العلامات البيولوجية والتعريب. تجزئة مفصلة لكل من الأنسجة ومقصورات التحت خلوية يسمح للمستخدمين لدراسة التعبير العلامات البيولوجية، التعريب، وشارك في التعريب مع علامات أخرى من الفائدة. في دراسات سابقة، لقد أثبتنا فائدة IHC والتصوير متعدد الأطياف، وخاصة عندما تستخدم لدراسة البروتينات مترجمة إلى نفس 18،20،21 مقصورة الخلوية. عندما يقترن ميكروأرس الأنسجة 24، هذه التقنيات تسمح الكميات أسرع وأكثر موضوعية التعبير البروتين من المسموح به التحليل اليدوي من قبل الطبيب الشرعي.
قضية واحدة مع استخدام المناعية لتحديد الكميات البروتين هي irreproducibility النتائج بسبب subjecطبيعة TIVE التحليل والاختلافات الكامنة في تقنية والكواشف. وهناك ميزة هامة من استخدام منصات مثل التصوير متعدد الأطياف لقياس التعبير البروتين هو استنساخ النتائج. البيانات من منصات علم الأمراض المحوسبة ترتبط إلى حد كبير مع التحليل اليدوي من قبل الطبيب الشرعي أثناء عودته البيانات في شكل مستمر والحد بشكل كبير وقت العمل، ولا سيما عند العمل مع عينة كبيرة الاحجام 12،16،25. وقد أظهرت الدراسات التوافق الشامل عالية في النتائج بين منصات متعددة الأطياف المختلفة 14. وعلاوة على ذلك، لقد أثبتنا سابقا أن النتائج تلطيخ هي تكرار للغاية حتى عندما يكون هناك تقلب في عدد من البروتينات التحقيق 12. واستخدام منصات علم الأمراض الآلي لكل من تلطيخ والتحليل ليس القضاء على جميع التناقضات في النتائج، مثل تلك الناجمة عن الأجسام المضادة التي تم إنشاؤها نحو الحواتم مختلفة، ولكن هذه المنابر لا يقلل بشكل كبير التحيز والأشعة تحت الحمراءاستنساخ ترتبط عادة مع المناعية.
هناك خطوات معينة ضمن البروتوكول الذي لا غنى عنها للعودة، نتائج استنساخه دقيقة. التصميم التجريبي المناسب من خلال اختيار من البروتينات التي ستدرج في الانسجة أو علامات التحت خلوية مهمة لتجزئة دقيقة. عند إجراء التحليل إيجابية، واختيار من عتبة أدنى لتلطيخ إيجابي له تأثير كبير على النتائج النهائية. حين اختيار عتبة "تشغيل / إيقاف" بروتينات مثل عوامل النسخ النووية غير واضحة إلى حد ما، العثور على عتبة للبروتينات وأعرب أكثر بتباين أمر صعب. ينبغي من الناحية المثالية أن يتم تنفيذ هذا بالتعاون مع الطبيب الشرعي البولي التناسلي المجلس معتمدة أو على درجة متوسط عبر مراقبين متعددة للعثور على عتبة مثالية للتحليل.
ومن المهم أن يتعرف على بعض القيود المفروضة على الإصدارات الحالية من هذه التكنولوجيا. عندما ديتغريم مقصورة السيتوبلازم، ثلاثة نهج يمكن استخدامها: (1) تلطيخ مع علامة-السيتوبلازم معين، (2) تلطيخ مع علامة غشاء محددة واستخدام النواة لغشاء بعد علامة كما السيتوبلازم، و (3) باستخدام نهج الرسم لتحديد يدويا حدود السيتوبلازم فيما يتعلق النواة. من تجربتنا، وذلك باستخدام علامة غشاء محددة هي التقنية الأكثر دقة. النهج الرسم اليدوي عادة دقيقة إذا نوى تقع مركزيا أو إذا وزعت العلامات البيولوجية للاهتمام بشكل موحد في جميع أنحاء السيتوبلازم. تحديد دقيق لسيتوبلازم خلايا انسجة مثل الخلايا الليفية وخلايا العضلات الملساء لا يزال صعبا ويجب أن تؤخذ بعين الاعتبار عند تصميم تجربة.
الحد آخر من التكنولوجيا هو الاعتماد على نواة لتقسيم الخلية. إذا طائرة من قسم تستثني نواة خلية معينة، لن يتم تضمين هذه الخلية في التحليل. إذا لم يكن هناكالسيتوبلازم واضحة بين نواتين متجاورتين أو كتل من النوى، وغالبا ما يتم التعرف على هذه واحدة مقطوع النووي كبير، بدلا من نواة متميزة. وبصفة عامة، الهيماتوكسيلين مباين كافية عادة لتجزئة النووية مقبولة، والتلاعب في إعدادات برنامج مثل أقصى حد لحجم نواة يمكن إصلاح معظم القضايا مع تجزئة النووية.
وجود قيود النهائي من منصات علم الأمراض الآلي هو تقسيم لا يمكن الاعتماد عليها من الأنسجة الناتجة عن التصميم التجريبي الفقراء. لا يمكن المبالغة في أهمية اختيار الأنسجة والخلايا المؤشرات الحيوية المناسبة للرد على مسألة الفائدة. كما أثبتنا في نتائج تمثيلية لدينا، علامة الظهارية أو اللحمية التي تتغير بشكل ملحوظ التعبير بين الحالات المرضية يمكن أن تثير مشاكل عند إنشاء خوارزمية لتقسيم الأنسجة. ومن الجدير بالذكر أن هناك خيارات بديلة عندما يحلل صعوبة مثل هذه تنشأ. على سبيل المثال، ايماج الفرديةويمكن تحليل وفاق من خلال رسم جميع المقصورات الأنسجة يدويا، وليس من خلال تطبيق خوارزمية من مجموعة التدريب من الصور. هذا يوفر ميزة تقسيم هذا هو تماما تمشيا مع ما يرغب المستخدم، ولكنه يقدم أيضا الذاتية ويمكن أن تزيد بشكل كبير من الوقت اللازم لإنهاء تحليل. التصميم التجريبي المناسب هو أسهل وسيلة لتسريع تحليل وتحقيق أقصى قدر من الدقة من الأنسجة وتجزئة الخلية.
هذه التكنولوجيا وبروتوكول لديها العديد من التطبيقات المستقبلية. وقد تم تحديد العديد من المؤشرات الحيوية للخاصة الحالات المرضية ولكن لم يثبت صحته. عالية الإنتاجية تحليل موضوعي مع منصات متعددة الأطياف يسهل التحقق من صحة هذه المؤشرات الحيوية. وعلاوة على ذلك، وتقييم التعبير والمشاركة في توطين بروتينات متعددة يمكن أن توفر نظرة ثاقبة مسارات إشارات غير مفهومة. مما لا شك فيه، والحد من الذاتية الكامنة المرتبطة تحليل staini المناعىنغ هي قيمة لفهم التعبير وتوطين مجموعة واسعة من علامات البروتين.
Disclosures
الكتاب تعلن أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
الكتاب أشكر جامعة مبادرات البحوث بالحركة ولاية ويسكونسن في مختبر علم الأمراض، في جزء بدعم من وزارة UW علم الأمراض والطب المخبري ومنحة UWCCC P30 CA014520، لاستخدام التسهيلات والخدمات التي تقدمها.
Materials
| Name | Company | Catalog Number | Comments |
| Xylene | Fisher Chemical | X3F1GAL | NFPA rating: Health – 2, Fire – 3 , Reactivity – 0 |
| Ethyl Alcohol-200 proof | Fisher Scientific | 4355223 | NFPA rating: Health – 0, Fire – 3 , Reactivity – 0 |
| Tris Base | Fisher Scientific | BP152-500 | NFPA rating: Health – 2, Fire – 0 , Reactivity – 0 |
| Tris Hydroxymethyl aminomethane HCl | Fisher Scientific | BP153-1 | NFPA rating: Health – 2, Fire – 0 , Reactivity – 0 |
| Tween 20 | Chem-Impex | 1512 | NFPA rating: Health – 0, Fire – 1 , Reactivity – 0 |
| Phosphate-buffered saline | Fisher Scientific | BP2944-100 | NFPA rating: Health – 1, Fire – 0 , Reactivity – 0 |
| Peroxidazed | Biocare Medical | PX968 | Avoid contact with skin and eyes. May cause skin irritation and eye damage. |
| Estrogen Receptor alpha | Thermo Fisher Scientific-Labvision | RM9101 | Not classified as hazardous |
| Androgen Receptor | SCBT | sc-816 | Not classified as hazardous |
| CD147 | Biodesign | P87535M | Not classified as hazardous |
| E-cadherin | Dako | M3612 | Not classified as hazardous |
| Renoir Red Andibody Diluent | Biocare Medical | PD904 | It is specially designed to work with Tris-based antibodies |
| DeCloaking Chamber | Biocare Medical | Model DC2002 | Take normal precautions for using a pressure cooker |
| Barrier pen-Immuno Edge | Vector Labs | H-4000 | |
| Denaturing Kit-Elution step | Biocare Medical | DNS001H | Not classified as hazardous |
| Mach 2 Goat anti-Rabbit HRP Polymer | Biocare Medical | RHRP520 | Not classified as hazardous |
| Mach 2 Goat anti-Rabbit AP Polymer | Biocare Medical | RALP525 | Not classified as hazardous |
| Mach 2 Goat anti-Mouse HRP Polymer | Biocare Medical | M3M530 | Not classified as hazardous |
| Betazoid DAB Chromogen Kit | Biocare Medical | BDB2004 | 1. DAB is known to be a suspected carcinogen. 2. Do not expose DAB components to strong light or direct sunlight. 3. Wear appropriate personal protective equipment and clothing. 4. DAB may cause sensitization of skin. Avoid contact with skin and eyes. 5. Observe all federal, state and local environmental regarding disposal |
| Warp Red Chromogen Kit | Biocare Medical | WR806 | Corrosive. Acid that may cause skin irritation or eye damage. |
| Vina Green Chromogen Kit | Biocare Medical | BRR807 | Harmful if swallowed |
| Bajoran Purple Chromogen Kit | Biocare Medical | BJP807 | Flammable liquid. Keep away from heat, flames and sparks. Harmful by ingestion or absorption. Avoid contact with skin or eyes, and avoid inhalation. |
| Cat Hematoxylin | Biocare Medical | CATHE | Purple solution with a mild acetic acid (vinegar) scent. May be irritating to skin or eyes. Avoid contact with skin and eyes. Avoid ingestion. |
| XYL Mounting Media | Richard Allen | 8312-4 | NFPA rating: Health – 2, Fire – 3 , Reactivity – 0 |
| 1.5 Coverslips | Fisher Brand | 22266858 | Sharp edges |
| Incubation (Humidity)Chamber | obsolete | obsolete | Multiple vendors available |
| Convection Oven | Stabil- Therm | C-4008-Q | |
| Background Punisher Blocking Reagent | Biocare Medical | BP974 | This product is not classified as hazardous. |
| inForm software | PerkinElmer | CLS135781 | Primary multispectral imaging software used in manuscript |
| Nuance software | PerkinElmer | Nuance EX | Software used for making spectral libraries within manuscript |
| Vectra microscope and slide scanner | PerkinElmer | VECTRA | Automated slide scanner and microscope for obtaining IM3 image cubes |
References
- Valdman, A., et al. Expression of redox pathway enzymes in human prostatic tissue. Anal Quant Cytol Histol. 31 (6), 367-374 (2009).
- Rimm, D. L., Camp, R. L., Charette, L. A., Olsen, D. A., Provost, E. Amplification of tissue by construction of tissue microarrays. Exp Mol Pathol. 70 (3), 255-264 (2001).
- Jonmarker, S., et al. Expression of PDX-1 in prostate cancer, prostatic intraepithelial neoplasia and benign prostatic tissue. APMIS. 116 (6), 491-498 (2008).
- McCarty, K. S., Miller, L. S., Cox, E. B., Konrath, J., McCarty, K. S. Sr Estrogen receptor analyses. Correlation of biochemical and immunohistochemical methods using monoclonal antireceptor antibodies. Arch Pathol Lab Med. 109 (8), 716-721 (1985).
- Volante, M., et al. Somatostatin receptor type 2A immunohistochemistry in neuroendocrine tumors: a proposal of scoring system correlated with somatostatin receptor scintigraphy. Mod Pathol. 20 (11), 1172-1182 (2007).
- Muris, J. J., et al. Immunohistochemical profiling of caspase signaling pathways predicts clinical response to chemotherapy in primary nodal diffuse large B-cell lymphomas. Blood. 105 (7), 2916-2923 (2005).
- Jaraj, S. J., et al. Intra- and interobserver reproducibility of interpretation of immunohistochemical stains of prostate cancer. Virchows Arch. 455 (4), 375-381 (2009).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. J Histochem Cytochem. 14 (12), 929-931 (1966).
- Peters, T. J. Investigation of tissue organelles by a combination of analytical subcellular fractionation and enzymic microanalysis: a new approach to pathology. J Clin Pathol. 34 (1), 1-12 (1981).
- Emmert-Buck, M. R., et al. Laser Capture Microdissection. Science. 274 (5289), 998-1001 (1996).
- Waters, J. C. Accuracy and precision in quantitative fluorescence microscopy. J Cell Biol. 185 (7), 1135-1148 (2009).
- Huang, W., Hennrick, K., Drew, S. A colorful future of quantitative pathology: validation of Vectra technology using chromogenic multiplexed immunohistochemistry and prostate tissue microarrays. Hum Pathol. 44 (1), 29-38 (2013).
- Rimm, D. L. C-Path: A Watson-Like Visit to the Pathology Lab. Science Translational Medicine. 3 (108), (2011).
- Fiore, C., et al. Utility of multispectral imaging in automated quantitative scoring of immunohistochemistry. J Clin Pathol. 65 (6), 496-502 (2012).
- Stack, E. C., Wang, C., Roman, K. A., Hoyt, C. C. Multiplexed immunohistochemistry, imaging, and quantitation: A review, with an assessment of Tyramide signal amplification, multispectral imaging and multiplex analysis. Methods. 70 (1), 46-58 (2014).
- Rizzardi, A. E., et al. Quantitative comparison of immunohistochemical staining measured by digital image analysis versus pathologist visual scoring. Diagn Pathol. 7, 42(2012).
- Bauman, T. M., et al. Characterization of fibrillar collagens and extracellular matrix of glandular benign prostatic hyperplasia nodules. PLoS One. 9 (10), e109102(2014).
- Bauman, T. M., et al. Beta-catenin is elevated in human benign prostatic hyperplasia specimens compared to histologically normal prostate tissue. Am J Clin Exp Urol. 2 (4), 313-322 (2014).
- Bauman, T. M., Ewald, J. A., Huang, W., Ricke, W. A. CD147 expression predicts biochemical recurrence after prostatectomy independent of histologic and pathologic features. BMC Cancer. 15 (1), 549(2015).
- Bauman, T. M., et al. Finasteride treatment alters tissue specific androgen receptor expression in prostate tissues. Prostate. 74 (9), 923-932 (2014).
- Nicholson, T. M., Sehgal, P. D., Drew, S. A., Huang, W., Ricke, W. A. Sex steroid receptor expression and localization in benign prostatic hyperplasia varies with tissue compartment. Differentiation. 85 (4-5), 140-149 (2013).
- Taylor, C. R., Levenson, R. M. Quantification of immunohistochemistry--issues concerning methods, utility and semiquantitative assessment II. Histopathology. 49 (4), 411-424 (2006).
- Matos, L. L., Trufelli, D. C., de Matos, M. G., da Silva Pinhal, M. A. Immunohistochemistry as an important tool in biomarkers detection and clinical practice. Biomark Insights. 5, 9-20 (2010).
- Kononen, J., et al. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med. 4 (7), 844-847 (1998).
- Ong, C. W., et al. Computer-assisted pathological immunohistochemistry scoring is more time-effective than conventional scoring, but provides no analytical advantage. Histopathology. 56 (4), 523-529 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved